Похожие презентации:
Химическая связь
1.
Химическая связь2.
Химическая связь• Ионная связь- происходит полный переход электрона от
одного атома к другому, электроотрицательность атомов
сильно различается
• Ковалентная неполярная связь - происходит образование
общей электронной пары, пара в общей степени
принадлежит обоим атомам( молекула образуется из
одинаковых атомов), электроотрицательность атомов
одинакова
• Ковалентная полярная связь - происходит образование
общей электронной пары, пара в разной степени
принадлежит обоим атомам( молекула образуется из
разных атомов), электроотрицательность атомов
различаются
3.
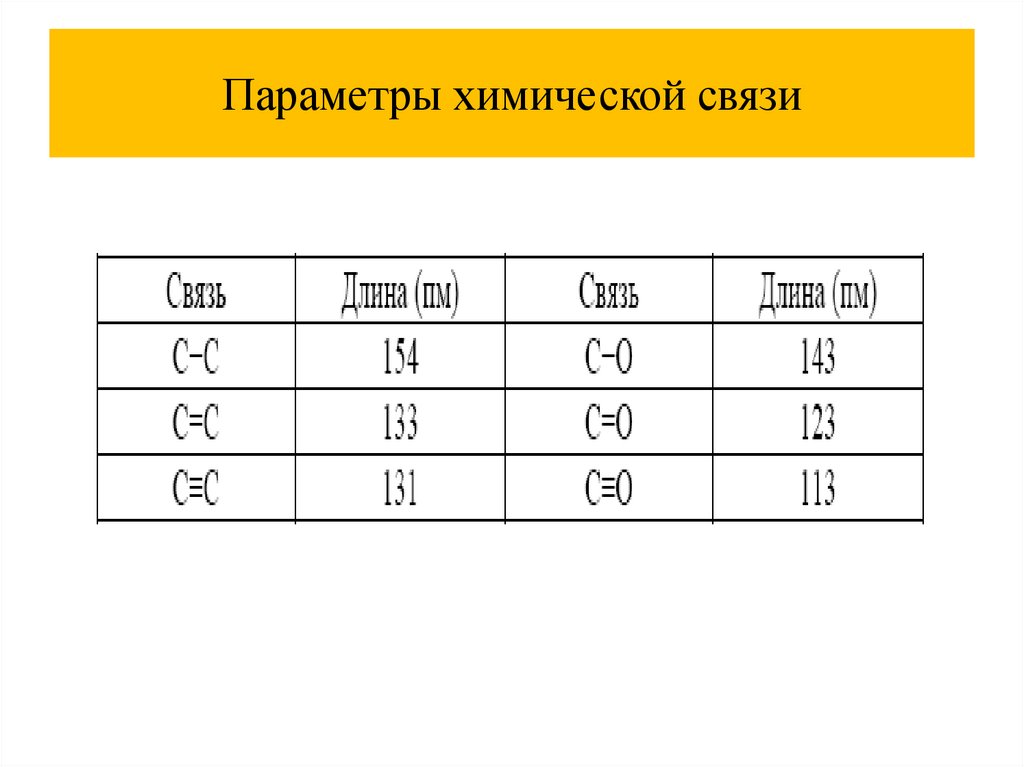
Параметры химической связи4.
Параметры химической связи5.
Параметры химической связи6.
Параметры химической связи• химическое соединение образуется только в том случае,
когда это выгодно энергетически. Силы притяжения
преобладают над силами отталкивания, потенциальная
энергия взаимодействующих атомов понижается.
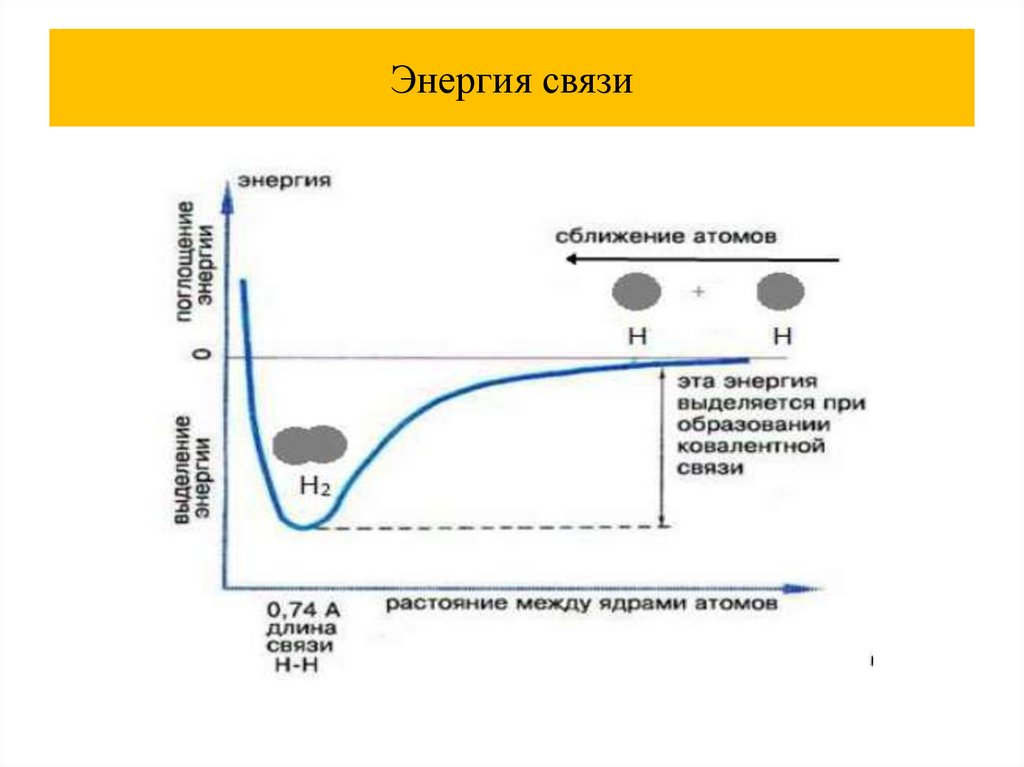
• энергия связи- это та энергия, которая необходима для
разъединения атомов в молекуле и для удаления их друг от
друга на расстояние, на котором их взаимодействие
невозможно
7.
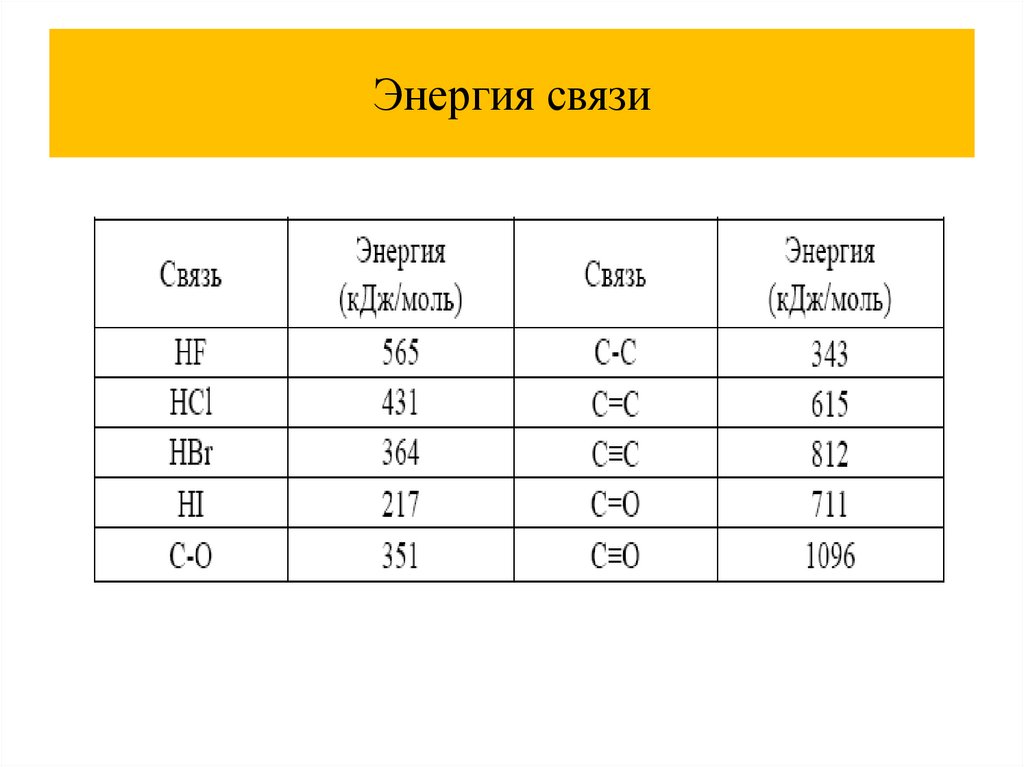
Энергия связи8.
Энергия связи9.
Энергия связи10.
Энергия связи11.
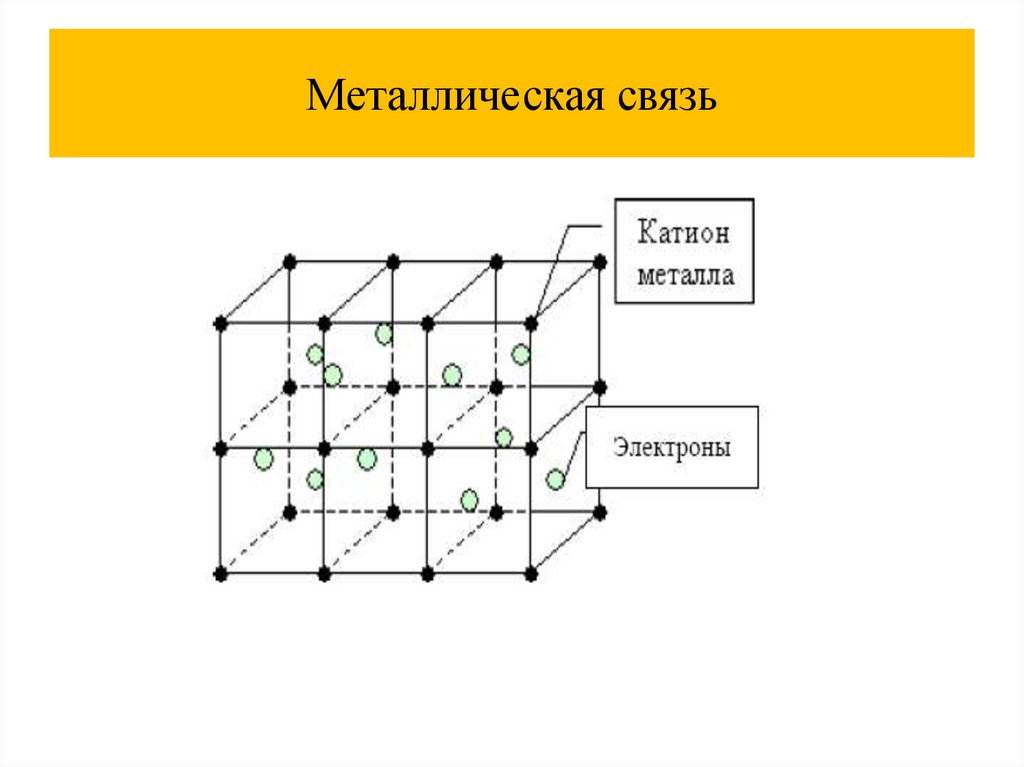
Ионная связь12.
Ионная связь13.
Ионная связь14.
Характеристики ионной связи15.
Характеристики ионной связи16.
Энергия ионной кристаллической решетки17.
Энергия ионной кристаллической решетки18.
Энергия ионной кристаллической решетки19.
Поляризация ионов20.
Поляризация ионов21.
Поляризация ионов22.
Деформация электронной оболочки23.
Зависимость свойств веществ от поляризацияионов
24.
Зависимость свойств веществ от поляризацияионов
25.
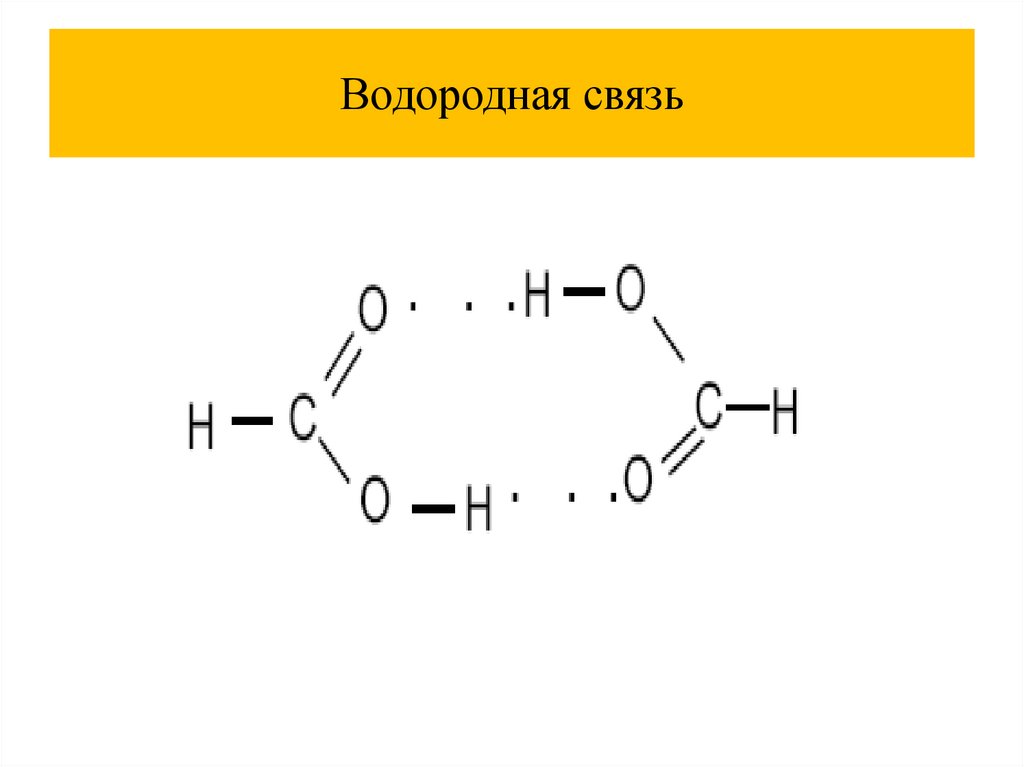
Ковалентная связь26.
Характеристики ковалентная связь27.
Метод валентных связей (МВС)28.
Метод валентных связей (МВС)29.
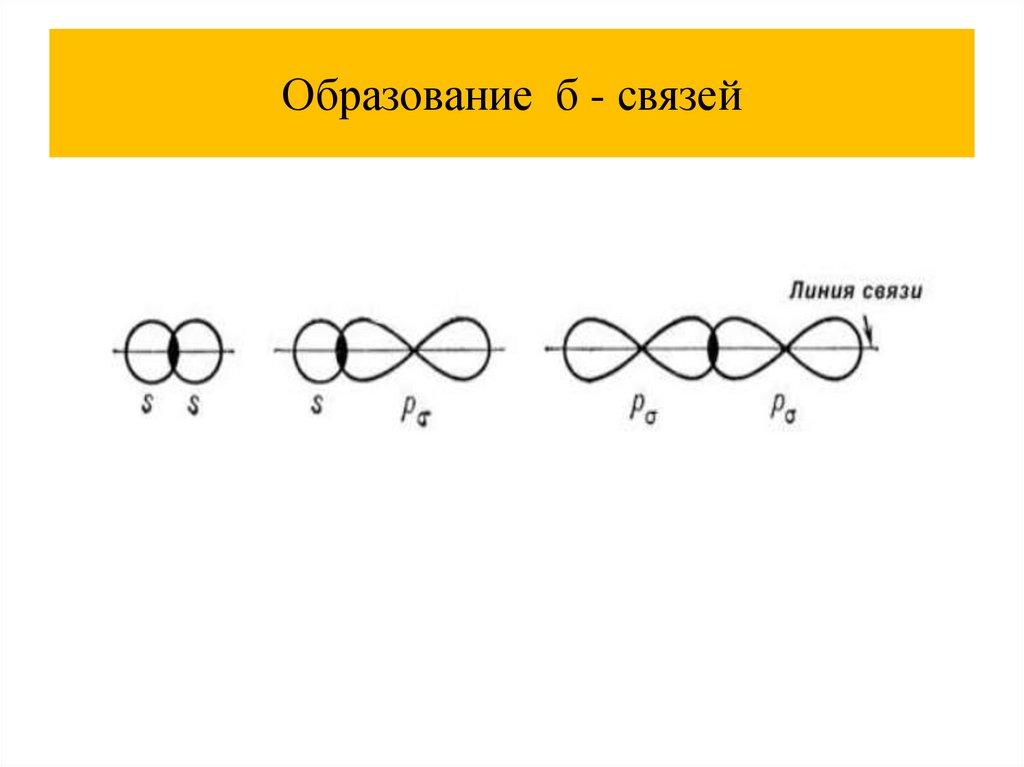
Образование б - связей30.
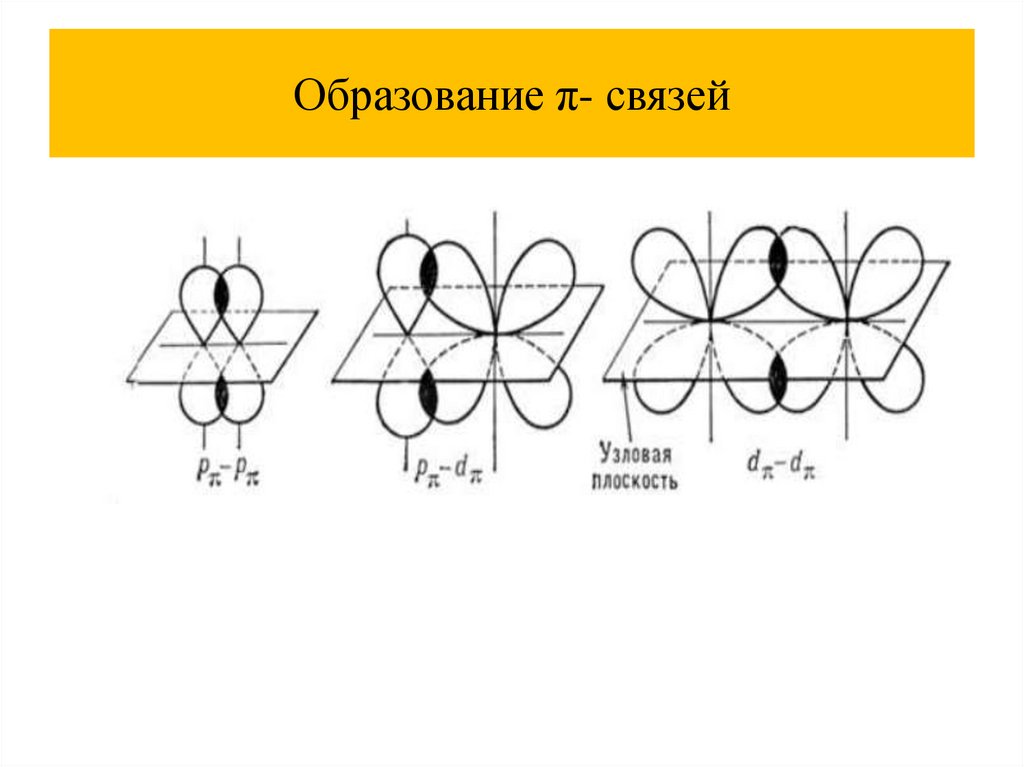
Образование π- связей31.
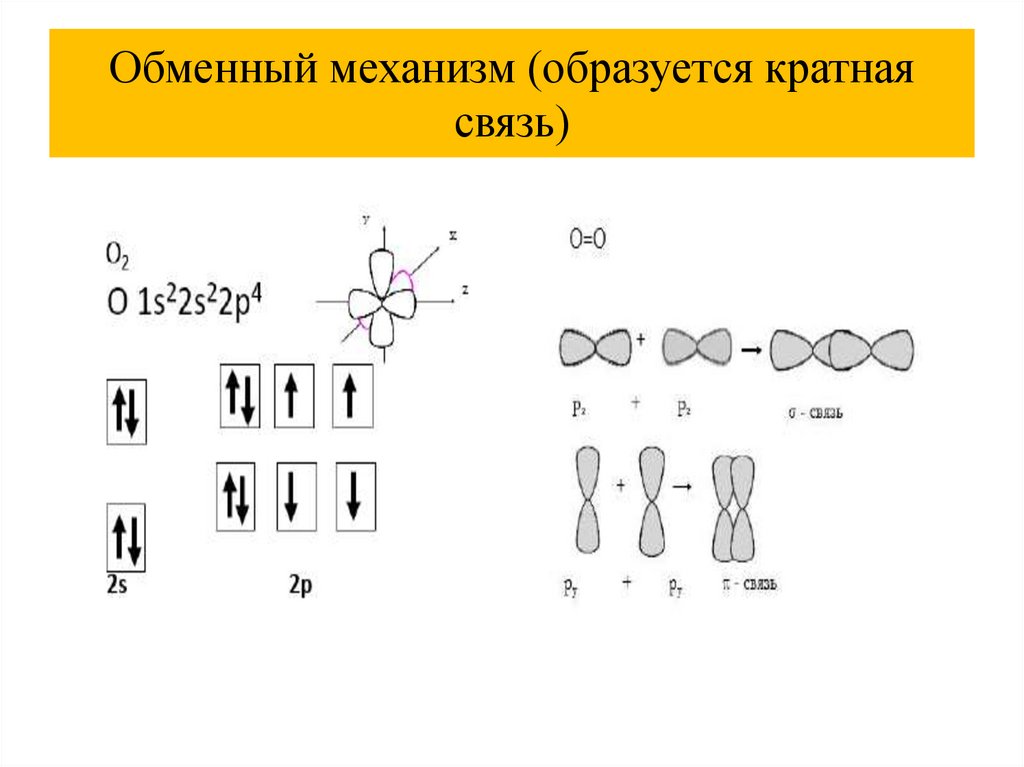
Обменный механизм32.
Обменный механизм (образуется кратнаясвязь)
33.
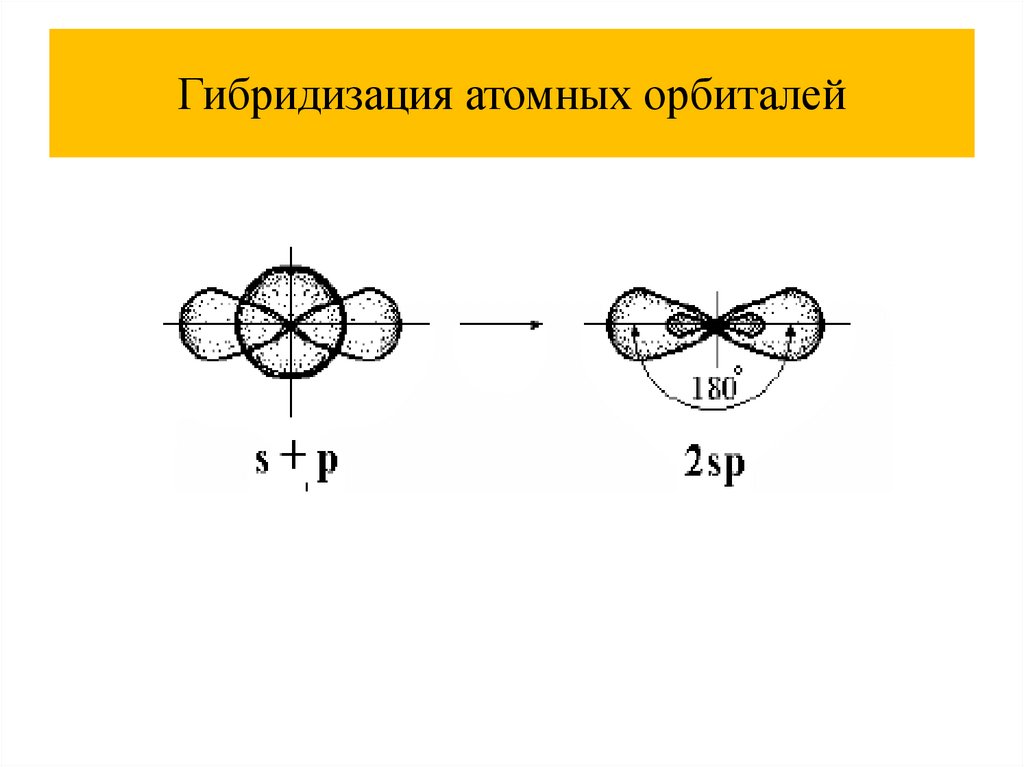
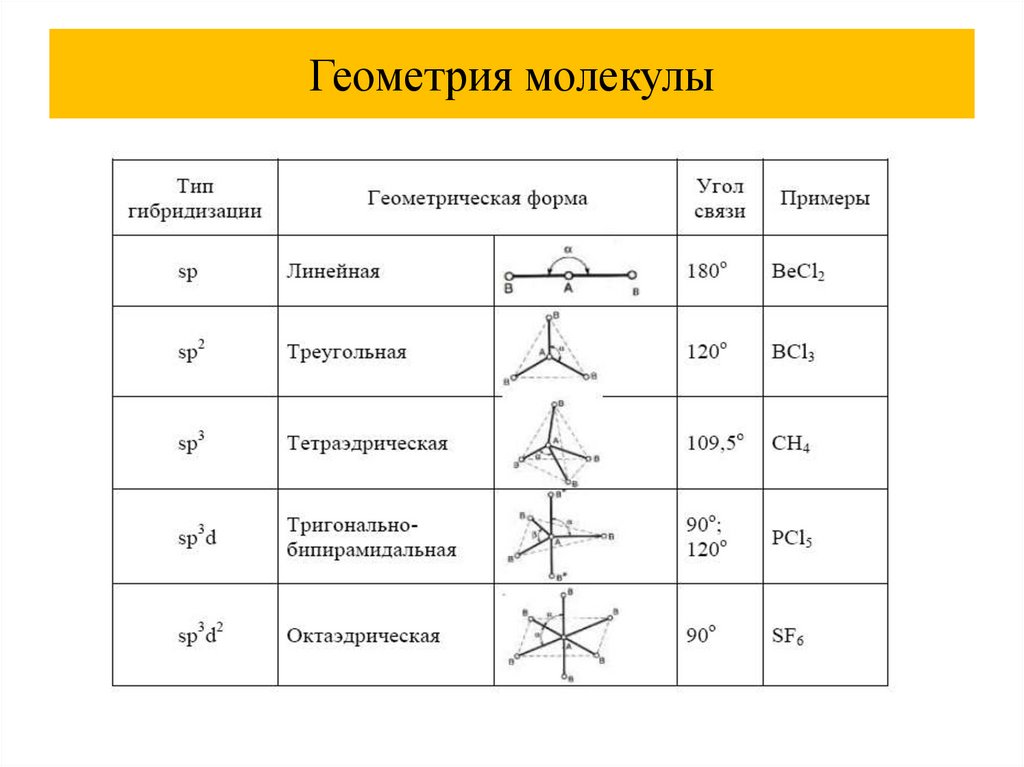
Гибридизация атомных орбиталей34.
Гибридизация атомных орбиталей35.
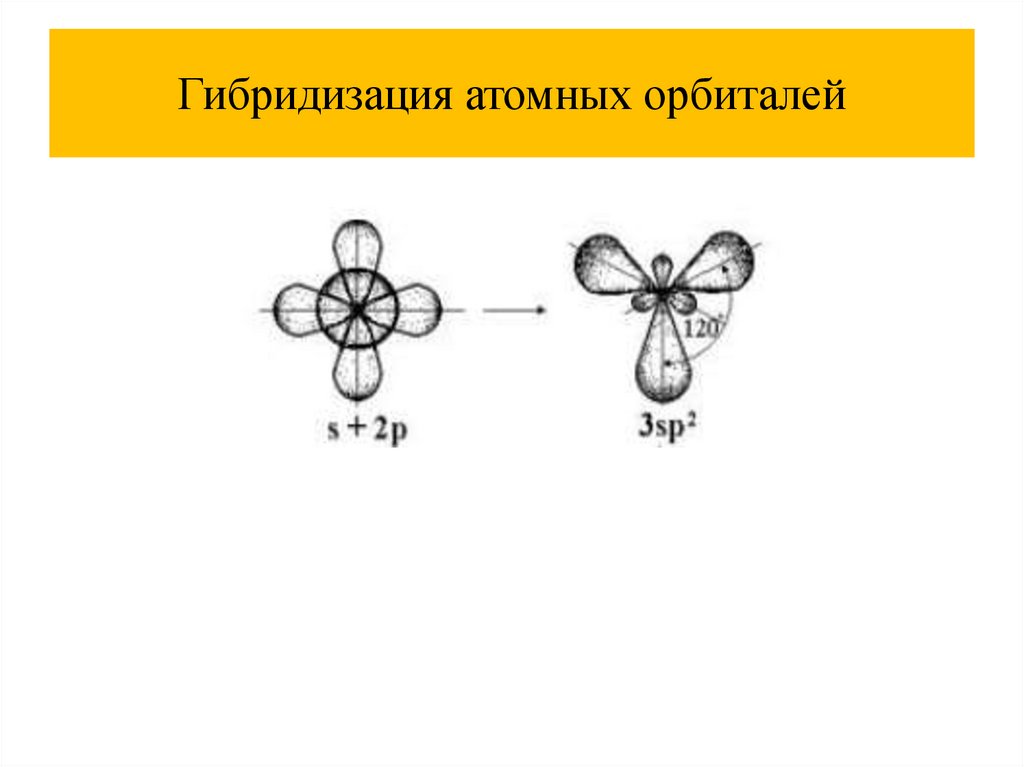
Гибридизация атомных орбиталей36.
Гибридизация атомных орбиталей37.
Геометрия молекулы38.
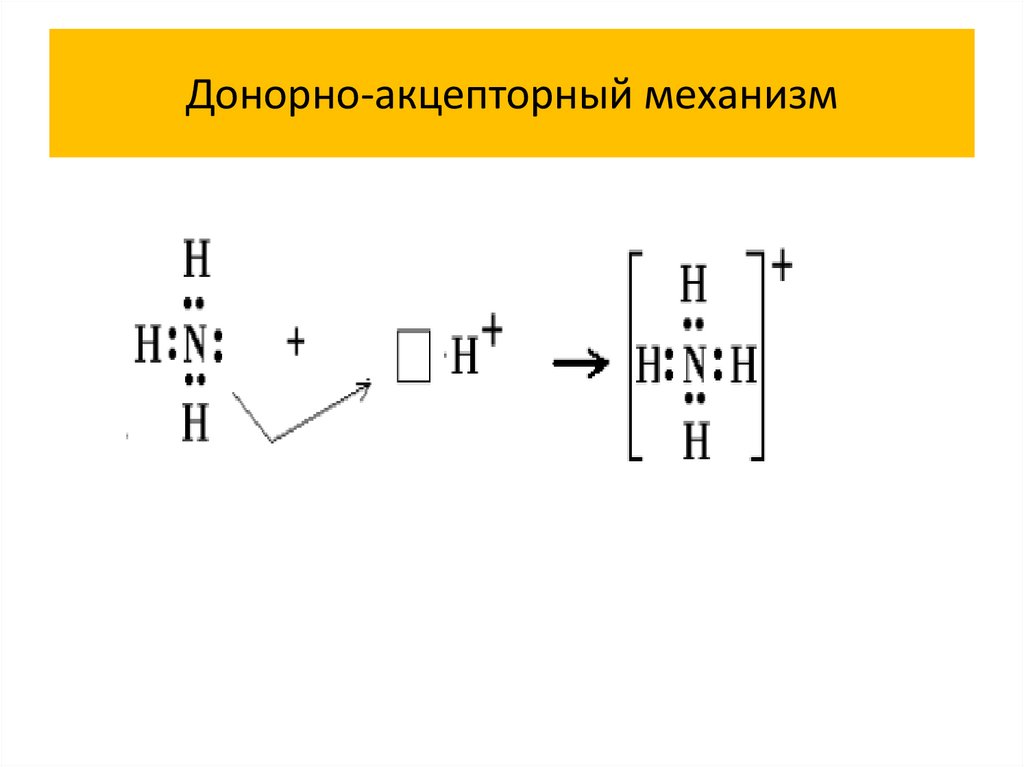
Донорно-акцепторный механизм39.
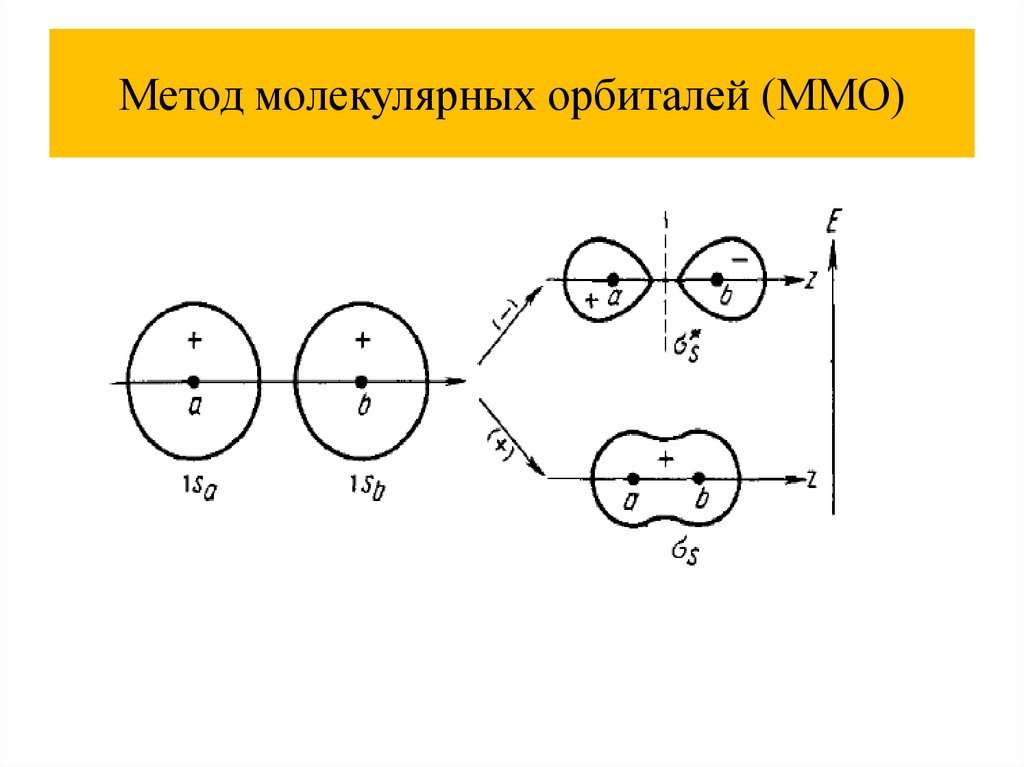
Метод молекулярных орбиталей (ММО)Основные положения
Каждый электрон находится в поле всех ядер, связь
делокализована.
Связь не обязательно образована парой электронов.
При комбинации атомных орбиталей (АО) образуются
молекулярные орбитали (МО), их количество равно сумме
атомных.
Электроны на молекулярных орбиталях размещаются по
тем же принципам, что и на атомных орбиталях .
Молекулярные орбитали называют: связывающие,
разрыхляющие, несвязывающие
40.
Метод молекулярных орбиталей (ММО)41.
Метод молекулярных орбиталей (ММО)42.
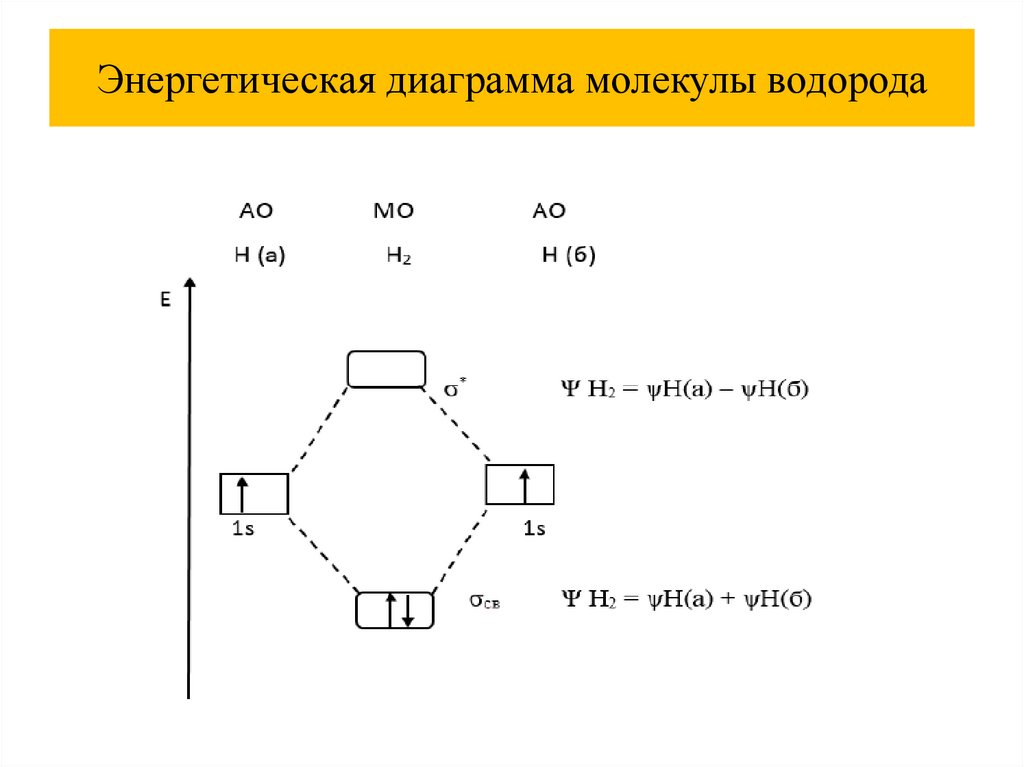
Энергетическая диаграмма молекулы водорода43.
Расчет порядка связи44.
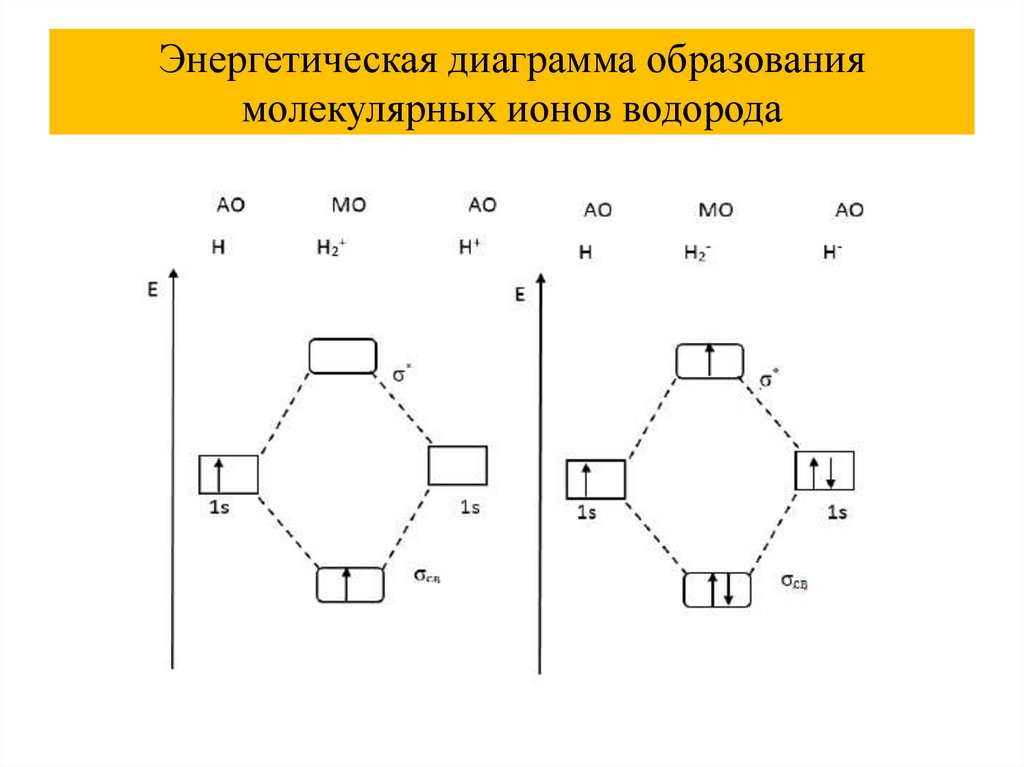
Энергетическая диаграмма образованиямолекулярных ионов водорода
45.
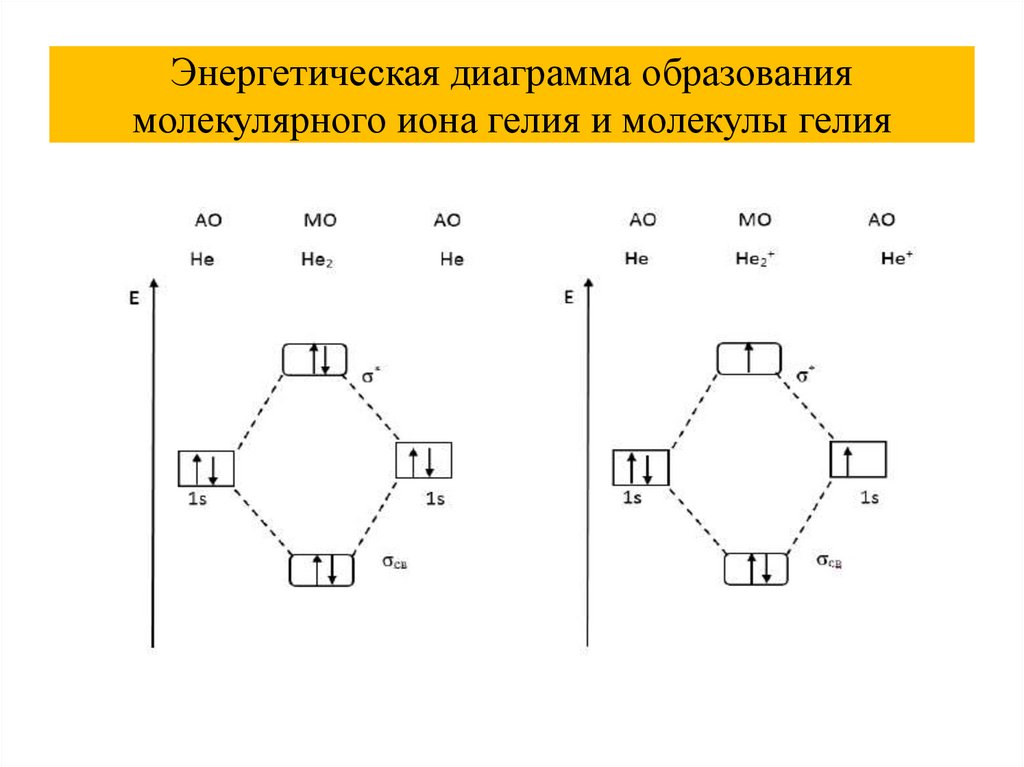
Энергетическая диаграмма образованиямолекулярного иона гелия и молекулы гелия
46.
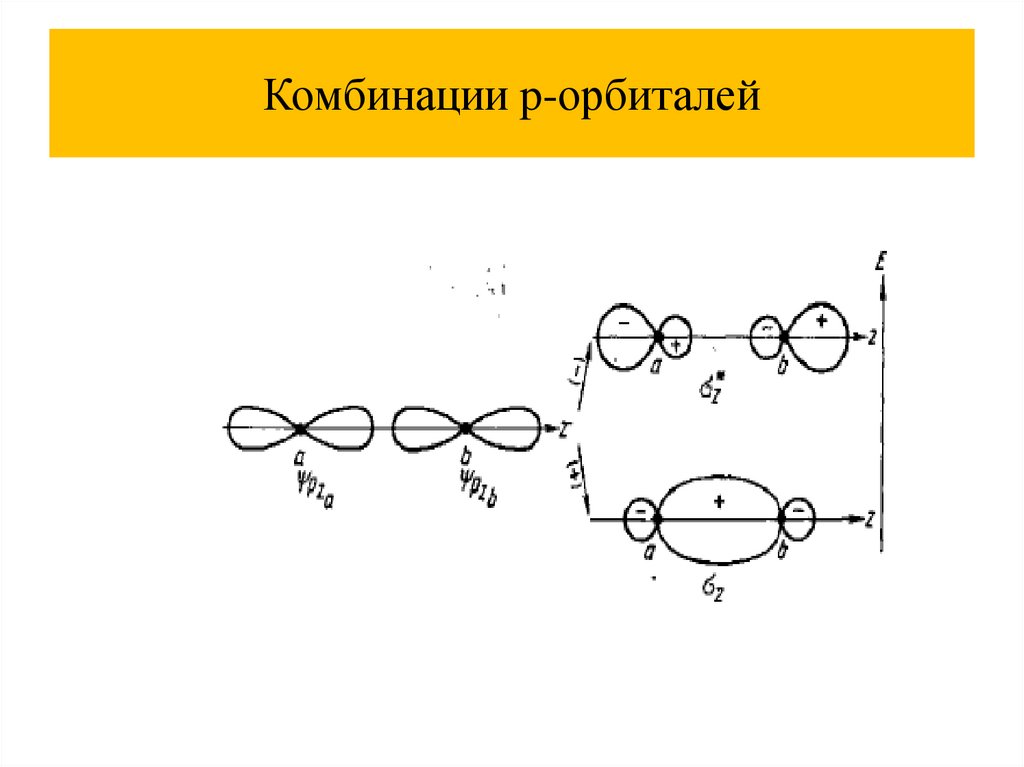
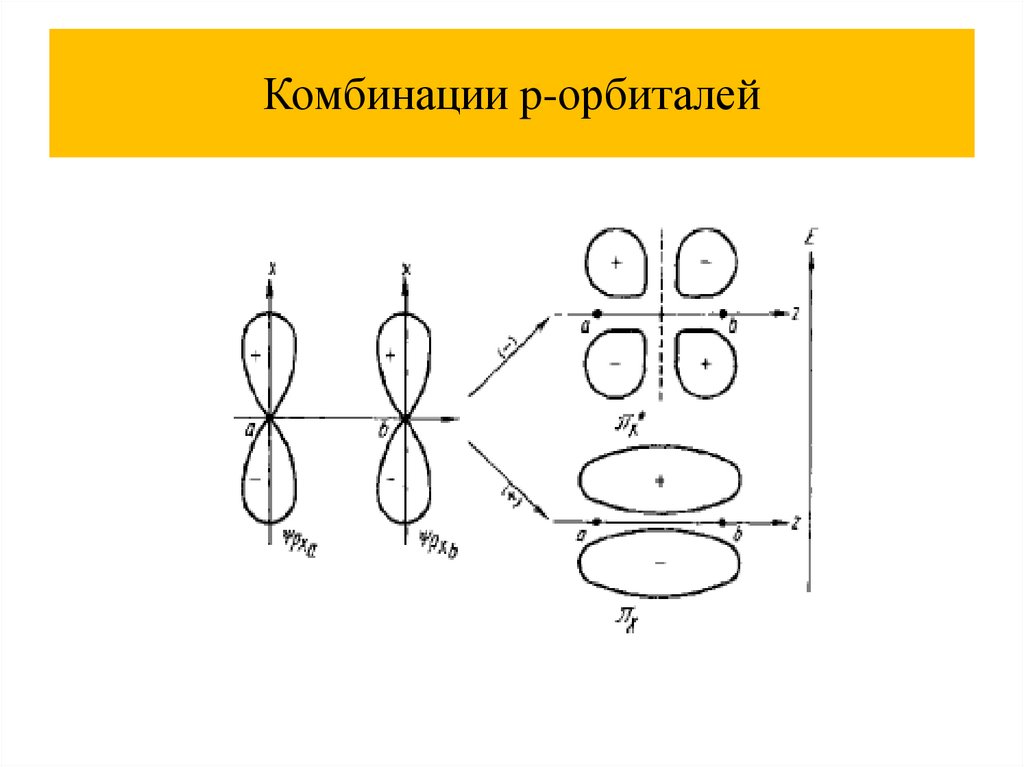
Комбинации p-орбиталей47.
Комбинации p-орбиталей48.
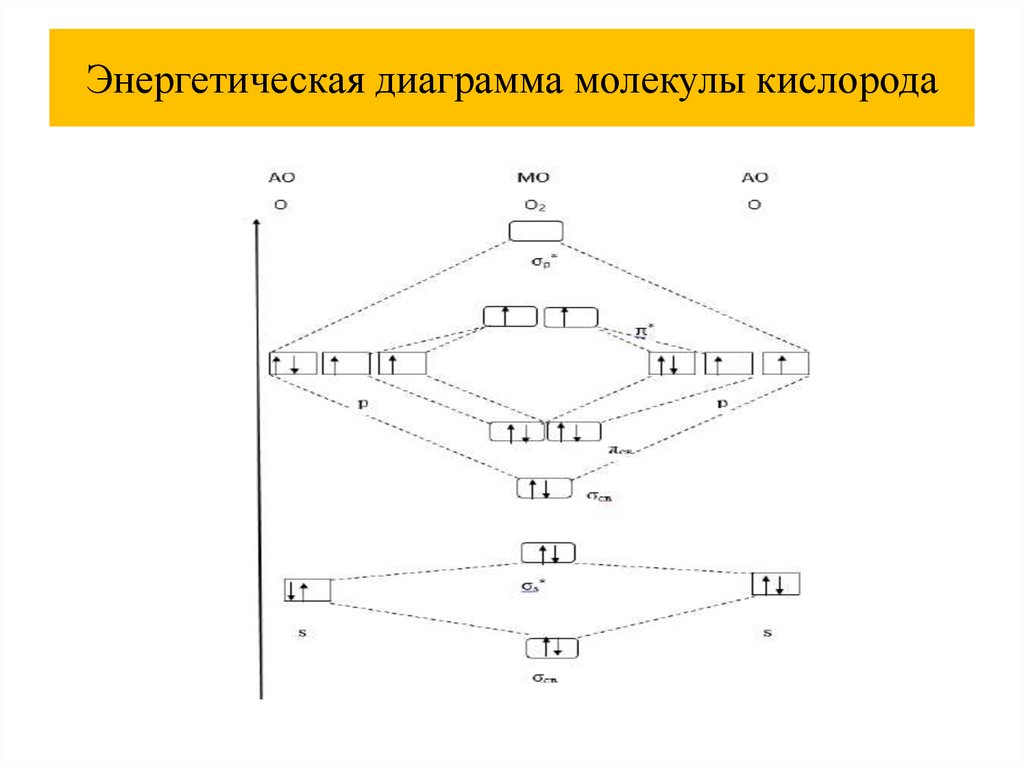
Электронная формула молекулы кислорода49.
Энергетическая диаграмма молекулы кислорода50.
Полярность ковалентной связи51.
Эффективный заряд52.
Полярность ковалентной связи53.
Дипольный момент связи54.
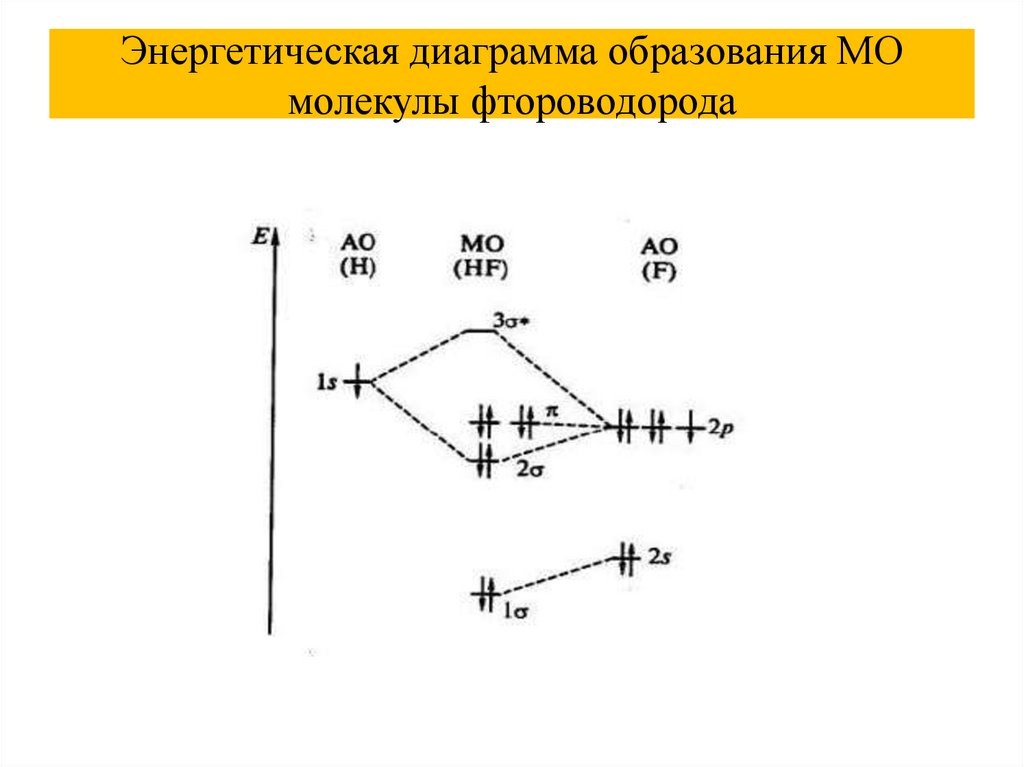
Энергетическая диаграмма образования МОмолекулы фтороводорода






































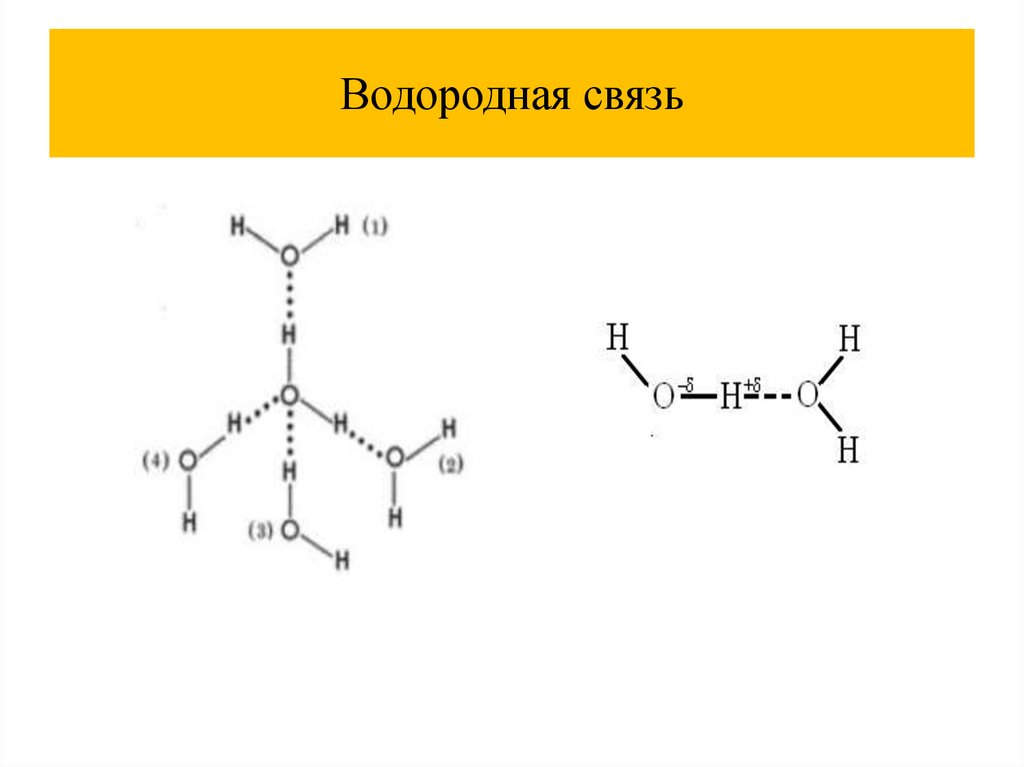
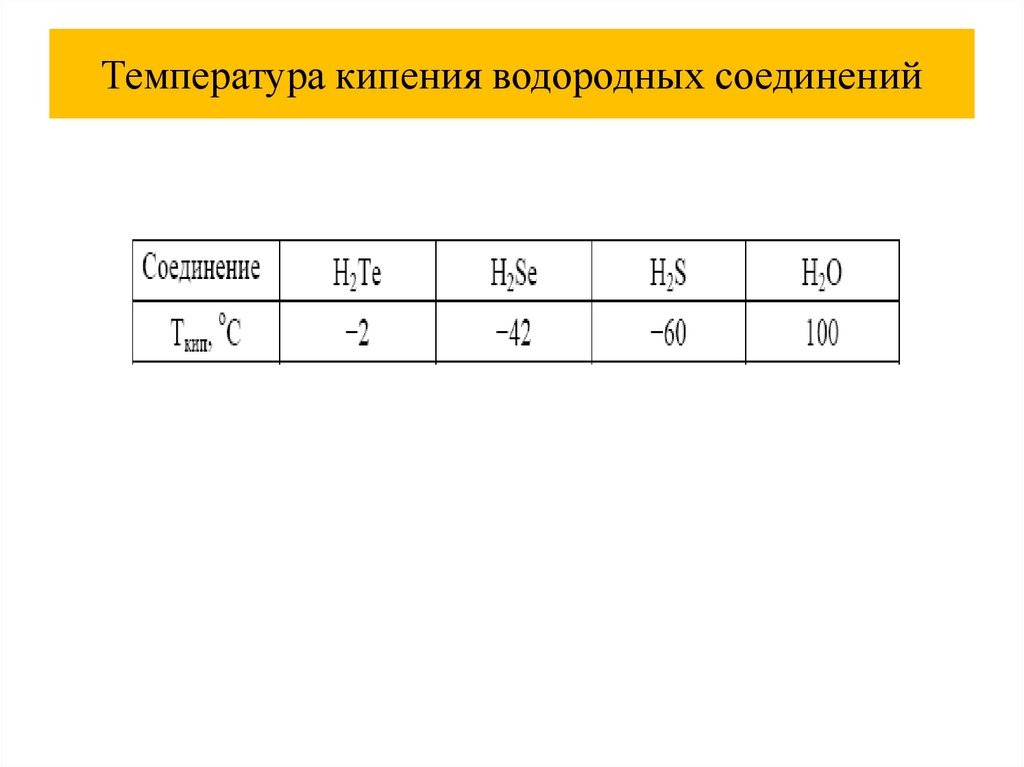

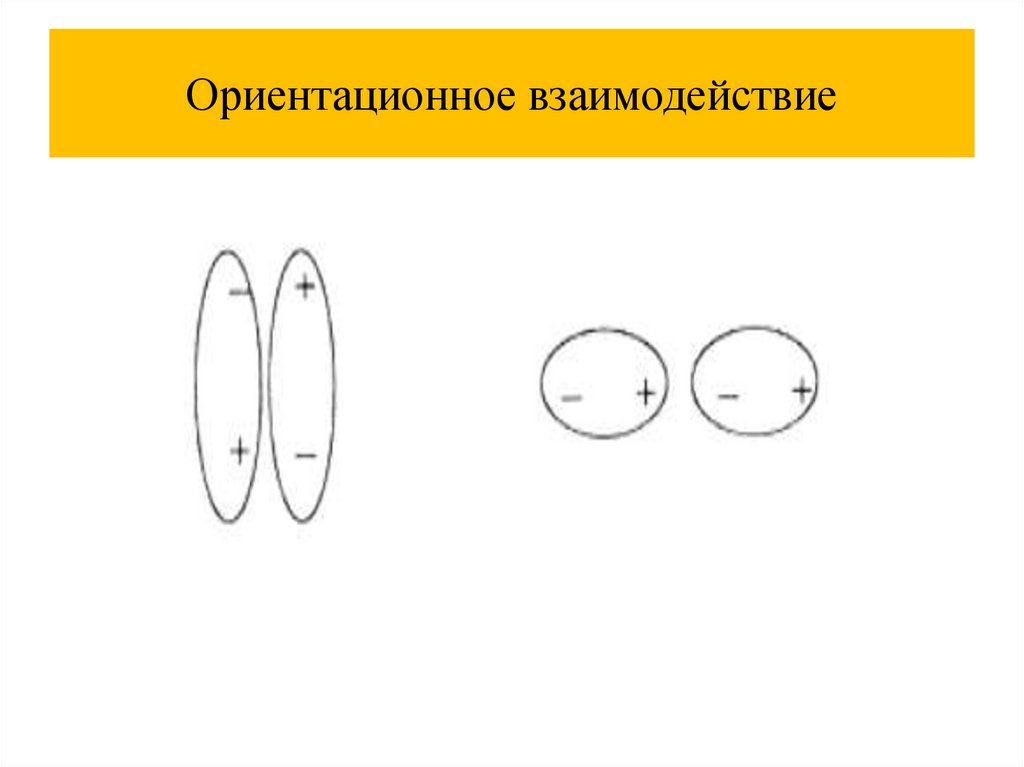

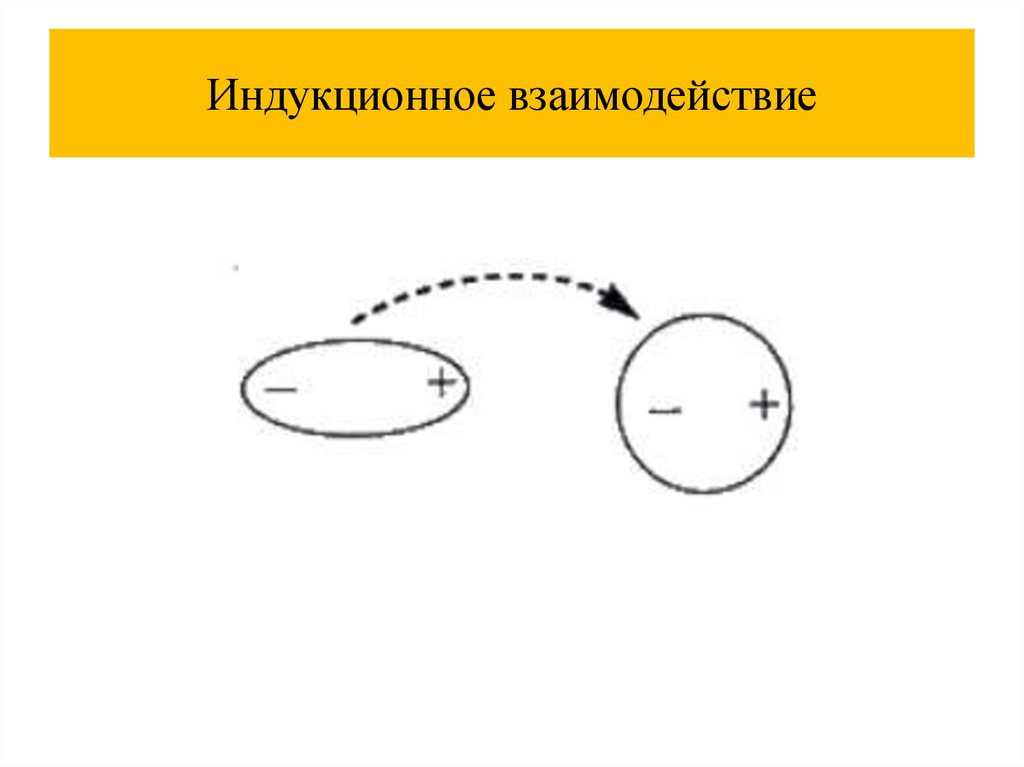


 Химия
Химия








