Похожие презентации:
Соединения галогенов
1.
Соединения галогенов2.
Тема урока: Соединения галогеновЦель урока: ознакомить учащихся с
основными соединениями галогенов
Задачи:
Состав и свойства галогеноводородов
Получение галогеноводородов
Изучение свойств соляной кислоты
Соли галогеноводородных кислот
3.
Этапы урока• Водородные соединения галогенов
(учащиеся используют ПС, таблицу
растворимости)
• Получение хлороводорода в лаборатории
(демонстрационный опыт)
• Общие свойства соляной кислоты
(ученический эксперимент)
• Соли галогеноводородов (составляют
химические формулы, определяют
растворимость, качественный реактив)
• Применение знаний
4.
Тип урока: проблемно- поисковый• Вид деятельности:
словесный, аналитический, размышление,
экспериментальный
• Знания: закрепление знаний о соединениях
галогенов –кислоты, соли
• Умения: анализировать новую информацию
с ранее изученной, делать самостоятельно
выводы
• Навыки: связь теоретических знаний с
результатами
эксперимента, развитие техники лабораторной
работы
• Актуальность: использование знаний
на уроках химии, в повседневной жизни
• Новизна: эксперимент - микрометод
5.
План урока
Водородные соединения
галогенов
Получение хлороводорода в
лаборатории (демонстрационный
опыт)
Общие свойства соляной кислоты
(ученический эксперимент)
Соли галогеноводородов
Применение знаний
6.
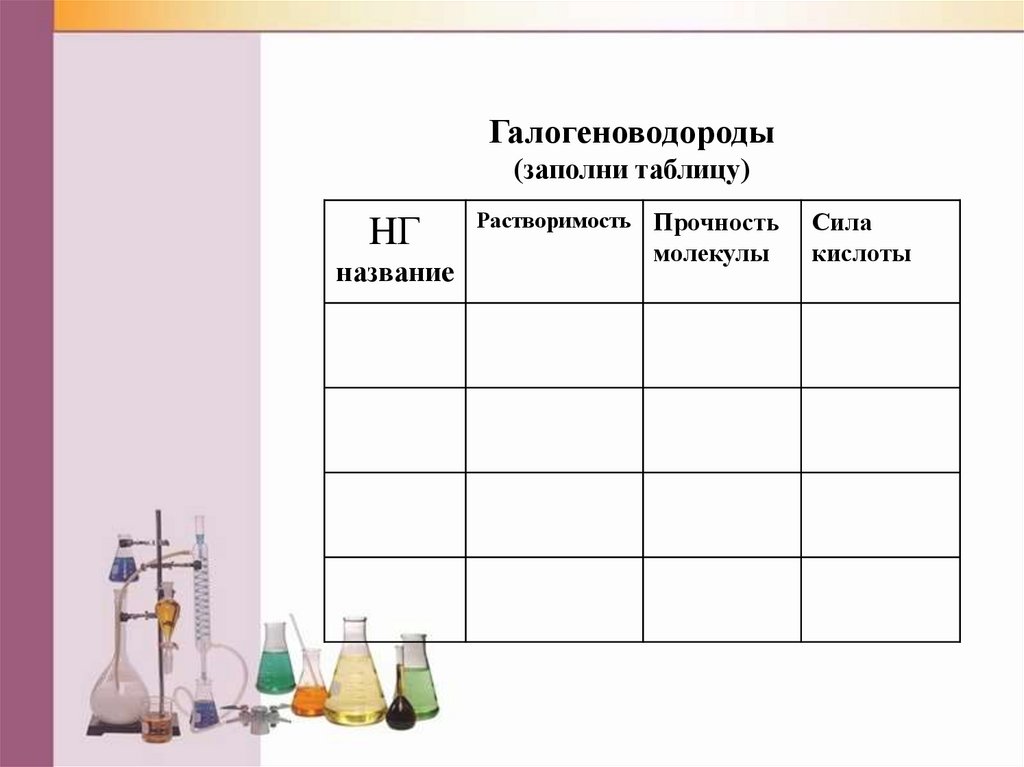
Галогеноводороды(заполни таблицу)
HГ
название
Растворимость Прочность
молекулы
Сила
кислоты
7.
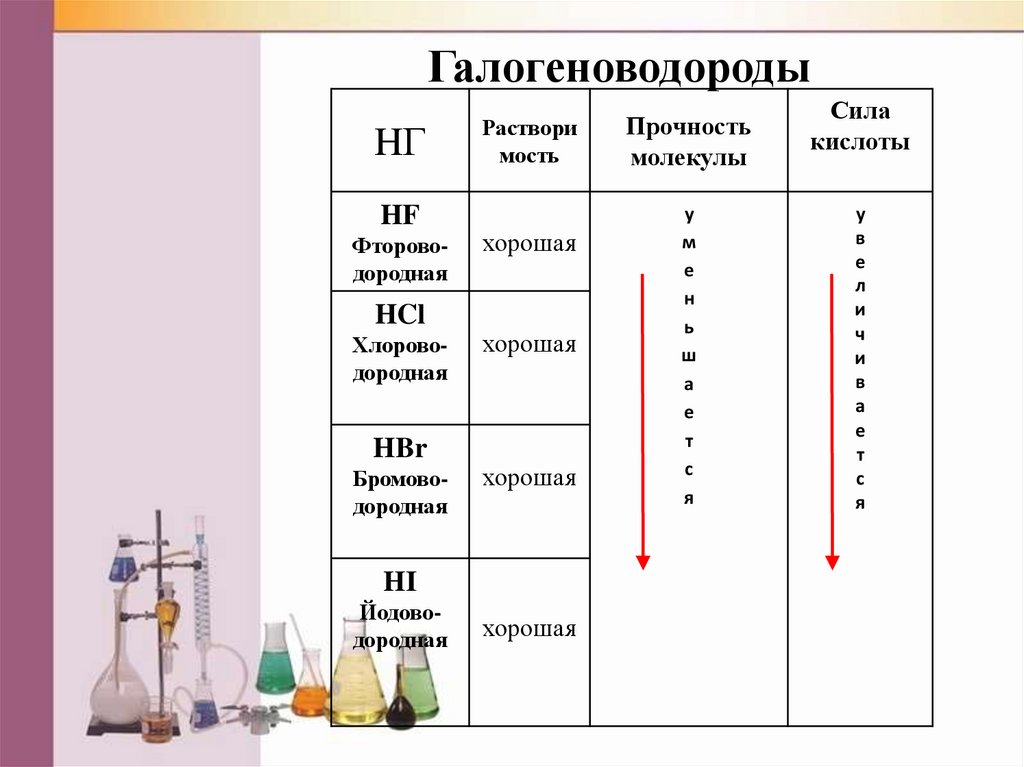
ГалогеноводородыHГ
HF
Фтороводородная
HCl
Хлороводородная
HBr
Бромоводородная
Раствори
мость
хорошая
хорошая
хорошая
HI
Йодоводородная
хорошая
Прочность
молекулы
у
м
е
н
ь
ш
а
е
т
с
я
Сила
кислоты
у
в
е
л
и
ч
и
в
а
е
т
с
я
8.
Соляная кислота- HClСоляная кислота – бесцветная, дымящая на воздухе жидкость
(в продажу поступает 36% раствор хлороводорода в воде)
несколько тяжелее воды (плотность 1.19 г/мл)
9.
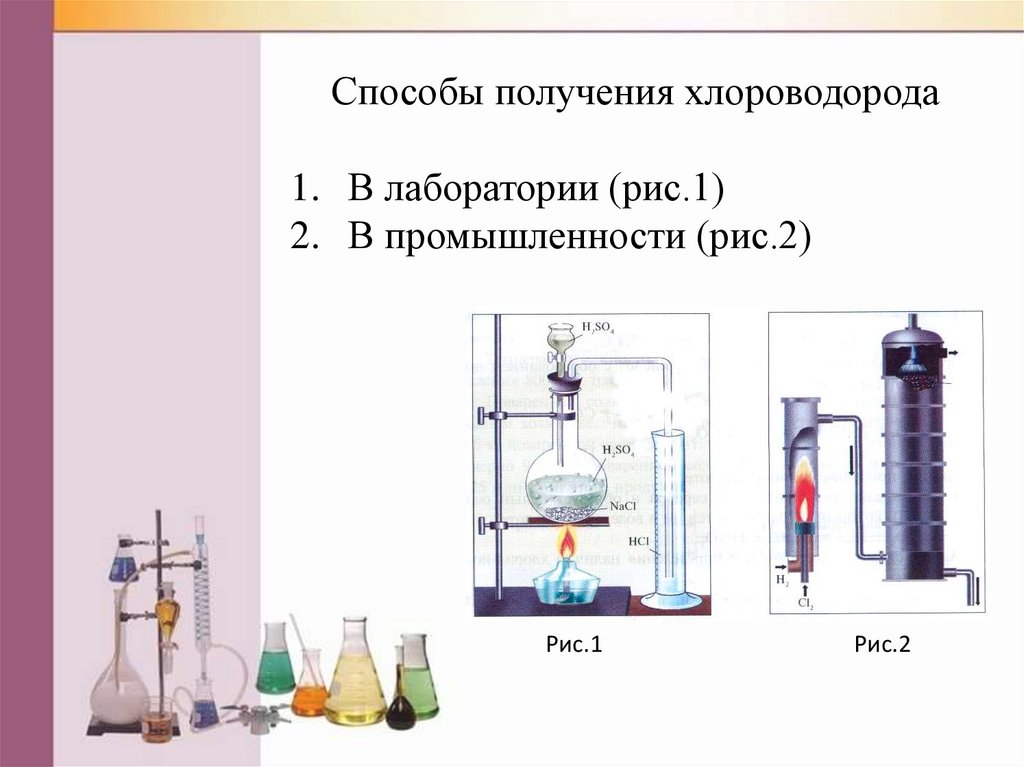
Способы получения хлороводорода1. В лаборатории (рис.1)
2. В промышленности (рис.2)
Рис.1
Рис.2
10.
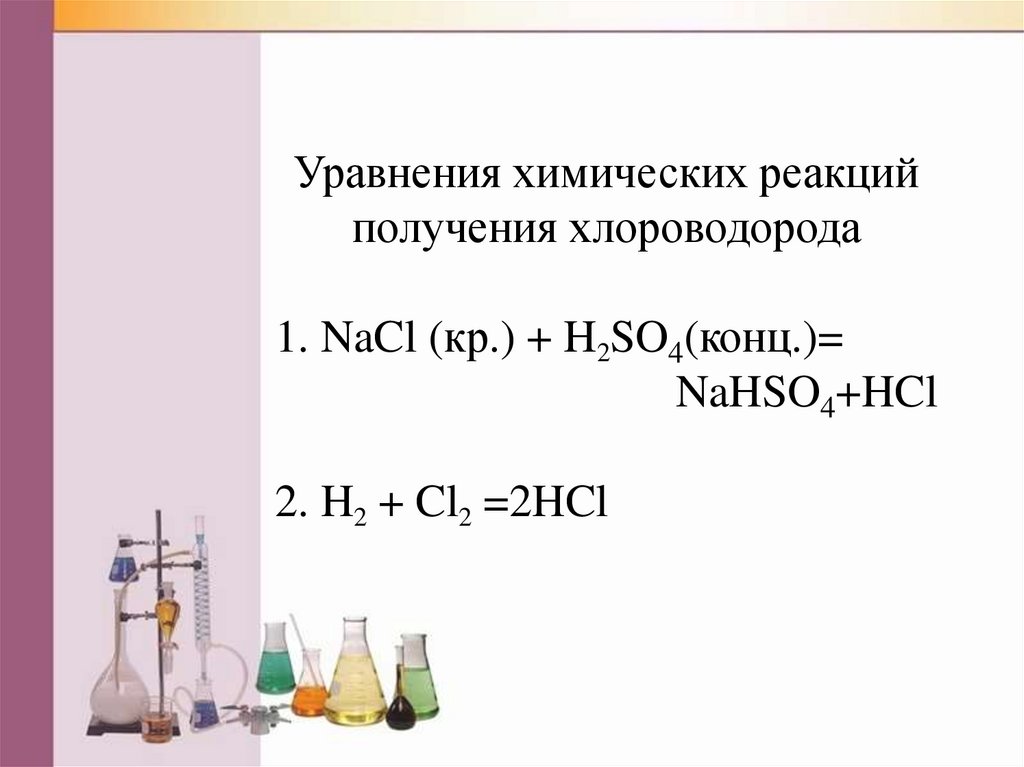
Уравнения химических реакцийполучения хлороводорода
1. NaCl (кр.) + H2SO4(конц.)=
NaHSO4+HCl
2. H2 + Cl2 =2HCl
11.
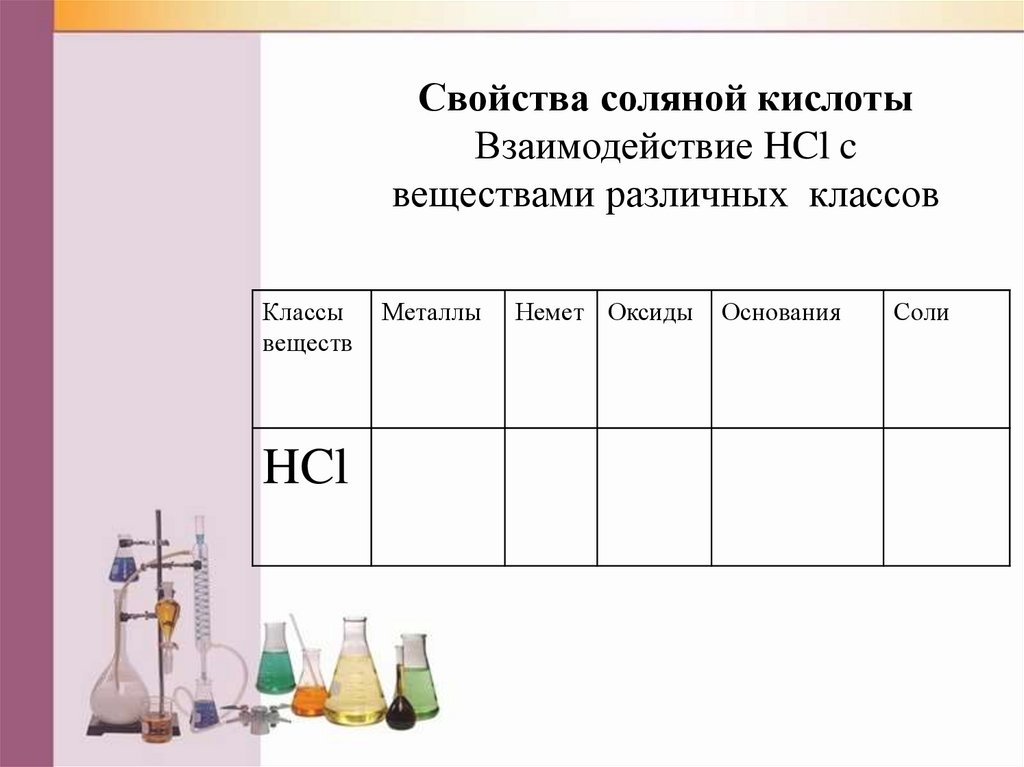
Свойства соляной кислотыВзаимодействие HCl c
веществами различных классов
Классы
веществ
HCl
Металлы
Немет Оксиды
Основания
Соли
12.
Свойства соляной кислотыc веществами каких классов
реагирует
Классы
веществ
Металлы
Неме
Оксиды
Основания
Соли
HCl
+ до Н в
ряду
напряжения
-
МеО
Основные,
Амфотер.
+
+ если
обр-ся
непрочная
кислота
13.
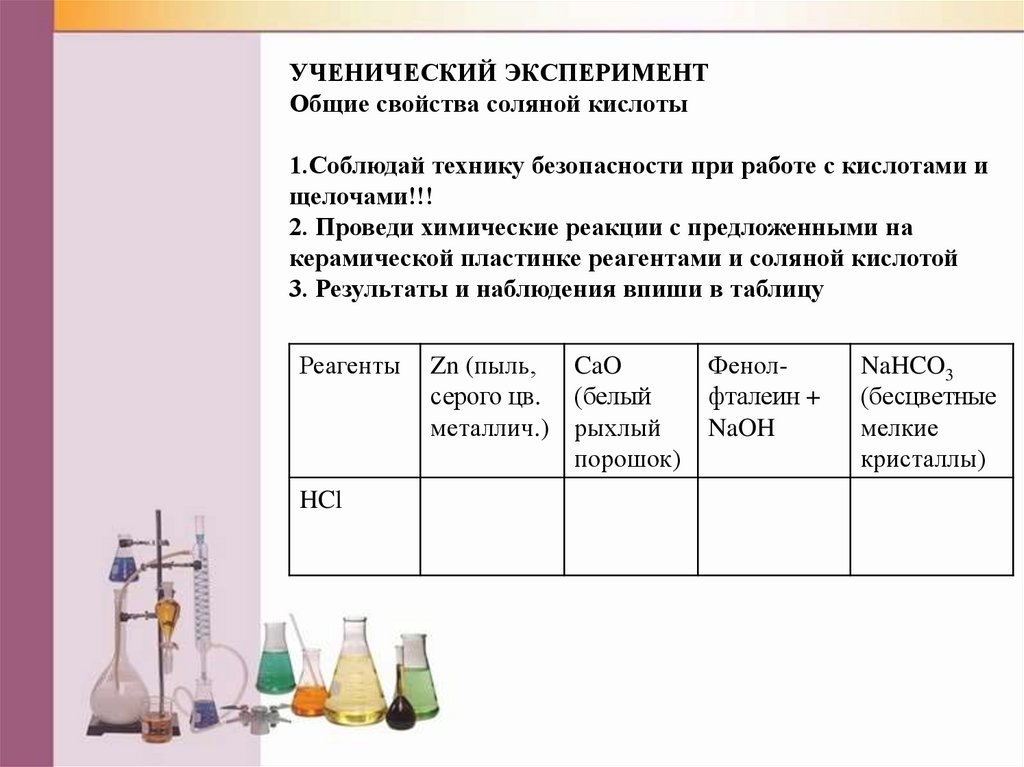
УЧЕНИЧЕСКИЙ ЭКСПЕРИМЕНТОбщие свойства соляной кислоты
1.Соблюдай технику безопасности при работе с кислотами и
щелочами!!!
2. Проведи химические реакции с предложенными на
керамической пластинке реагентами и соляной кислотой
3. Результаты и наблюдения впиши в таблицу
Реагенты
HCl
Zn (пыль, CaO
серого цв. (белый
металлич.) рыхлый
порошок)
Фенолфталеин +
NaOH
NaHCO3
(бесцветные
мелкие
кристаллы)
14.
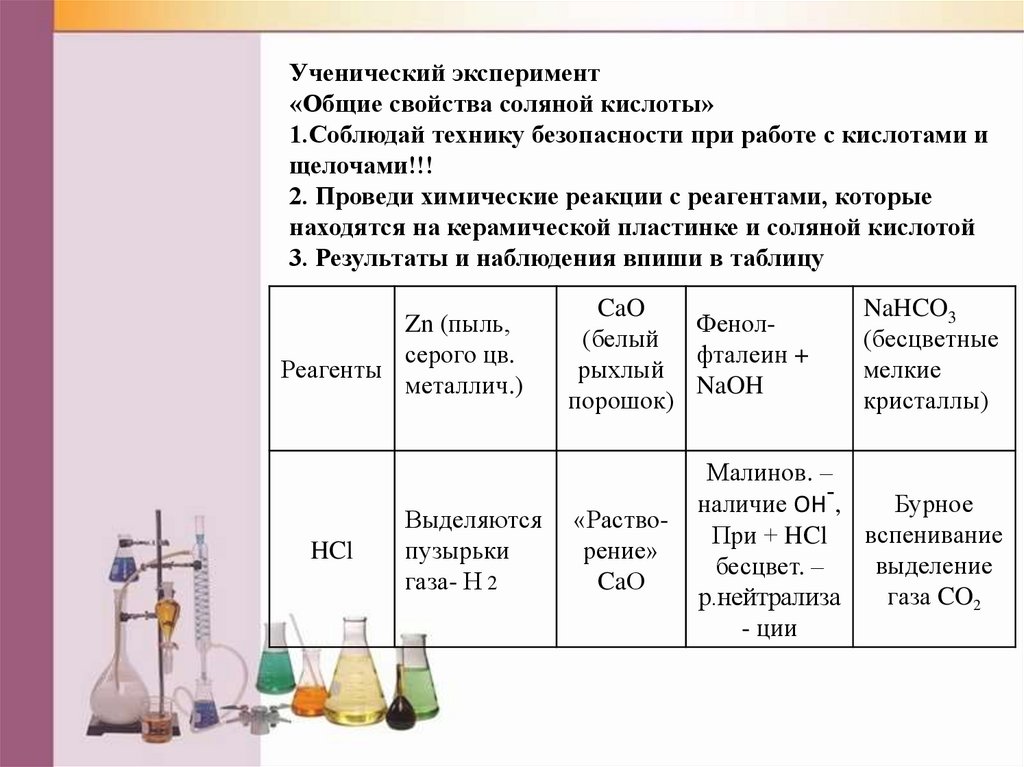
Ученический эксперимент«Общие свойства соляной кислоты»
1.Соблюдай технику безопасности при работе с кислотами и
щелочами!!!
2. Проведи химические реакции с реагентами, которые
находятся на керамической пластинке и соляной кислотой
3. Результаты и наблюдения впиши в таблицу
Zn (пыль,
серого цв.
Реагенты
металлич.)
HCl
Выделяются
пузырьки
газа- Н 2
CaO
Фенол(белый
фталеин +
рыхлый
NaOH
порошок)
«Растворение»
CaО
NaHCO3
(бесцветные
мелкие
кристаллы)
Малинов. –
наличие ОН-,
Бурное
При + HCl вспенивание
выделение
бесцвет. –
газа CO2
р.нейтрализа
- ции
15.
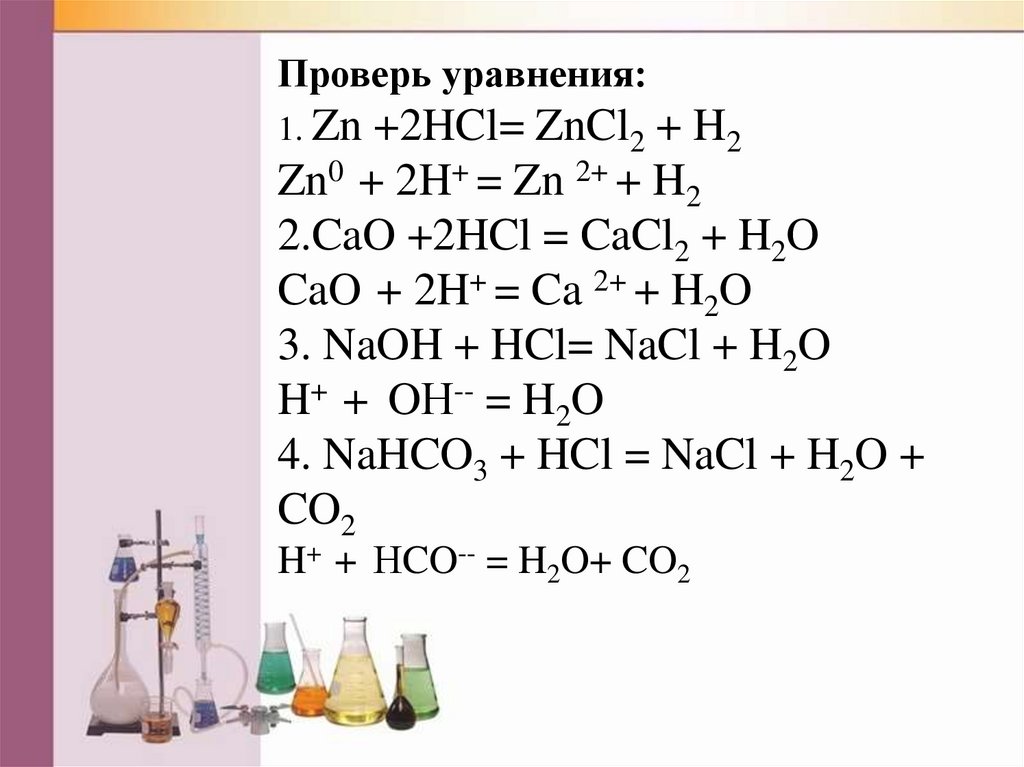
Проверь уравнения:1. Zn
+2HCl= ZnCl2 + H2
Zn0 + 2H+ = Zn 2+ + H2
2.CaO +2HCl = CaCl2 + H2O
CaO + 2H+ = Ca 2+ + H2O
3. NaOH + HCl= NaCl + H2O
H+ + OН-- = H2O
4. NaHCO3 + HCl = NaCl + H2O +
CO2
H+ + НCO-- = H2O+ CO2
16.
Зарядка для глаз17.
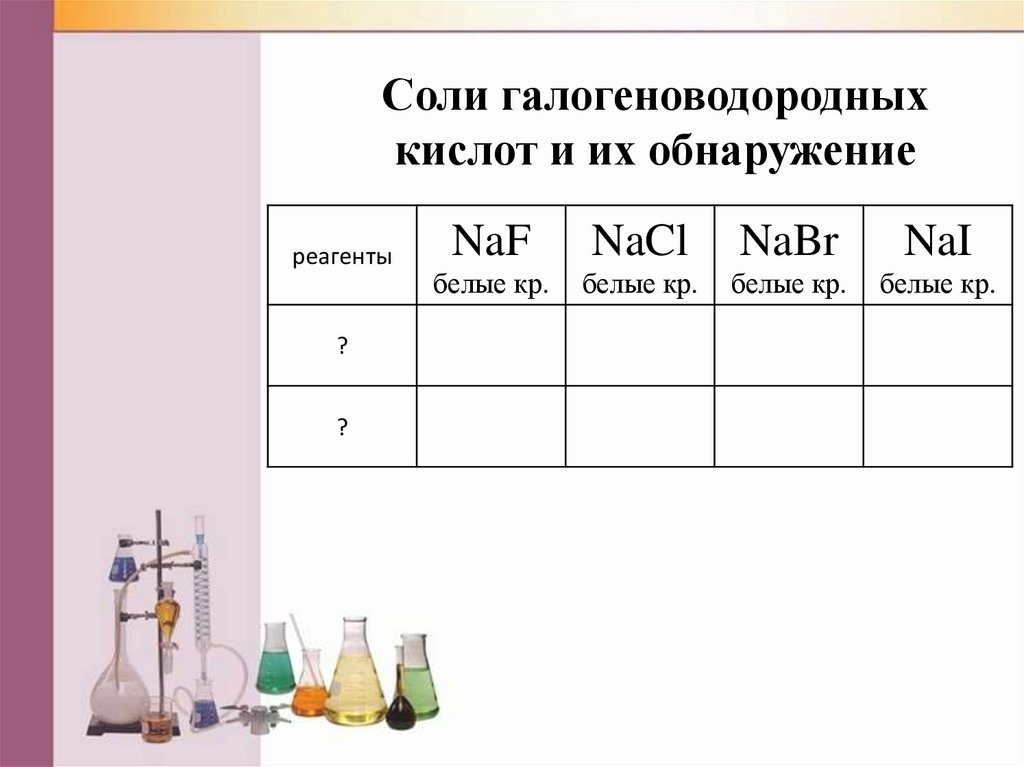
Соли галогеноводородныхкислот и их обнаружение
реагенты
?
?
NaF
NaCl
NaBr
NaI
белые кр.
белые кр.
белые кр.
белые кр.
18.
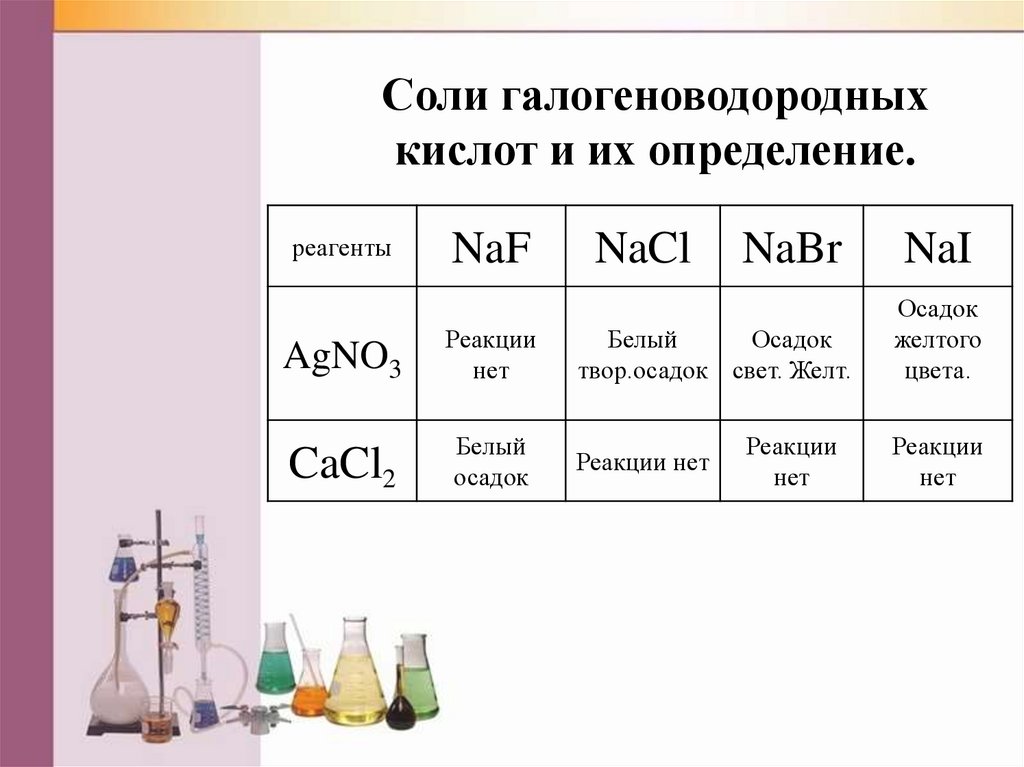
Соли галогеноводородныхкислот и их определение.
реагенты
NaF
AgNO3
Реакции
нет
CaCl2
Белый
осадок
NaCl
NaBr
Белый
Осадок
твор.осадок свет. Желт.
Реакции нет
Реакции
нет
NaI
Осадок
желтого
цвета.
Реакции
нет
19.
Применение знаний урока• при изучении последующих тем
курса химии;
• на контрольной работе;
• при сдаче ОГЭ;
• в повседневной жизни.
20.
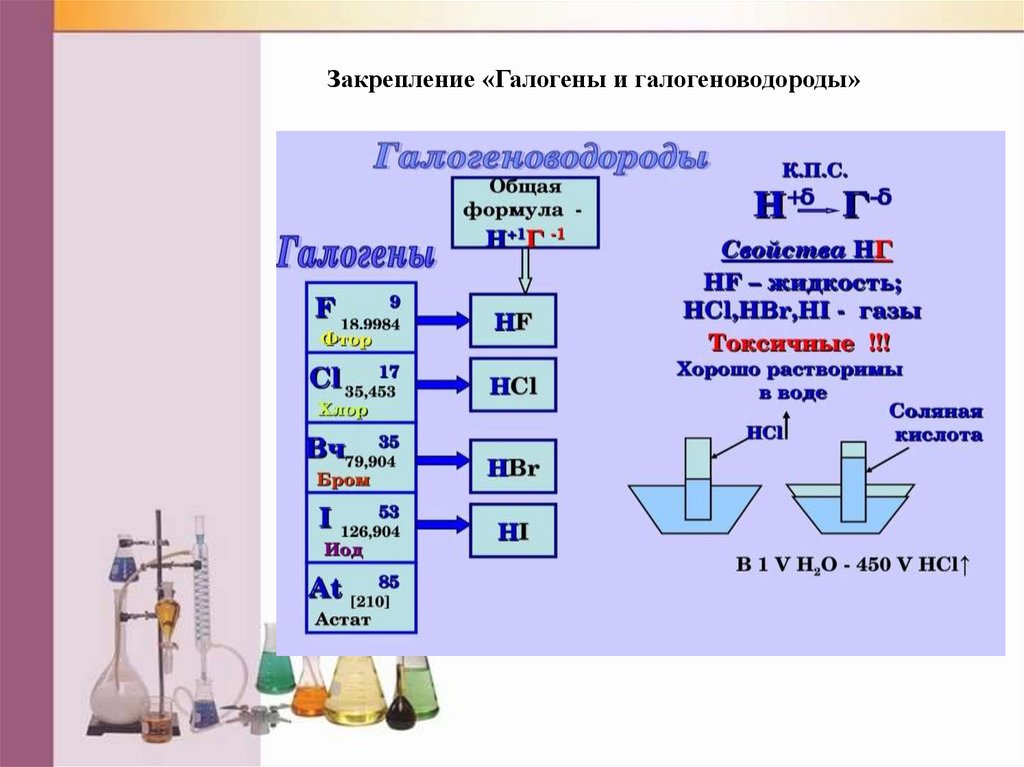
Закрепление «Галогены и галогеноводороды»21.
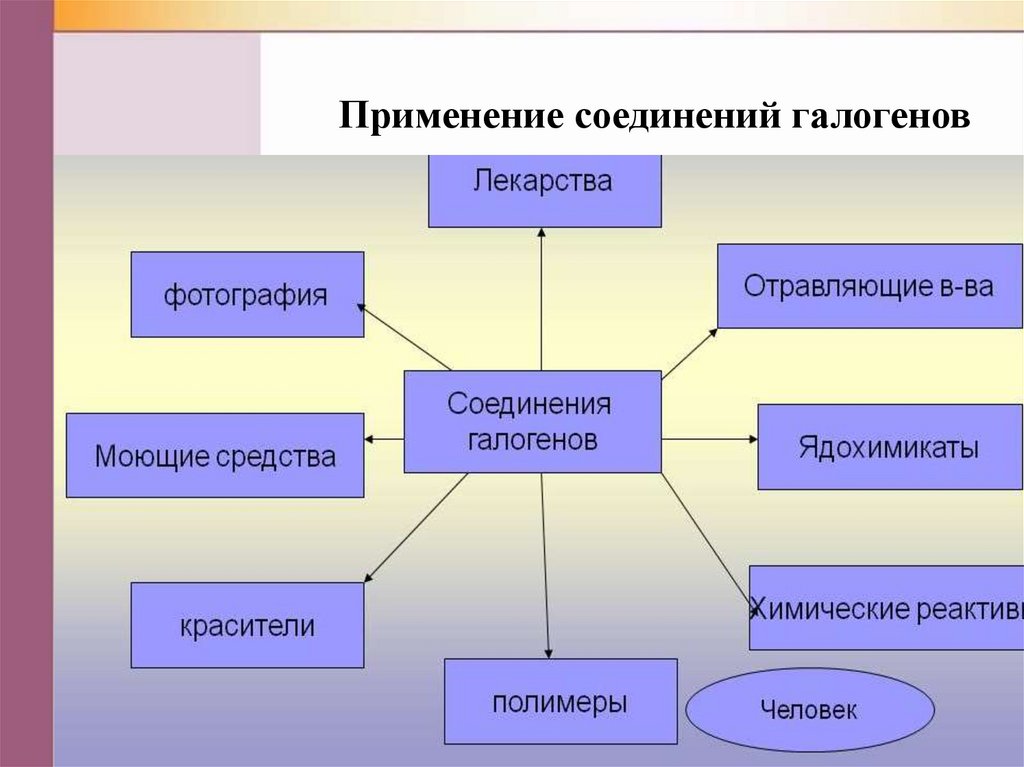
Применение соединений галогенов22.
Задания из ОГЭ 20171. В реакцию с соляной кислотой вступает:
1) нитрат серебра 2) нитрат калия 3) серебро 4) оксид
кремния
2. Какое сокращённое ионное уравнение соответствует
взаимодействию соляной кислоты с оксидом меди(ІІ)?
1) Cu2+ + H+ = CuCl2 + H2O 2) CuO + 2 H+ = Cu2+ + H2O
3) Cu(OH)2 + 2H+ = Cu2+ + 2 H2O 4) CuO + H+ = Cu2+ + 2 H2O
3. С помощью какого реактива можно различить
растворы веществ NaCl и NaNO3?
1) лакмус 2) AgNO3 3) H2SO4 4)фенолфталеин
23.
Ответы к заданиям ОГЭ 20171)AgNO3+HCl =AgCl + HNO3
2) CuO + 2 H+ = Cu2+ + H2O
3) AgNO3+NaCl =AgCl + HNO3
24.
Домашнее задание:1. Составить ионные уравнения
химических реакций по
результатам эксперимента
2. п.19 у.1-4
Спасибо за внимание!











 Химия
Химия








