Похожие презентации:
Соединения галогенов
1. Соединения галогенов.
2. Цели урока:
Рассмотреть свойства иприменение важнейших
соединений галогенов. Изучить
качественные реакции на
галогенид-ионы. Рассмотреть
свойства и применение важнейших
соединений галогенов и способы
получения галогенов.
3. Основное содержание
Понятие о галогеноводородахГалогеноводородные кислоты
Оксокислоты
Галогениды.(соли)
Значение соединений галогенов.
4. Соединения галогенов
Галогеноводороды, – Это едкие газы срезким запахом, хорошо раствормые в воде
HF
фтороводород
HCl
хлороводород
HBr
бромоводород
HI
йодоводород
5.
Получение хлороводородаNaСl(тв) + Н2SО4(конц) = НСl↑ + NaНSО4.
6. Галогеноводородные кислоты
Образуются при растворениигалогеноводородов в воде.
HF
HCl
Фтороводородная хлороводородная
кислота
кислота
(соляная)
(плавиковая)
HBr
HI
бромоводородная
кислота
йодоводородная
кислота
7. Оксокислоты
Хлорная–
НСlO4
Сl2O7
Хлорноватая – НСlO3
Сl2O5
Хлористая –
Сl2O3
НСlO2
Хлорноватистая- НСlO
Сl2O
8. Соли
ГалогенидыФториды
Хлориды
Бромиды
Йодиды
Na F
KCl
KBr
NaI
9. Качественная реакция на галогенид - ионы
AgNO3 + KCl = KNO3 + AgCl↓ белый )AgNO3 + KВr = KNO3 + AgBr↓ (Светло-желтый)
AgNO3 + KI = KNO3 + AgI↓ (желтый)
Ca(NO3)2 + 2KF = 2KNO3 + CaF2↓(белый)
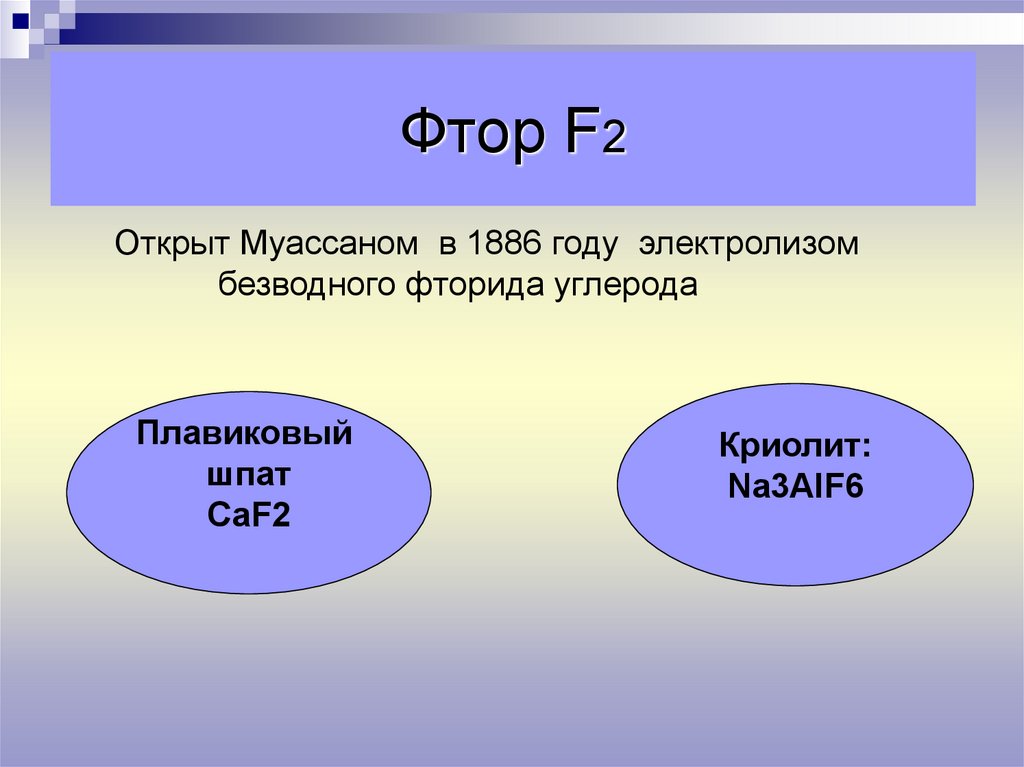
10. Фтор F2
Открыт Муассаном в 1886 году электролизомбезводного фторида углерода
Плавиковый
шпат
СаF2
Криолит:
Na3AlF6
11. Соединения фтора
n(-CF2-CF2-)Тефлон устойчив к
действию всех
известных кислот и их
смесей. Он
выдерживает
температуры от -269 до
+200°С.
Плавиковая кислота:
HF
Разъедает стекло
Зарин и зоман-
Боевые отравляющие
вещества
12. Соединения фтора
.Соединения фтора
1) Плавление стекла:
SiO2 + 4HF → SiF4 + 2H2O
2) Между щелочами и фтором характерна
реакция диспропорционирования:
2NaOH + 2F2 → 2NaF + OF2 + H2O
3) Взаимодействия фтора с водой
2F2 + 2H2O → 4HF + O2↑
13. Соединения Хлора
1) Взаимодействие хлора с холодным и горячемраствором щелочи:
Cl2 + 2NaOH хол.р-ра → NaClO + NaCl + H2O
(гипохлорит натрия)
3Cl2 + 6NaOH гор.р-ра → NaClO3 + 5NaCl + 3H2O
(хлорат натрия)
2) KClO3 - Бертолетова соль.
2KClO3 + 3S = 2KСl + 3SO2↑
14. Бром
AgBr- фотографияNaBr- дубление кожи
KBr- линзы
LiBr- используется в кондиционерах.
15. Йод
Получил Б.Куртуа. (1811 г)2NaI + 2H2SO4 = I2 + SO2↑ + Na2SO4 + 2H2O
16.
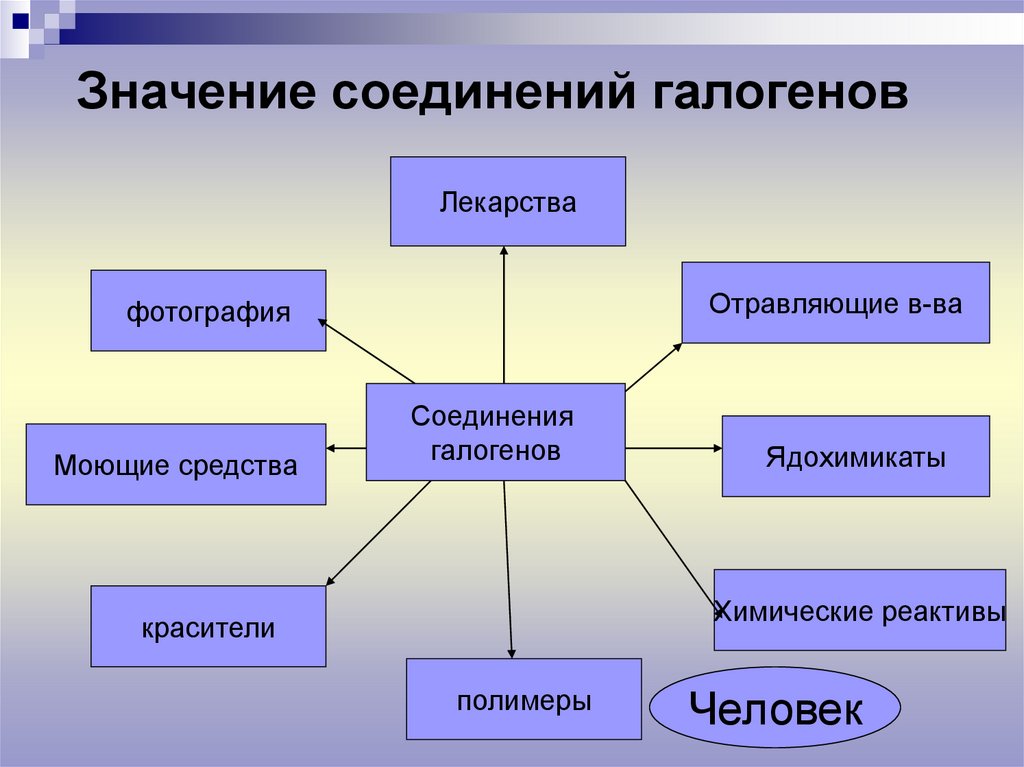
Значение соединений галогеновЛекарства
Отравляющие в-ва
фотография
Моющие средства
Соединения
галогенов
Ядохимикаты
Химические реактивы
красители
полимеры
Человек














 Химия
Химия








