Похожие презентации:
Химические свойства многоатомных спиртов
1.
ХИМИЧЕСКИЕСВОЙСТВА
МНОГОАТОМНЫХ
СПИРТОВ
Р
2.
1 СВОЙСТВО: ВЗАИМОДЕЙСТВИЕ СОЩЕЛОЧНЫМИ МЕТАЛЛАМИ
Этиленгликоль при этом образует однозамещённый
гликолят
2HO—CH2—CH2—OH + 2Na → 2HO—CH2—CH2—ONa + H2
(вещества в эквивалентном соотношении)
или
двухзамещённый гликолят:
HO—CH2—CH2—OH + 2Na → NaO—CH2—CH2—ONa + H2
(натрий в избытке)
3.
2 СВОЙСТВО: ВЗАИМОДЕЙСТВИЕ СРАСТВОРАМИ ЩЕЛОЧЕЙ
CH2-OH
│
CH -OH
│
CH2-OH
CH2-OH
│
CH2-OH
CH2-O-Na
+ NaOH →
+ NaOH →
│
CH -O-Na + H2O
│
CH2-ONa
CH2-O-Na
│
CH2-ONa
+ H2O
4.
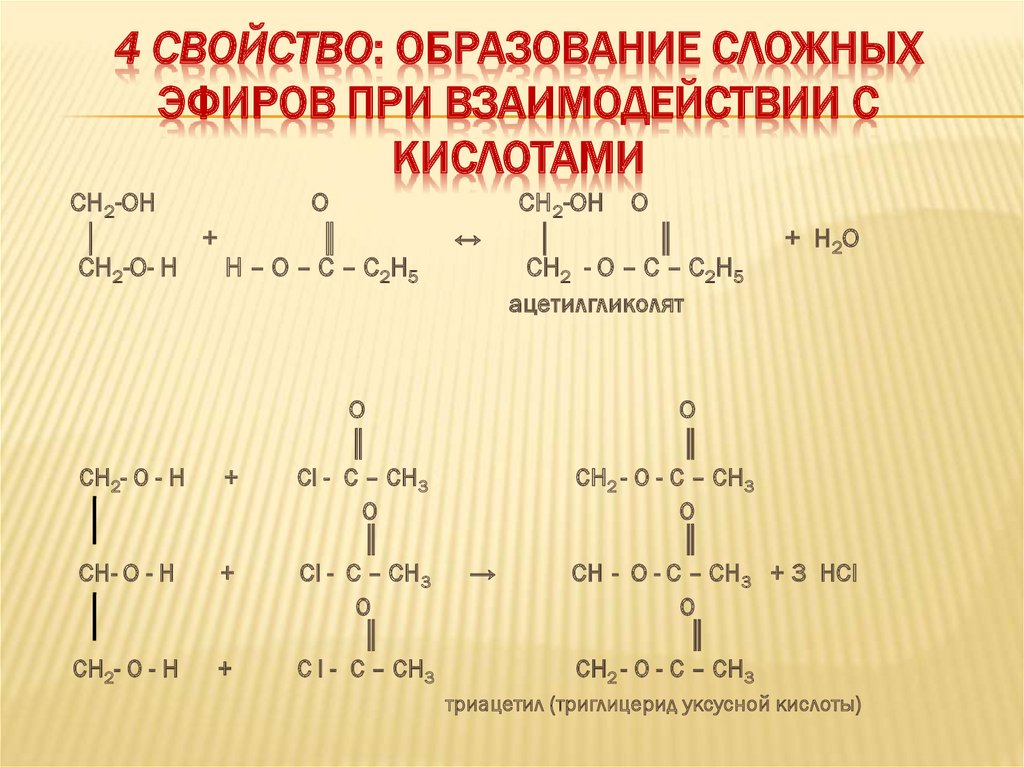
4 СВОЙСТВО: ОБРАЗОВАНИЕ СЛОЖНЫХЭФИРОВ ПРИ ВЗАИМОДЕЙСТВИИ С
КИСЛОТАМИ
CH2-OH
О
│
+
║
CH2-O- H
Н – О – С – С 2 Н5
CH2- O - H
+
CH- O - H
+
CH2- O - H
+
О
║
Cl - С – СН3
О
║
Cl - С – СН3
О
║
C l - С – СН3
↔
→
CH2-OH О
│
║
CH2 - O – С – С2Н5
ацетилгликолят
+ H2O
О
║
CH2 - O - С – СН3
О
║
CH - O - С – СН3 + 3 HCl
О
║
CH2 - O - С – СН3
триацетил (триглицерид уксусной кислоты)
5.
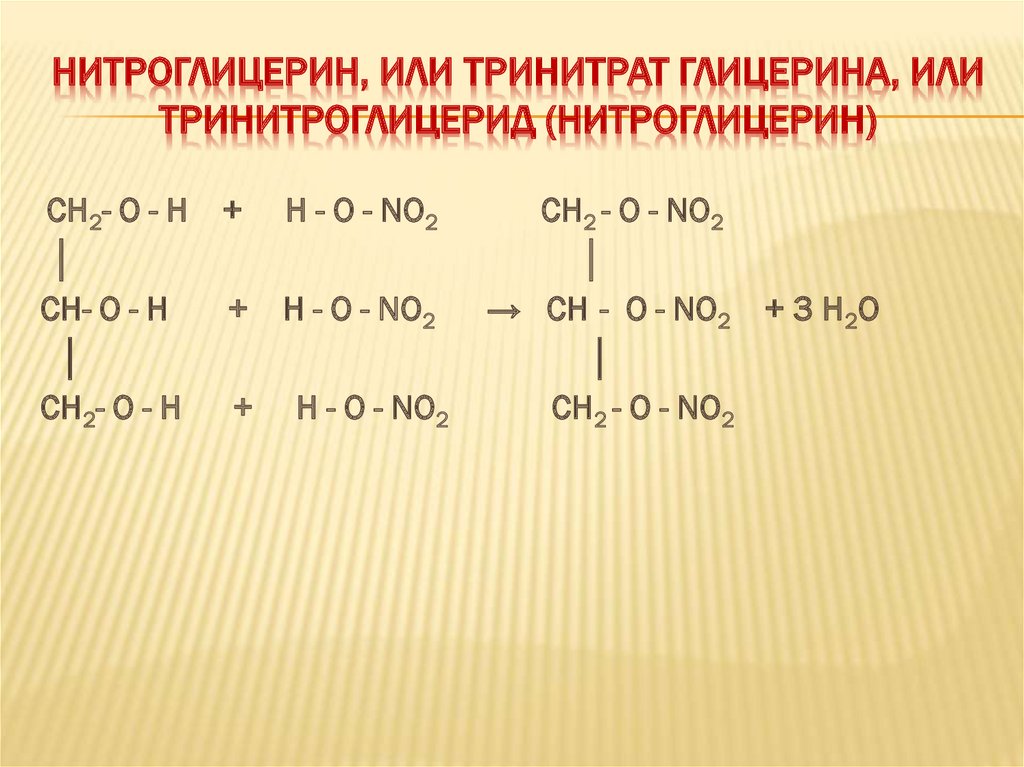
НИТРОГЛИЦЕРИН, ИЛИ ТРИНИТРАТ ГЛИЦЕРИНА, ИЛИТРИНИТРОГЛИЦЕРИД (НИТРОГЛИЦЕРИН)
CH2- O - H
│
CH- O - H
│
CH2- O - H
+
Н - О - NO2
+
Н - О - NO2
+
Н - О - NO2
CH2 - O - NO2
│
→ CH - O - NO2 + 3 H2O
│
CH2 - O - NO2
6.
5 СВОЙСТВО: РЕАКЦИИ ДЕГИДРАТАЦИИА) внутримолекулярная дегидратация
О
║
СН2 – СН – ОН → [Н2С = СН – ОН] → СН3 - С - Н
│
│
- Н2О виниловый спирт уксусный альдегид
ОН
Н
Б) межмолекулярная дегидратация
СН2 – О – Н
Н – О – СН2
│
+
│
СН2 – О – Н
Н – О – СН2
СН2 – О – СН2
→ │
│
СН2 – О – СН2
1,4 – диоксан
(диэтилендиоксид)
7.
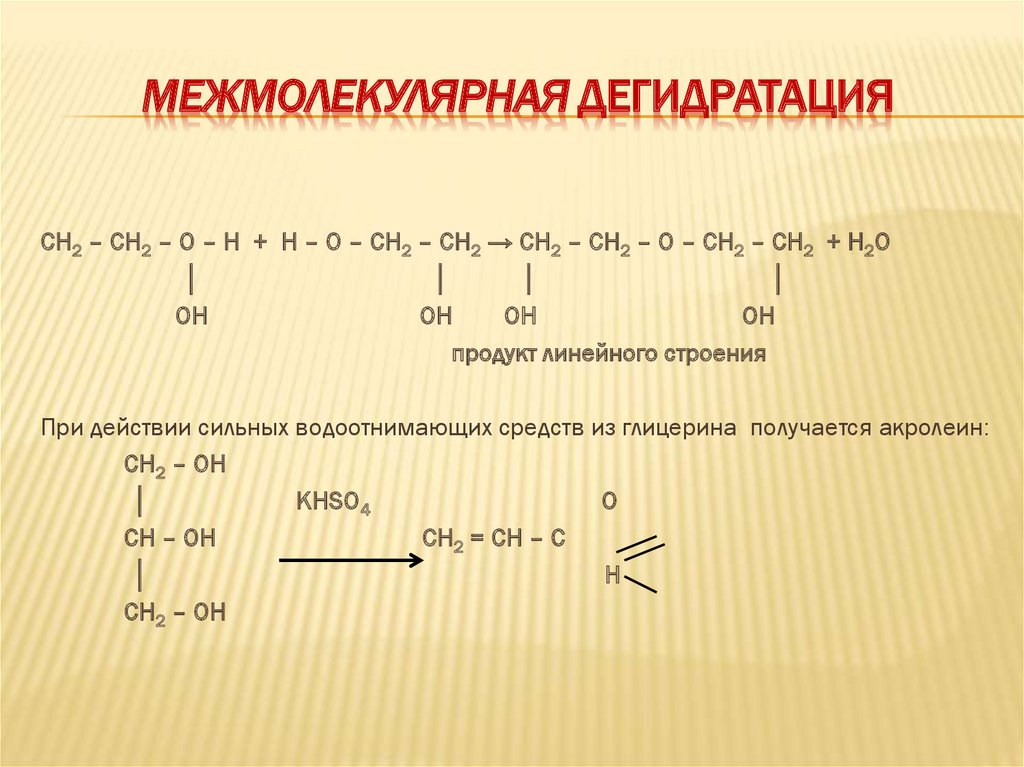
МЕЖМОЛЕКУЛЯРНАЯ ДЕГИДРАТАЦИЯСН2 – СН2 – О – Н + Н – О – СН2 – СН2 → СН2 – СН2 – О – СН2 – СН2 + Н2О
│
│
│
│
ОН
ОН
ОН
ОН
продукт линейного строения
При действии сильных водоотнимающих средств из глицерина получается акролеин:
CH2 – ОН
│
KHSO4
O
СН – ОН
CH2 = CH – C
│
H
CH2 – ОН
8.
6 СВОЙСТВО: ВЗАИМОДЕЙСТВИЕ СГАЛОГЕНОВОДОРОДАМИ
СН2 – О – Н
СН2 – Br
│
HBr → │
СН2 – О – Н
- H2O СН2 – ОH
этандиол – 1,2
+
2 - бромэтанол
CH2 - OH
CH2 - Cl
│
│
CH - OH + 3 PCl5 → CH - Cl + 3 POCl3 + 3 HCl
│
│
CH2 - ОН
CH2 – Cl
СН2 – Br
HBr → │
- H2O СН2 – Br
1,2 – дибромэтан
или
CH2 - OH
CH2 – Cl
│
│
CH - OH + 3 SOCl2 → CH – Cl + 3 SO2 + 3 HCl
│
│
CH2 - OH
CH2 - Cl
9.
ДОМАШНЕЕ ЗАДАНИЕЗаписать уравнение реакции горения: 1 вариант – этиленгликоля;
2 вариант – глицерина
Записать уравнение реакции окисления: 1 вариант – глицерина
перманганатом калия в кислой среде с образованием глицериновой
кислоты; 2 вариант – этиленгликоля дихроматом калия в кислой среде до
щавелевой кислоты. Реакции уравнять методом электронного баланса.
10.
ЗАКОНЧИТЕ ОДНО ИЗ ПРЕДЛОЖЕНИЙНа уроке мне было понятно…………
Из сегодняшнего материала мне не совсем
понятно……
Для более полного понимания сегодняшней темы
мне нужно……..
На сегодняшнем уроке…….







 Химия
Химия








