Похожие презентации:
Обобщить и систематизировать знания учащихся о кислотах неорганических и органических, о их составе и свойствах
1. Тема урока:
2. Цель урока
Обобщить и систематизироватьзнания учащихся
о кислотах
неорганических и органических,
о их составе и свойствах
3. Кислоты - электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков
HCl+
H + Cl
CH3COOH
+
COO +H
CH3
4.
5.
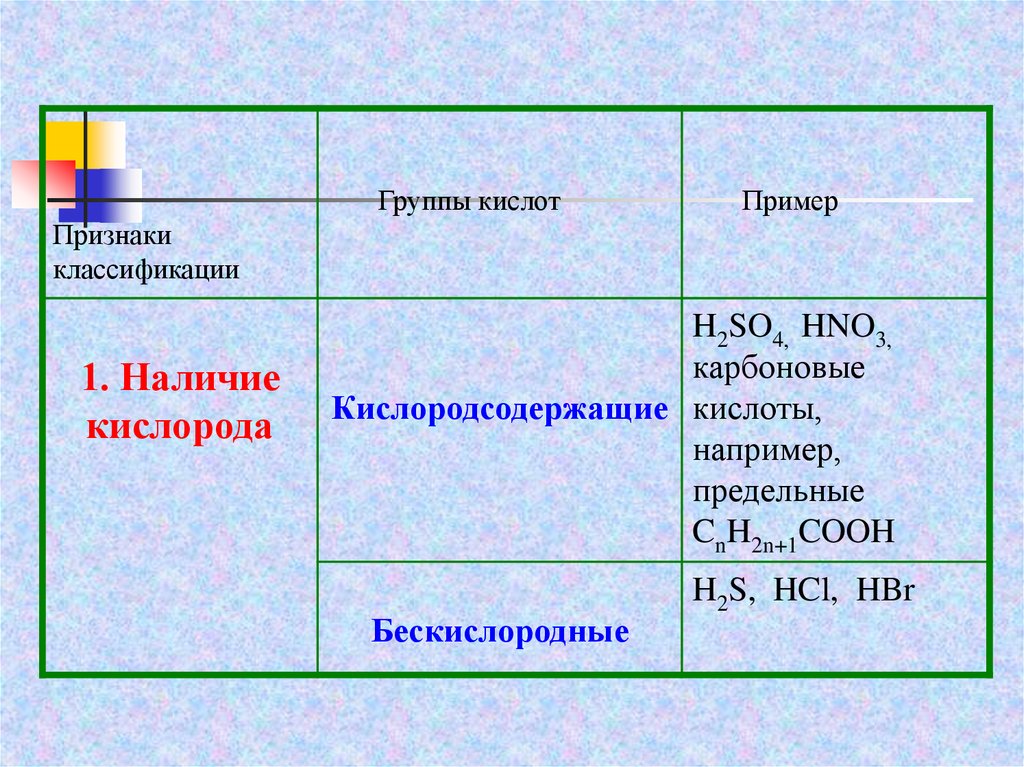
Группы кислотПример
Признаки
классификации
1. Наличие
кислорода
H2SO4, HNO3,
карбоновые
Кислородсодержащие кислоты,
например,
предельные
CnH2n+1COOH
Бескислородные
H2S, HCl, HBr
6.
ОдноосновныеHCL, HNO3,
CH3COOH
2.Основность
(число атомов Н в
молекуле,
способных
замещаться на
металл)
Двухосновные
Трехосновные
H2S, H2SO4,
HOOC-COOH
щавелевая кислота
H3PO4
7.
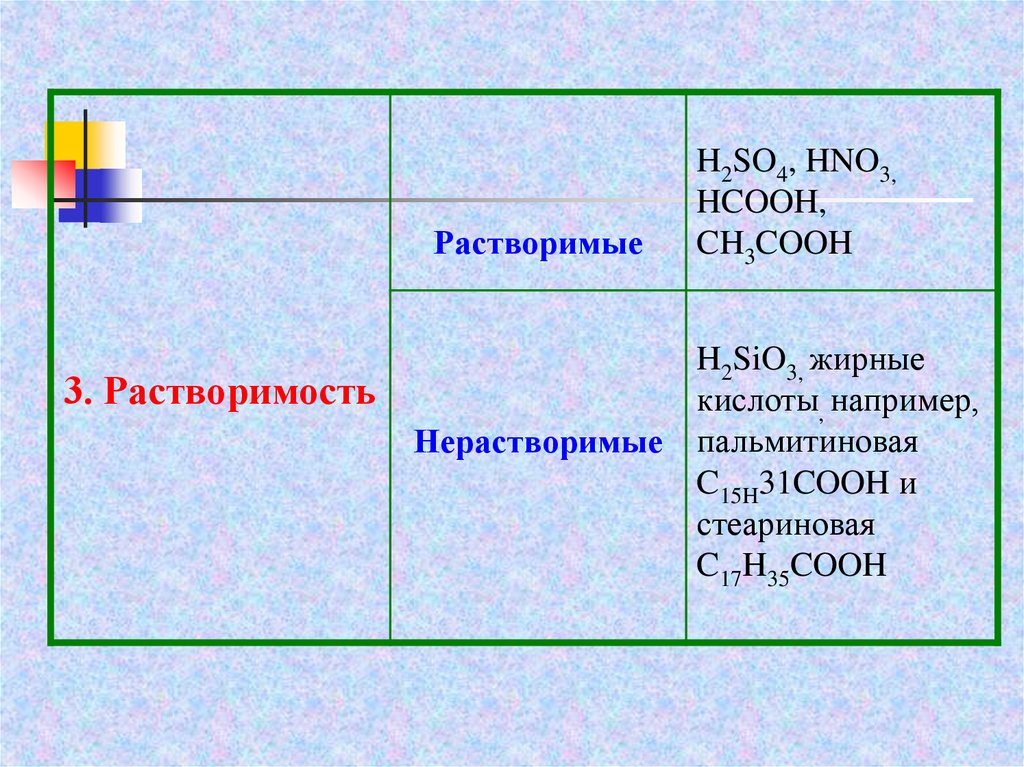
Растворимые3. Растворимость
H2SO4, HNO3,
HCOOH,
CH3COOH
H2SiO3, жирные
кислоты, например,
Нерастворимые пальмитиновая
C15H31COOH и
стеариновая
C17H35COOH
8.
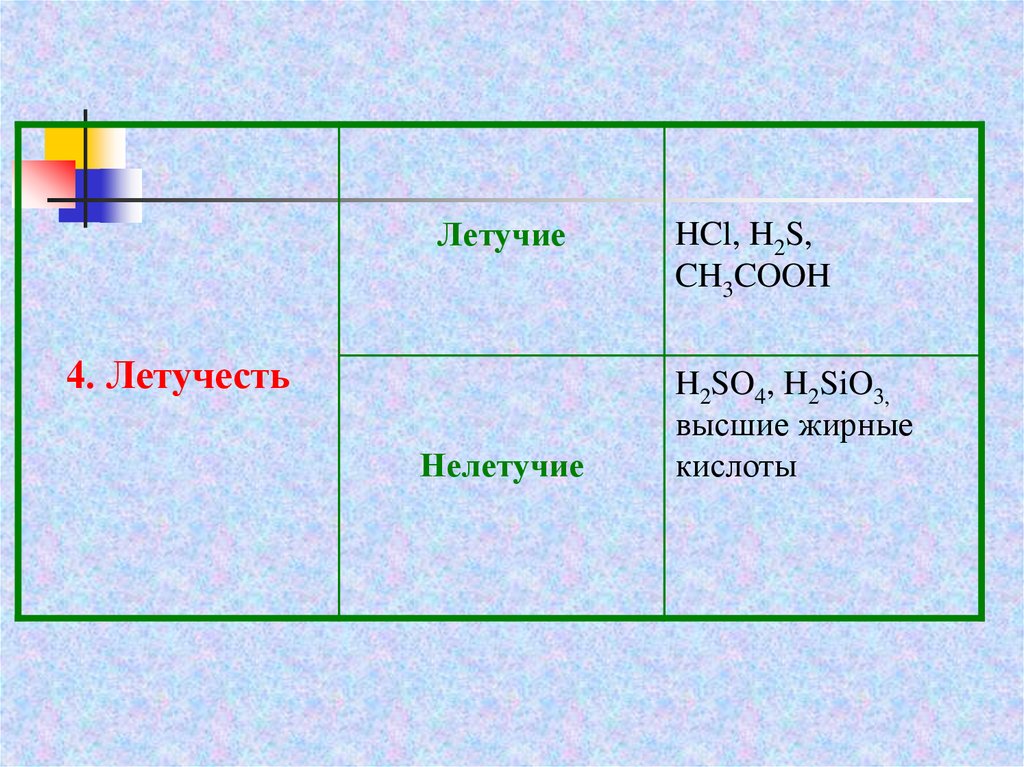
Летучие4. Летучесть
Нелетучие
HCl, H2S,
CH3COOH
H2SO4, H2SiO3,
высшие жирные
кислоты
9.
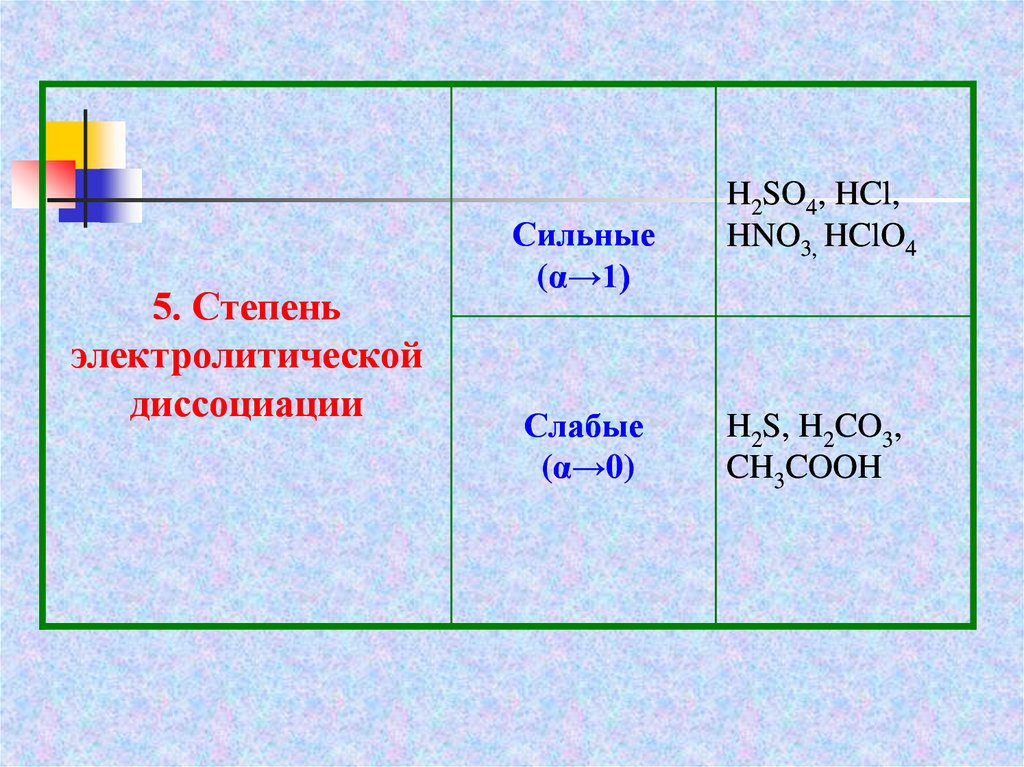
5. Степеньэлектролитической
диссоциации
Сильные
(α→1)
Слабые
(α→0)
H2SO4, HCl,
HNO3, HClO4
H2S, H2CO3,
CH3COOH
10.
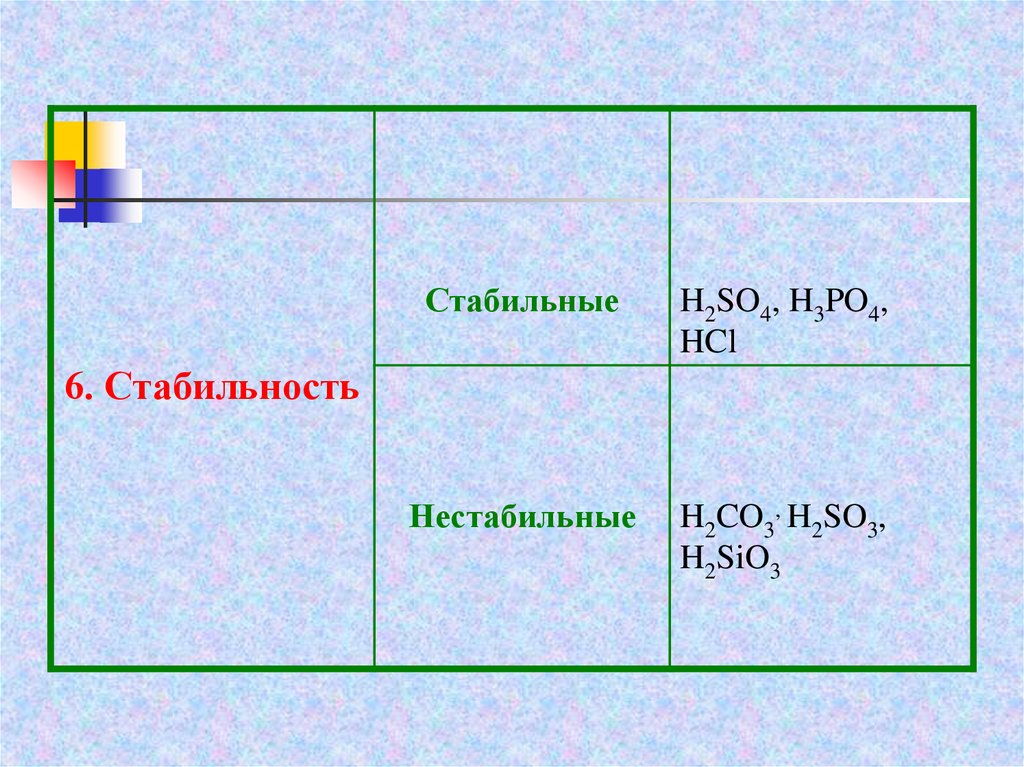
СтабильныеH2SO4, H3PO4,
HCl
Нестабильные
H2CO3, H2SO3,
H2SiO3
6. Стабильность
11. ЗАДАНИЕ НА КЛАССИФИКАЦИЮ:
ДАЙТЕ ХАРАКТЕРИСТИКУ СЛЕДУЮЩИМКИСЛОТАМ, ИСПОЛЬЗУЯ РАЗЛИЧНЫЕ
ПРИЗНАКИ КЛАССИФИКАЦИИ:
HBr
H2 SO4
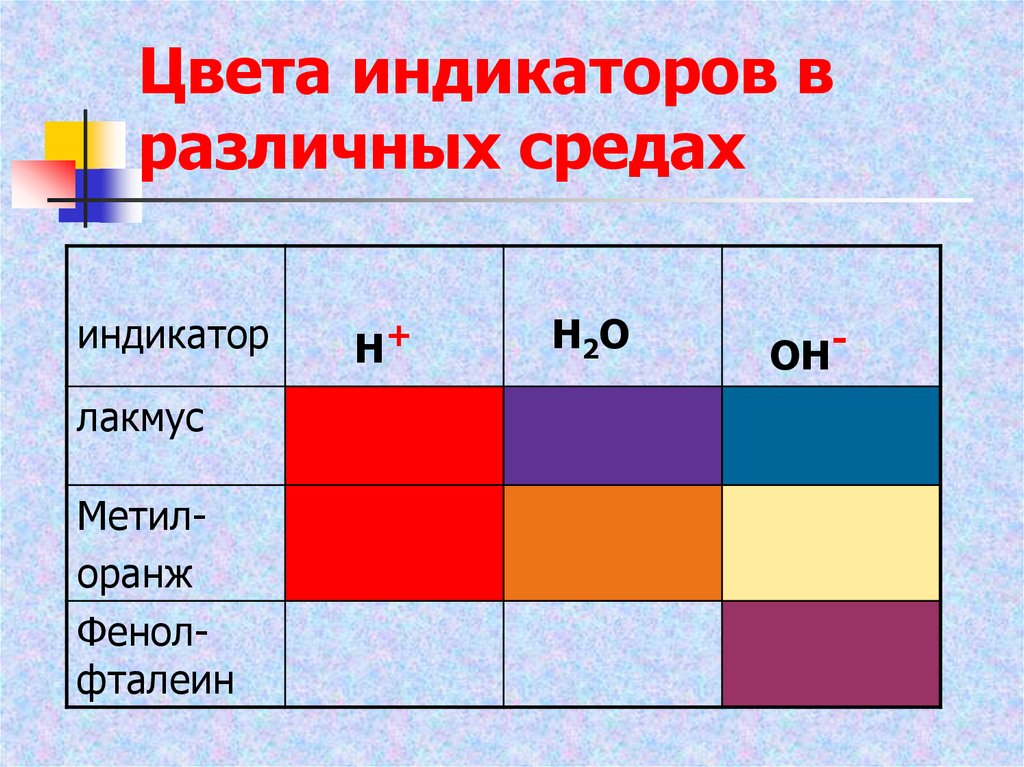
12. Цвета индикаторов в различных средах
индикаторлакмус
Метилоранж
Фенолфталеин
Н+
Н2О
ОН-
13.
14.
15.
16.
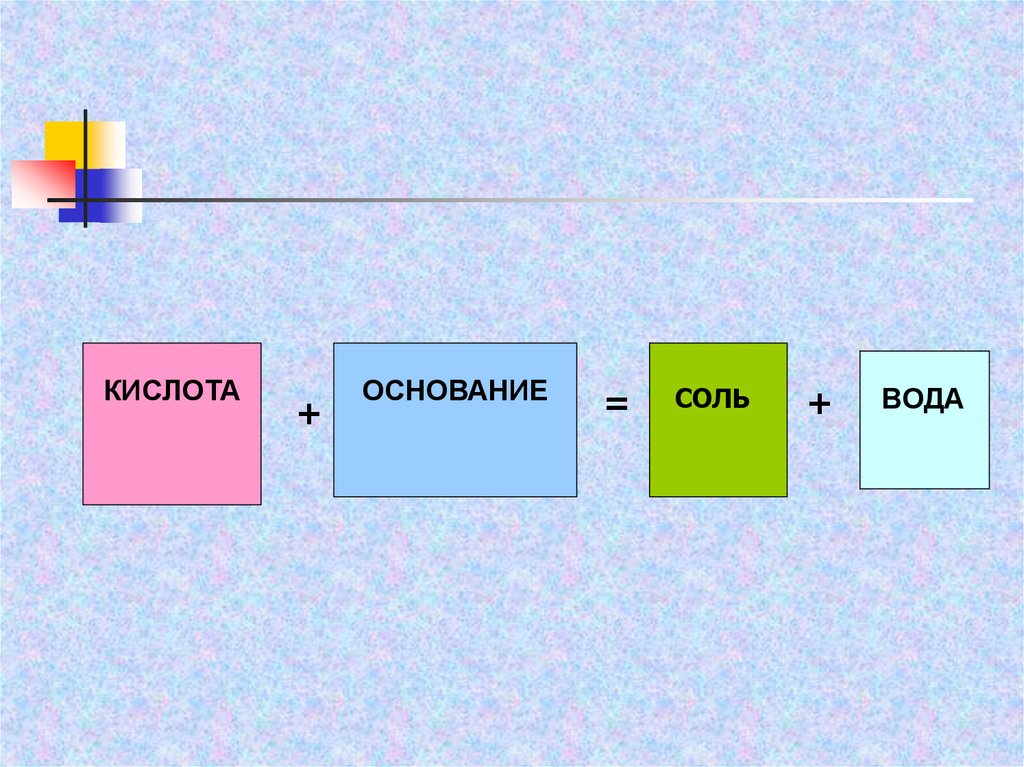
КИСЛОТА+
ОСНОВАНИЕ
=
СОЛЬ
+
ВОДА
17.
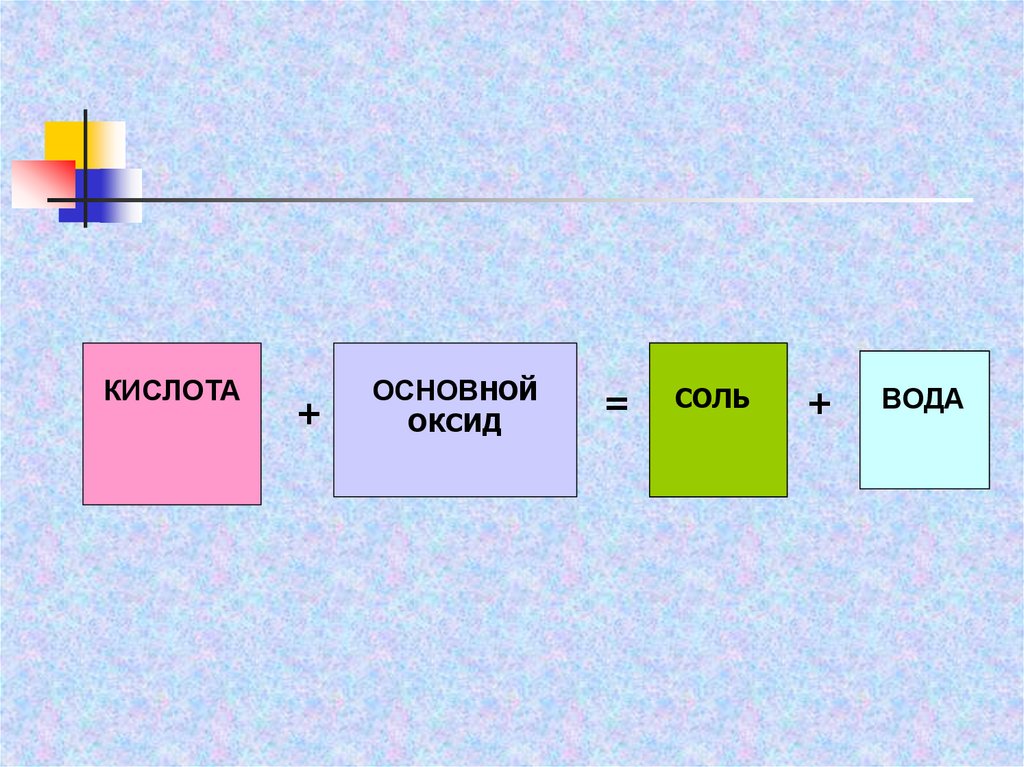
КИСЛОТА+
ОСНОВНОЙ
ОКСИД
=
СОЛЬ
+
ВОДА
18.
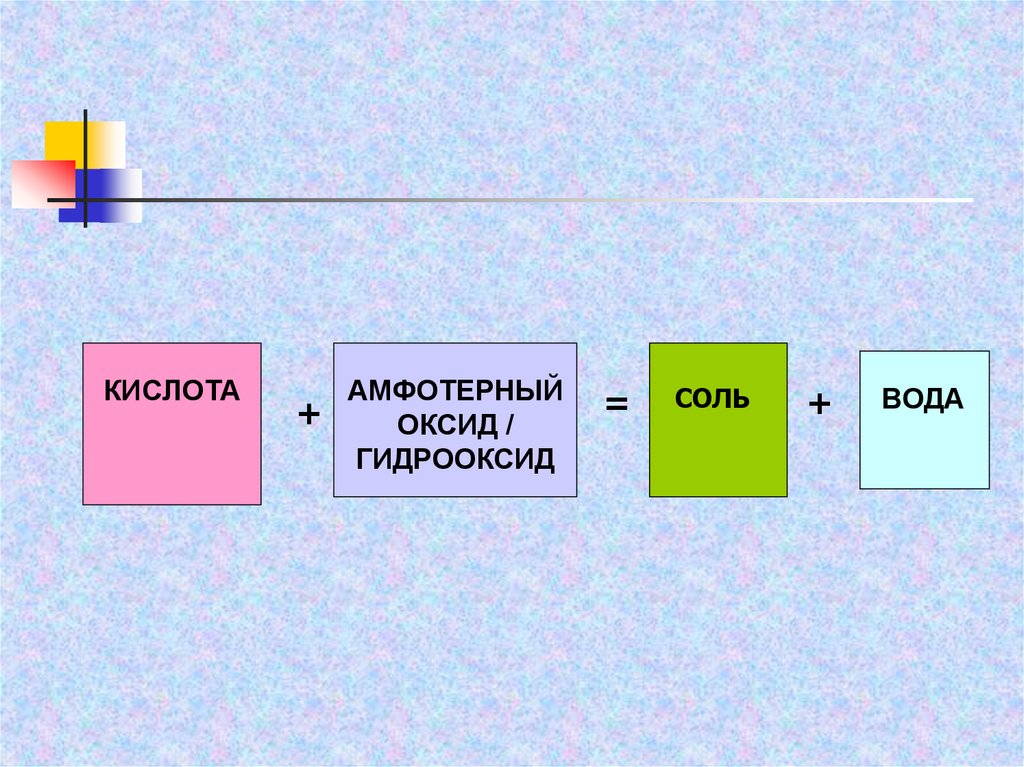
КИСЛОТААМФОТЕРНЫЙ
+
ОКСИД /
ГИДРООКСИД
=
СОЛЬ
+
ВОДА
19.
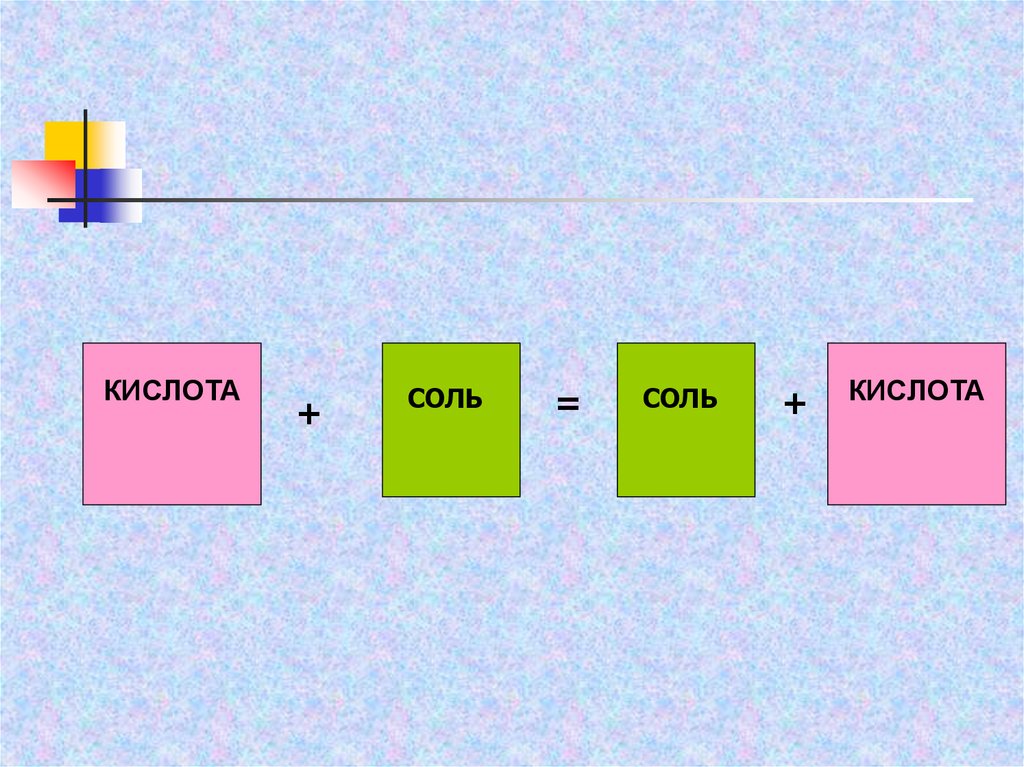
КИСЛОТА+
СОЛЬ
=
СОЛЬ
+
КИСЛОТА
20.
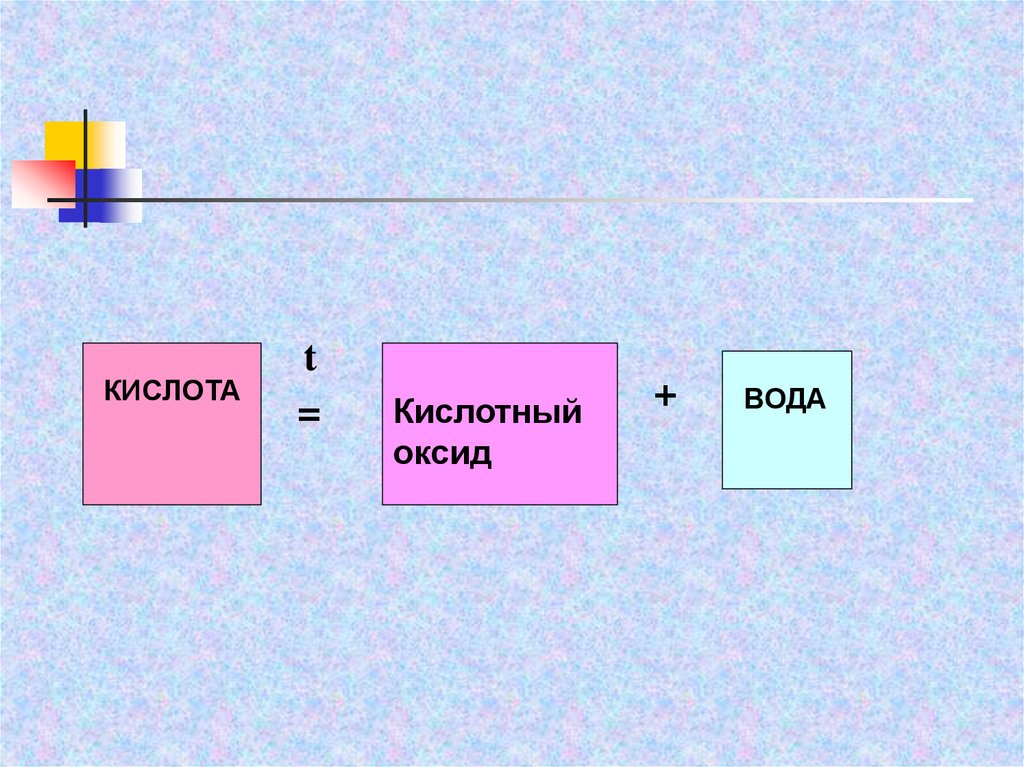
КИСЛОТАt
=
Кислотный
оксид
+
ВОДА
21.
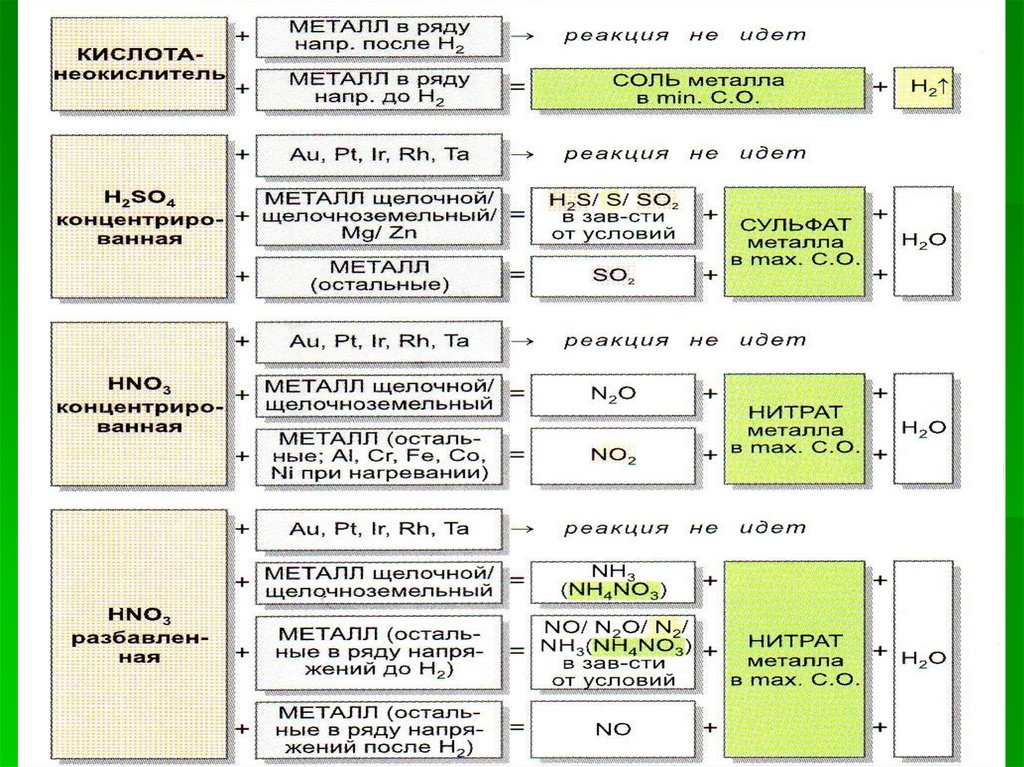
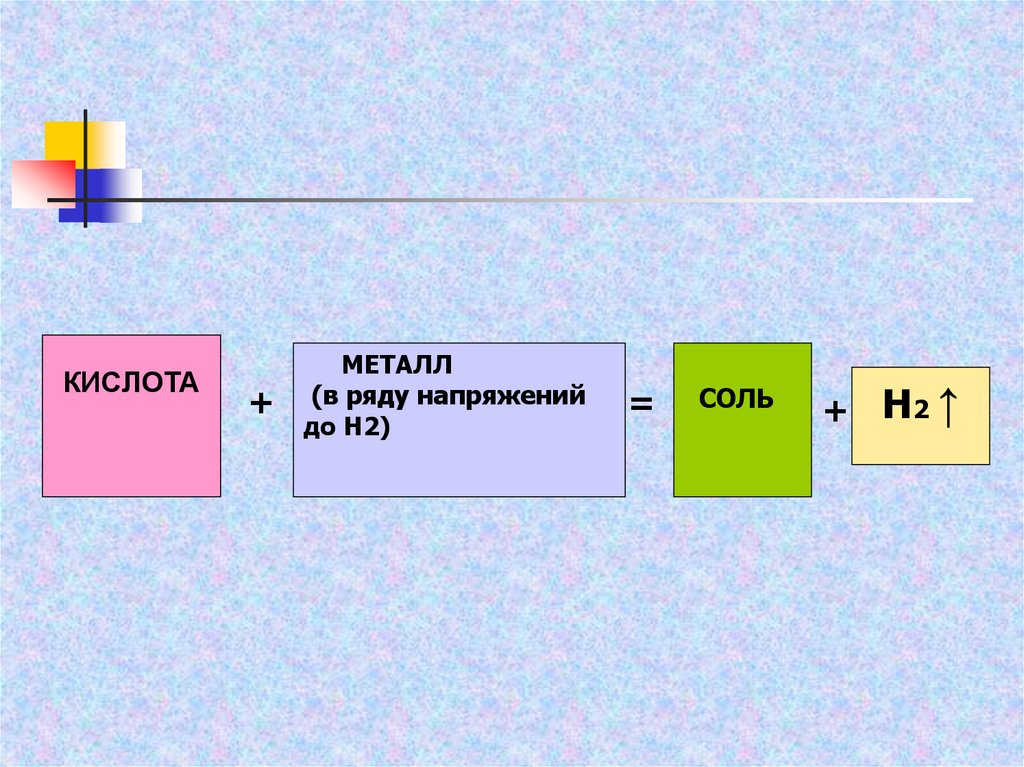
КИСЛОТА+
МЕТАЛЛ
(в ряду напряжений
до Н2)
=
СОЛЬ
+ H2 ↑









 Химия
Химия








