Похожие презентации:
Азотосодержащие соединения: Амины. Аминокислоты. Белки
1. Азотосодержащие соединения: Амины. Аминокислоты.Белки.
2.
“Жизнь--есть способсуществования белковых тел”
Ф.Энгельс
3. Содержание
АминыАминокислоты
Свойства аминокислот
Белки(полипептиды)
Строение белка
Классификация белков
Физические свойства белков
Химические свойства белков
Функции белков в организме
4.
5.
6. Определение
Аминокислоты – бифункциональные соединения,которые обязательно содержат две
функциональные группы: аминогруппу – NH2 и
карбоксильную группу – COOH, связанные с
углеводородным радикалом
Аминокислоты – производные кислот, которые
можно рассматривать как продукты замещения
одного или более атомов водорода в их
радикалах на одну или более аминогрупп
7. Строение
Общая формула (NH2)mR(COOH)n, где m и nчаще всего равны 1 или 2. таким образом,
аминокислоты --соединения со смешанными
функциями
8. Систематическая номенклатура
1. выбрать самую длинную цепь содержащуюкарбоксильную группу и аминогруппу;
2. пронумеровать начиная с углерода
карбоксильной группы;
3. Место (NH2) – сколько – амино – место R –
сколько –какой – кто – овая кислота
Например: 2-аминопропановая кислота
9. Рациональная номенклатура
По рациональной номенклатуре положениеаминогруппы указывается буквами греческого
алфавита, начиная со второго атома углерода от СООН: α, β, γ, δ, ε и т.д. Например:
α – аминопропионовая кислота
10.
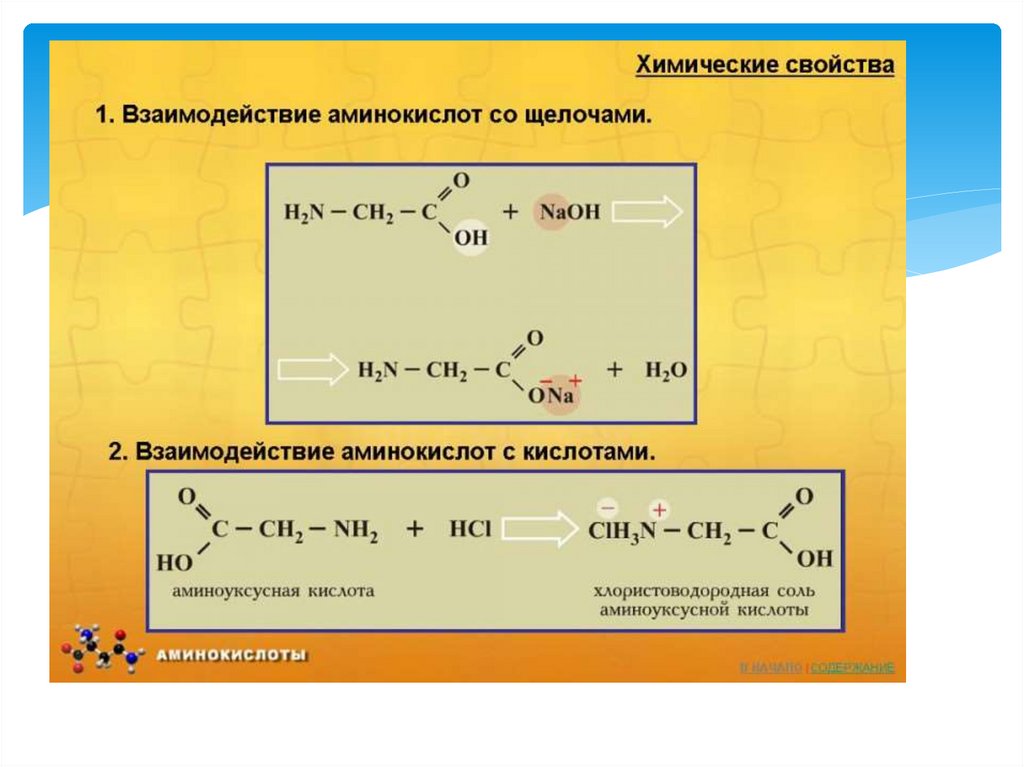
11. Особые свойства аминокислот
1. Образование внутренней соли при диссоциацииNH2 – CH2 – COOH ⇄ +NH3 – CH2 – COO
2. Образование пептидов (реакция
поликонденсации)
12.
13.
Белки –высокомолекулярные
природные соединения
(биополимеры),
состоящие из остатков
аминокислот, которые
соединены пептидной
связью.
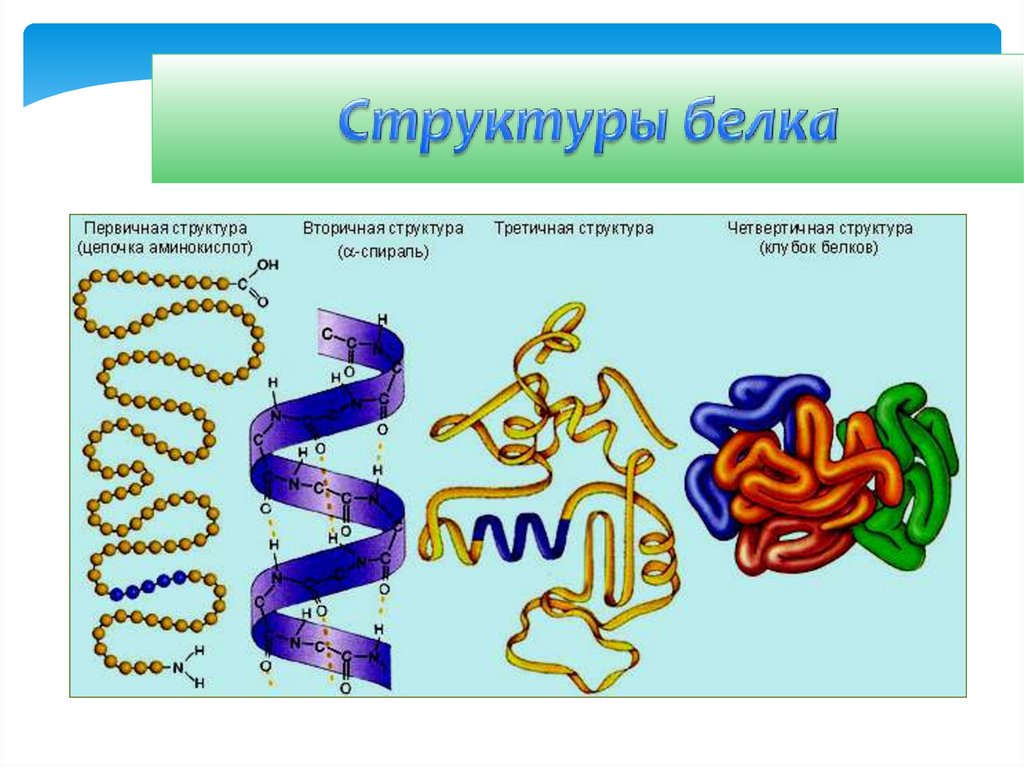
14. Структуры белка
15.
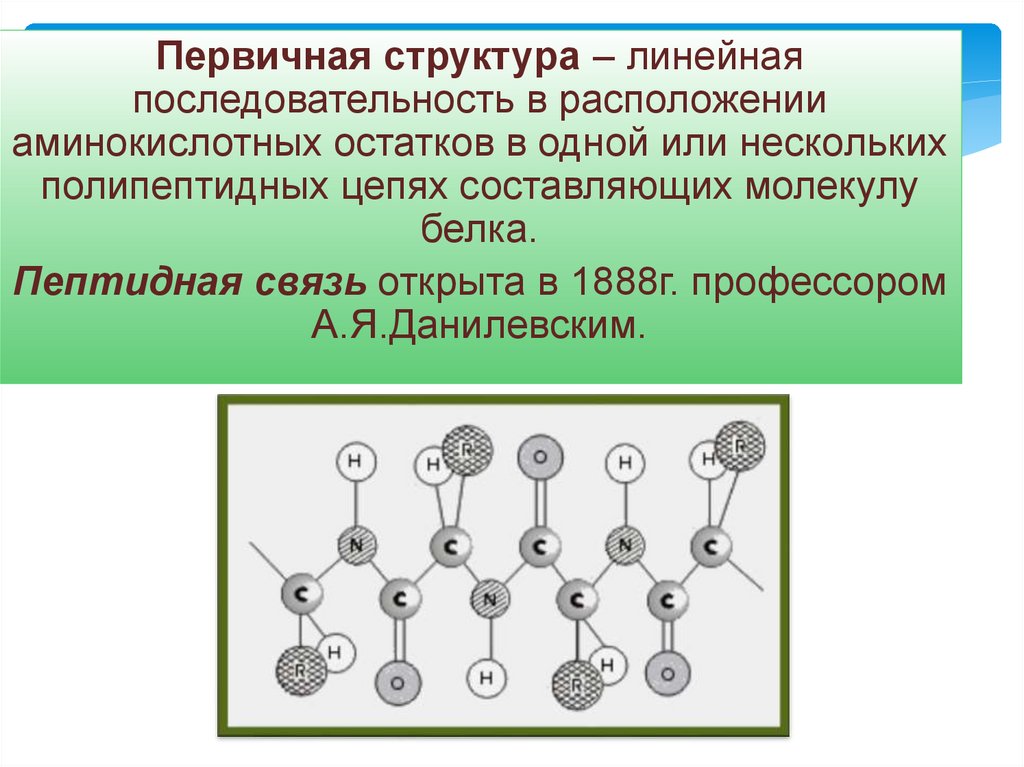
Первичная структура – линейнаяпоследовательность в расположении
аминокислотных остатков в одной или нескольких
полипептидных цепях составляющих молекулу
белка.
Пептидная связь открыта в 1888г. профессором
А.Я.Данилевским.
16.
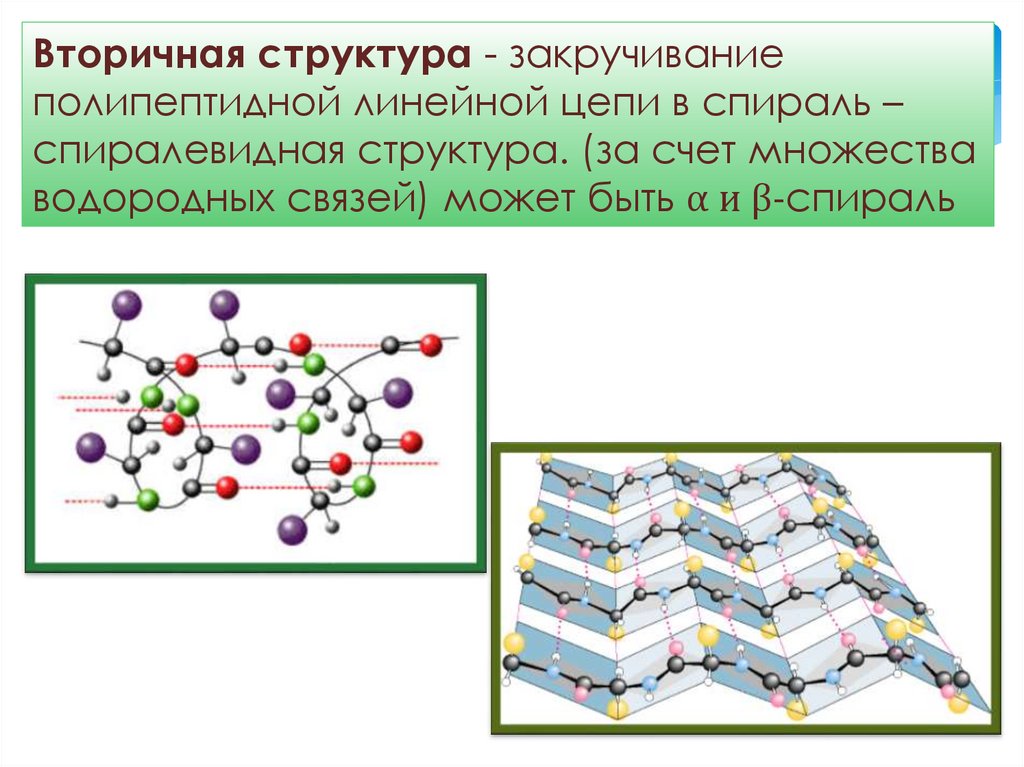
Вторичная структура - закручиваниеполипептидной линейной цепи в спираль –
спиралевидная структура. (за счет множества
водородных связей) может быть α и β-спираль
17.
Третичная структура - упаковка вторичнойспирали в глобулу – глобулярная структура
зависит от первичной структуры, за счет:
1) Дисульфидные мостики (-S – S -);
2) Солевые мостики за счет связей между СООН
и NН2 ;
3) гидрофобные связи при взаимодействии
радикалов. При этом могут образовываться
глобулярные и фибриллярные белки.
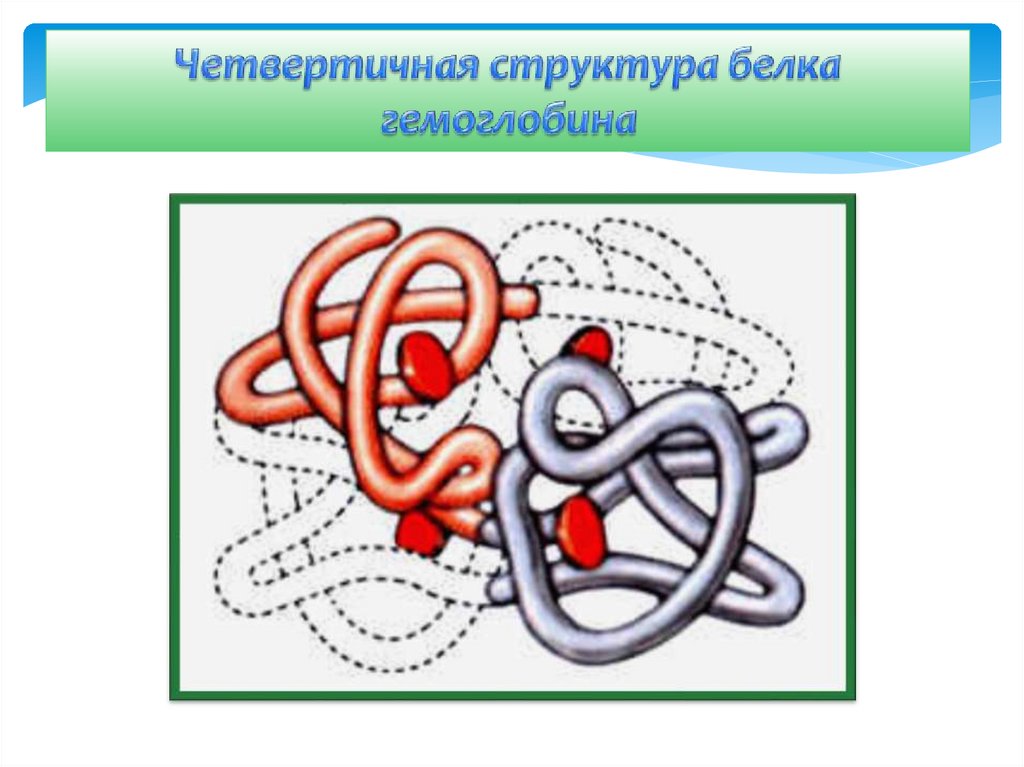
18.
Четвертичная структура - встречается редко.Комплекс, объединяющий несколько третичных
структур органической природы и неорганическое
вещество.
19.
20.
21.
22.
Классификация белков по хим. составуПростые (протеины)
Белки, состоящие
только из аминокислот
Сложные (протеиды)
Содержат белковую часть и
небелковую (ионы металлов,
липиды, углеводы и.т.п.)
Альбумины, глобулины,
фибрин, трипсин, гистоны
Липопротеиды,
гликопротеиды,
фосфопротеиды,
(гемоглобин)
23.
24.
25.
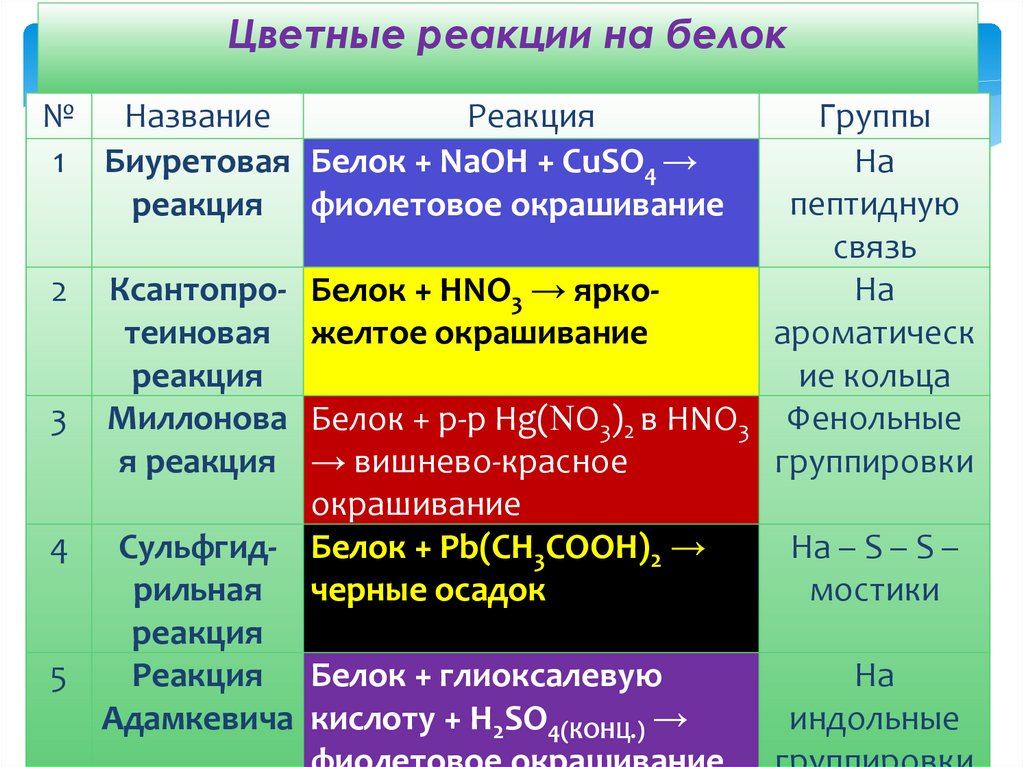
Цветные реакции на белок№ Название
Реакция
1 Биуретовая Белок + NаОН + СuSО4 →
реакция фиолетовое окрашивание
2
3
Ксантопротеиновая
реакция
Миллонова
я реакция
Группы
На
пептидную
связь
На
Белок + НNО3 → яркоароматическ
желтое окрашивание
ие кольца
Белок + р-р Нg( О3)2 в НNО3 Фенольные
группировки
→ вишнево-красное
окрашивание
На – S – S –
Белок + Рb(СН3СООН)2 →
черные осадок
мостики
Сульфгидрильная
реакция
Реакция Белок + глиоксалевую
5
Адамкевича кислоту + Н2SО4(КОНЦ.) →
4
На
индольные























 Химия
Химия








