Похожие презентации:
Ионное уравнение
1.
Раствор — это однородная система,состоящая из частиц растворённого
вещества, растворителя и продуктов их
взаимодействия.
2.
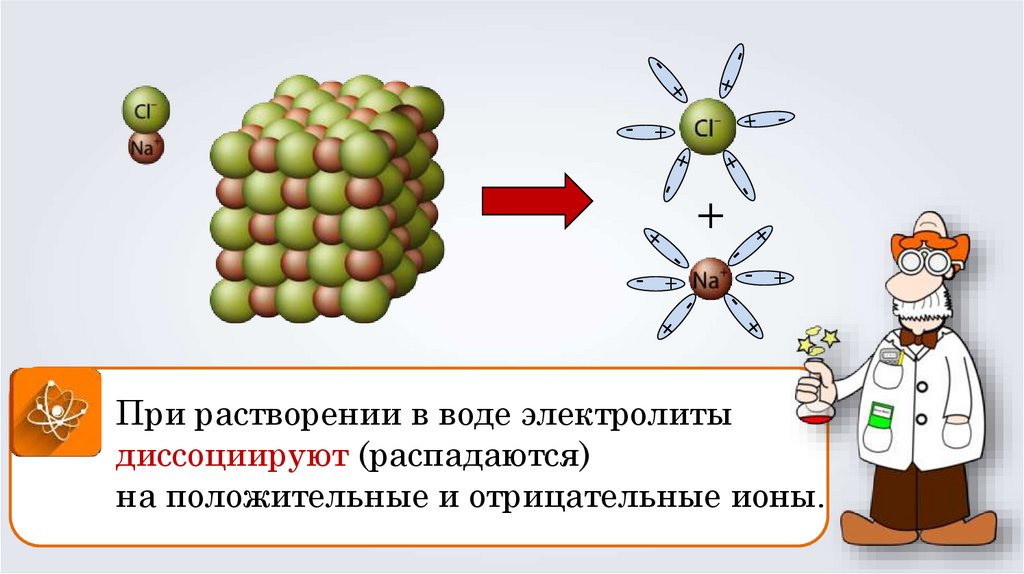
+-
+
+
-
+
-
При растворении в воде электролиты
диссоциируют (распадаются)
на положительные и отрицательные ионы.
3.
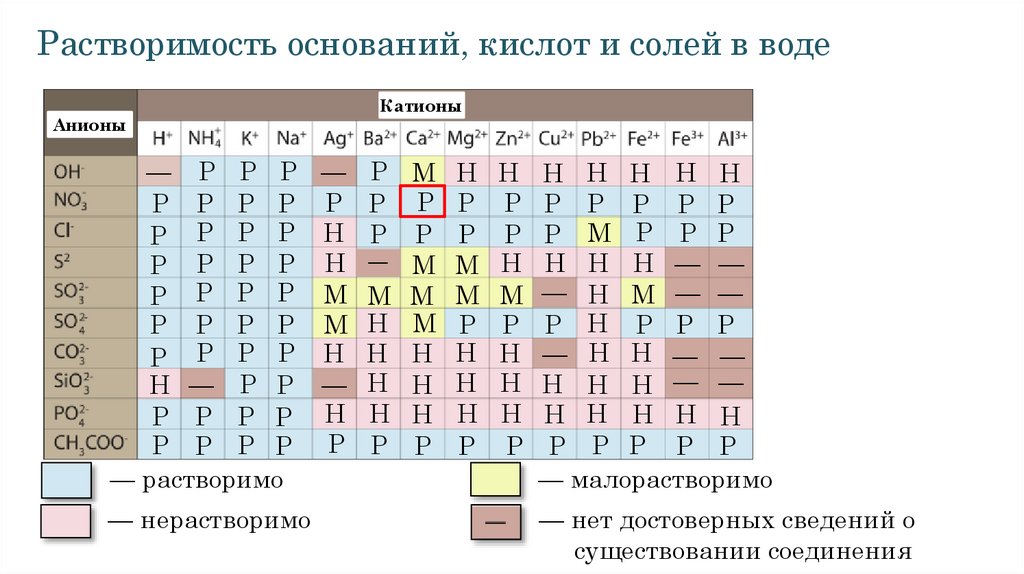
Растворимость оснований, кислот и солей в водеАнионы
Катионы
— Р Р Р — Р М Н Н Н Н Н Н Н
Р Р Р Р Р Р Р Р Р Р Р Р Р Р
Р Р Р Р Н Р Р Р Р Р М Р Р Р
Р Р Р Р Н Р М М Н Н Н Н — —
Р Р Р Р М М М М М — Н М — —
Р Р Р Р М Н М Р Р Р Н Р Р Р
Р Р Р Р Н Н Н Н Н — Н Н — —
Н — Р Р — Н Н Н Н Н Н Н — —
Р Р Р Р Н Н Н Н Н Н Н Н Н Н
Р Р Р Р Р Р Р Р Р Р Р Р Р Р
— растворимо
— малорастворимо
— нерастворимо
— нет достоверных сведений о
существовании соединения
4.
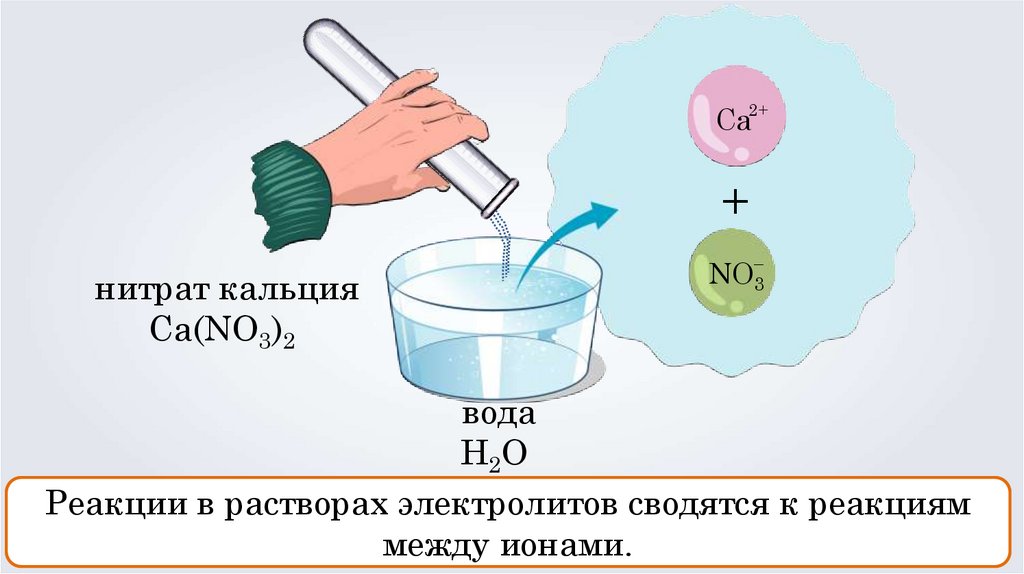
Са2++
нитрат кальция
Ca(NО3)2
–
NO3
вода
H 2O
Реакции в растворах электролитов сводятся к реакциям
между ионами.
5.
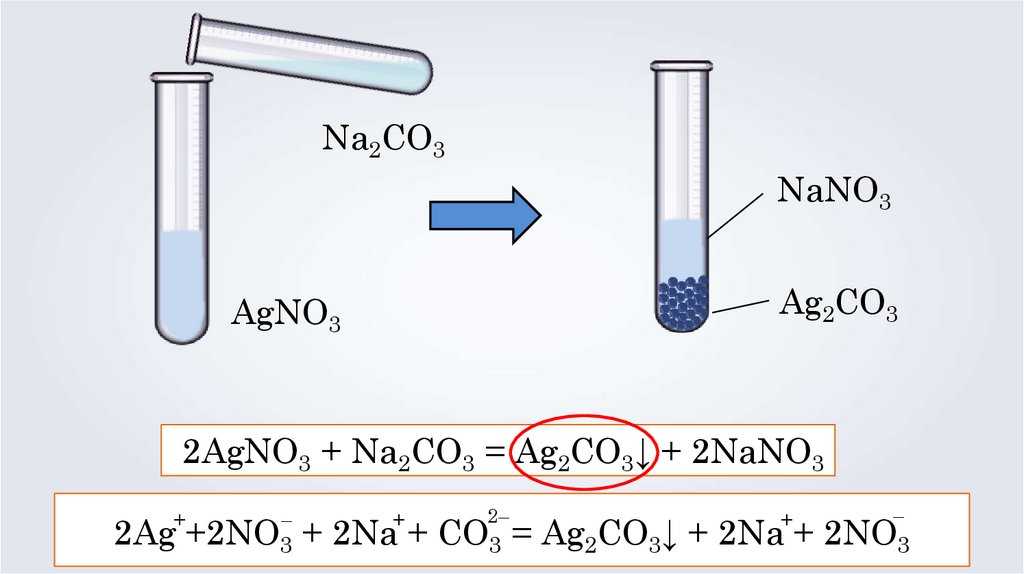
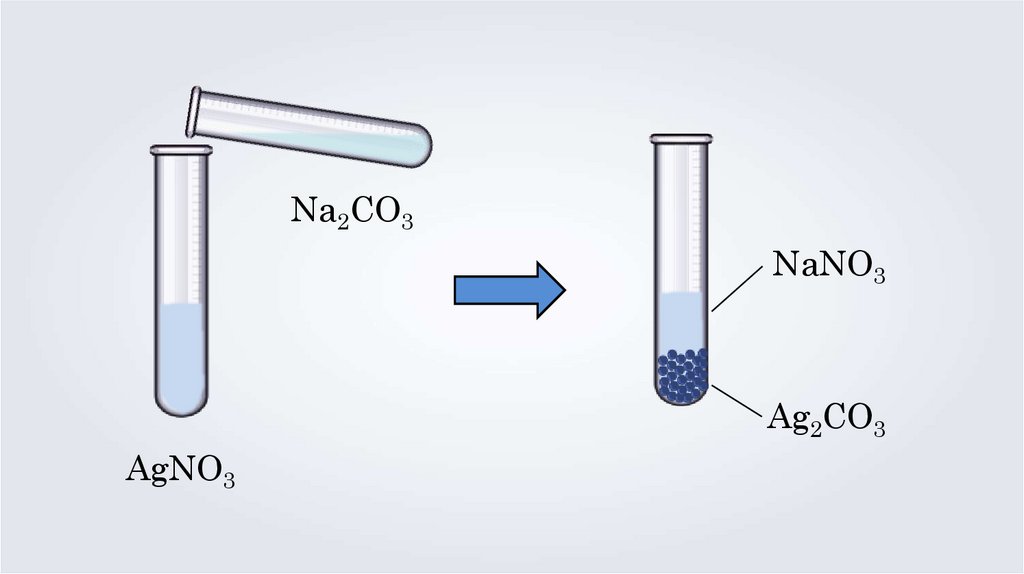
Na2CO3NaNO3
Ag2CO3
AgNO3
2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
+
–
+
2–
+
–
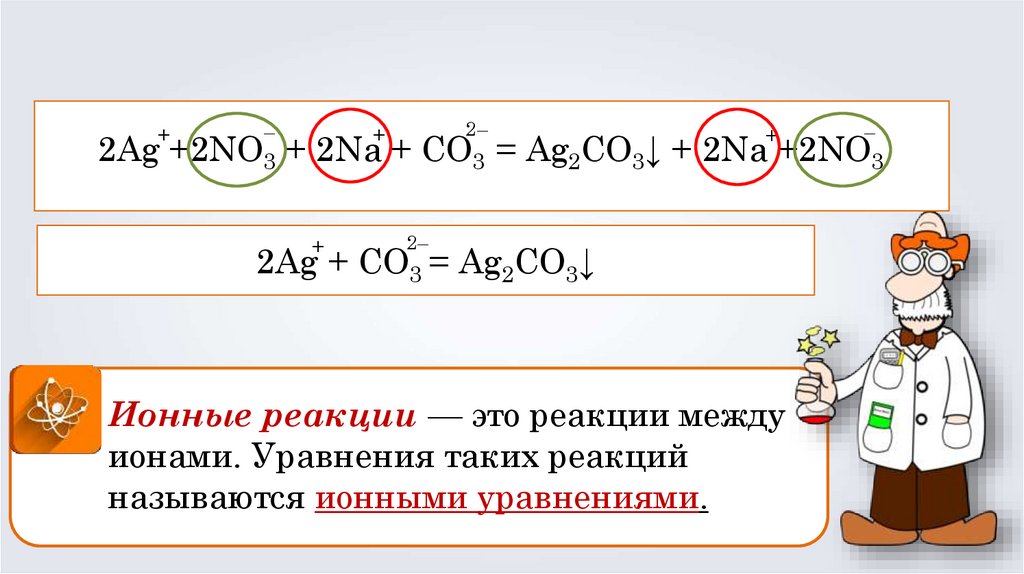
2Ag +2NO3 + 2Na + CO3 = Ag2CO3↓ + 2Na + 2NO3
6.
+–
2–
+
+
–
2Ag +2NO3 + 2Na + CO3 = Ag2CO3↓ + 2Na +2NO3
+
2–
2Ag + CO3 = Ag2CO3↓
Ионные реакции — это реакции между
ионами. Уравнения таких реакций
называются ионными уравнениями.
7.
Na2CO3NaNO3
Ag2CO3
AgNO3
8.
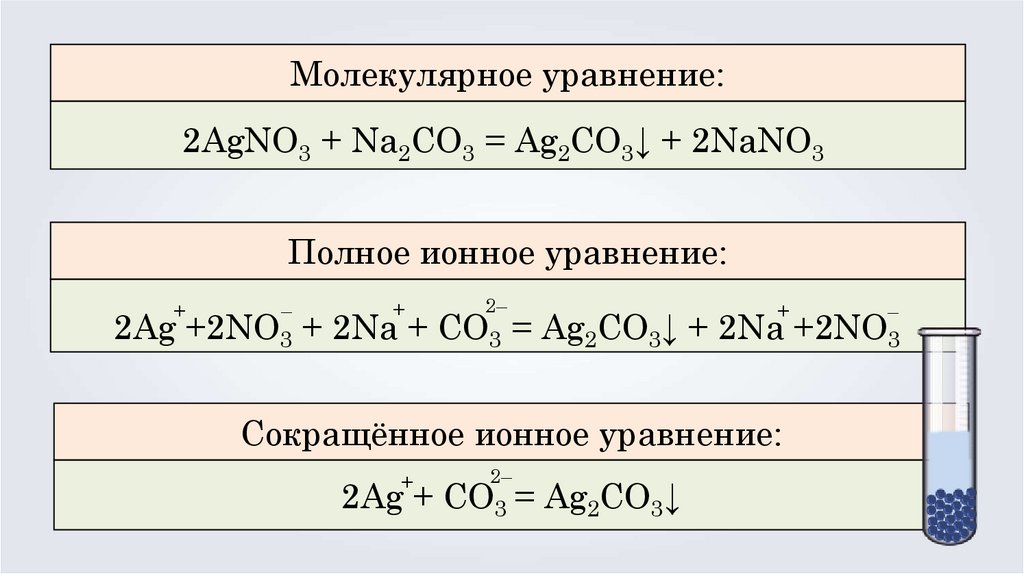
Молекулярное уравнение:2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3
Полное ионное уравнение:
+
–
+
2–
+
–
2Ag +2NO3 + 2Na + CO3 = Ag2CO3↓ + 2Na +2NO3
Сокращённое ионное уравнение:
+
2–
2Ag + CO3 = Ag2CO3↓
9.
Условия протекания реакцийионного обмена до конца
1. Образование в результате реакции нерастворимого
в воде вещества.
2. Образование в результате реакции газообразного
вещества.
3. Образование в результате реакции
малодиссоциирующего вещества.
10.
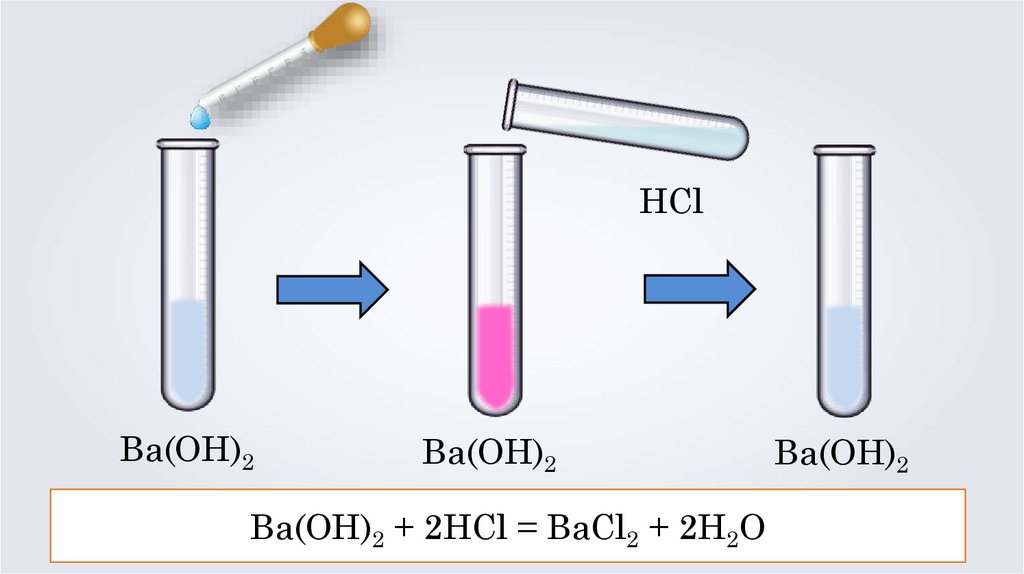
HClBa(OH)2
Ba(OH)2
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba(OH)2
11.
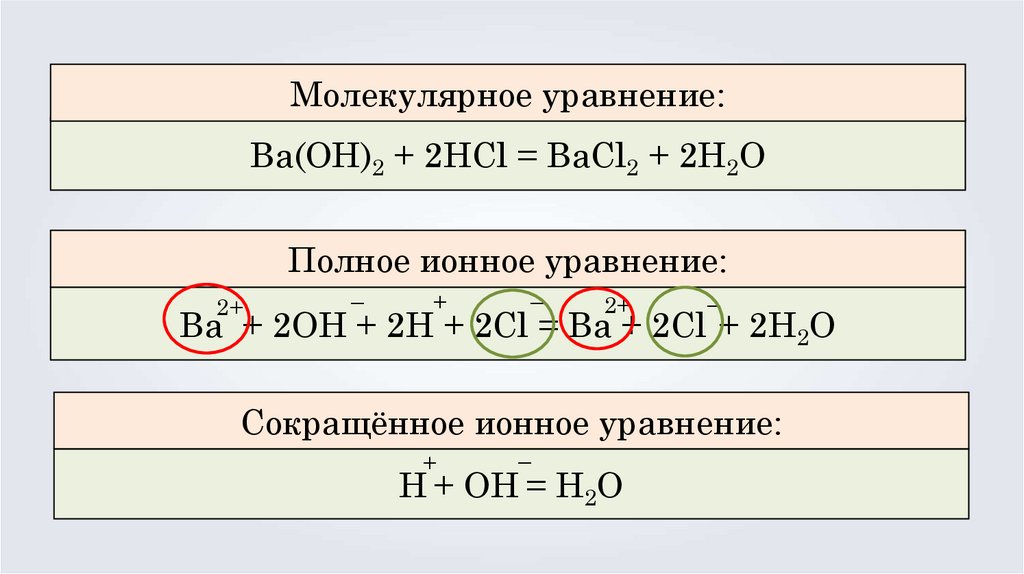
Молекулярное уравнение:Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Полное ионное уравнение:
2+
–
+
–
2+
–
Ba + 2OH + 2H + 2Cl = Ba + 2Cl + 2H2O
Сокращённое ионное уравнение:
+
–
H + OH = H2O
12.
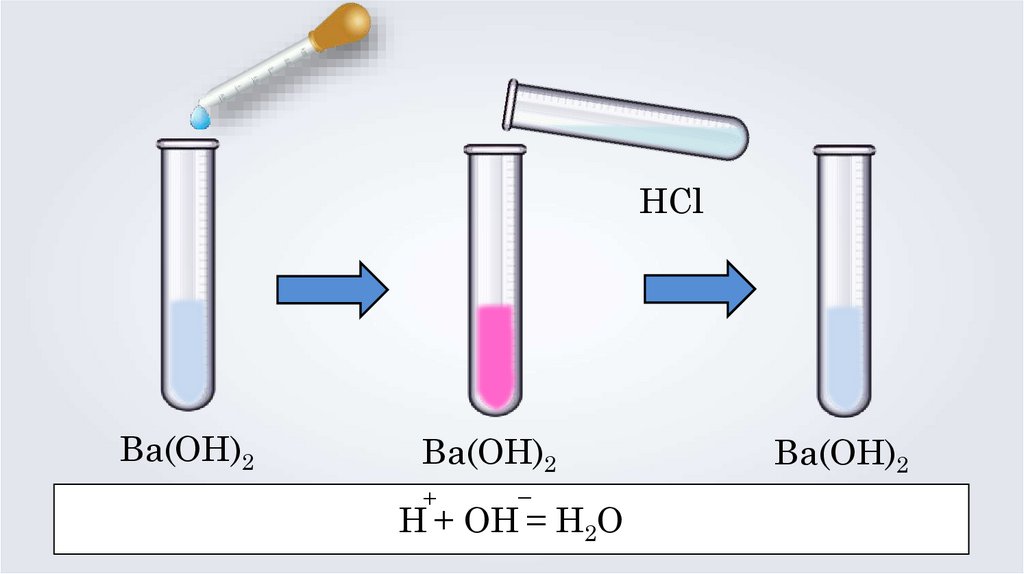
HClBa(OH)2
Ba(OH)2
+
–
H + OH = H2O
Ba(OH)2
13.
Реакции нейтрализации — это реакциивзаимодействия сильной кислоты
со щёлочью, в результате которых образуется
малодиссоциирующее вещество — вода —
и соль.
14.
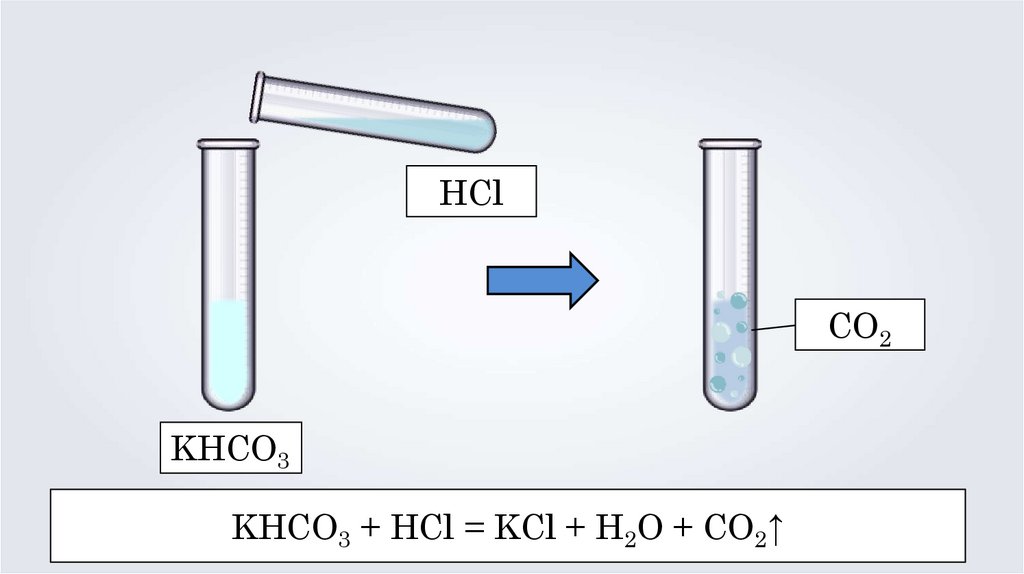
HClCO2
KHCO3
KHCO3 + HCl = KCl + H2O + CO2↑
15.
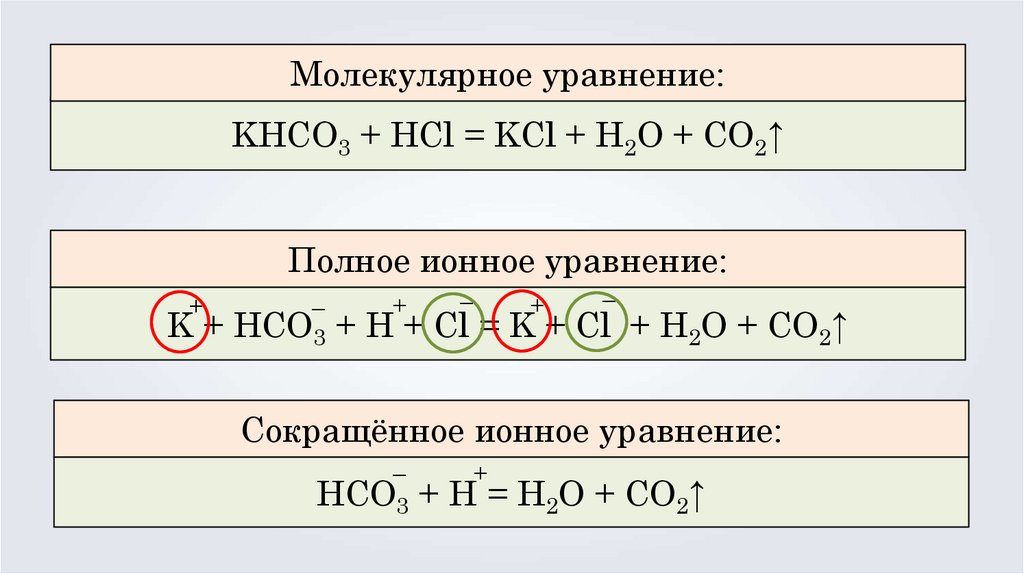
Молекулярное уравнение:KHCO3 + HCl = KCl + H2O + CO2↑
Полное ионное уравнение:
+
K+
–
HCO3
+
–
+
–
+ H + Cl = K + Cl + H2O + CO2↑
Сокращённое ионное уравнение:
–
HCO3
+
+ H = H2O + CO2↑
16.
Реакции в водных растворах электролитовявляются реакциями между ионами и
протекают до конца в случае образования
осадка, газа или воды. Они записываются
в виде ионных уравнений.




 Химия
Химия








