Похожие презентации:
Современное представление о строении атома, S- и P- орбитали
1.
К середине XIX века было ужедостаточно накоплено
экспериментального материала
по органической химии: получено
много соединений, изучен их состав,
прослежены закономерности
протекания отдельных химических
реакций.
2.
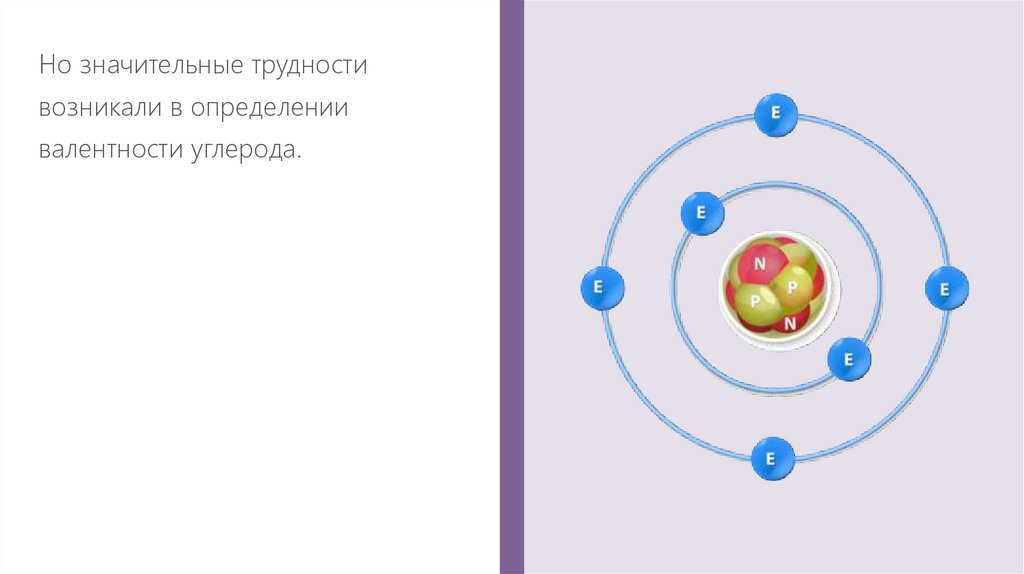
Но значительные трудностивозникали в определении
валентности углерода.
3.
СН4 С2Н6 С3Н8В соединенияx метана, этана, пропана,
которые входят в состав природного
газа, углерод может дать разную
валентность и даже дробную.
4.
Согласно с современнымиэлектронными представлениями,
все особенности органических
соединений определяются
свойствами элемента углерода.
5.
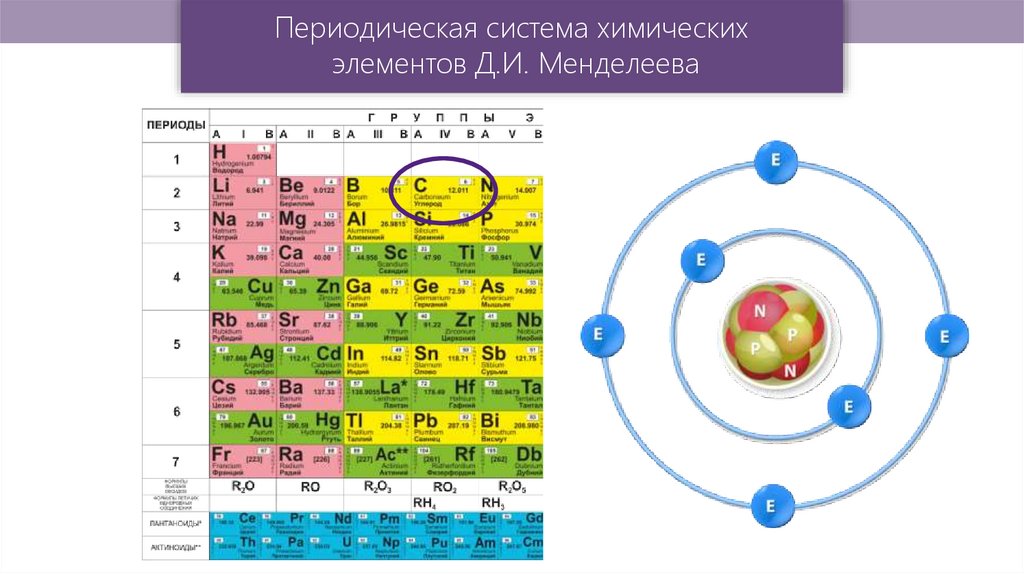
Периодическая система химическихэлементов Д.И. Менделеева
6.
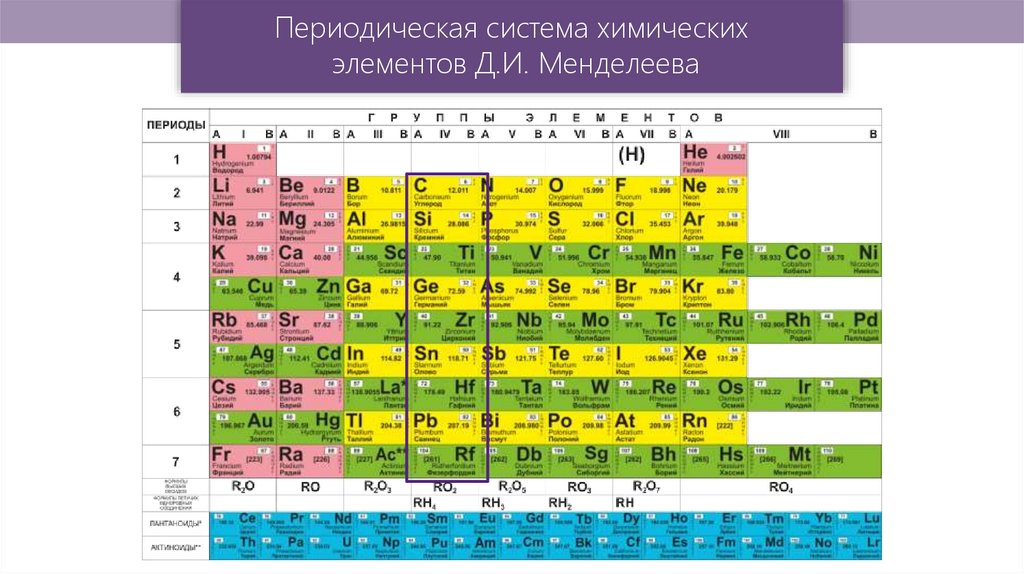
Периодическая система химическихэлементов Д.И. Менделеева
7.
Углерод1S22S22P2
1S22S12P3
В свободном состоянии
В возбуждённом состоянии
E
E
2S
1S
2P
2S
1S
2P
8.
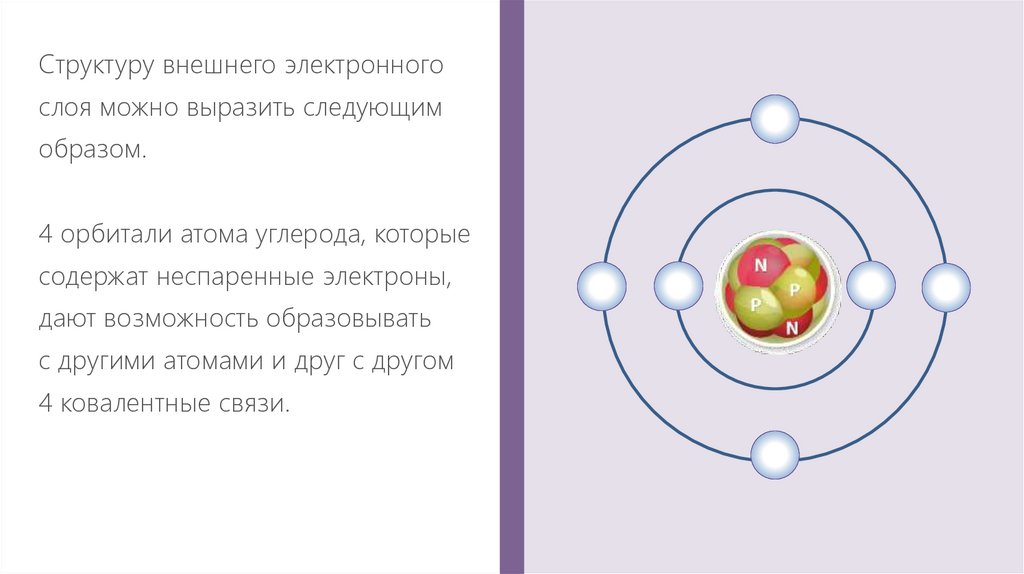
Структуру внешнего электронногослоя можно выразить следующим
E
образом.
4 орбитали атома углерода, которые
содержат неспаренные электроны,
дают возможность образовывать
E
E
E
с другими атомами и друг с другом
4 ковалентные связи.
E
E
9.
Ковалентная связь (от латинского «со» —совместно и «vales» — имеющий силу)
осуществляется за счёт электронной пары,
принадлежащей обоим атомам.
10.
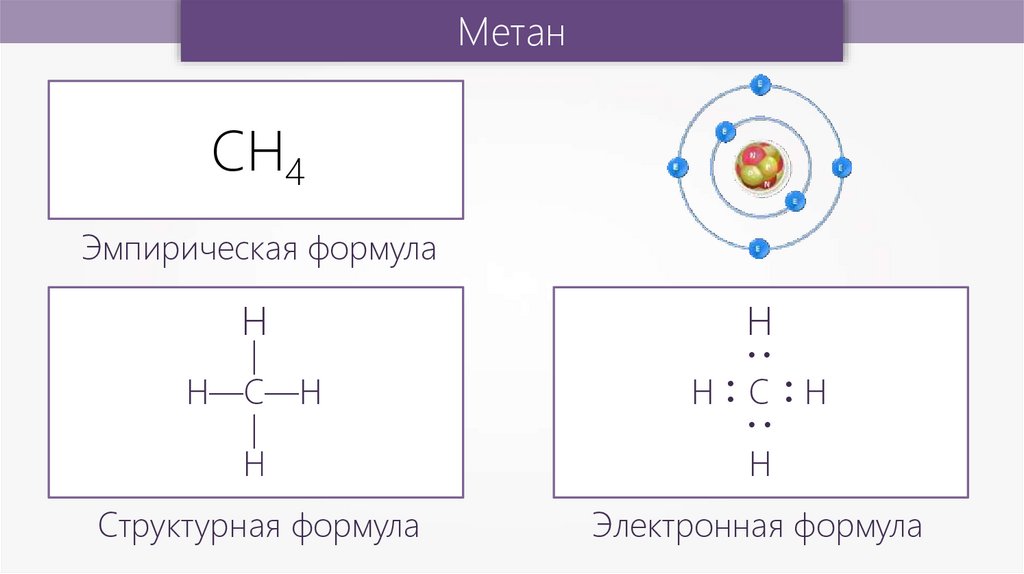
МетанСН4
Эмпирическая формула
—
..
H—С—H
..
Структурная формула
Электронная формула
H—С—H
H
H
..
— —
..
—
H
H
11.
Структурные формулысчитаются языком
органической химии.
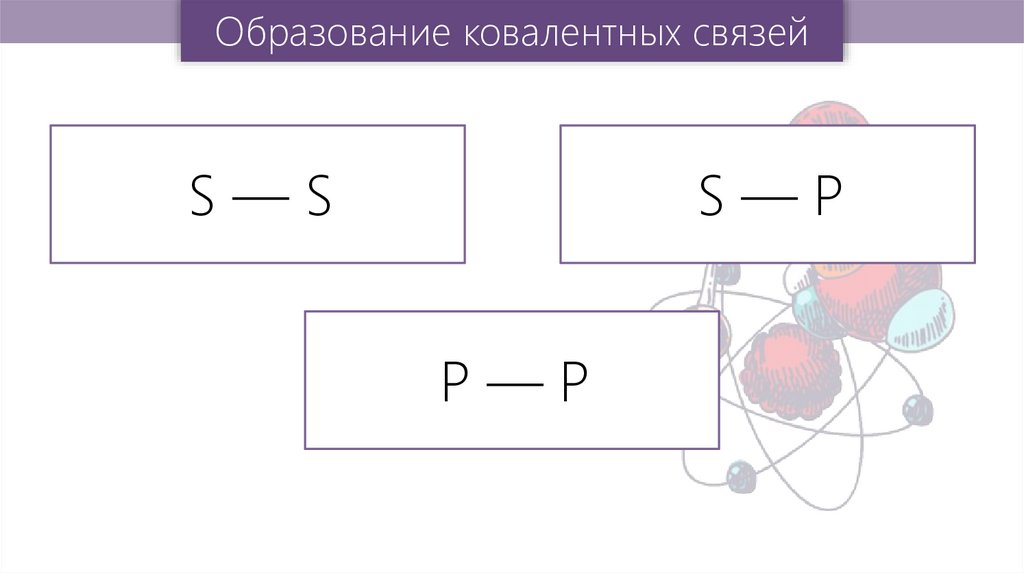
12.
Образование ковалентных связейS—S
S—P
P—P
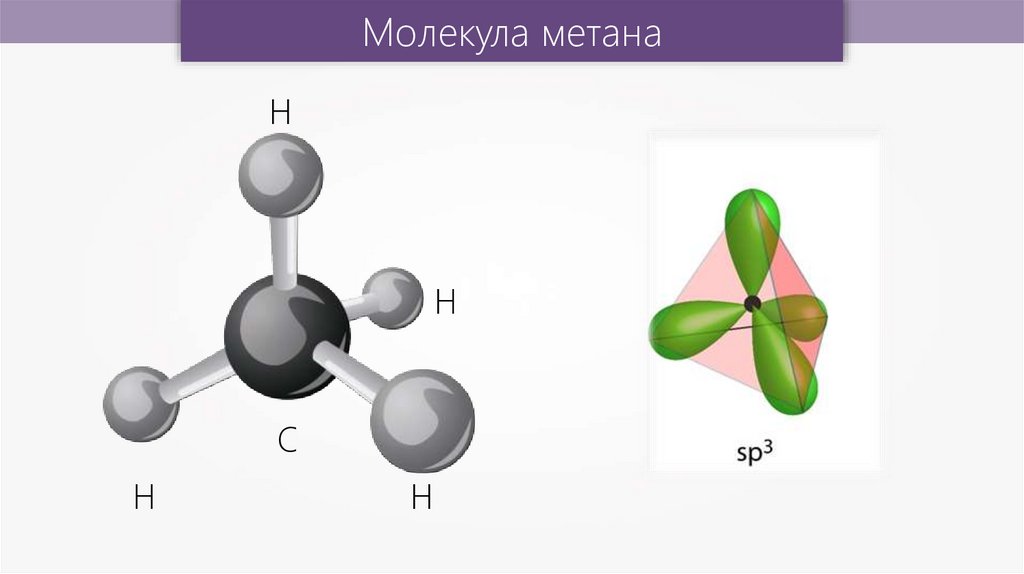
13.
Молекула метанаH
H
С
H
H
14.
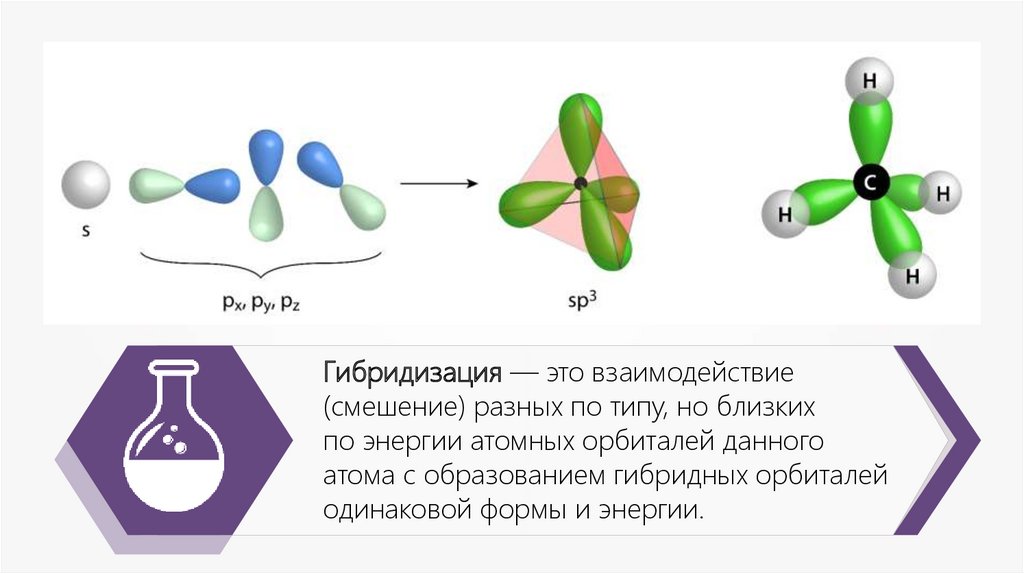
Гибридизация — это взаимодействие(смешение) разных по типу, но близких
по энергии атомных орбиталей данного
атома с образованием гибридных орбиталей
одинаковой формы и энергии.
15.
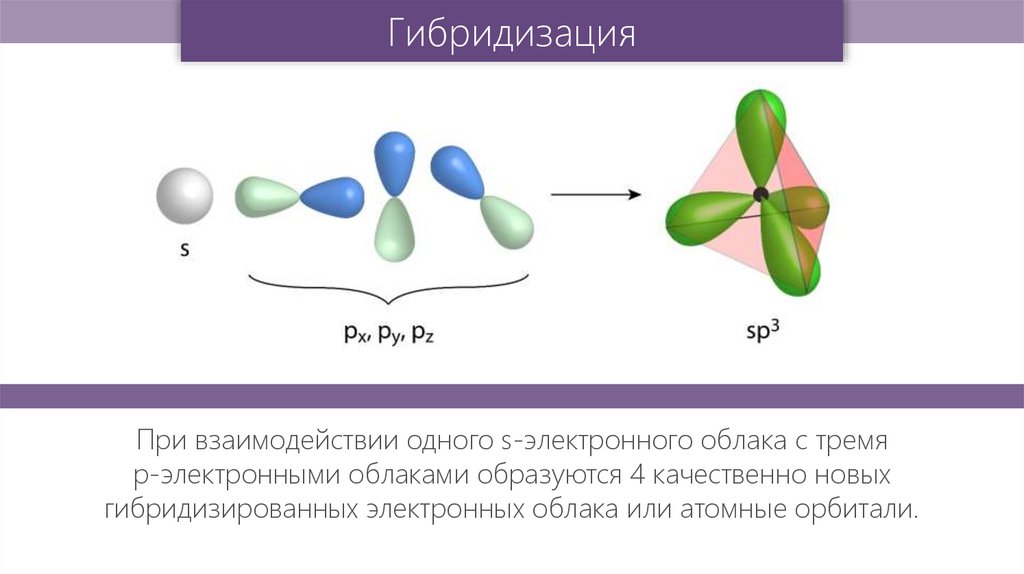
ГибридизацияПри взаимодействии одного s-электронного облака с тремя
р-электронными облаками образуются 4 качественно новых
гибридизированных электронных облака или атомные орбитали.
16.
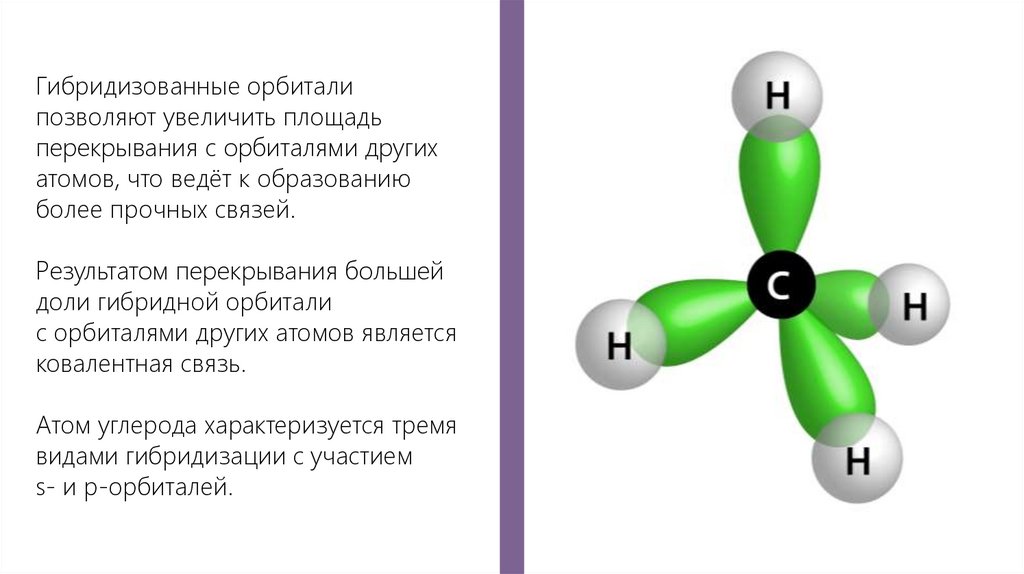
Гибридизованные орбиталипозволяют увеличить площадь
перекрывания с орбиталями других
атомов, что ведёт к образованию
более прочных связей.
Результатом перекрывания большей
доли гибридной орбитали
с орбиталями других атомов является
ковалентная связь.
Атом углерода характеризуется тремя
видами гибридизации с участием
s- и р-орбиталей.
17.
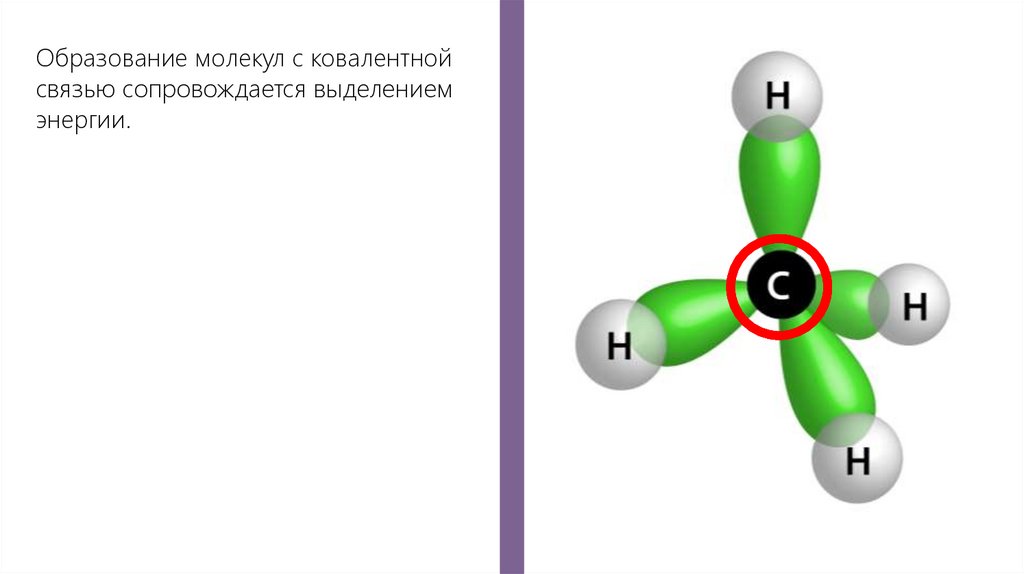
Образование молекул с ковалентнойсвязью сопровождается выделением
энергии.
18.
кДж/мольЭнергия связи указывает
на его прочность и измеряется
в килоджоулях на 1 моль.
19.
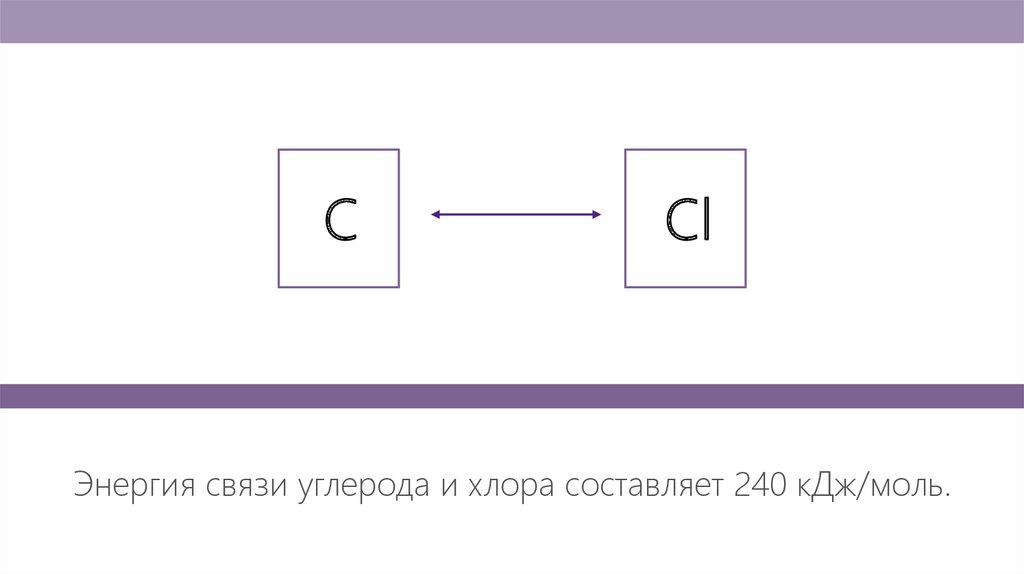
CCl
Энергия связи углерода и хлора составляет 240 кДж/моль.
20.
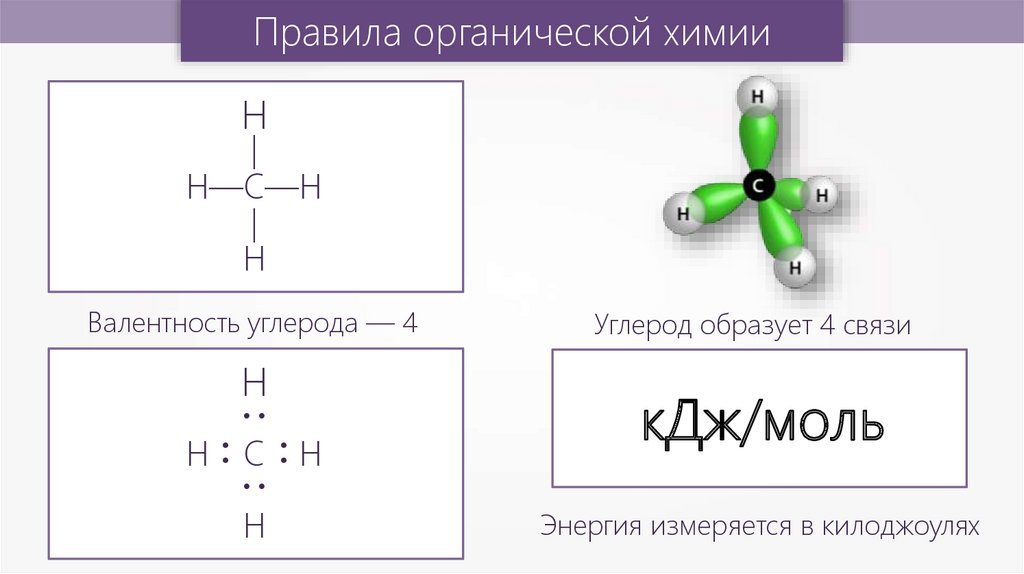
Правила органической химии—
H
H—С—H
—
H
Валентность углерода — 4
..
H—С—H
..
..
— —
..
H
H
Углерод образует 4 связи
кДж/моль
Энергия измеряется в килоджоулях






 Химия
Химия








