Похожие презентации:
Молекулярно-кинетическая теория (презентации к системе уроков)
1. Молекулярно-кинетическая теория (презентации к системе уроков)
Молекулярнокинетическаятеория
(презентации к системе уроков)
2. Тема: «Основные положения МКТ. Сила взаимодействия молекул»
Цель урока: выяснить значение силвзаимодействия молекул.
Задачи: Учиться самостоятельно приобретать
информацию по теме урока, выделить главную
идею занятия.
усвоить формулировки законов молекулярной
физики научиться записывать основные понятия и
физические величины.
приобрести умения анализировать, устанавливать
связи между элементами содержания ранее
изученного материала по основам молекулярной
3. Немного вспомните!
4. Знакомые опыты:
5. Основные положения МКТ
6. Атомы и молекулы
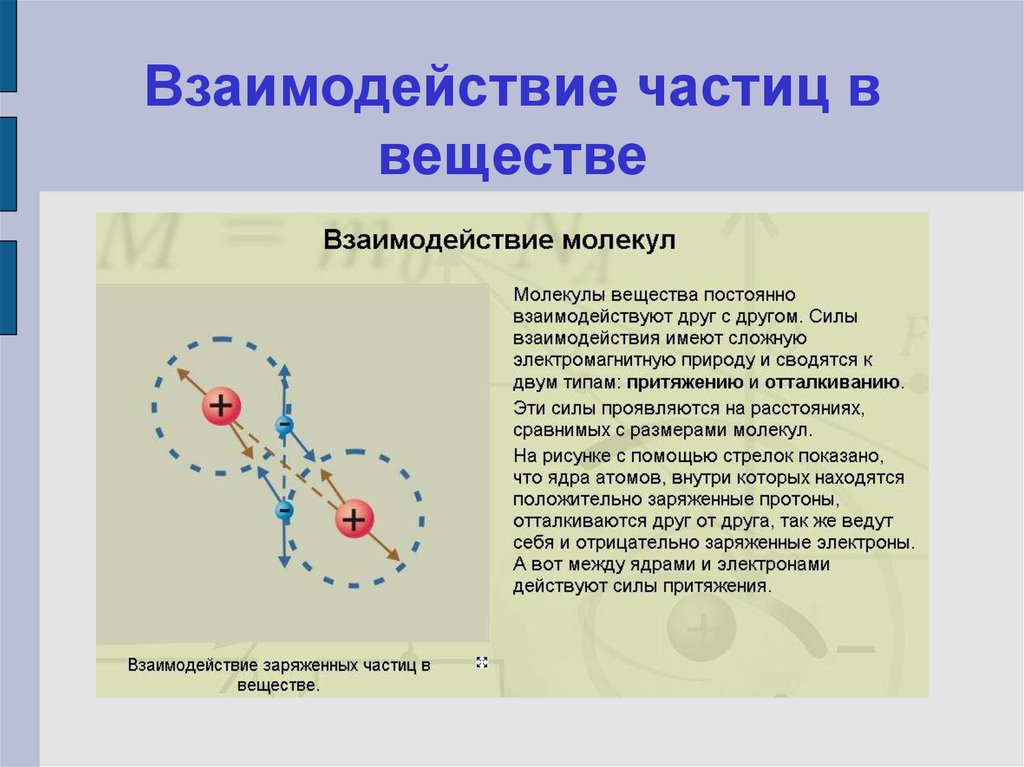
7. Взаимодействие частиц в веществе
8. Сила взаимодействия частиц
9. Опыт «диффузия в жидкостях» (выполнен учащимися класса)
4.11.2006 – 21.303.11.2006 – 21.20
2.11.2006 – 21.50
2.11.2006 – 7.50
1.11.2006 – 21.00
10. Схема броуновского движения
11. Изменение агрегатного состояния вещества
12. Найдите объяснение
13. Твоё настроение!
14. Основы термодинамики
Термодинамическиепараметры
Тепловое равновесие
температура
15. Структура раздела
Методическая идея заключается всовместном изучении тепловых явлений и
молекулярной физики
Раздел имеет следующую структуру:
Основные положения МКТ;
Основы термодинамики ( тепловое равновесие,
параметры состояния, температура, газовые
законы, первый закон термодинамики)
Молекулярно-кинетическая теория идеального
газа (основное уравнение МКТ газов, температура
- как мера средней кинетической энергии
молекул);
Свойства жидкостей, твёрдых тел и их взаимные
превращения
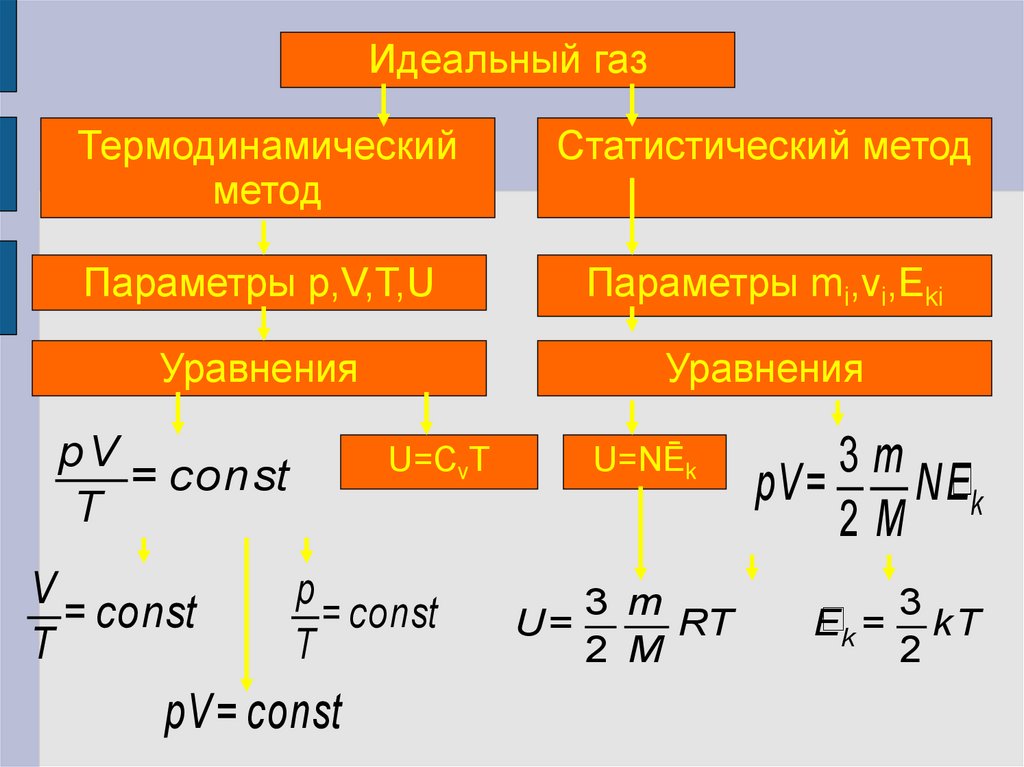
16.
Идеальный газТермодинамический
метод
Статистический метод
Параметры p,V,T,U
Параметры mi,vi,Eki
Уравнения
Уравнения
pV
= const
T
V
= const
T
U=CvT
p
= const
T
pV = const
U=NĒk
3 m
U=
RT
2 M
3m
pV=
NEk
2M
3
Ek = kT
2
17. Опытное подтверждение основных положений МКТ
диффузия;броуновское движение;
тепловое расширение и сжатие тел;
наблюдения в электронный микроскоп
свойства тел
18. Основные постоянные:
Постоянная Авогадро –6,022169 ·1025 моль-1
(число молекул в одном моле вещества)
Постоянная Лошмидта –
2,68799 ·1025 м-3
(число молекул в одном м3 газа при нормальных
условиях)
Размеры молекул
масса - 10-26 - 10-27 кг
диаметр - 10-10 м
19. Модели
1. Идеальный газВ термодинамике: газ, подчиняющийся газовым
законам
В МКТ: материальные точки , абсолютно упруго
взаимодействующие при ударе и не взаимодействующие
на расстоянии
2. Изолированная система
20. Введение основных понятий
21. Температура
исторически сначала научились измерять(принцип действия термометров)
различные шкалы;
температура – мера средней кинетической
энергии молекул;
температура –физическая величина,
характеризующая состояние теплового
равновесия системы
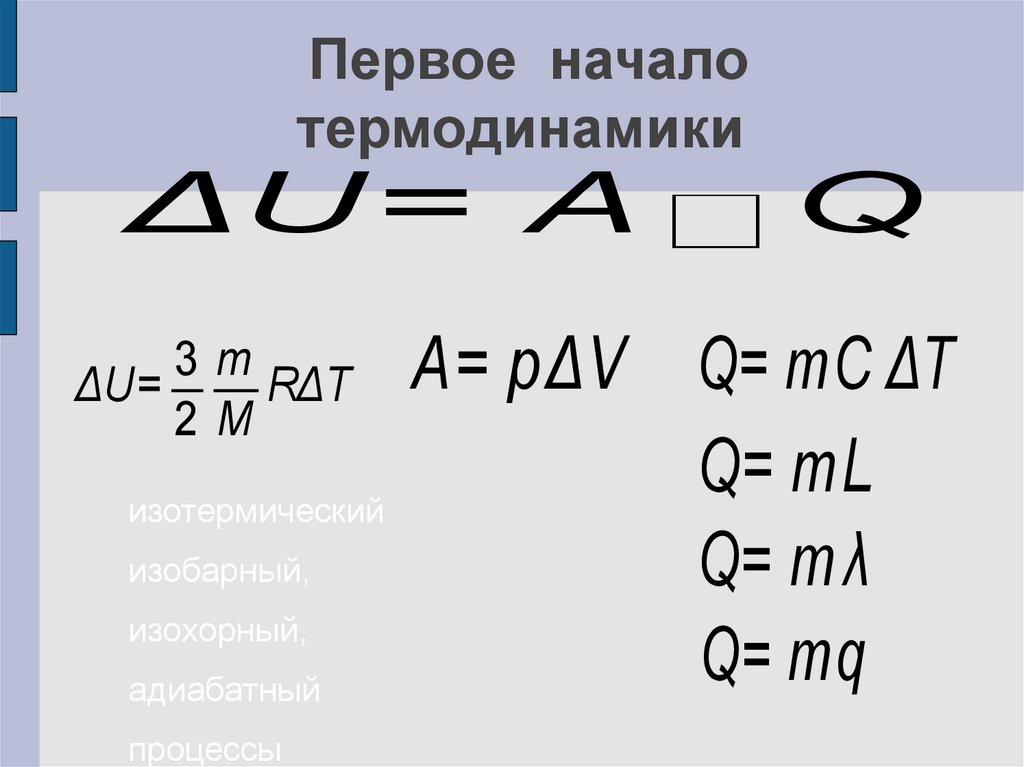
22. Первое начало термодинамики
ΔU = A3m
ΔU=
RΔT
2M
изотермический
изобарный,
изохорный,
адиабатный
процессы
Q
A= pΔV Q= mC ΔT
Q= mL
Q= m λ
Q= mq
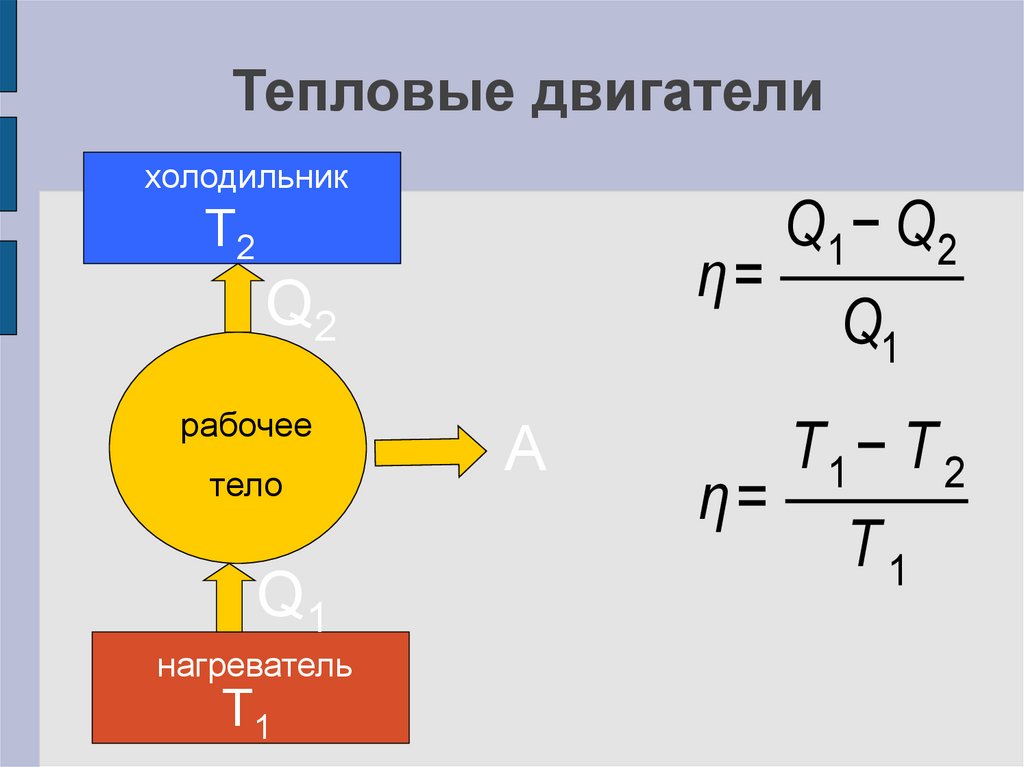
23. Тепловые двигатели
холодильникT2
η=
Q2
рабочее
тело
Q1
нагреватель
T1
A
η=
Q1 − Q2
Q1
T1 − T 2
T1
24. Основные опыты
Наблюдение диффузии, теплового расширениятел, слипание свинцовых пластин, осмоса и т.п.
Изменение агрегатных состояний вещества,
нагревание, охлаждение (виды теплопередачи)
Адиабатное расширение и сжатие (воздушное
огниво, туман в бутылке), взрыв бензиновых
паров под поршнем.
Лабораторные работы по определению уд.
теплоёмкости, уд. теплоты парообразования,
плавления, мощности горелки, КПД установки и
т.п.
25. Основные задачи
На нахождение скоростей, массы, числа,концентрации молекул.
С использованием уравнения состояния
идеального газа, изопроцессов
(количественные, графические).
На составление уравнения теплового баланса,
нахождение работы в термодинамике.
На использование первого начала
термодинамики.
На определение КПД теплового двигателя,
мощности и работы.




















 Физика
Физика








