Похожие презентации:
Условия химического, фазового и мембранного равновесий. Правило фаз
1.
Лекция 8Условия химического, фазового и мембранного
равновесий. Правило фаз.
Диаграммы состояния однокомпонентных
систем (вода).
2.
Лекция 7Фугитивность. Химический потенциал
идеального и реального газов.
Условие химического равновесия. Стандартная
энергия Гиббса химической реакции.
3.
1 баллЧто такое уравнения Максвелла (УМ)? Какие утверждения –
правильные?
1) УМ - это равенство вторых производныx функций H,G,F друг
другу.
2) УМ - это равенство вторых смешанных производныx функций
H,G,F по естественным переменным.
3) УМ справедливы только для идеальных газов.
4) УМ справедливы потому, что H,G,F – функции состояния.
4.
Какие формулы здесь – правильные?1) Уравнение Гиббса-Дюгема:
2 балла
SdT Vdp i dni 0
i
2) Условие «самопроизвольности протекания процесса»
dsi 0
3) Условие «самопроизвольности протекания процесса»
dG T , p ,n 0
4) Условие «самопроизвольности протекания процесса»
dSсист 0
5) Уравнение Гиббса-Дюгема:
SdT Vdp ni d i 0
i
5.
«Неравенство Клаузиуса».dS
Q
T
; dS
Q
T
dsi ; dsi 0
6.
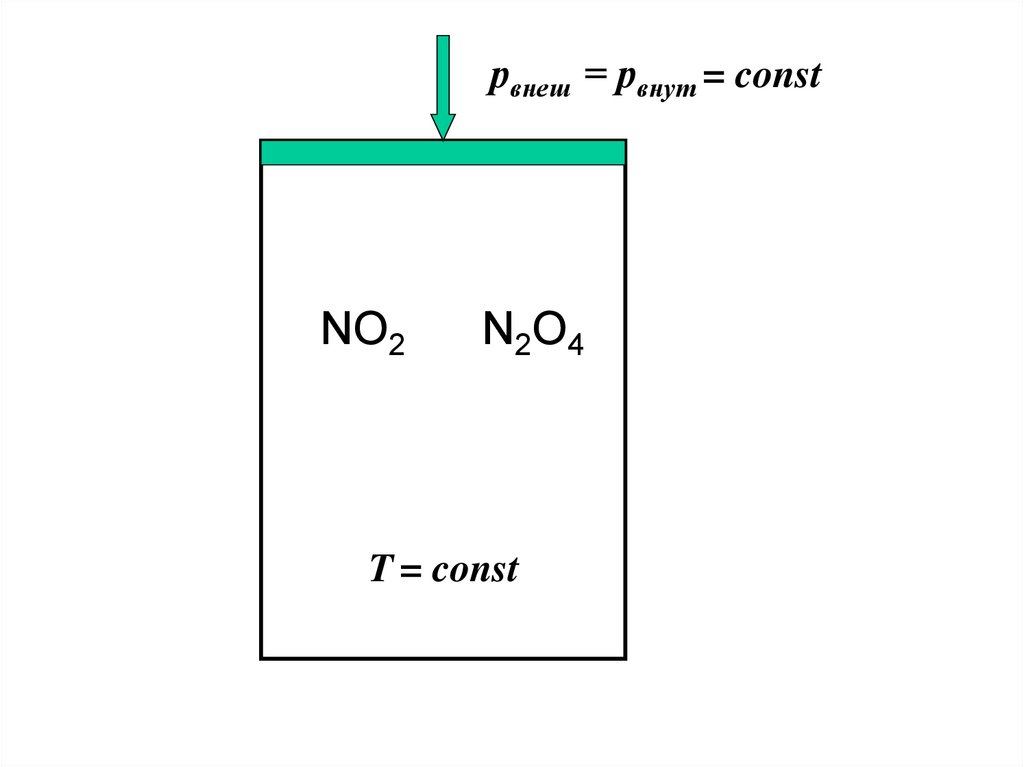
ХИМИЧЕСКОЕ РАВНОВЕСИЕ7.
рвнеш = рвнут = constNO2
N2O4
T = const
8.
dG p,T ,ni
0
9.
Условия химического равновесияG
Gr N 2O4 2 NO2 0
T , p
N O 2 NO 0
2 4
i i
Продукты
2
j j 0
Реагенты
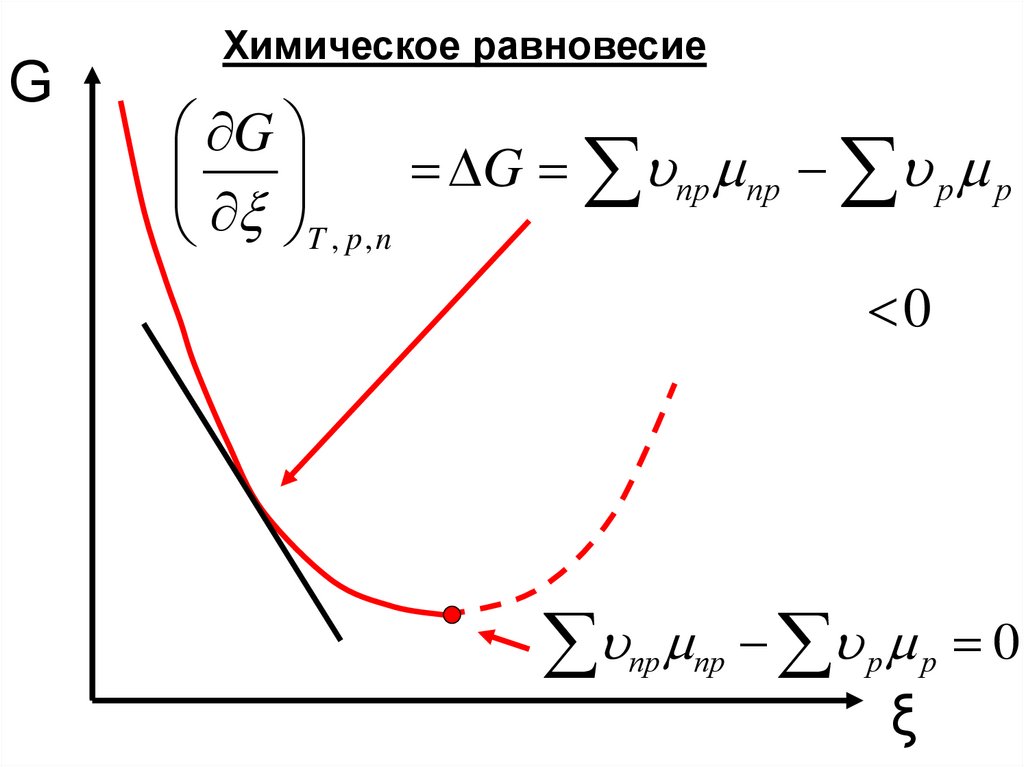
10.
GХимическое равновесие
G
G пр пр р р
T , p , n
0
пр
пр р р 0
ξ
11.
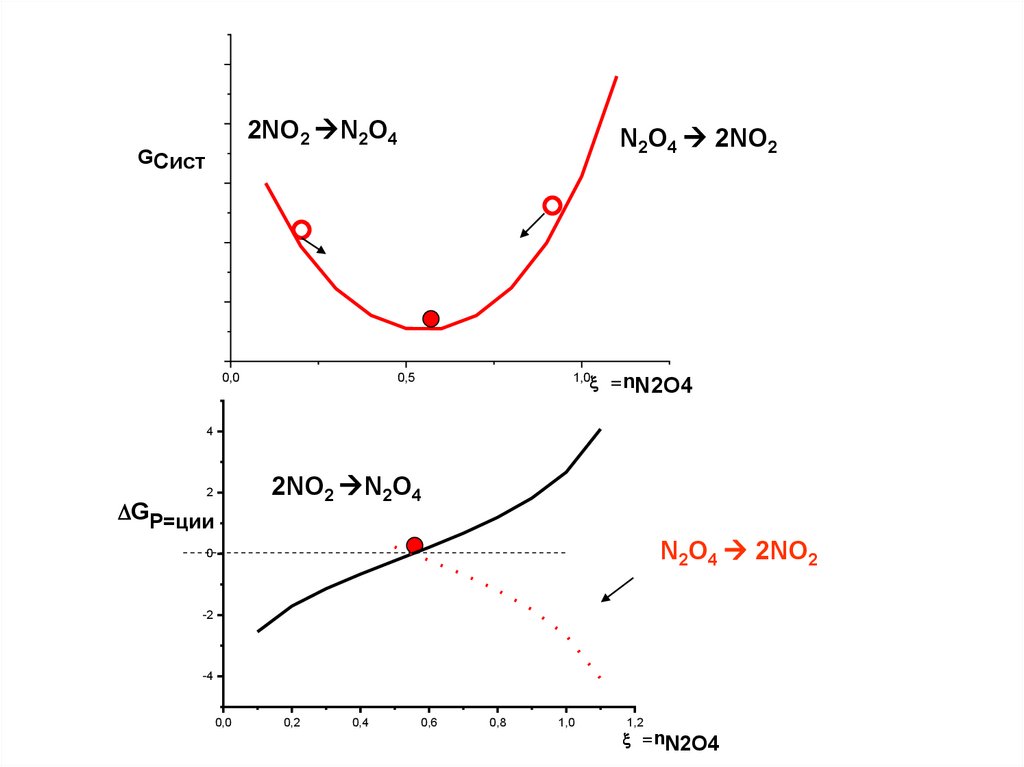
2NO2 N2O4N2O4 2NO2
GСист
0,0
1,0
0,5
nN2O4
4
2NO2 N2O4
2
GР=ции
N2O4 2NO2
0
-2
-4
0,0
0,2
0,4
0,6
0,8
1,0
1,2
nN2O4
12.
Химический потенциал идеального газаNO (T ; p)
2
0
NO2
N O (T , p)
2 4
(T ) RT ln
pNO2
(T ) RT ln
pN2O4
0
N 2O4
p
p
0
0
13.
Достижение равновесия в химической реакции2NO2
μ (NO2), μ (N2O4)
2μ (NO2)
N2O4
μ (N2O4)
p(NO2) + p(N2O4) = const
Рав.
p(N2O4)
p(NO2)
14.
Изотерма химической реакцииG
Gr N 2O4 2 NO2 0
T , p
N O p, T
2 4
0
N 2O4
(T ) RT ln
pN2O4
p
0
N 2O4
; NO2 p, T
0
NO2
pN 2O4
GT
2
RT ln 2
pNO
2
0
GT GT RT ln Q 0
0
N 2O4
0
NO2
(T ) RT ln
G RT ln K ; e
0
T
pN 2O4
K 2
p NO
2
0
pNO
2
p
pN 2O4
2
NO2
GT GT0 RT ln Q равн 0; Q равн K
GT0
RT
pNO2
p
pN 2O4
2
NO2
0
0
0
15.
Химический потенциал идеального и реального газаp
ид. (T ; p) (T ) RT ln 0
p
0
f ( p, T )
реал (T , p ) (T ) RT ln
0
p
0
16.
Изотерма химической реакцииG
Gr N 2O4 2 NO2 0
T , p
N O p, T
2 4
0
N 2O4
(T ) RT ln
f N2O4
p
0
N 2O4
; NO2 p, T
0
NO2
f N 2O4
GT
2
RT ln 2
f NO
2
0
GT GT RT ln Q 0
0
N 2O4
0
NO2
(T ) RT ln
G RT ln K ; e
0
T
f N 2O4
K 2
f NO
2
0
pNO
2
p
pN 2O4
2
NO2
GT GT0 RT ln Q равн 0; Q равн K
GT0
RT
f NO2
p
pN 2O4
2
NO2
0
0
0
17.
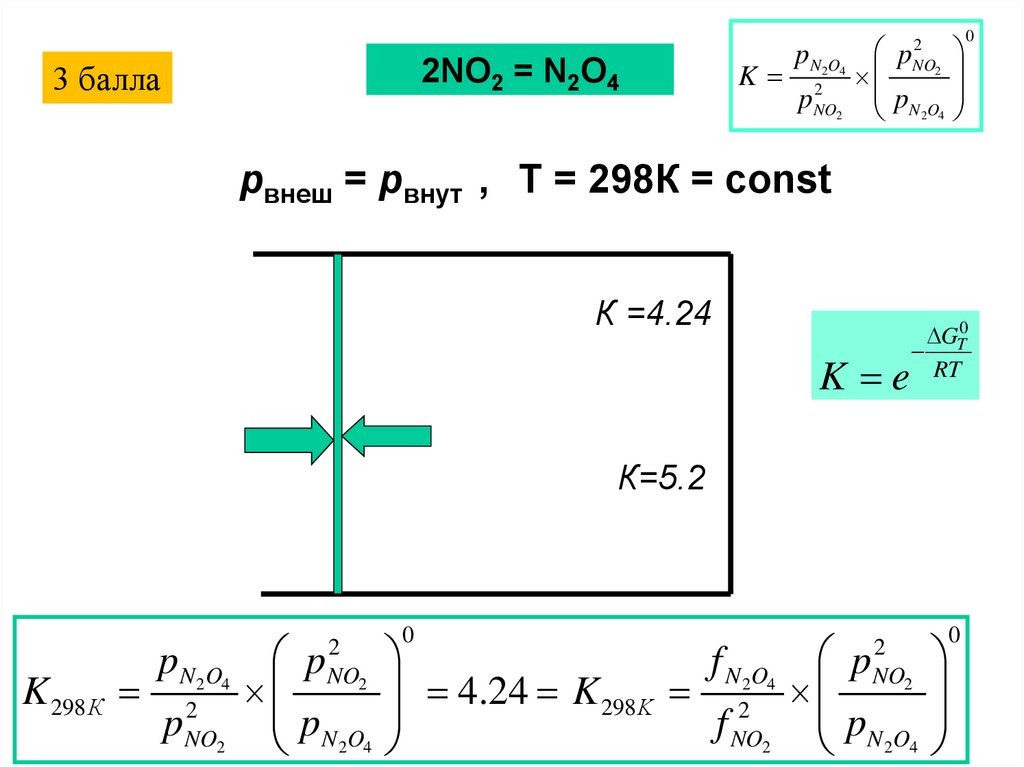
2NO2 = N2O43 балла
K
pN2O4
2
pNO
2
2
pNO
2
pN O
24
0
pвнеш = pвнут , T = 298К = const
К =4.24
K e
GT0
RT
К=5.2
K 298 К
pN 2O4
p
2
NO2
p
pN O
2 4
2
NO2
0
f N 2O4 p
4.24 K 298 K 2
f NO2 pN 2O4
2
NO2
0
18.
Уравнение Гиббса-ГельмгольцаG
G U TS pV H TS ; dG SdT Vdp;
S
T p
G
G T
H;
T p
G 1 G
H
2
2
T
T T p T
G
T
H
2
T
T
p
19.
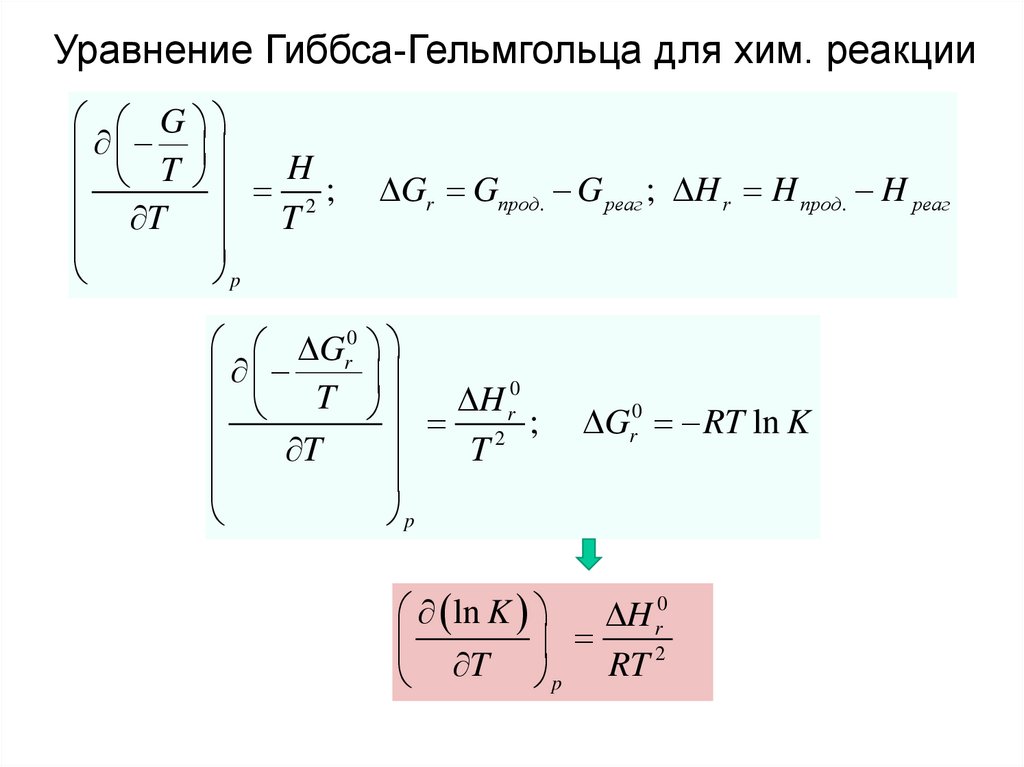
Уравнение Гиббса-Гельмгольца для хим. реакцииG
T
H
2;
T
T
p
Gr Gпрод. G реаг ; H r H прод. H реаг
Gr0
0
T
H
r
;
2
T
T
p
Gr0 RT ln K
ln K
H r0
2
T
RT
p
20.
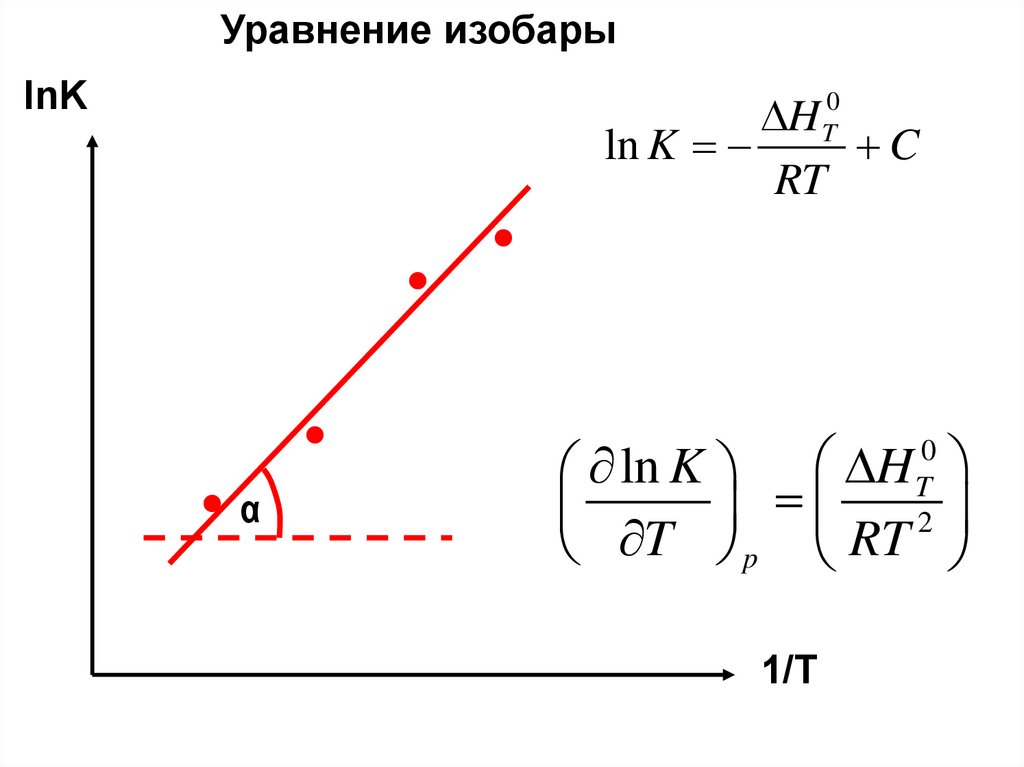
Уравнение изобарыlnK
H
ln K
C
RT
0
T
α
ln K H
T p RT
0
T
2
1/T
21.
Уравнение изобары1 балл
lnK
H
ln K
C
RT
0
T
ln K H
T p RT
0
T
2
1/T
22.
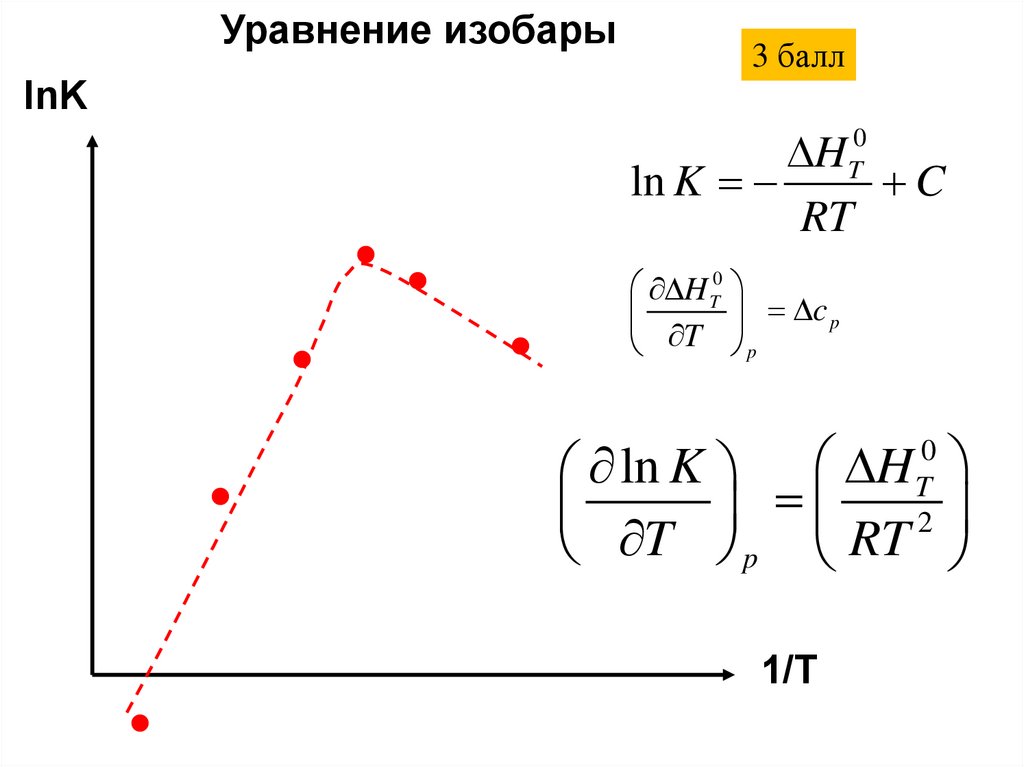
Уравнение изобары3 балл
lnK
H
ln K
C
RT
0
T
H T0
c p
T p
ln K H
T p RT
0
T
2
1/T
23.
2 баллаХимическая реакция. Отметьте правильные утверждения
1) Энергия Гиббса самопроизвольной химической реакции
должна убывать.
2) При самопроизвольной реакции (dG)сист.<0
3) Условие химического равновесия: равенство химических
потенциалов продуктов и реагентов (с учетом стехиометрии).
4) При самопроизвольной реакции энергия Гиббса закрытой
системы при постоянных p,T должна убывать.
5) При самопроизвольной реакции энергия Гельмгольца закрытой
системы при постоянных V,T должна убывать.
24.
Фазовое равновесие25.
Фазовое равновесие: j фаз, i компонентовdU V ,S ,n
i
0; V , S , ni const
T , p ,
(2)
(2)
(2)
i
T (1) , p(1) , i(1)
T (3) , p(3) , i(3)
T , p ,
(4)
T (5) , p(5) , i(5)
(4)
(4)
i
T ( j ) , p( j ) , i( j )
26.
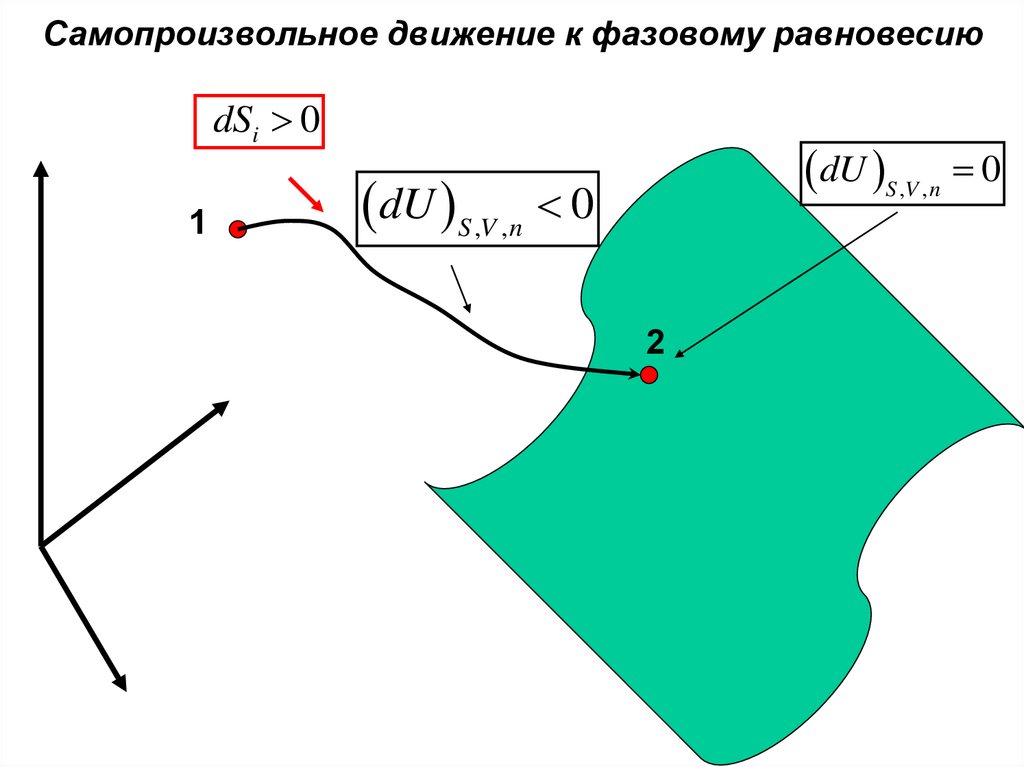
Самопроизвольное движение к фазовому равновесиюdSi 0
1
dU S ,V ,n 0
dU S ,V ,n 0
2
27.
Фазовое равновесие: 2 фазы, 2 компонентов.dU S ,V ,n
i
T , p , ,
(1)
dS
(1)
dS
(1)
dV
(2)
T
(2)
(1)
2
(1)
2
dn
(1)
1
dn
(1)
dV
(1)
1
(2)
1
dn
(2)
(2)
2
dn
, p , ,
(2)
(2)
1
(2)
2
0;
28.
Фазовое равновесие.Билет 31, 2 сем., 1 курс
2
(dU ) S ,V ,n1 , n2 TdS pdV i dni Tdsi 0
i 1
(dU ) S ,V ,n1 , n2 dU (1) dU (2)
T (1) dS (1) p (1) dV (1) 1(1) dn2(1) 2(1) dn2(1)
T (2) dS (2) p (2) dV (2) 1(2) dn1(2) 2(2) dn2(2) 0
dS (1) dS (2) dS 0; dV (1) dV (2) dV 0
dn1(1) dn1(2) dn1 0; dn2(1) dn2(2) dn2 0
(dU ) S ,V ,n1 , n2 Tdsi 0 dU (1) dU (2)
T (1) T (2) dS (1) p (1) p (2) dV (1)
(1)
1
1(2) dn1(1) 2(1) 2(2) dn2(1) 0
T (1) T (2) ; p (1) p (2)
1(1) 1(2) ; 2(1) 2(1)
29.
Испарение и сублимацияH2O (пар)
Ag+Au
(пар)
H2O (ж.)
Ag+Au
(тв. р=р)
Т пар Т ж ; р пар р ж ;
пар ж
Н 2О
Н 2О
Т пар Т тв. р р ; р пар р тв. р р ;
тв . р р
пар
тв . р р
пар
Ag
Ag
; Au
Au
30.
РастворениеТ
p p
NaCl , тв
NaCl
T
NaCl , тв
NaCl +H2O
NaCl (тв)
(р=р)
р р
NaCl
; p
p p
;
p
NaCl , тв
H 2O
NaCl , тв
р р
H 2O
31.
ЭкстракцияT C6 H 6 T H 2O ; p C6 H 6 p H 2O
AC H AH O
6
6
2
HC HO HH OO ; CC HH CH HO
6
2
6
2
6
6
2
6
6
2
6
6
С6Н6
А
А
Н2О
32.
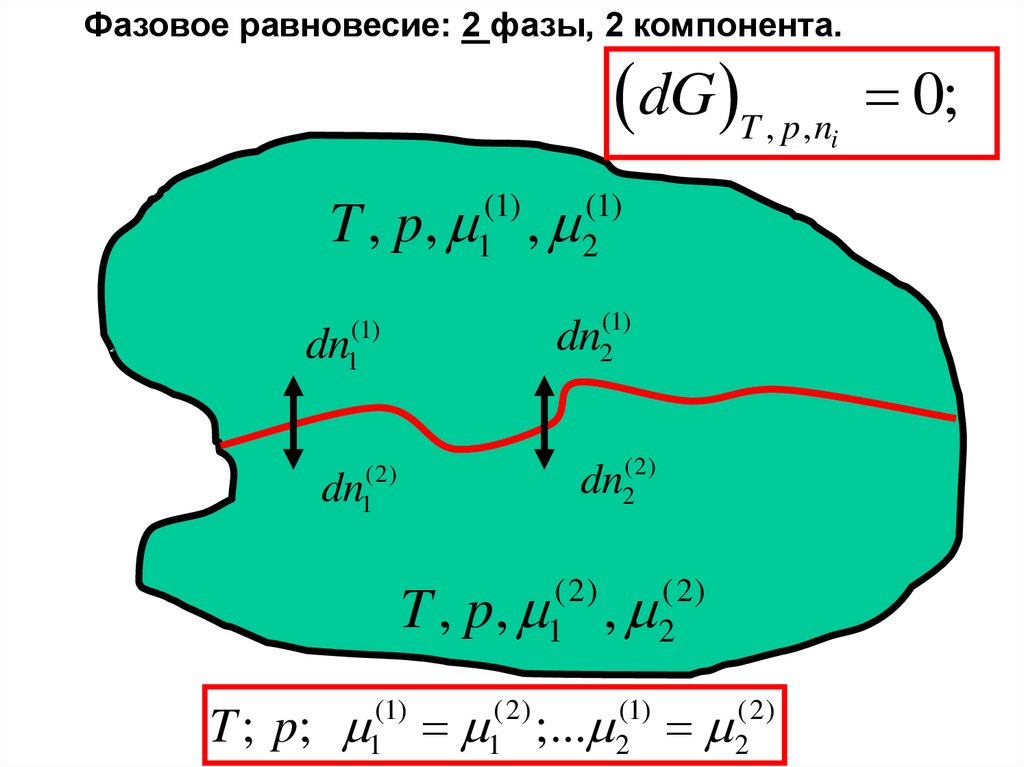
Фазовое равновесие: 2 фазы, 2 компонентa.dG T , p, n
i
T , p, ,
(1)
1
(1)
2
dn2(1)
(1)
1
dn
dn2(2)
(2)
1
dn
T , p, ,
(2)
1
T ; p;
(1)
1
;...
(2)
1
(1)
2
(2)
2
(2)
2
0;
33.
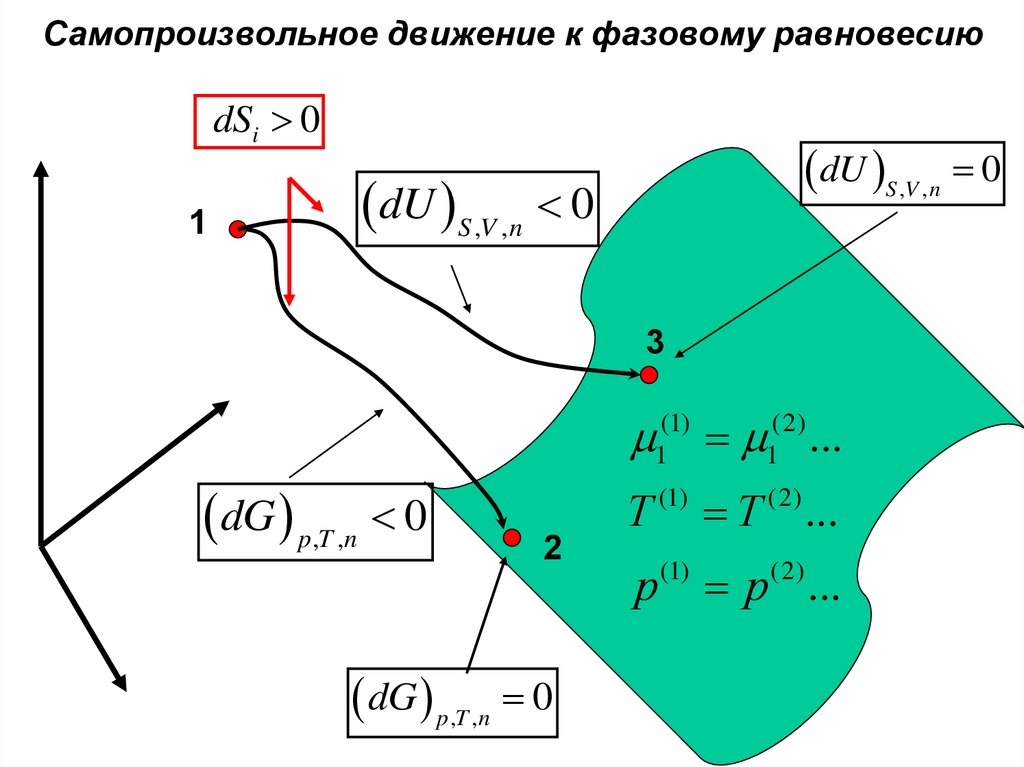
Самопроизвольное движение к фазовому равновесиюdSi 0
1
dU S ,V ,n 0
dU S ,V ,n 0
3
dG p,T ,n 0
2
dG p,T ,n 0
(1)
1
...
Т
(1)
Т ...
р
(1)
р ...
(2)
1
(2)
(2)
34.
Равновесие в химической реакцииi i
Продукты
j j 0
Реагенты
Фазовое равновесие
Число Фаз (j)
T (1) T (2) .....T ( j )
p (1) p (2) ..... p ( j )
1(1) 1(2) ..... 1( j )
.............................
i(1) i(2) ..... i( j )
Число Компонентов (i) +2
35.
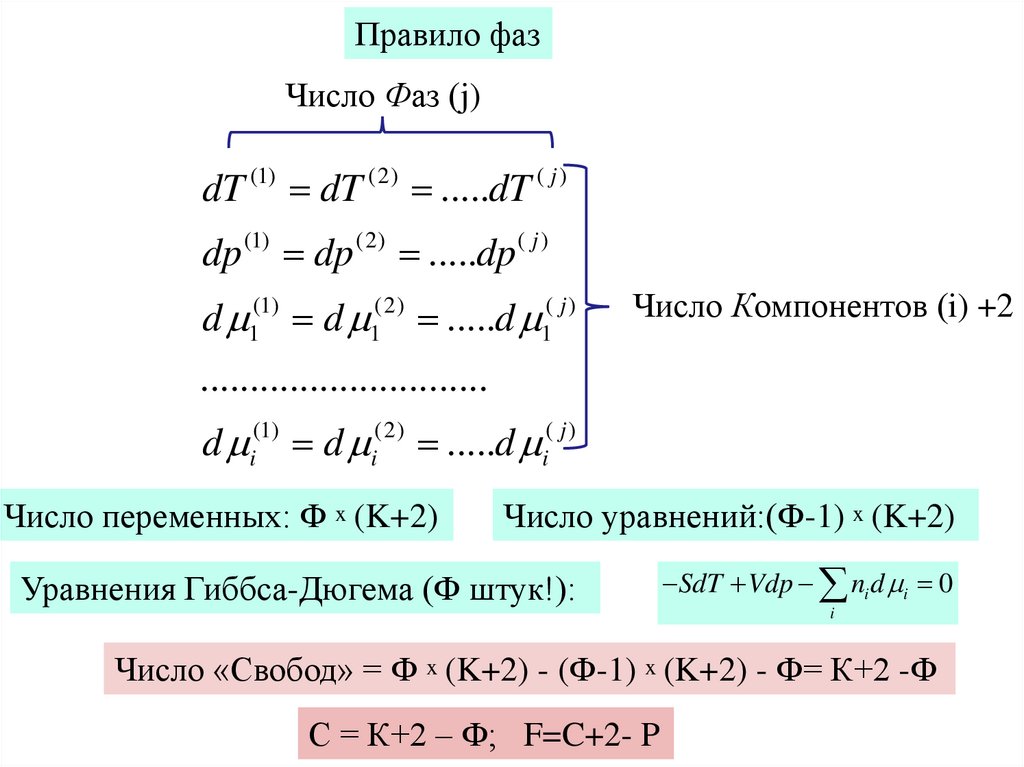
Правило фазЧисло Фаз (j)
dT (1) dT (2) .....dT ( j )
dp (1) dp (2) .....dp ( j )
d 1(1) d 1(2) .....d 1( j )
Число Компонентов (i) +2
.............................
d
(1)
i
d
(2)
i
.....d
Число переменных: Ф x (K+2)
( j)
i
Число уравнений:(Ф-1) x (K+2)
Уравнения Гиббса-Дюгема (Ф штук!):
SdT Vdp ni d i 0
i
Число «Свобод» = Ф x (K+2) - (Ф-1) x (K+2) - Ф= К+2 -Ф
С = К+2 – Ф; F=C+2- P
36.
Мембранное равновесие37.
Мембранное равновесие: j фаз, i компонентовdU S ,V ,n
i
0; V , S , ni const
T , p ,
(2)
(2)
(2)
i
T (1) , p(1) , i(1)
T (3) , p(3) , i(3)
T , p ,
(4)
(4)
(4)
i
i( j )
T (5) , p(5) , i(5)
T , p , , dV
( j)
( j)
( j)
i 1
( j)
0
38.
Мембранное равновесие: j фаз, i компонентовT (1) T (2) .....T ( j )
p (1) p (2) ..... p ( j 1)
1(1) 1(2) ..... 1( j )
.............................
(1)
i
V j const ;
(2)
i
.....
( j)
i 1
p j p j 1 p j 2 ... p1
i j i j 1 i j 2 ...... i1
39.
Осмотическое равновесиеδQ
dn1
p
(1)
; ;T
(1)
1
(1)
2
p
; ;T
(2)
1
(1)
(1)
(2)
2
p
p
(2)
(2)
(2)
dn2
T
(1)
T ; p p ; ;
(2)
(1)
(2)
(1)
1
(2)
1
(1)
2
(2)
2
40.
Фазовое равновесие в однокомпонентной системе41.
Фазовое равновесие: 2 фаза, 1 компонент.dG T , p, n
i
T , p,
(1)
1
dn1(1)
dn1(2)
T , p,
(2)
1
T ; p;
(1)
1
(2)
1
0;
42.
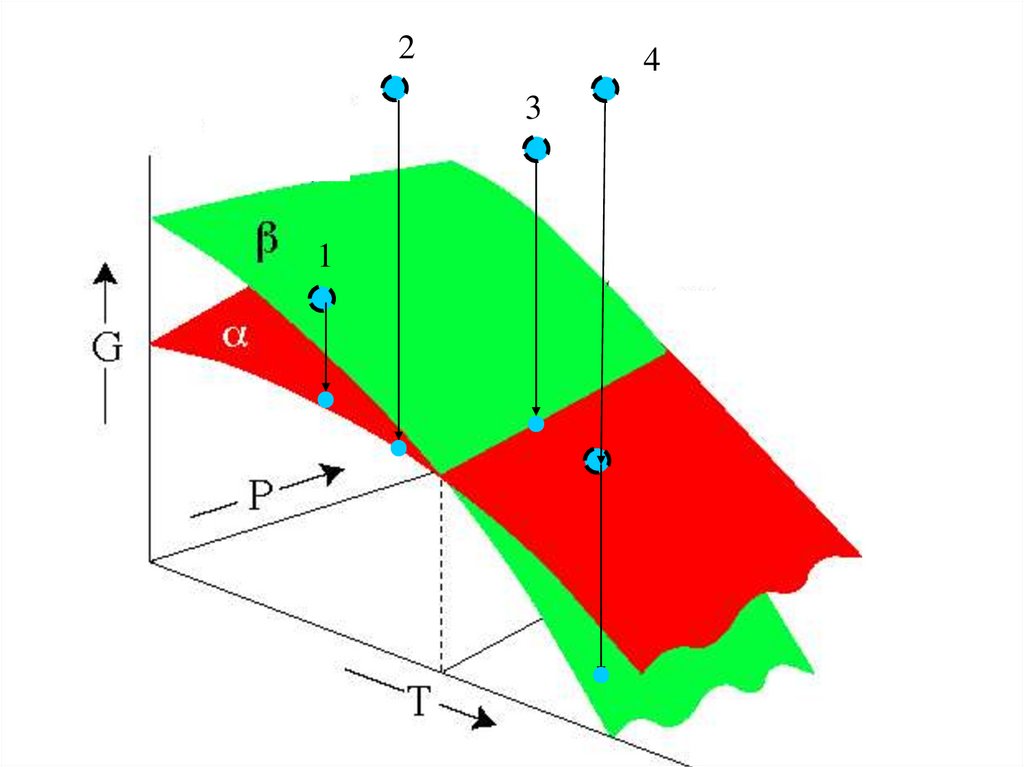
24
3
1
43.
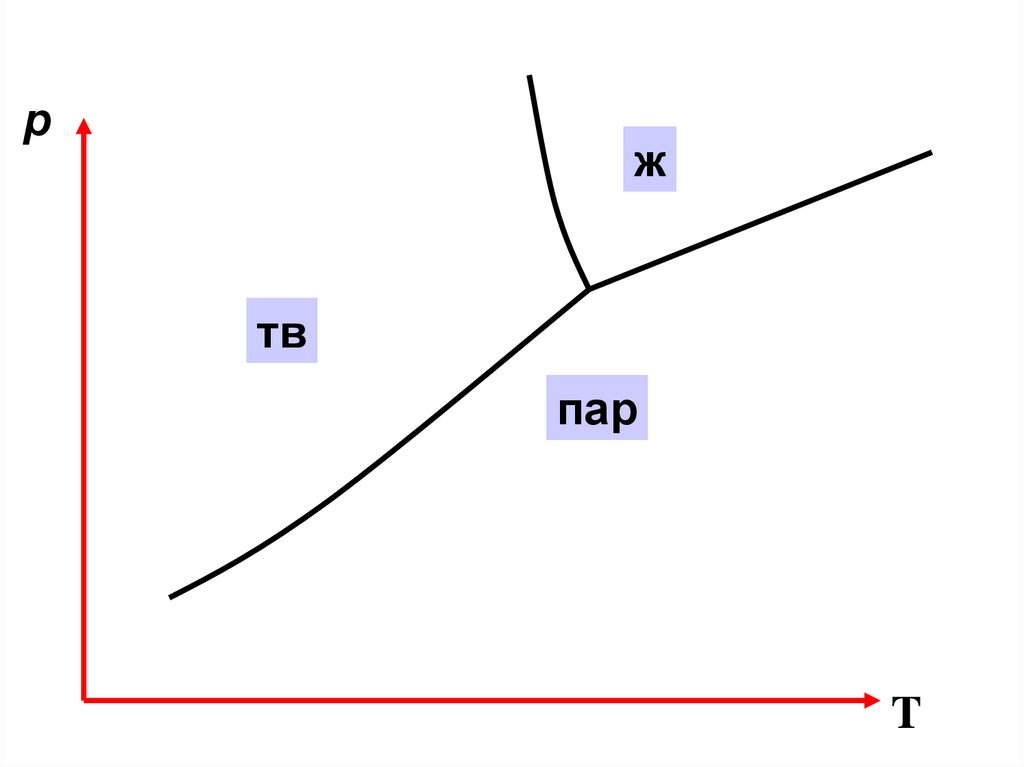
pж
тв
α
пар
β
T
44.
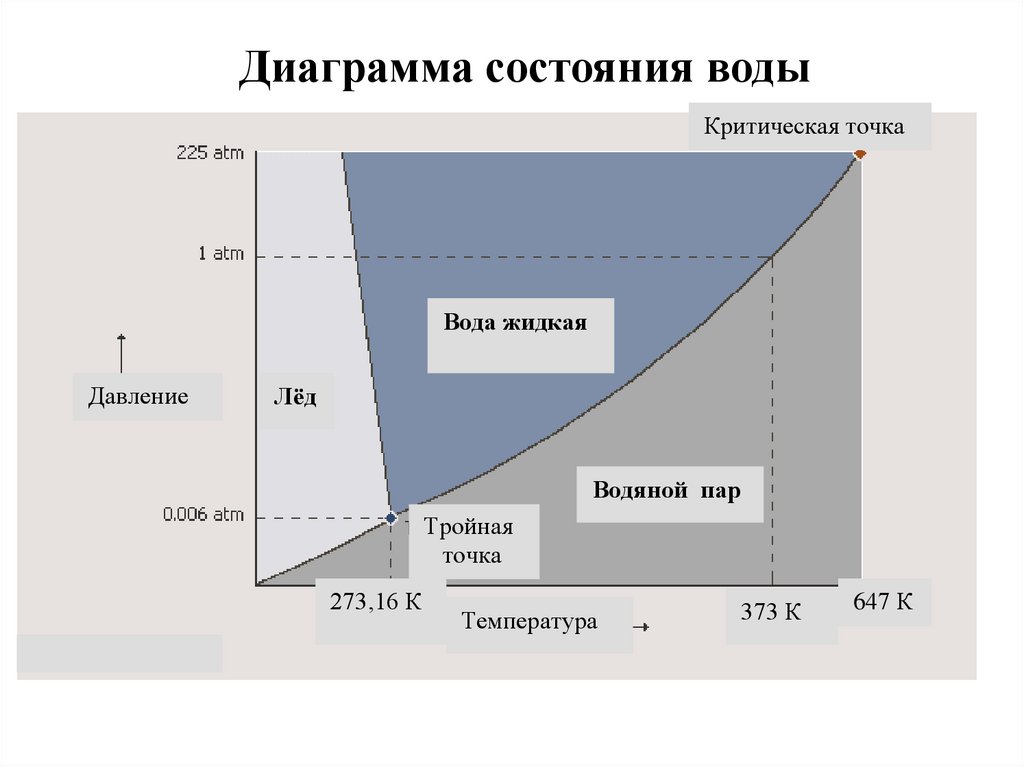
Диаграмма состояния водыКритическая точка
Вода жидкая
Давление
Лёд
Водяной пар
Тройная
точка
273,16 К
Температура
373 К
647 К






























 Химия
Химия








