Похожие презентации:
Ароматические углеводороды. Арены
1.
Министерство науки и высшего образования РФ ФГБОУ ВО«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Органическая химия
Лекция
Тема: Ароматические углеводороды. Арены.
Преподаватель: д.х.н., профессор Климочкин Ю.Н
2.
Классификация• С одним ядром:
а) чисто ароматические:
б) жирно-ароматические:
CH3
• Многоядерные:
• С конденсированными ядрами:
2
3.
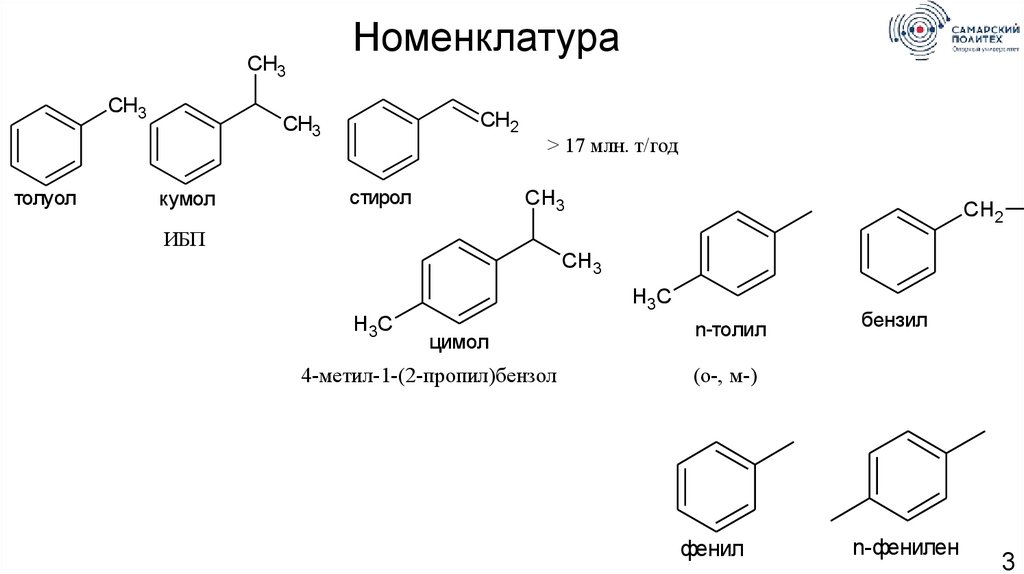
НоменклатураCH3
CH3
толуол
CH2
CH3
кумол
стирол
> 17 млн. т/год
CH3
CH2
ИБП
CH3
H3C
H3C
цимол
4-метил-1-(2-пропил)бензол
n-толил
бензил
(о-, м-)
фенил
n-фенилен
3
4.
Систематические названия строят из названия углеводородного радикала(приставка) и слова бензол (корень):
Если радикалов два или более, их
CH
CH3
CH3
положение указывается номерами
атомов углерода в кольце, с
которыми они связаны.
метилбензол
этилбензол
этинилбензол
Для дизамещенных бензолов R-C6H4-R используется также и другой способ построения
названий, при котором положение заместителей указывают перед тривиальным
названием соединения приставками:
орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-;
мета- (м-) заместители через один атом углерода (1,3-);
пара- (п-) заместители на противоположных сторонах кольца (1,4-).
CH3
CH3
1
6
CH3
2
3
4
1,2-диметилбензол
орто-ксилол
(о-ксилол)
5
6
1
2
6
5
4
3
CH3
1
2
3
4
CH3
1,4-диметилбензол
пара-ксилол
(n-ксилол)
5
CH3
1,3-диметилбензол
мета-ксилол
(м-ксилол)
4
5.
ИзомерияCH3
1. Изомерия боковой цепи
CH3
CH3
2. Изомерия, обусловленная наличием кольца
а) моно-, пента-, гексазамещенные - один изомер
б) ди-, три- и тетра – три изомера
CH3
CH3
CH3
CH3
CH3
CH3 H3C
CH3
CH3
CH3
CH3
CH3
H3C
CH3
рядовой
несимметричный
CH3
симметричный
5
6.
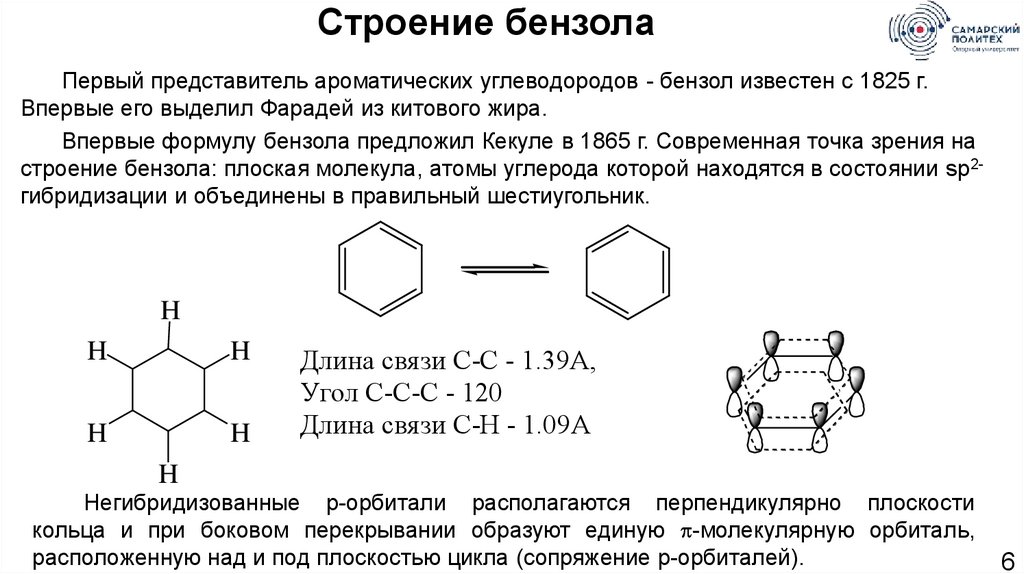
Строение бензолаПервый представитель ароматических углеводородов - бензол известен с 1825 г.
Впервые его выделил Фарадей из китового жира.
Впервые формулу бензола предложил Кекуле в 1865 г. Современная точка зрения на
строение бензола: плоская молекула, атомы углерода которой находятся в состоянии sp2гибридизации и объединены в правильный шестиугольник.
H
H
H
H
H
Длина связи С-С - 1.39А,
Угол С-С-С - 120
Длина связи С-Н - 1.09А
H
Негибридизованные р-орбитали располагаются перпендикулярно плоскости
кольца и при боковом перекрывании образуют единую -молекулярную орбиталь,
расположенную над и под плоскостью цикла (сопряжение р-орбиталей).
6
7.
Недостатки формулы Кекуле:Различная длина связей С-С и С=С. Существование двух орто-замещённых изомеров:
CH3
CH3
CH3
CH3
и
O3
O
O
H3C
+
H
3
:
H
O
O
2
H3C
+
:
CH3
O
O
1
Кекуле предполагал, что двойные связи могут «перетекать» по бензольному кольцу (осциллировать).
В настоящее время:
1.
Бензол — плоская молекула с осью
2.
симметрии 6-го порядка .
2. Молекула бензола неполярна и в магнитном
отношении симметрична.
3. Бензол термически более устойчив, чем можно
было полагать из формулы Кекуле.
8.
Критерии ароматичности1. Правило Хюккеля — плоские циклические соединения, содержащие
замкнутую систему (4n+2) π-электронов, являются ароматическими
n=0,1,2,3 и т. д.
2. Термическая стабильность
3. Планарность кольцевой системы
4. Сдвиг протонов в ЯМР в слабое поле (кольцевой ток)
8
9.
Строение бензолаЭнергия сопряжения 36,6 ккал/моль.
Все атомы С находятся в состоянии sp2-гибридизации.
Все длины связей одинаковы: С-С — 1,39 Å, С-Н — 1,09 Å.
Негибридизованные p-электроны каждого атома углерода кольца принимают
участие в образовании двух двойных связей.
Следовательно, использование формулы Кекуле носит условный характер.
Оси негибридных pz-электронов перпендикулярны плоскости σ-связей, спины
чередуются по циклу.
10.
Способы получения1. Из каменноугольной смолы: (уголь, 1000оС, без доступа воздуха, образуются:)
• а) светильный газ (300м3 на тонну угля 3-4%), содержит бензол и его
производные.
• б) надсмольная вода (NH3).
• в) каменноугольная смола 3-3,5%.
• г) кокс 75%.
Разгонка каменноугольной смолы:
• I. Лёгкое (карболовое) масло 80-170оС — бензол, толуол, ксилол.
• II. Среднее масло 170-230оС — фенол, немного крезолов
• III. Креозотовое (тяжёлое) масло 230-270оС - крезолы, нафталин.
• IV. Антраценовое (зелёное) масло - 270-340оС - нафталин, антрацен и т. д.
• V. Остаток — пек.
10
11.
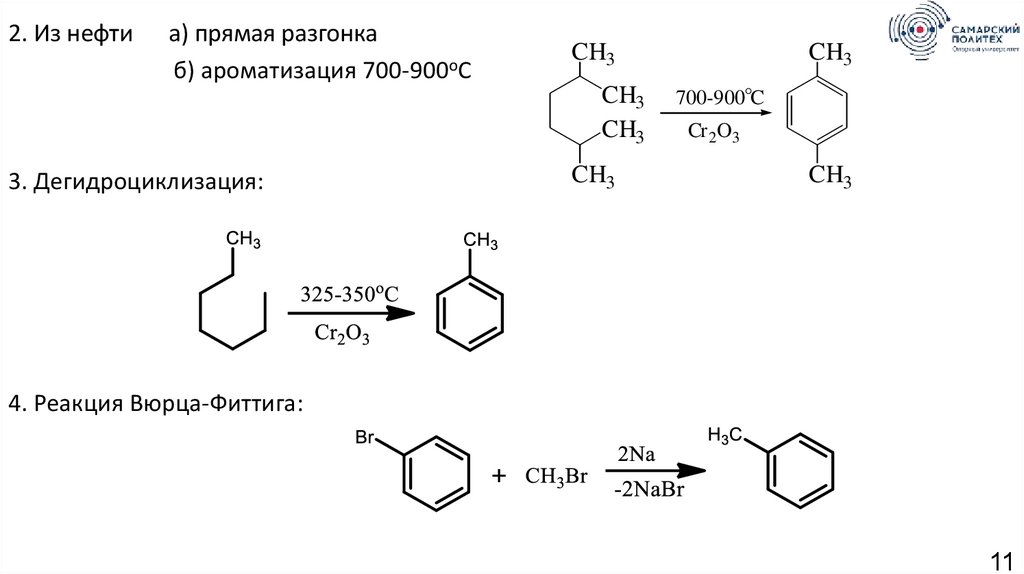
2. Из нефтиа) прямая разгонка
б) ароматизация 700-900оС
CH3
CH3
CH3
3. Дегидроциклизация:
CH3
CH3
700-900°C
Cr 2O3
CH3
4. Реакция Вюрца-Фиттига:
11
12.
Реакция Фриделя-Крафтса+ CH3Br
AlBr 3
- HBr
CH3
H3C
+ H2C
CH
R
+
R
AlCl 3-HCl или HF-BF 3
или HF, H 3PO 4, H2SO 4
CH3
AlCl 3 или BF 3,
H3C
CH3
или H 2SO 4, или H 3PO 4 P2O 5
OH
CH3
H3C
CH3
+ H2O
CH 2CH 2CH 3
+
3 Br
CH3 AlBr 3, 24 ч
- 3HBr
H3CH 2CH 2C
CH 2CH 2CH 3
13.
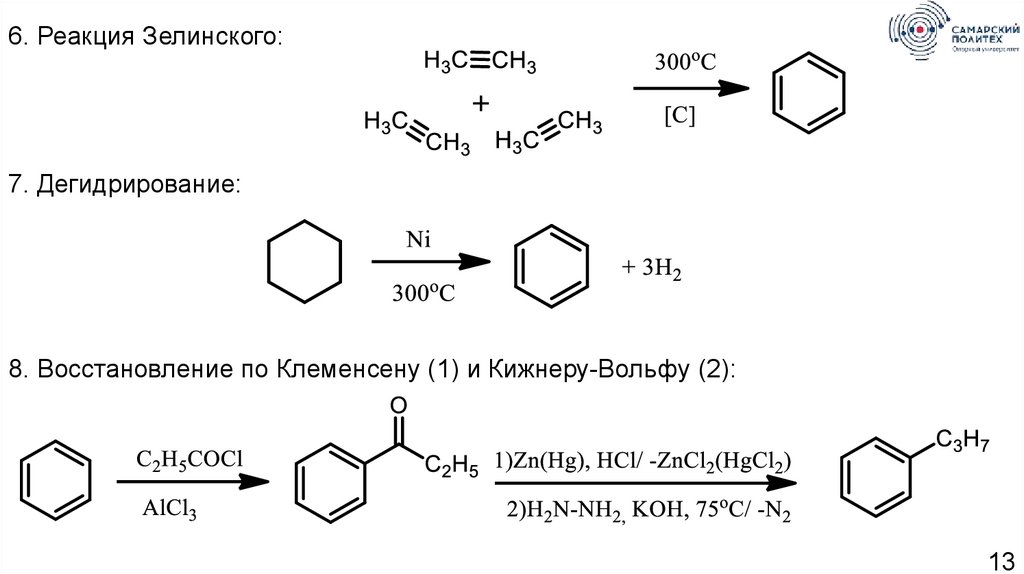
6. Реакция Зелинского:7. Дегидрирование:
8. Восстановление по Клеменсену (1) и Кижнеру-Вольфу (2):
13
14.
Физические свойстваАроматические соединения - жидкости или твердые вещества,
отличающиеся от своих алифатических и алициклических
аналогов более высокими показателями преломления и
поглощением в близкой УФ- или видимой области спектра
• tкип> tкип алканов
tкип пара > tкип орто
Ароматические соединения не растворяются в воде
d = 0,85-0,89
14
15.
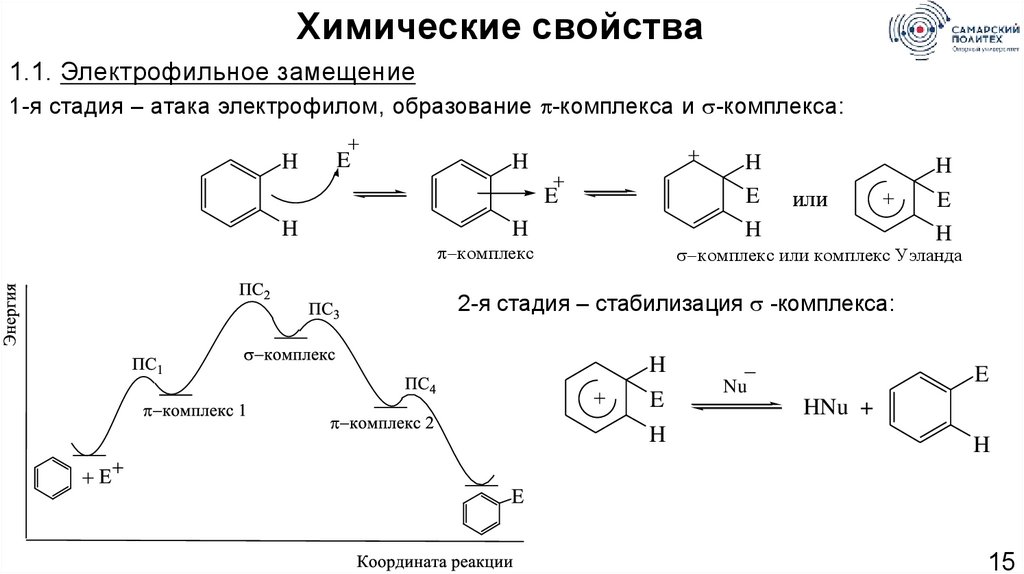
Химические свойства1.1. Электрофильное замещение
1-я стадия – атака электрофилом, образование -комплекса и -комплекса:
H
E
H
H
E
H
E
H
H
или
H
комплекс
E
H
комплекс или комплекс Уэланда
2-я стадия – стабилизация -комплекса:
H
E
H
E
Nu
HNu +
H
15
16.
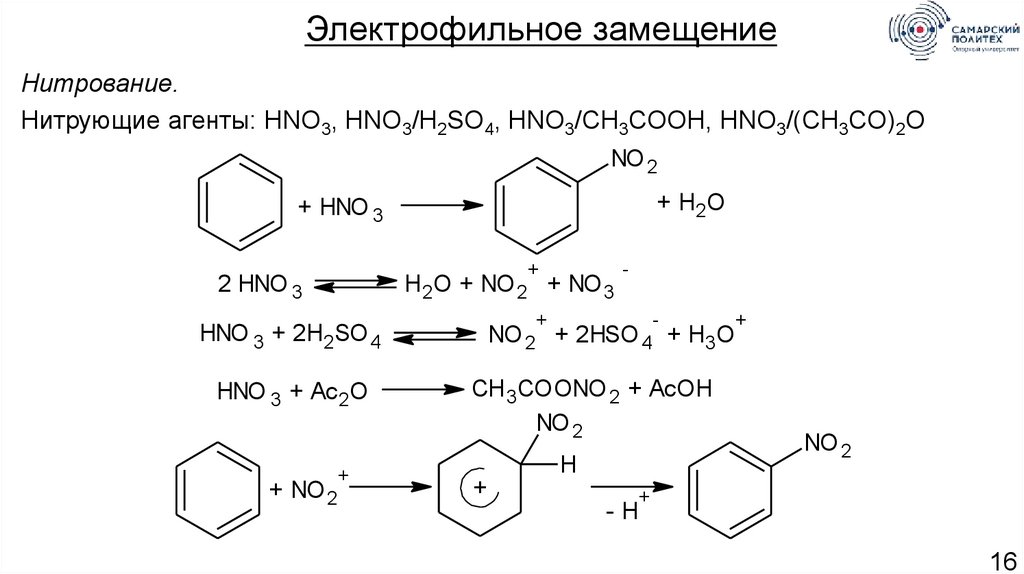
Электрофильное замещениеНитрование.
Нитрующие агенты: HNO3, HNO3/H2SO4, HNO3/CH3COOH, HNO3/(CH3CO)2O
NO 2
+ H2O
+ HNO 3
+
2 HNO 3
H2O + NO 2 + NO 3
+
HNO 3 + 2H2SO 4
HNO 3 + Ac2O
+ NO 2
+
-
NO 2 + 2HSO 4 + H3O
CH 3COONO 2 + AcOH
NO 2
H
+
+
NO 2
+
-H
16
17.
Электрофильное замещениеГалогенирование:
FeCl 3 + Cl 2
+
Cl [FeCl 4]
-
Cl
+ Cl
H
+
медленно
+
FeCl 4
-
быстро
Cl
+ HCl + FeCl 3
18.
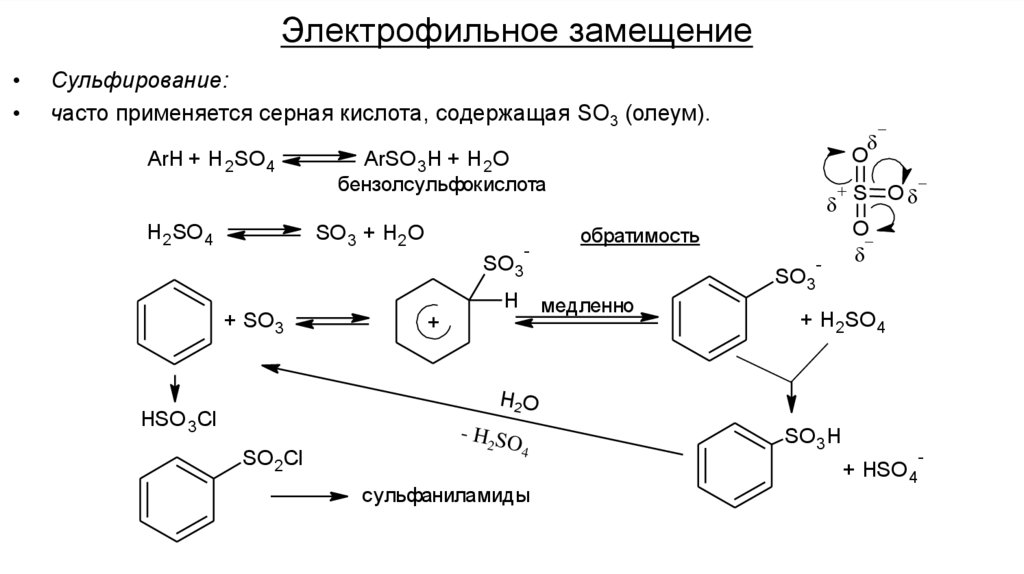
Электрофильное замещениеСульфирование:
часто применяется серная кислота, содержащая SO3 (олеум).
ArH + H 2SO 4
H2SO 4
ArSO 3H + H 2O
бензолсульфокислота
SO 3 + H2O
SO 3
+ SO3
O
+
-
обратимость
H медленно
SO 3
-
S O
O
+ H2SO 4
H2O
HSO 3Cl
SO 2Cl
- H SO
2
4
сульфаниламиды
SO 3H
+ HSO 4
-
19.
Алкилирование по Фриделю – КрафтсуАктивность кислот Льюиса: AlBr3>AlCl3>FeCl3>TiCl4>BF3>SnCl4>ZnCl2
Активность R-Hal: RI > RBr > RCl > RF
PhCH2X > CH2=CH-CH2X > R3CX > R2CHX > RCH2X > CH3X
19
20.
Алкилирование по Фриделю – Крафтсу• Полиалкилирование и изомеризация алкильного радикала
• R+ - изомерия алкильного остатка:
CH3
H3C
Cl
+
AlCl 3
CH3
H3C
CH3
H3C
Ph
+ Ph
CH3
CH3
+
H2C
O
O
+
+
ZnCl 2
+
Ph
• Хлорметилирование
H2C
CH3
CH3 Ph
CH 2Cl
ZnCl 2
HCl
+
H2C
O
ZnCl 2
-
CH3
21.
Ацилированиие по Фриделю-Крафтсу:O
+ RCOCl
R + HCl
AlCl 3
RCOCl + AlCl 3
+
R C
O
[AlCl 4]
AlCl
O
3
R C
Cl
O
+R
+
C
COR
H
O
+
-
[AlCl 4]
- AlCl 3
R
+ HCl
21
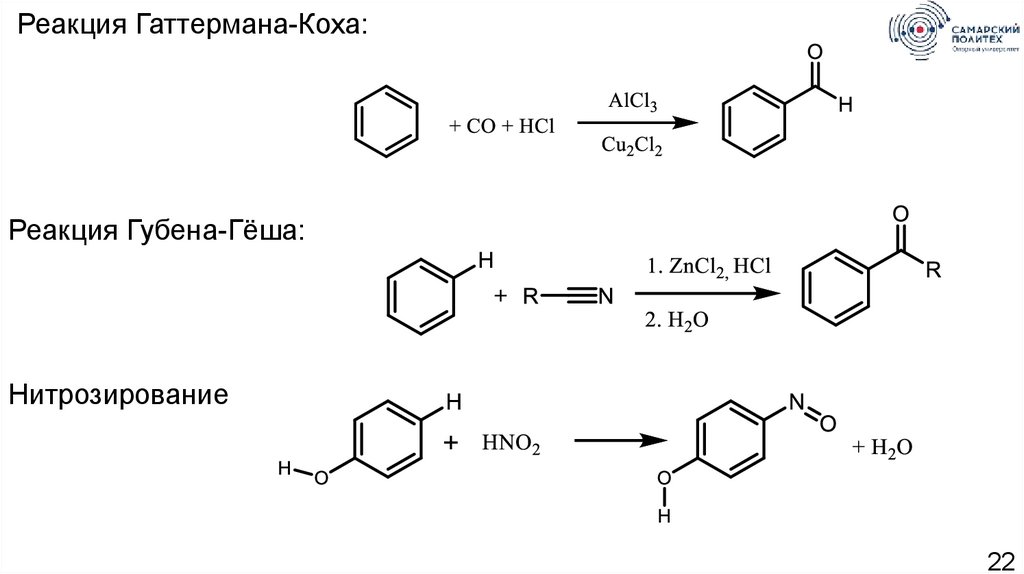
22.
Реакция Гаттермана-Коха:Реакция Губена-Гёша:
Нитрозирование
22
23.
1.2. Нуклеофильное замещение - не характерно:Nu
+ Nu
Nu
H
-
+H
-
-
1.3. Радикальное замещение - не характерно, нет селективности:
R
R
+
R
+
R
H
H
H
диспропорционирование
H
H
H
H
R
R
H
присоединение
23
24.
ОриентацияВ бензоле все атомы С одинаковы.
Но если уже есть заместитель,
то возможны варианты:
Определяется энергией образования
σ-комплекса. Зависит от заместителя.
Электронодонорные заместители
увеличивают электронную плотность в
бензольном кольце и облегчают атаку
электрофилом, замещение происходит
в о- и п-положения.
Реакции проходят быстрее, чем в
случае незамещенного бензола.
24
25.
По селективности ориентации:O
+
CH3
метаBr
C6H6
H
Активация орто- и пара- положения:
орто-, пара-
Hal
По скорости реакции: Cl, Br, I, F
ориентируют в орто- и пара-положения,
но уменьшают скорость реакции
(дезактивируют), так как: –I > +M.
метаорто-, параC6H6
25
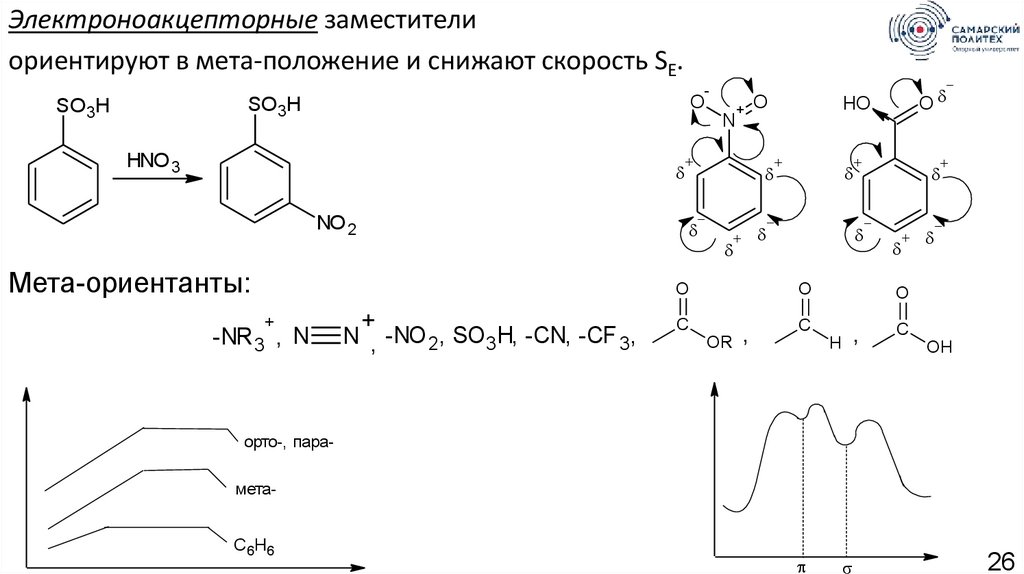
26.
Электроноакцепторные заместителиориентируют в мета-положение и снижают скорость SE.
O
SO 3H
SO 3H
+
O
HO
N
HNO 3
NO 2
Мета-ориентанты:
O
+
-NR 3 , N
+
N , -NO 2, SO3H, -CN, -CF 3,
O
C
OR
,
O
O
C
,
H
C
OH
орто-, параметаC 6H6
26
27.
Влияние заместителей в бензольном ядрена электрофильное замещение
Орто-, пара - ориентанты
Активируют ароматическое кольцо
-OH, -OR
Мета-ориентанты
Дезактивируют ароматическое
кольцо
-NH2, -NHR, -NR2
-CN
-NHCOR
-COOH
Алкил
-COOR
Арил
-CHO
-NO2
Дезактивируют
-+NR3
F, Cl, Br, I
-SO3H, -SO2OR
27
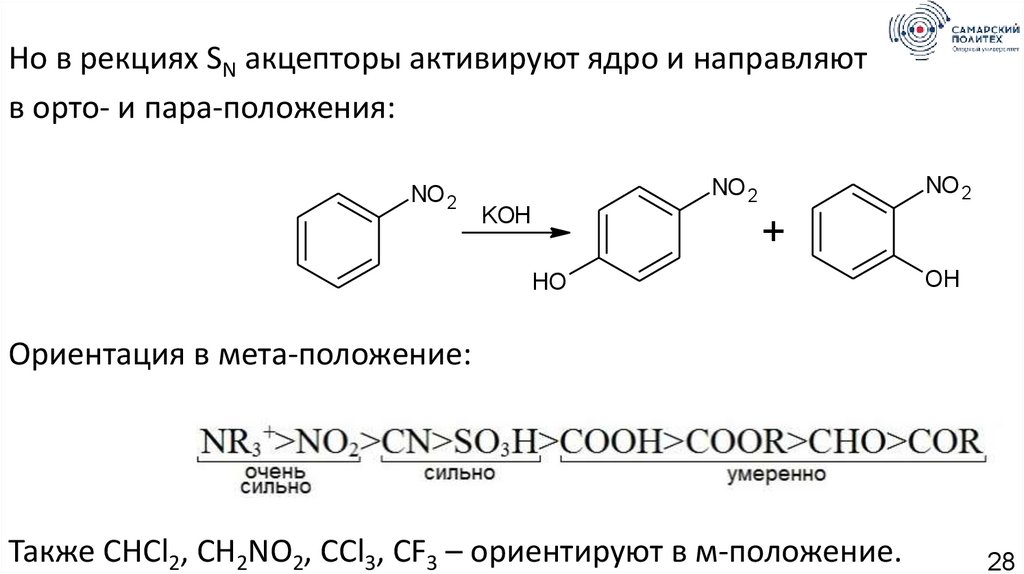
28.
Но в рекциях SN акцепторы активируют ядро и направляютв орто- и пара-положения:
NO 2
NO 2
NO 2
KOH
+
HO
OH
Ориентация в мета-положение:
Также CHCl2, CH2NO2, CCl3, CF3 – ориентируют в м-положение.
28
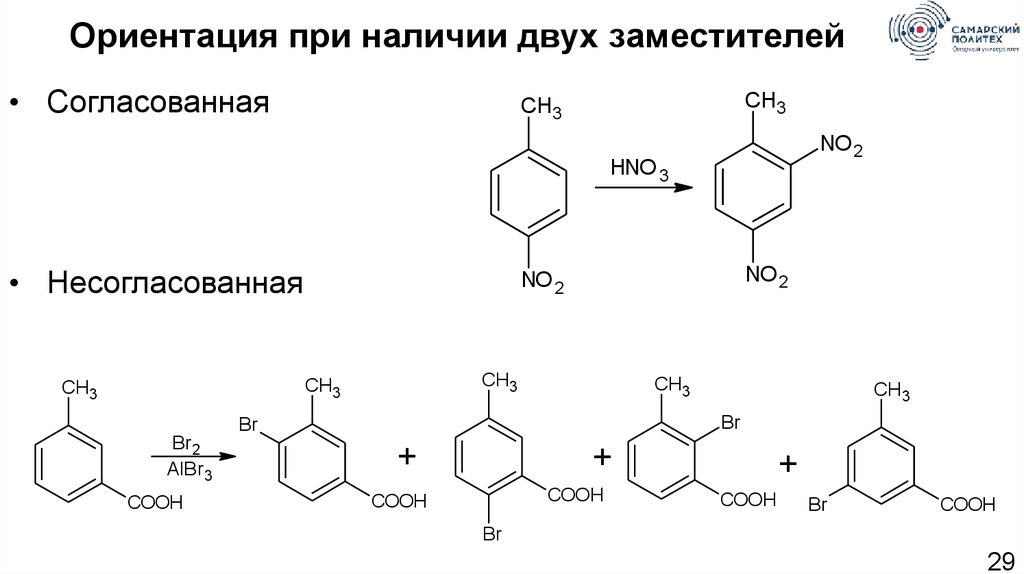
29.
Ориентация при наличии двух заместителей• Согласованная
CH3
CH3
NO 2
HNO 3
• Несогласованная
CH3
CH3
CH3
NO 2
NO 2
CH3
Br
Br
Br2
AlBr3
COOH
CH3
+
+
COOH
COOH
+
COOH
Br
COOH
Br
29
30.
Радикальное замещение• Галогенирование
Cl 2, hv
- HCl
Cl 2, hv
- HCl
CCl 3
CHCl 2
CH 2Cl
CH3
Cl 2, hv
- HCl
O
H5C6 OH
H5C6 COOH
H5C6
• Нитрование
H
CH3
CH3 HNO 3 разб.
o
100 C
NO 2
+ H2O
30
31.
Реакции окисления1. Бензольное кольцо в обычных условиях с трудом окисляется
в присутствии пятиокиси ванадия V2O5:
2
+ 9 O2
V2O5
HC COOH
2 CO2 + 2 H2O + 2
HC COOH
малеиновая кислота
O
3 [O]
- H 2O
O
6 [O]
- CO 2
O
O + H2O
O
31
32.
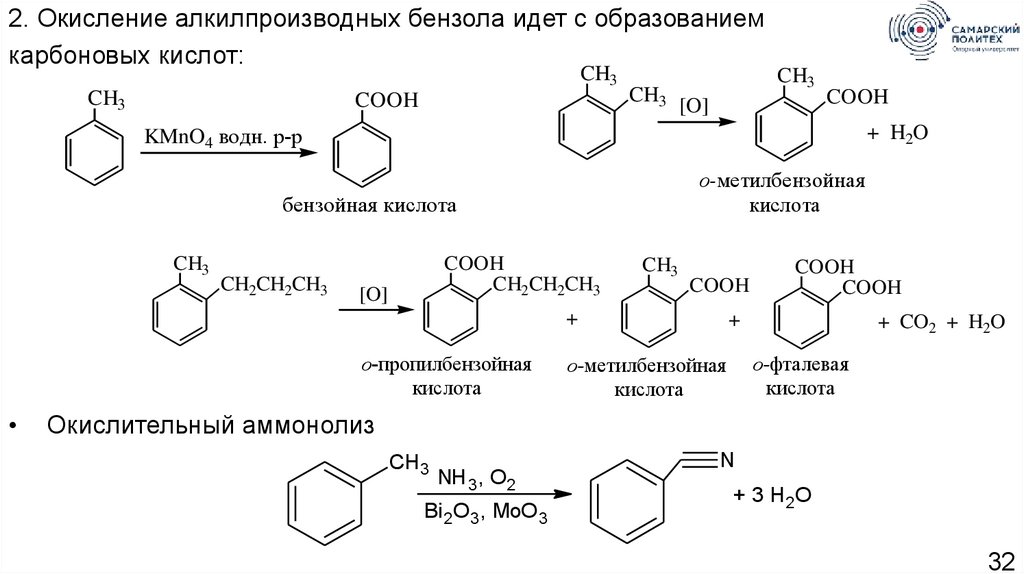
2. Окисление алкилпроизводных бензола идет с образованиемкарбоновых кислот:
CH3
CH3
COOH
CH3
CH3
[O]
COOH
KMnO4 водн. р-р
+ H2O
о-метилбензойная
кислота
бензойная кислота
CH3
CH2CH2CH3
COOH
CH2CH2CH3
[O]
CH3
COOH
+
о-пропилбензойная
кислота
COOH
COOH
+
+ CO2 + H2O
о-фталевая
кислота
о-метилбензойная
кислота
Окислительный аммонолиз
CH3
NH 3, O2
Bi 2O3, MoO 3
N
+ 3 H 2O
32
33.
Присоединение• Восстановление
3 H2
o
Ni, 200 C
Na
NH3
1,4-дигидробензол
Cl
• Присоединение хлора:
Cl
Cl
Cl
Cl
3 Cl 2
hv
Cl
гексахлоран
33





















 Химия
Химия