Похожие презентации:
Ароматические углеводороды (арены)
1.
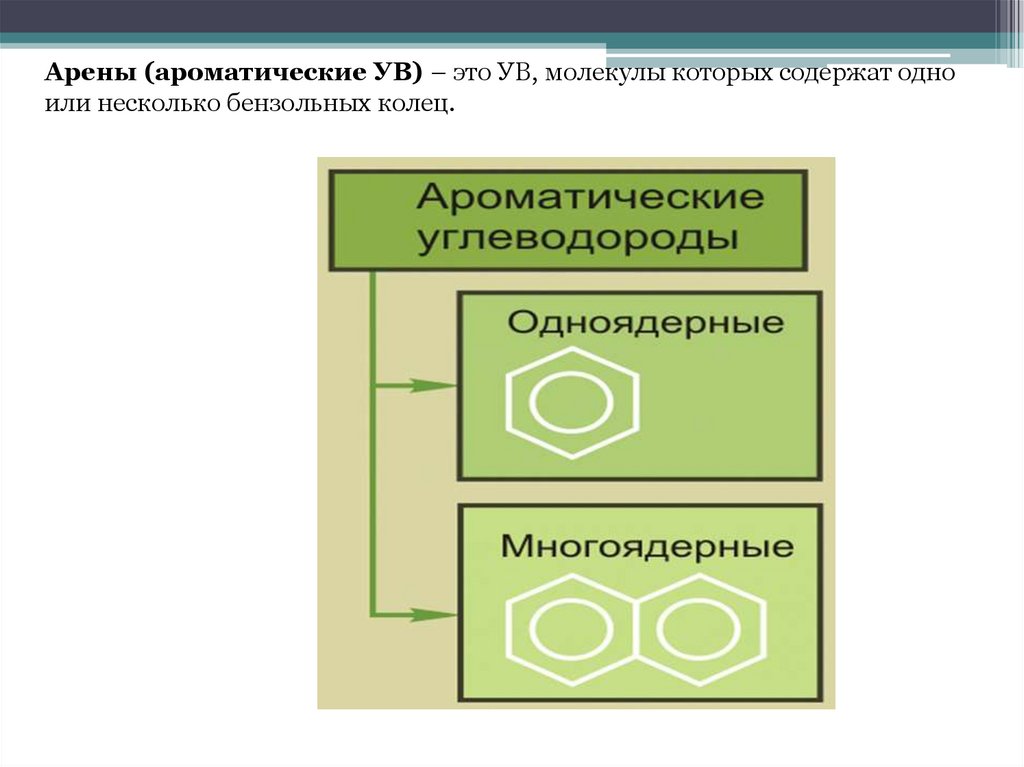
ЛЕКЦИЯ АРЕНЫ (ароматические УВ)Арены – это УВ, молекулы которых содержат одно или несколько
бензольных колец.
Ароматические углеводороды (арены) составляют лишь небольшую часть
нефти.
Все ароматические углеводороды, присутствующие в нефти, можно
разделить на следующие группы:
бензол и его гомологи;
дифенил и фенилированные бензолы;
дифенилметан и его гомологи;
конденсированные ароматические системы.
Общее содержание моноциклических ароматических углеводородов в
нефтяных фракциях до 200°С находится в пределах 5-25% (масс.).
Содержание аренов увеличивается при переходе от низших фракций к
высшим и достигает максимальных значений в тяжелых фракциях нефтей.
2.
Арены (ароматические УВ) – это УВ, молекулы которых содержат одноили несколько бензольных колец.
3.
4.
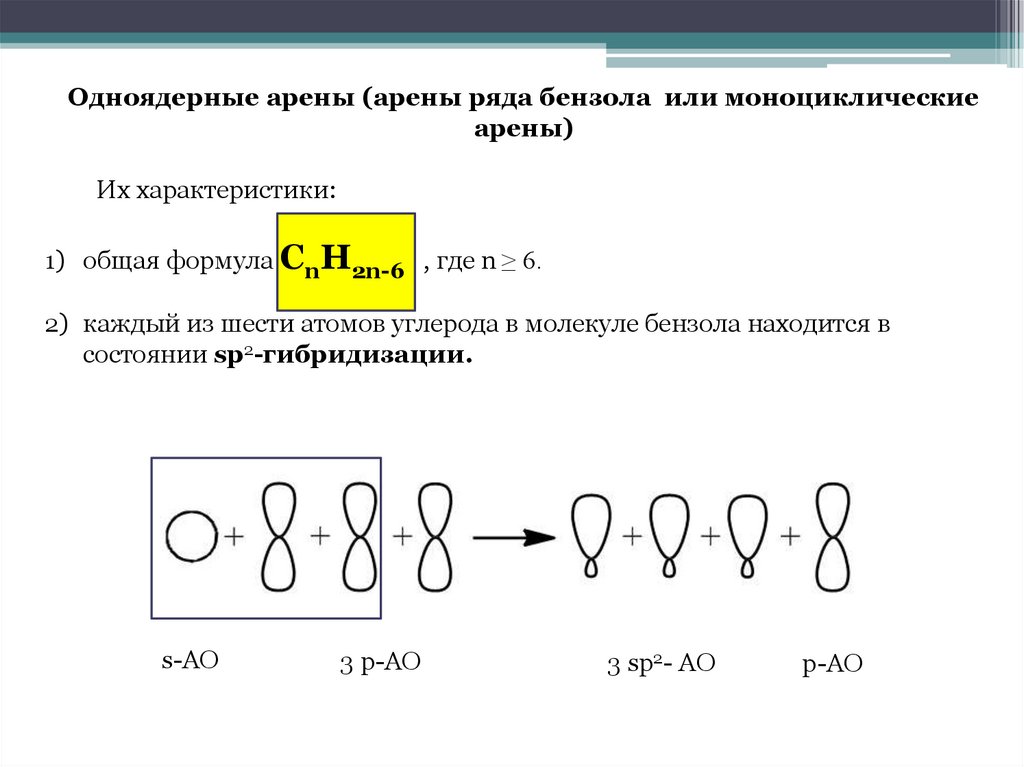
Одноядерные арены (арены ряда бензола или моноциклическиеарены)
Их характеристики:
1) общая формула СnH2n-6 , где n ≥ 6.
2) каждый из шести атомов углерода в молекуле бензола находится в
состоянии sp2-гибридизации.
s-АО
3 p-АО
3 sp2- АО
p-АО
5.
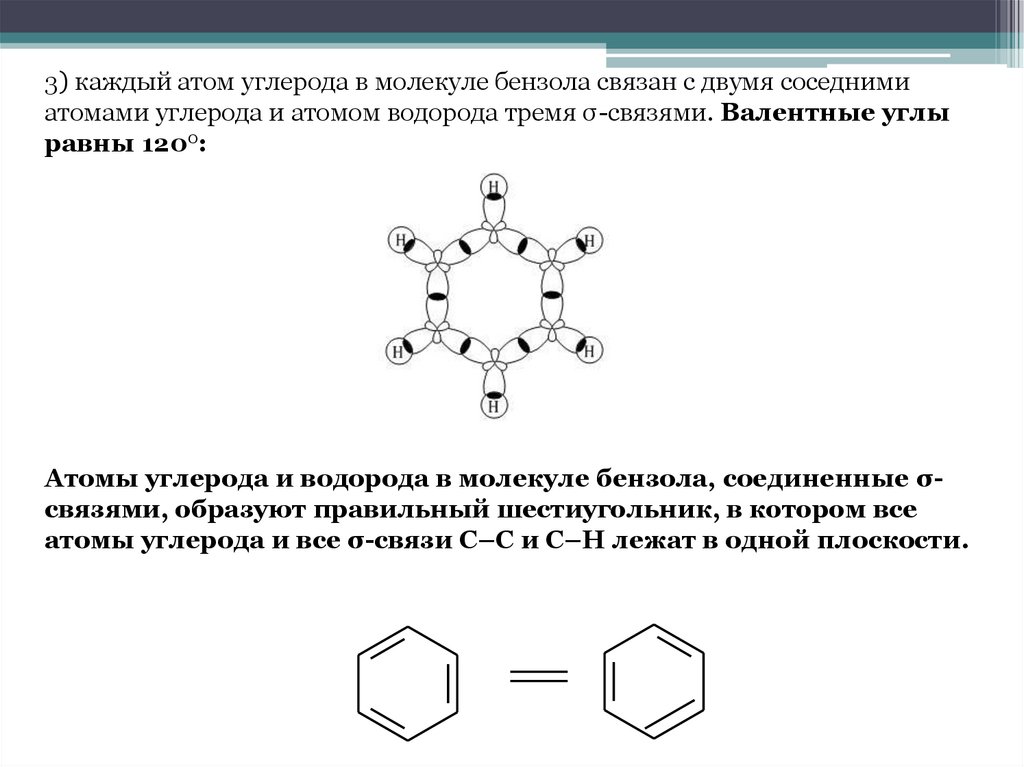
3) каждый атом углерода в молекуле бензола связан с двумя соседнимиатомами углерода и атомом водорода тремя σ-связями. Валентные углы
равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σсвязями, образуют правильный шестиугольник, в котором все
атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
6.
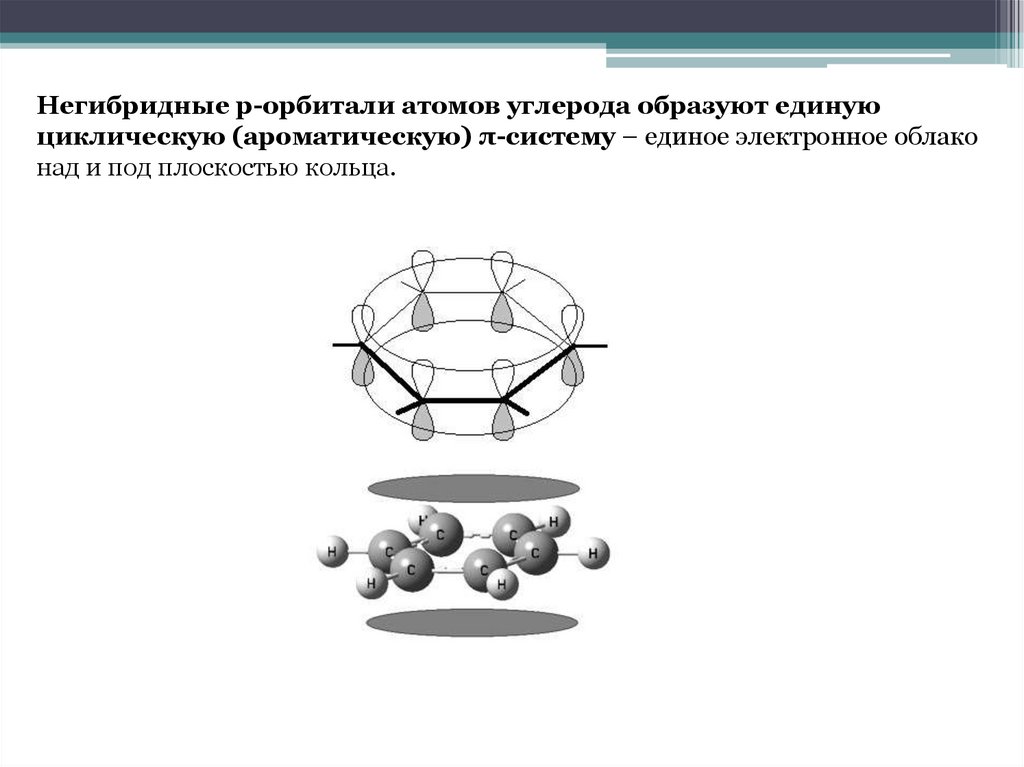
Негибридные р-орбитали атомов углерода образуют единуюциклическую (ароматическую) π-систему – единое электронное облако
над и под плоскостью кольца.
7.
Соответственно, на самом деле все связи между атомами углерода вмолекуле бензола одинаковой длины (0,140 нм), что соответствует
промежуточному значению между одинарной и двойной (полуторная
связь).
Соответственно, в молекуле бензола между углеродными атомами нет
обычных одинарных и двойных связей, а все они выравнены
(делокализованы).
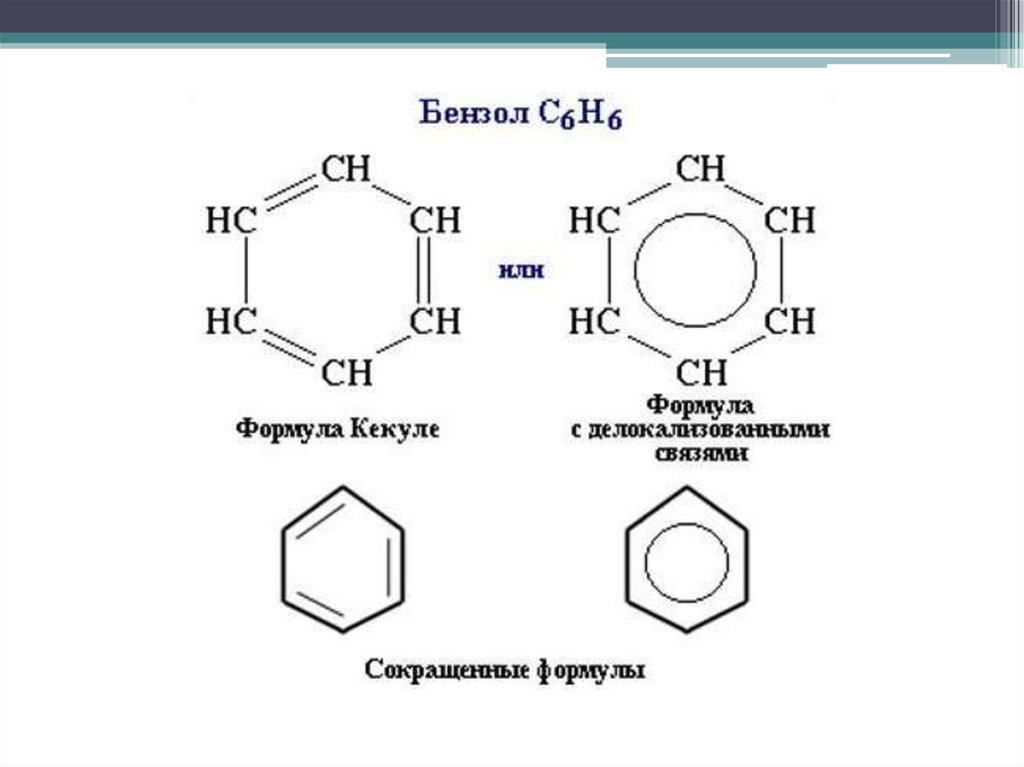
HПоэтому структурную формулу бензола изображают в виде
правильного шестиугольника и кружка внутри него, который
обозначает делокализованные π-связи:
H
C
C
C
C
H шести σ-связей с единой π-системой называется ароматической
Сочетание
Hсвязью. Цикл из шести атомов углерода, связанных ароматической связью,
называется бензольным кольцом, или бензольным ядром.
8.
29.
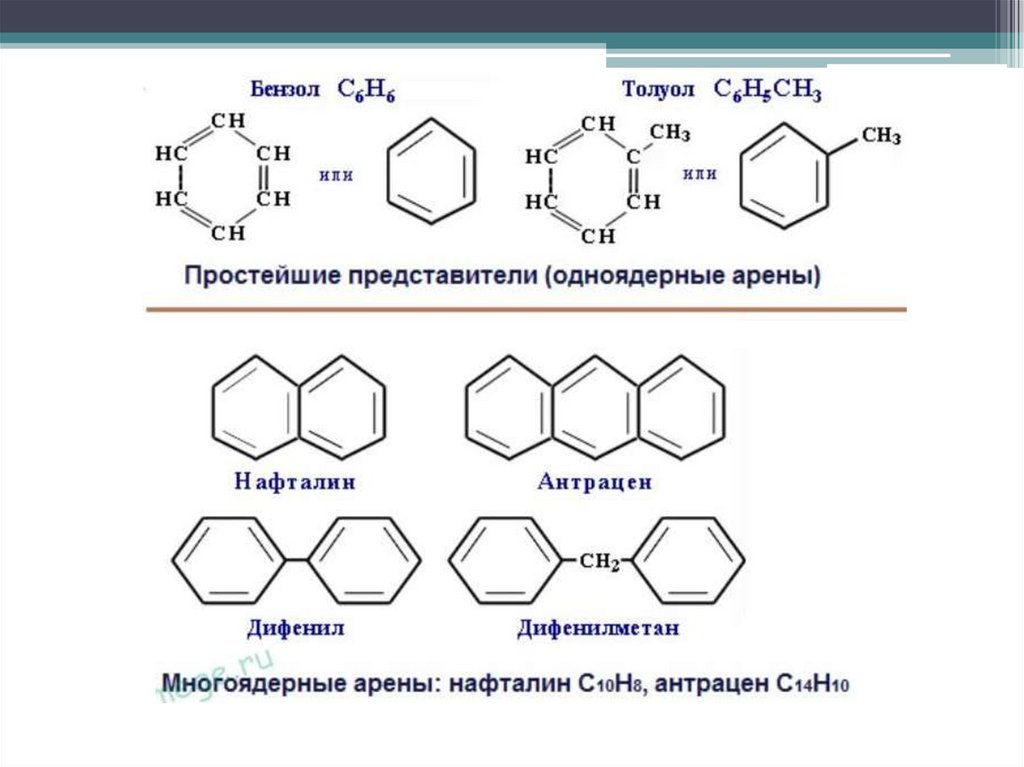
Гомологический ряд ареновH
C
Простейший представитель гомологического ряда аренов —
бензол:
H
C
C
C
C
H
C
H
Ближайший гомолог бензола – толуол (метилбензол):
10.
При составлении названия ароматического соединения за главную цепьпринимают молекулу бензола. Если в ароматическом кольце несколько
заместителей, то атомы углерода бензольного кольца нумеруются: в
направлении, где больше заместителей, от самого главного заместителя (чем
больше атомов углерода в радикале, тем он старше).
1,2-диметилбензол
11.
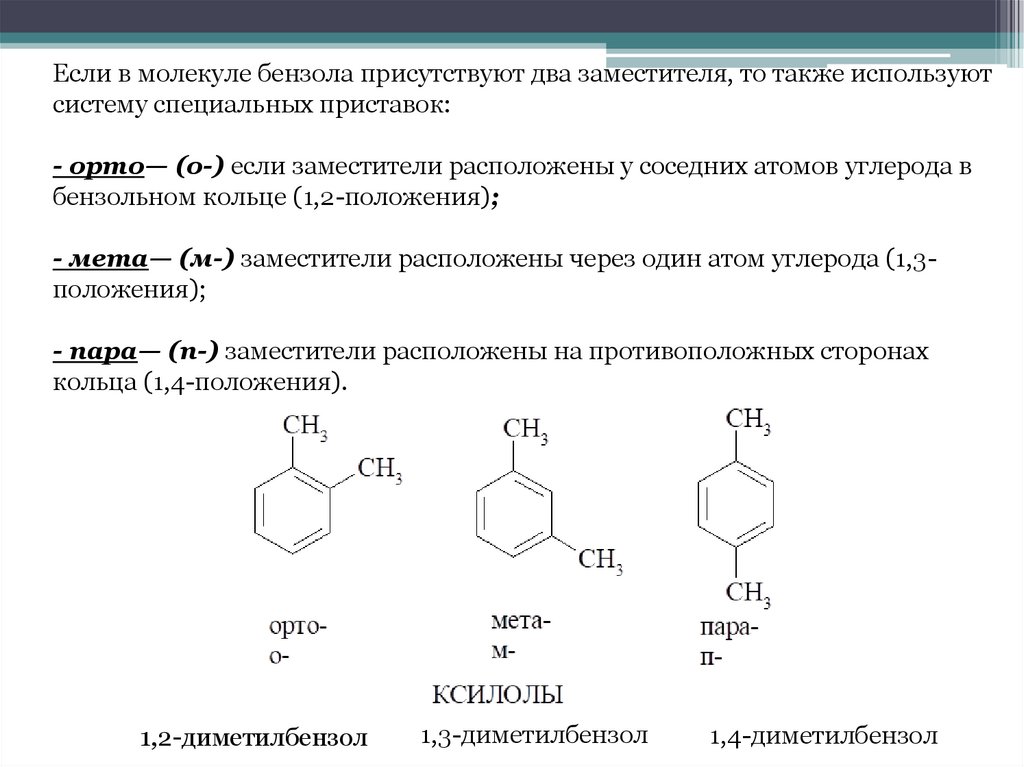
Если в молекуле бензола присутствуют два заместителя, то также используютсистему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в
бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3положения);
- пара— (п-) заместители расположены на противоположных сторонах
кольца (1,4-положения).
1,2-диметилбензол
1,3-диметилбензол
1,4-диметилбензол
12.
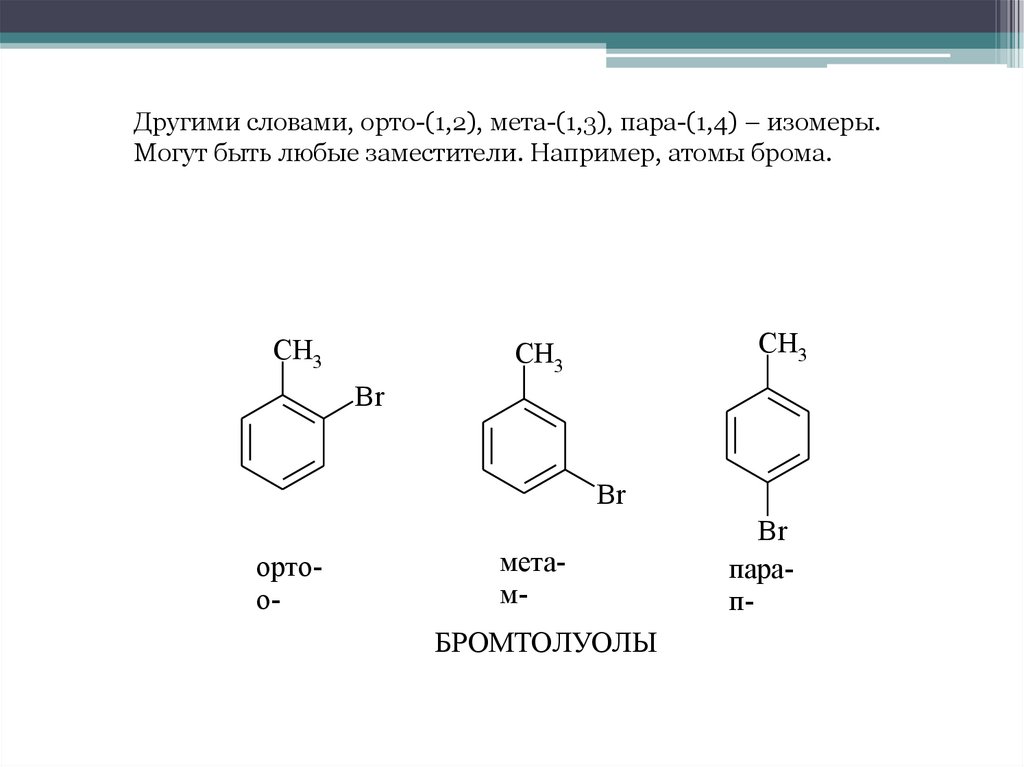
Другими словами, орто-(1,2), мета-(1,3), пара-(1,4) – изомеры.Могут быть любые заместители. Например, атомы брома.
CH3
CH3
CH3
Br
Br
ортоо-
метамБРОМТОЛУОЛЫ
Br
парап-
13.
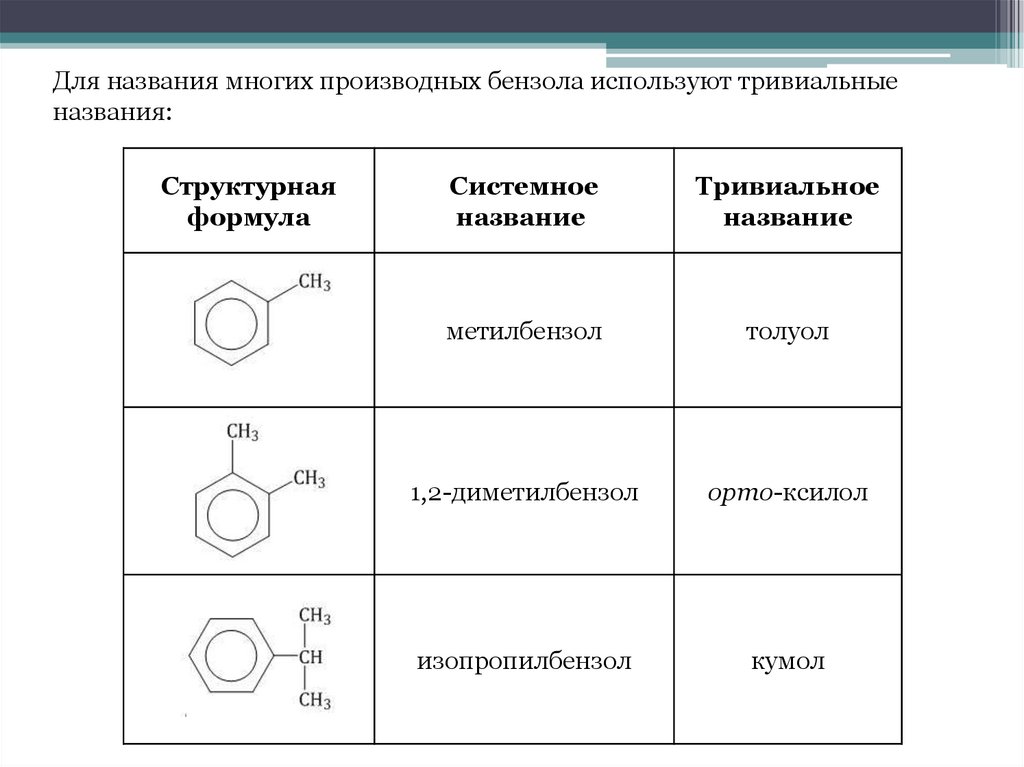
Для названия многих производных бензола используют тривиальныеназвания:
Структурная
формула
Системное
название
Тривиальное
название
метилбензол
толуол
1,2-диметилбензол
орто-ксилол
изопропилбензол
кумол
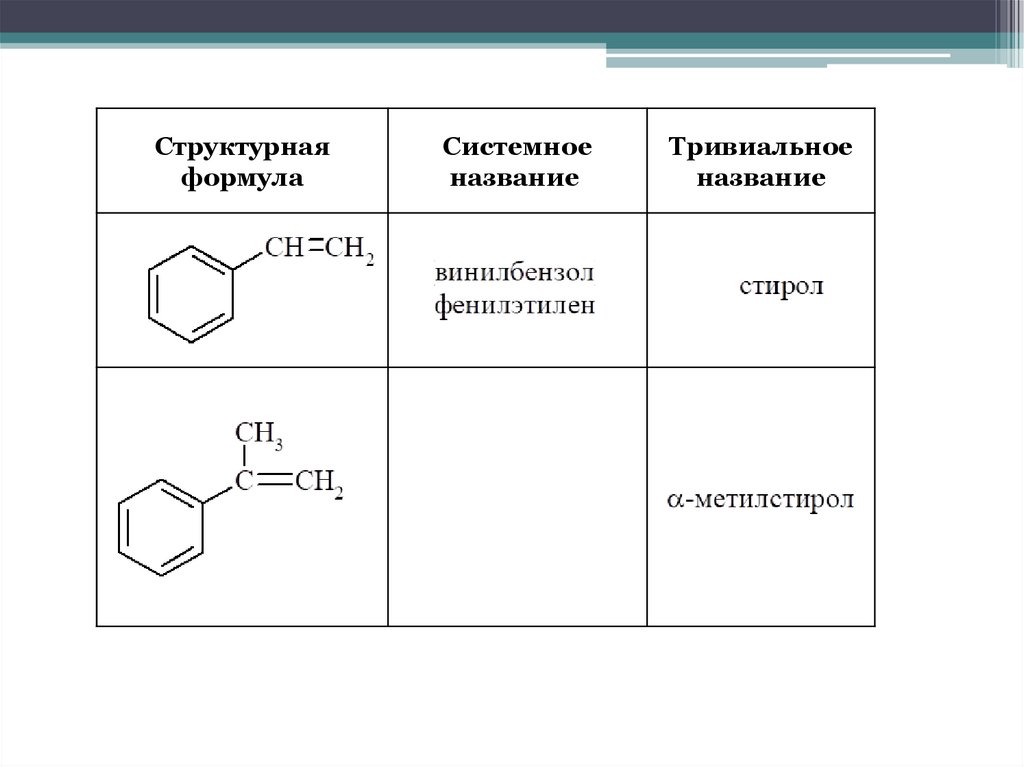
14.
Структурнаяформула
Системное
название
Тривиальное
название
15.
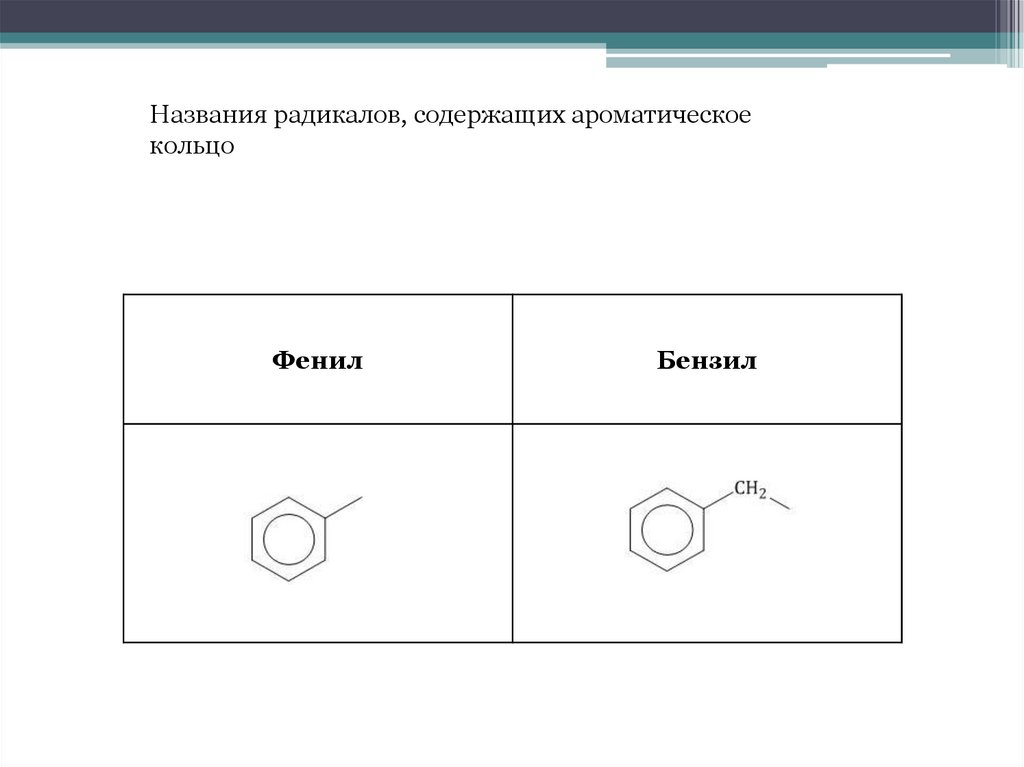
Названия радикалов, содержащих ароматическоекольцо
Фенил
Бензил
16.
Изомерия ареновСтруктурная изомерия
Структурные изомеры — это соединения с одинаковым составом,
которые отличаются порядком связывания атомов в молекуле, т.е.
строением молекул.
Изомерия углеродного скелета в боковой цепи характерна для
ароматических углеводородов, которые содержат три и более атомов
углерода в боковой цепи.
Формуле С9Н12 соответствуют
изопропилбензол
пропилбензол
17.
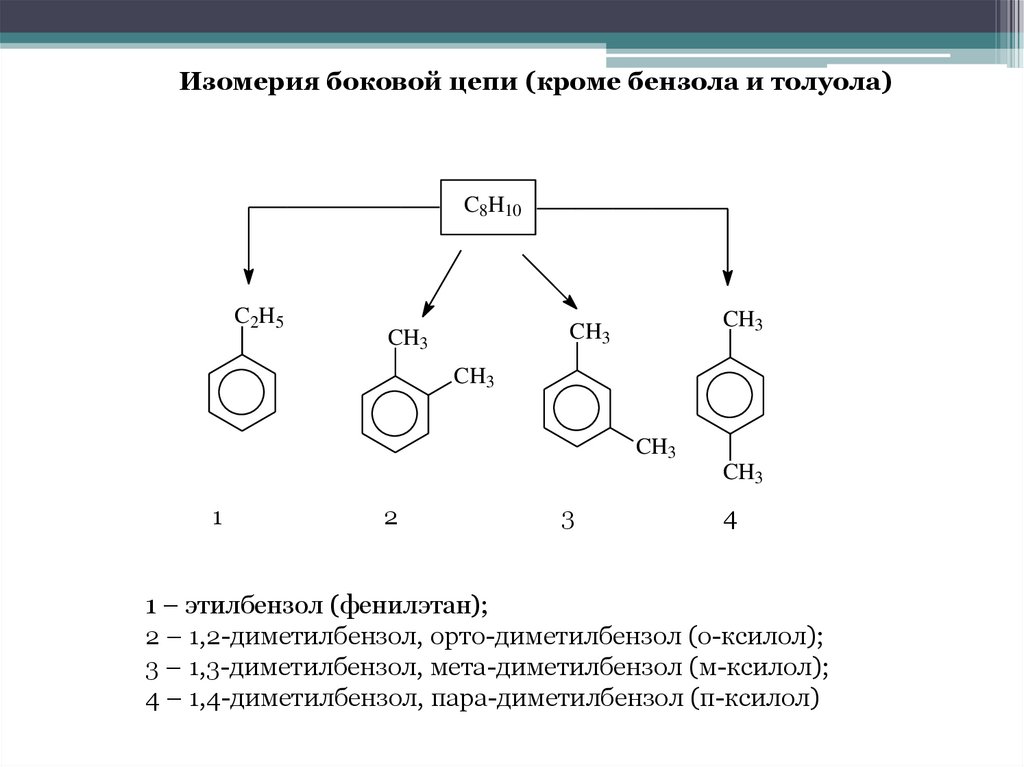
Изомерия боковой цепи (кроме бензола и толуола)C8H10
C2H5
CH3
CH3
CH3
CH3
CH3
CH3
1
2
3
4
1 – этилбензол (фенилэтан);
2 – 1,2-диметилбензол, орто-диметилбензол (о-ксилол);
3 – 1,3-диметилбензол, мета-диметилбензол (м-ксилол);
4 – 1,4-диметилбензол, пара-диметилбензол (п-ксилол)
18.
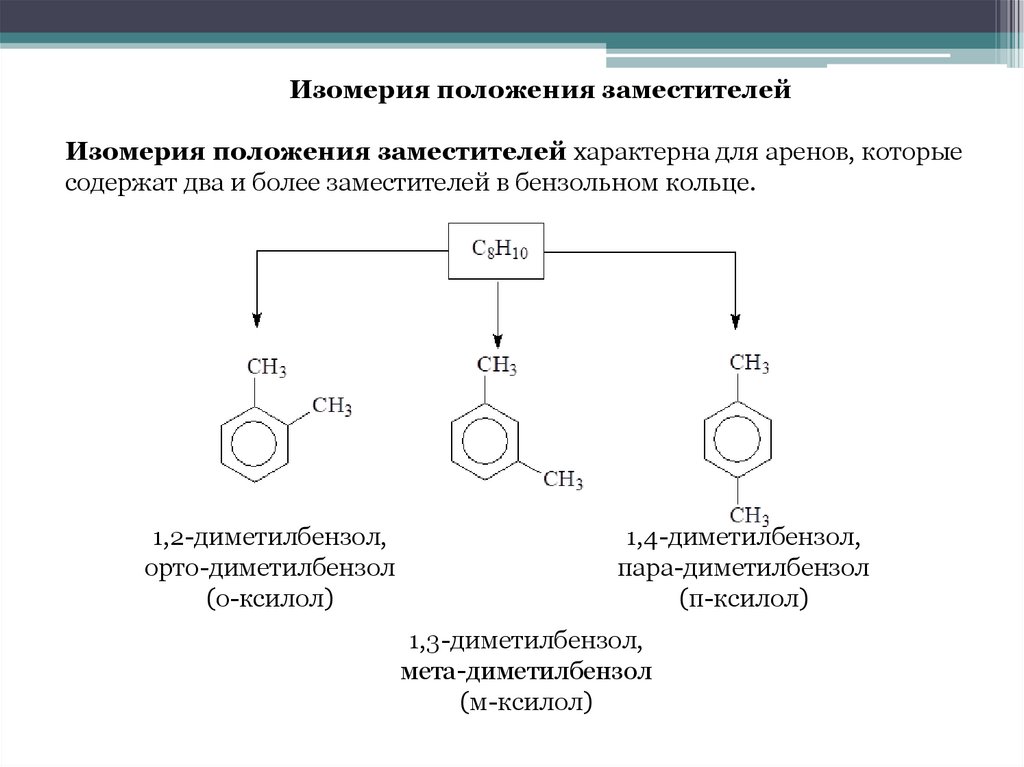
Изомерия положения заместителейИзомерия положения заместителей характерна для аренов, которые
содержат два и более заместителей в бензольном кольце.
1,2-диметилбензол,
орто-диметилбензол
(о-ксилол)
1,4-диметилбензол,
пара-диметилбензол
(п-ксилол)
1,3-диметилбензол,
мета-диметилбензол
(м-ксилол)
19.
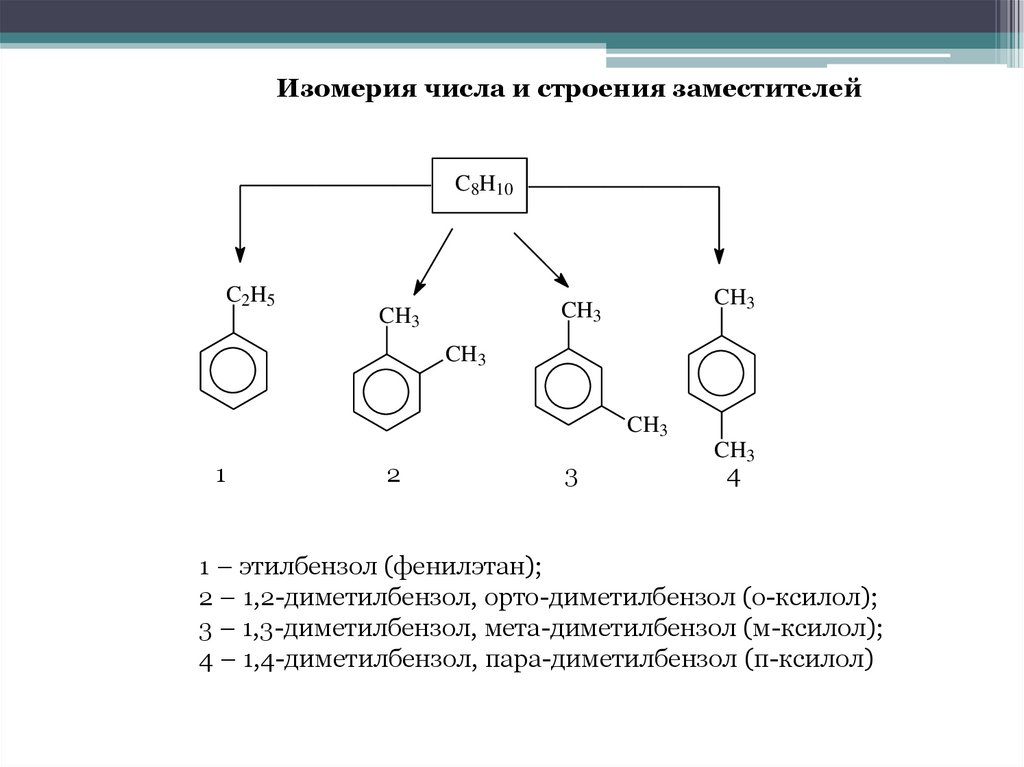
Изомерия числа и строения заместителейC8H10
C2H5
CH3
CH3
CH3
CH3
CH3
1
2
3
CH3
4
1 – этилбензол (фенилэтан);
2 – 1,2-диметилбензол, орто-диметилбензол (о-ксилол);
3 – 1,3-диметилбензол, мета-диметилбензол (м-ксилол);
4 – 1,4-диметилбензол, пара-диметилбензол (п-ксилол)
20.
Физические свойства. Бензол и толуол при обычных условияхбесцветные жидкости. Высшие гомологи – твердые вещества. Имеют
характерный запах; не смешиваются с водой, хорошие растворители,
токсичны. Толуол менее токсичен, чем бензол.
Направляющее (ориентирующее) действие заместителей в
бензольном кольце: Электронная плотность в кольце бензола
распределена равномерно, заместитель нарушает эту равномерность.
Под влиянием заместителей (заместителем считается любой атом
(кроме водорода) или группа атомов, связанные с атомом углерода)
происходит смещение электронной плотности в молекуле, ионе или
радикале, т.е. возникают электронные эффекты заместителей.
Виды электронных эффектов заместителей
1. Индуктивный (I) эффект.
2. Мезомерный (M) эффект.
21.
Индуктивный эффект (I-эффект)Известно, что полярная ковалентная связь образуется между
атомами с различной электроотрицательностью.
Наличие в молекуле полярной σ-связи вызывает
поляризацию ближайших двух–трех σ-связей и ведет к
возникновению частичных зарядов δ+ (дельта плюс) или δ–
(дельта минус) на соседних атомах.
Направление смещения электронной плотности всех σ-связей
обозначается прямыми стрелками (по линии связи) и
символами частичных зарядов, индуцируемых заместителем.
22.
Индуктивный эффект — смещение электроннойплотности по цепи σ-связей, которое обусловлено
различиями в электроотрицательностях атомов.
Виды индуктивных эффектов
1. Индуктивный эффект называется положительным
(+I), если заместитель увеличивает электронную плотность
на атоме углерода, индуцируя на нем частичный
отрицательный заряд δ-, сам при этом приобретая заряд δ+.
2. Индуктивный эффект называется отрицательным
(-I), если заместитель уменьшает электронную плотность на
атоме углерода, с которым связан этот заместитель.
При этом заместитель приобретает частичный
отрицательный заряд (δ-), а атом углерода – частичный
положительный заряд (δ+).
23.
Мезомерный эффект (М-эффект)Мезомерный эффект - смещение электронной плотности по
цепи делокализованных (сопряженных) π-связей.
Виды мезомерных эффектов
1. +М-эффектом обладают заместители, повышающие
электронную плотность в сопряженной системе.
К ним относятся группы, которые содержат атомы с
неподеленной парой электронов, способные к передаче этой
пары электронов в общую систему сопряжения.
2. –М-эффект проявляют заместители с
электроотрицательными атомами и смещающие электронную
плотность на себя.
24.
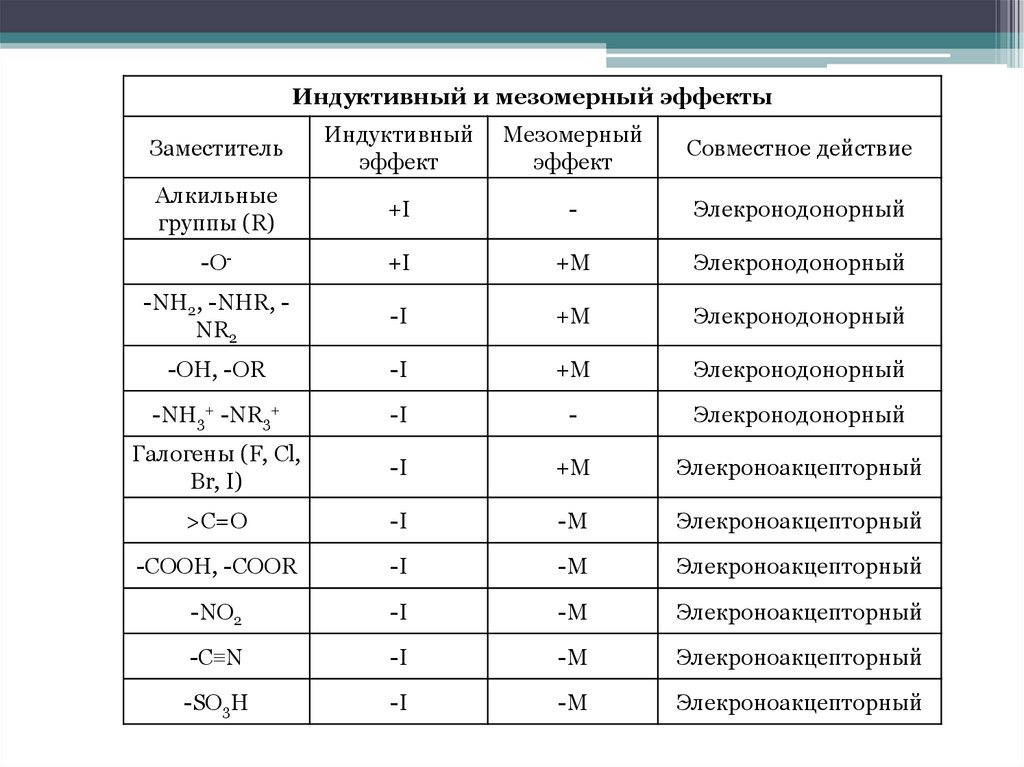
Индуктивный и мезомерный эффектыЗаместитель
Индуктивный
эффект
Мезомерный
эффект
Совместное действие
Алкильные
группы (R)
+I
-
Элекронодонорный
-O-
+I
+M
Элекронодонорный
-NH2, -NHR, NR2
-I
+M
Элекронодонорный
-OH, -OR
-I
+M
Элекронодонорный
-NH3+ -NR3+
-I
-
Элекронодонорный
Галогены (F, Cl,
Br, I)
-I
+M
Элекроноакцепторный
>C=O
-I
-M
Элекроноакцепторный
-COOH, -COOR
-I
-M
Элекроноакцепторный
-NO2
-I
-M
Элекроноакцепторный
-C≡N
-I
-M
Элекроноакцепторный
-SO3H
-I
-M
Элекроноакцепторный
25.
Первый заместитель вводится в молекулу в любое положение,так как все положения в молекуле бензола равноценны.
Второй и третий заместители вводятся в определенные
положения, согласно правилам ориентации.
Если в бензольном кольце имеются заместители, не только
алкильные, но и содержащие другие атомы (гидроксил,
аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов
водорода в ароматической системе протекают строго
определенным образом, в соответствии с характером влияния
заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их
влияния на электронную плотность ароматической системы:
- электронодонорные заместители (первого рода),
- электроноакцепторные заместители (второго рода).
26.
Виды заместителей- заместители I рода (электронодоноры – Д) подают электроны на
бензольное кольцо и увеличивают электронную плотность в орто – и параположениях. Направляют второй заместитель (Е) в орто – и пара-положения
бензольного кольца. Облегчают реакции замещения атомов водорода,
связанных с бензольным ядром.
D
= – Hal < – СН3 < -CH2R < – CR3 < – OR < -OH< – NH2 < – NHR < -NR2.
Гомологи бензола содержат алкильные заместители, которые
обладают электронодонорным эффектом: из-за того, что
электроотрицательность водорода меньше, чем углерода, электронная
плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее
передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в
бензольном кольце. При этом гомологи бензола вступают в
реакции замещения преимущественно в орто— и параположения
27.
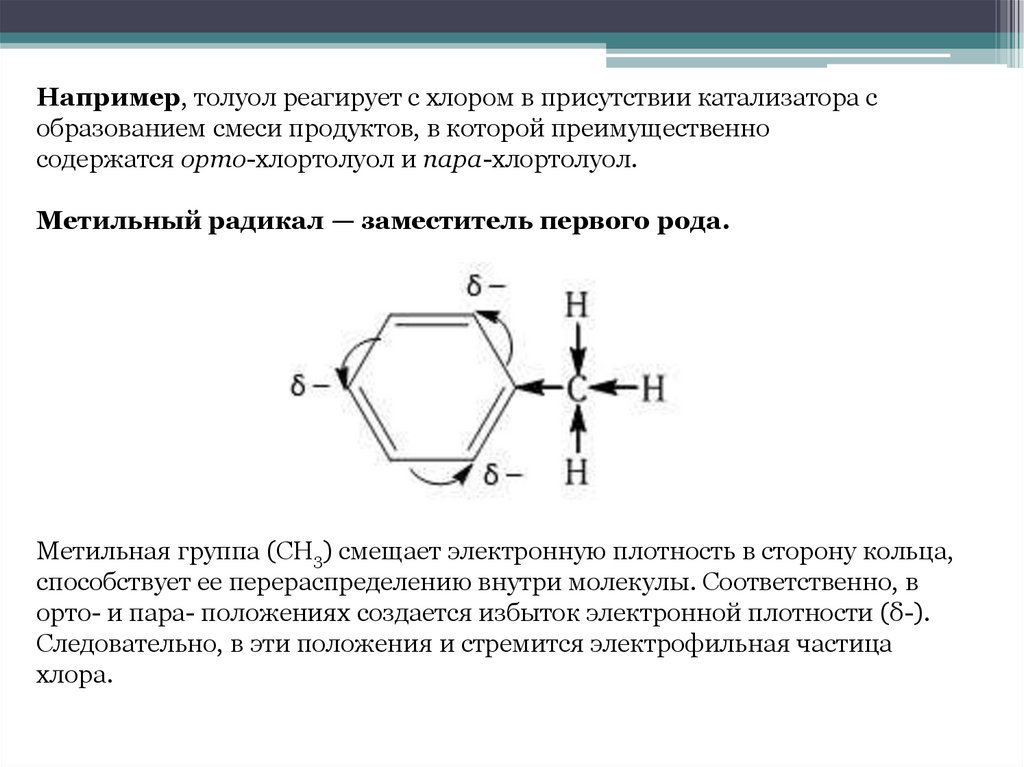
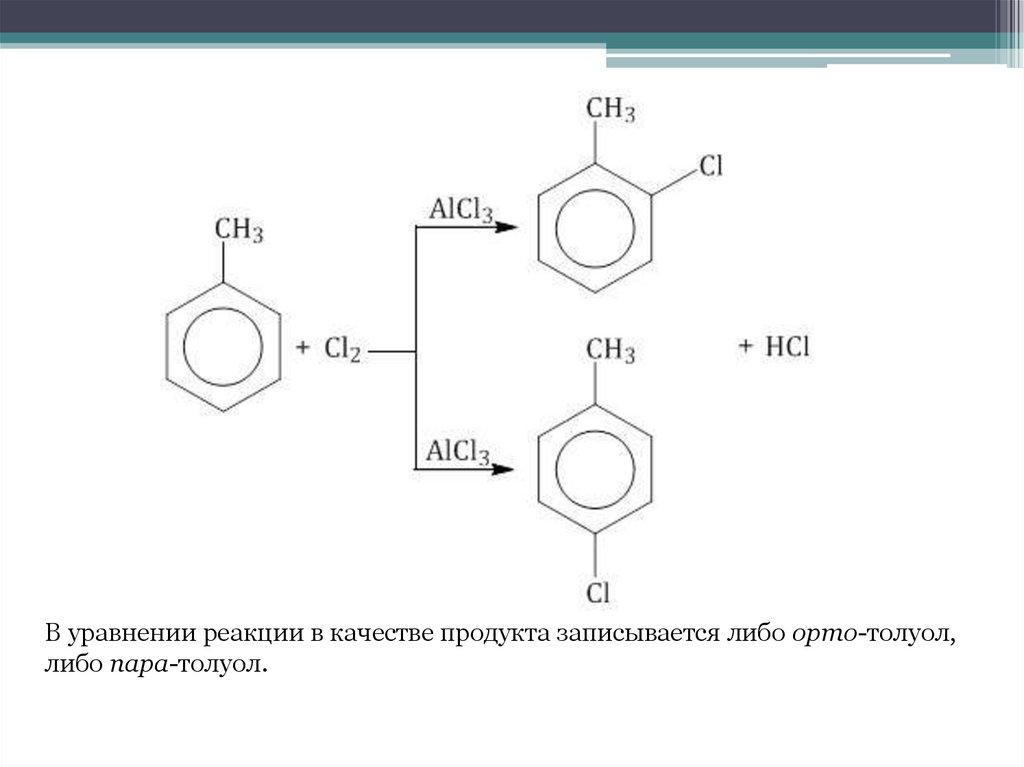
Например, толуол реагирует с хлором в присутствии катализатора собразованием смеси продуктов, в которой преимущественно
содержатся орто-хлортолуол и пара-хлортолуол.
Метильный радикал — заместитель первого рода.
Метильная группа (СH3) смещает электронную плотность в сторону кольца,
способствует ее перераспределению внутри молекулы. Соответственно, в
орто- и пара- положениях создается избыток электронной плотности (δ-).
Следовательно, в эти положения и стремится электрофильная частица
хлора.
28.
В уравнении реакции в качестве продукта записывается либо орто-толуол,либо пара-толуол.
29.
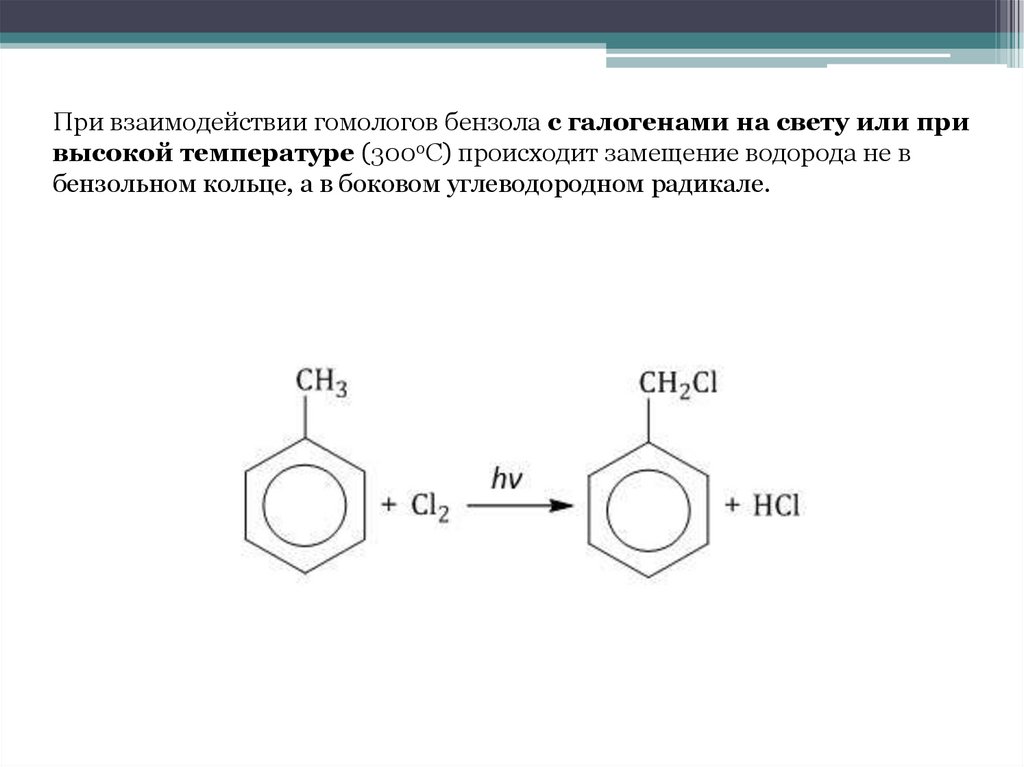
При взаимодействии гомологов бензола с галогенами на свету или привысокой температуре (300оС) происходит замещение водорода не в
бензольном кольце, а в боковом углеводородном радикале.
30.
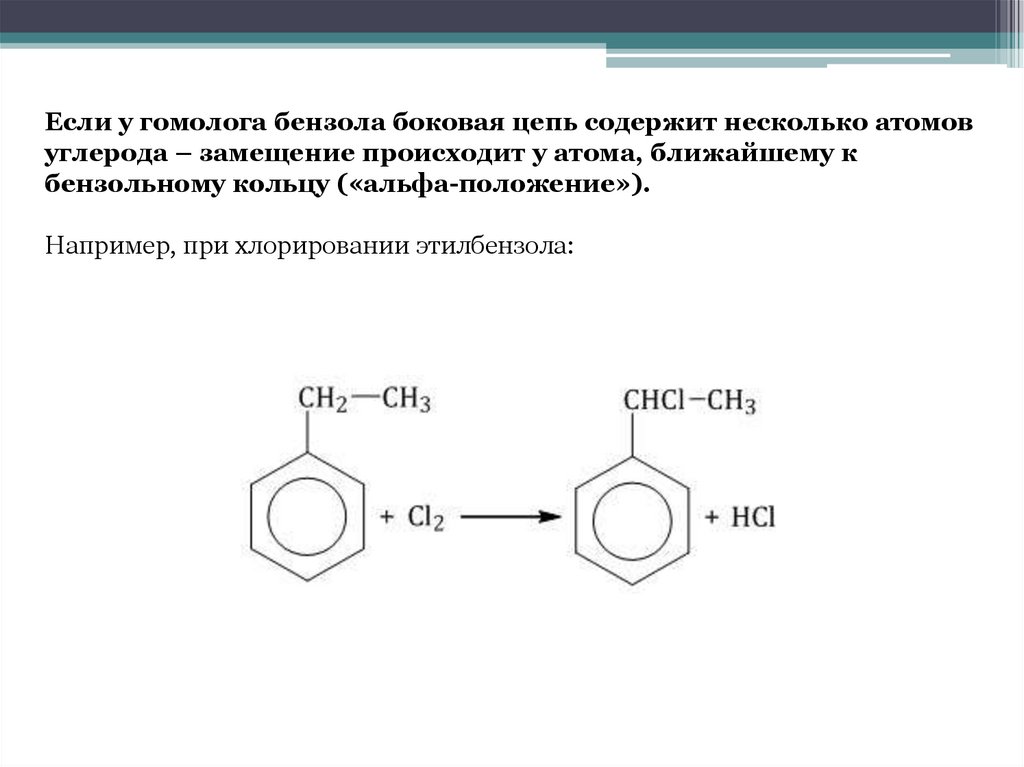
Если у гомолога бензола боковая цепь содержит несколько атомовуглерода – замещение происходит у атома, ближайшему к
бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
31.
Бензол реагирует с концентрированной азотной кислотой в присутствииконцентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
32.
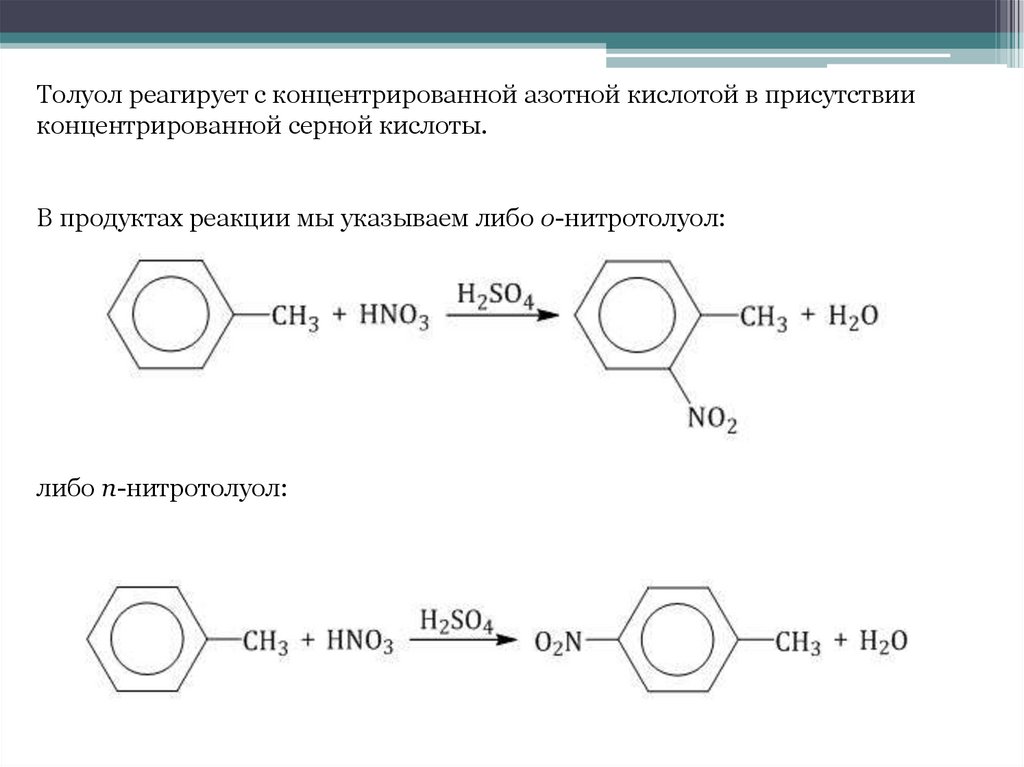
Толуол реагирует с концентрированной азотной кислотой в присутствииконцентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
33.
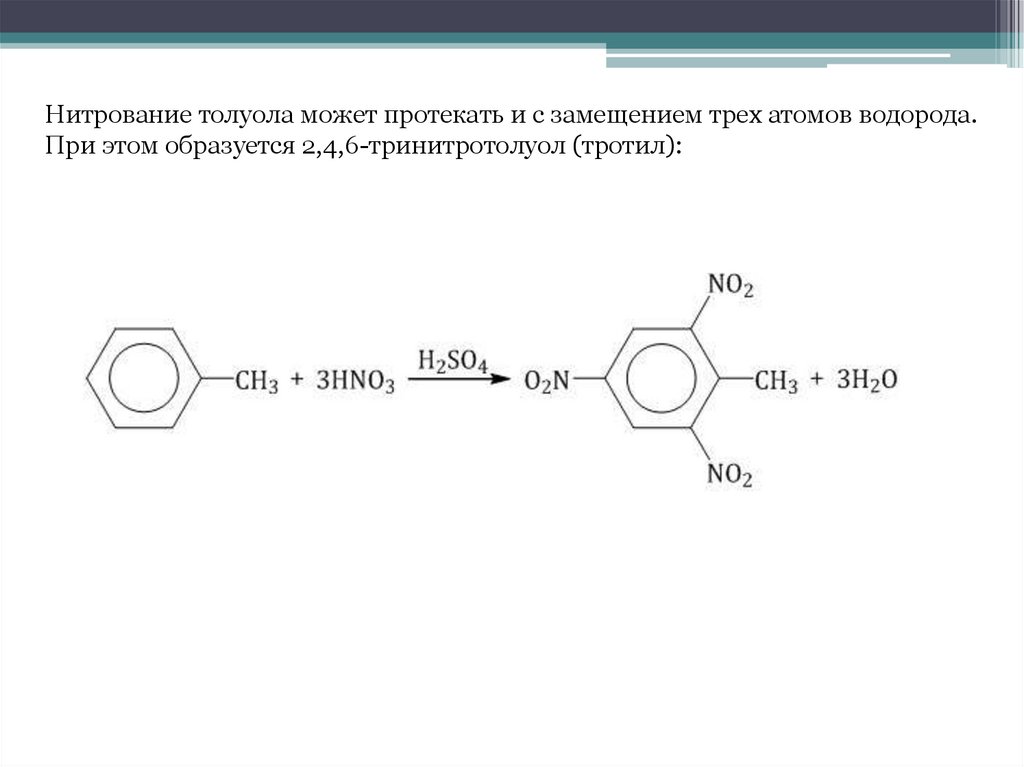
Нитрование толуола может протекать и с замещением трех атомов водорода.При этом образуется 2,4,6-тринитротолуол (тротил):
34.
- заместители II рода (электроноакцепторы – A) оттягиваютэлектроны от бензольного кольца. Направляют второй заместитель (Е) в
мета-положение. Затрудняют реакции замещения по сравнению с
незамещенным бензолом.
O
A =
C
O
<
OR
C
O
<
OH
C
<
H
SO3H <
C
N<
NO2
35.
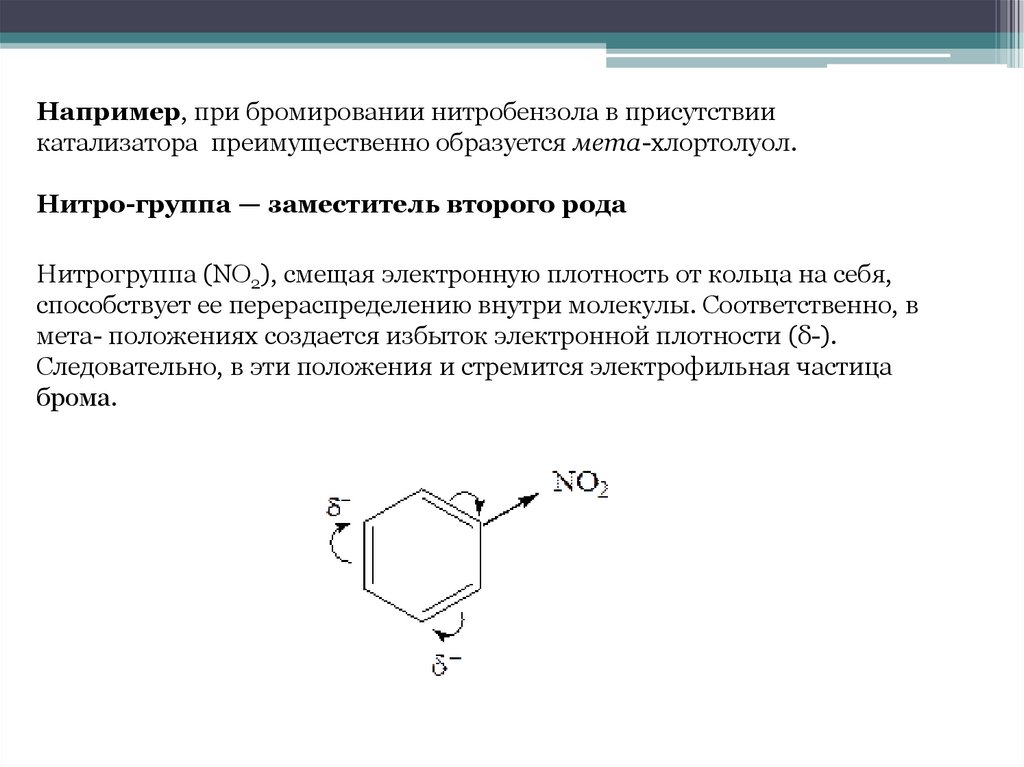
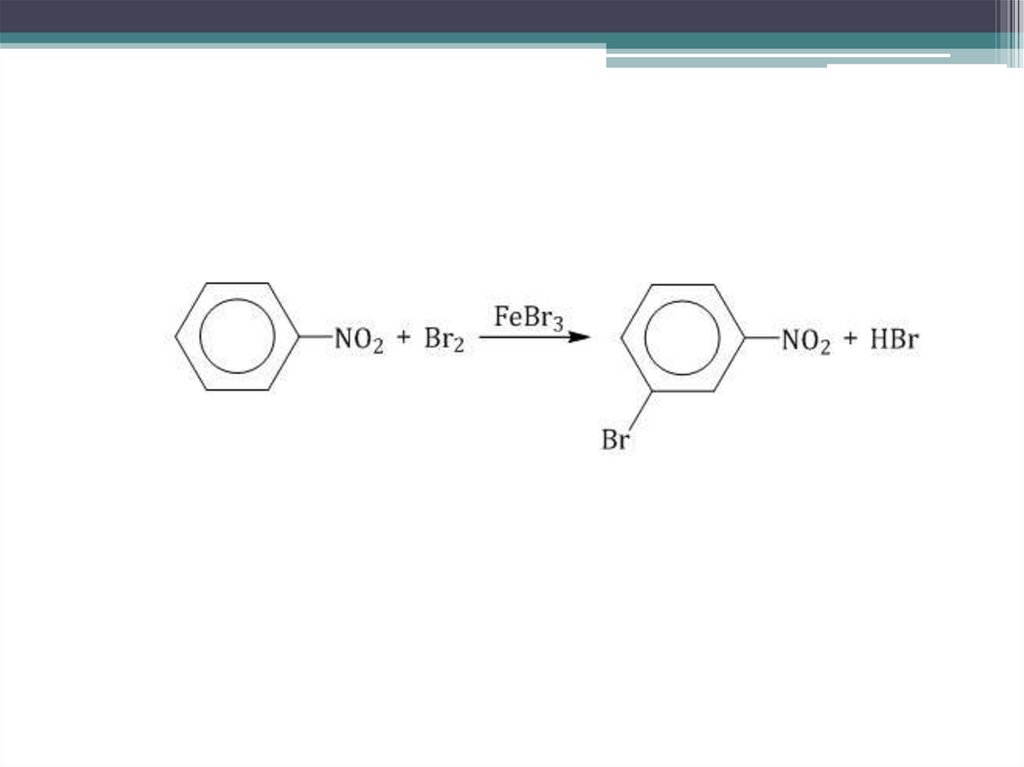
Например, при бромировании нитробензола в присутствиикатализатора преимущественно образуется мета-хлортолуол.
Нитро-группа — заместитель второго рода
Нитрогруппа (NO2), смещая электронную плотность от кольца на себя,
способствует ее перераспределению внутри молекулы. Соответственно, в
мета- положениях создается избыток электронной плотности (δ-).
Следовательно, в эти положения и стремится электрофильная частица
брома.
36.
37.
ПОЛУЧЕНИЕ АРЕНОВ.1. В промышленности:
- переработка нефти и угля;
- дегидрирование соответствующих циклогексанов (Н. Д. Зелинский):
Pt, Pd
+ 3H2
300oC
- дегидроциклизация (ароматизация) гексана (Н. Д. Зелинский, Б. А.
Казанский, А. Ф. Платэ):
CH3
CH2
CH2
CH2
CH2
300oC
CH3
Pt
- тримеризация ацетилена и его гомологов:
3 HC CH
400оС
активированный
уголь
+ 4H2
38.
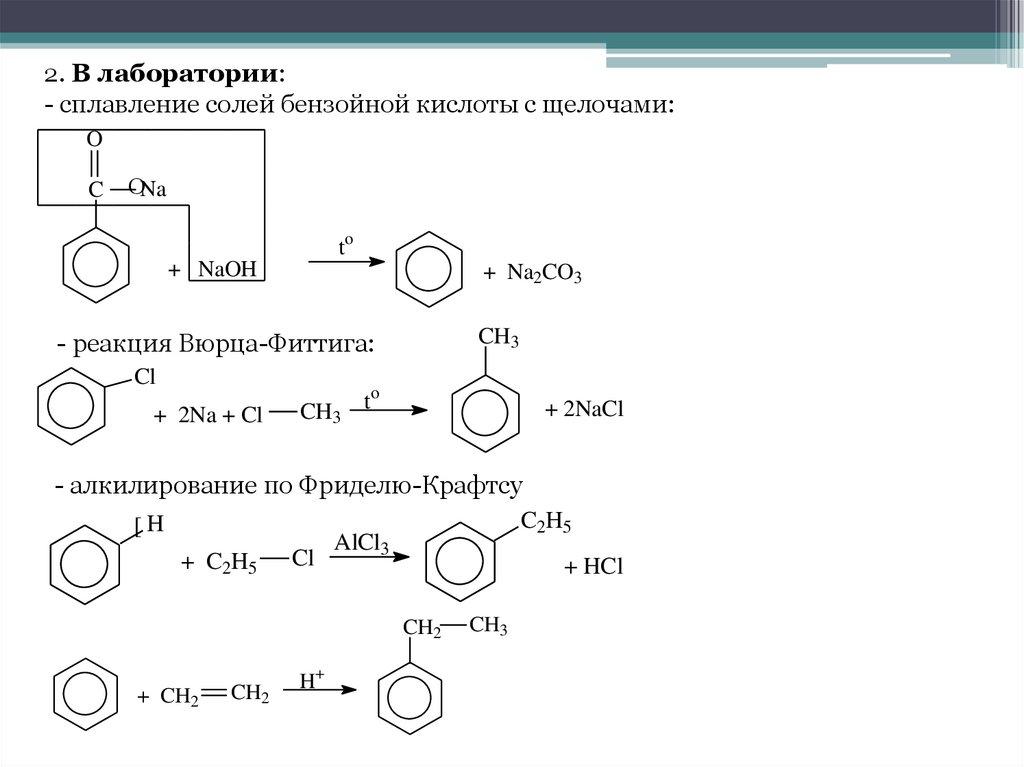
2. В лаборатории:- сплавление солей бензойной кислоты с щелочами:
O
C
ОNa
to
+ NaOH
+ Na2CO3
CH3
- реакция Вюрца-Фиттига:
Cl
+ 2Na + Cl
CH3
to
+ 2NaCl
- алкилирование по Фриделю-Крафтсу
[H
+ C2H5
Cl
C2H5
AlCl3
+ HCl
CH2
+ CH2
CH2
H+
CH3
39.
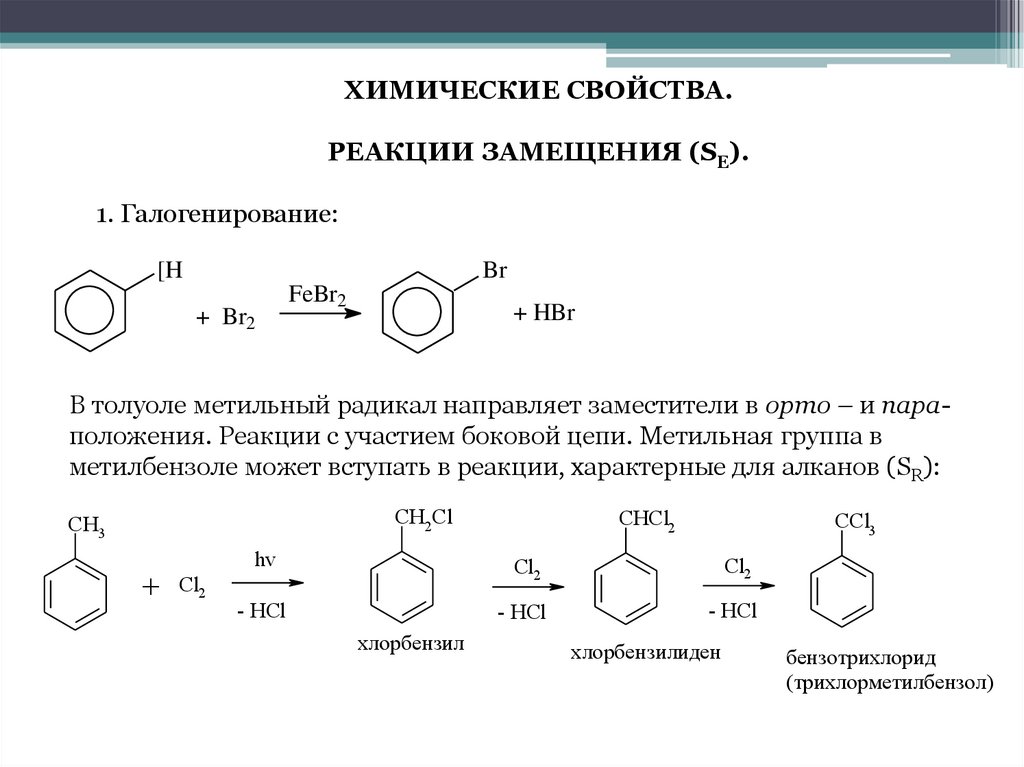
ХИМИЧЕСКИЕ СВОЙСТВА.РЕАКЦИИ ЗАМЕЩЕНИЯ (SE).
1. Галогенирование:
[H
Br
+ Br2
FeBr2
+ HBr
В толуоле метильный радикал направляет заместители в орто – и параположения. Реакции с участием боковой цепи. Метильная группа в
метилбензоле может вступать в реакции, характерные для алканов (SR):
CH2Cl
CH3
+
Cl2
CHCl2
CCl3
hv
Cl2
Cl2
- HCl
- HCl
- HCl
хлорбензил
хлорбензилиден
бензотрихлорид
(трихлорметилбензол)
40.
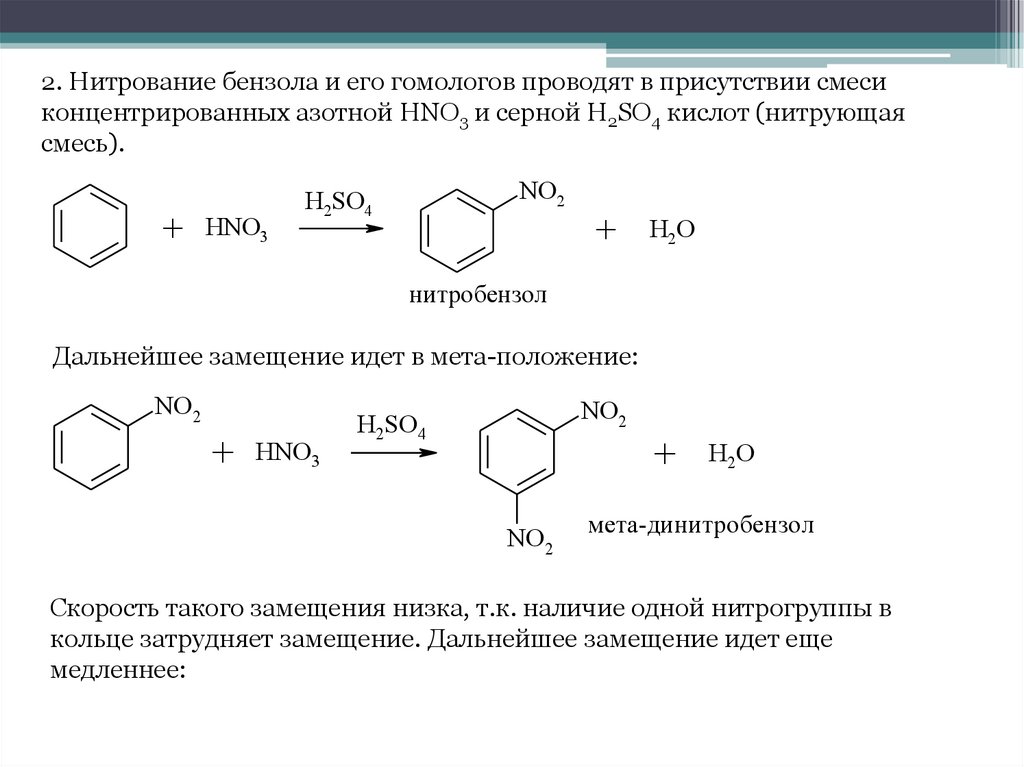
2. Нитрование бензола и его гомологов проводят в присутствии смесиконцентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая
смесь).
+ HNO3
NO2
H2SO4
+
H2O
нитробензол
Дальнейшее замещение идет в мета-положение:
NO2
+ HNO3
NO2
H2SO4
+
NO2
H2O
мета-динитробензол
Скорость такого замещения низка, т.к. наличие одной нитрогруппы в
кольце затрудняет замещение. Дальнейшее замещение идет еще
медленнее:
41.
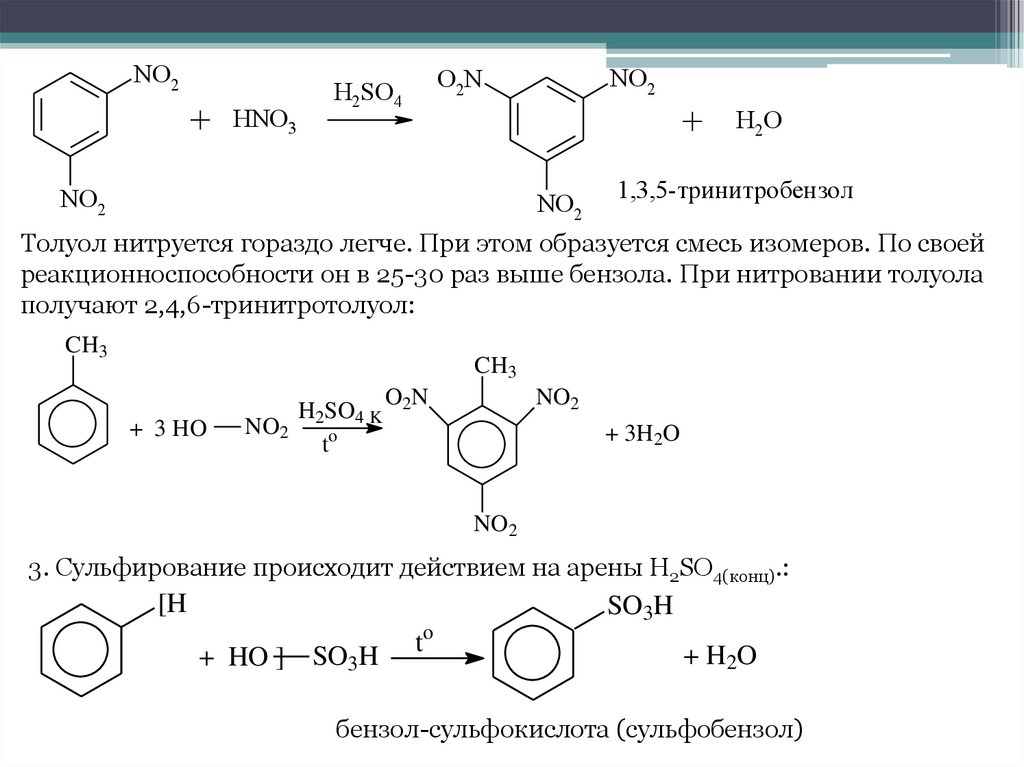
NO2+ HNO3
NO2
O 2N
H2SO4
+
NO2
NO2
H2O
1,3,5-тринитробензол
Толуол нитруется гораздо легче. При этом образуется смесь изомеров. По своей
реакционноспособности он в 25-30 раз выше бензола. При нитровании толуола
получают 2,4,6-тринитротолуол:
CH3
CH3
+ 3 HO
H SO
NO2 2 o 4 K
t
O2N
NO2
+ 3H2O
NO2
3. Сульфирование происходит действием на арены H2SO4(конц).:
[H
SO3H
+ HO ] SO3H
to
+ H2O
бензол-сульфокислота (сульфобензол)
42.
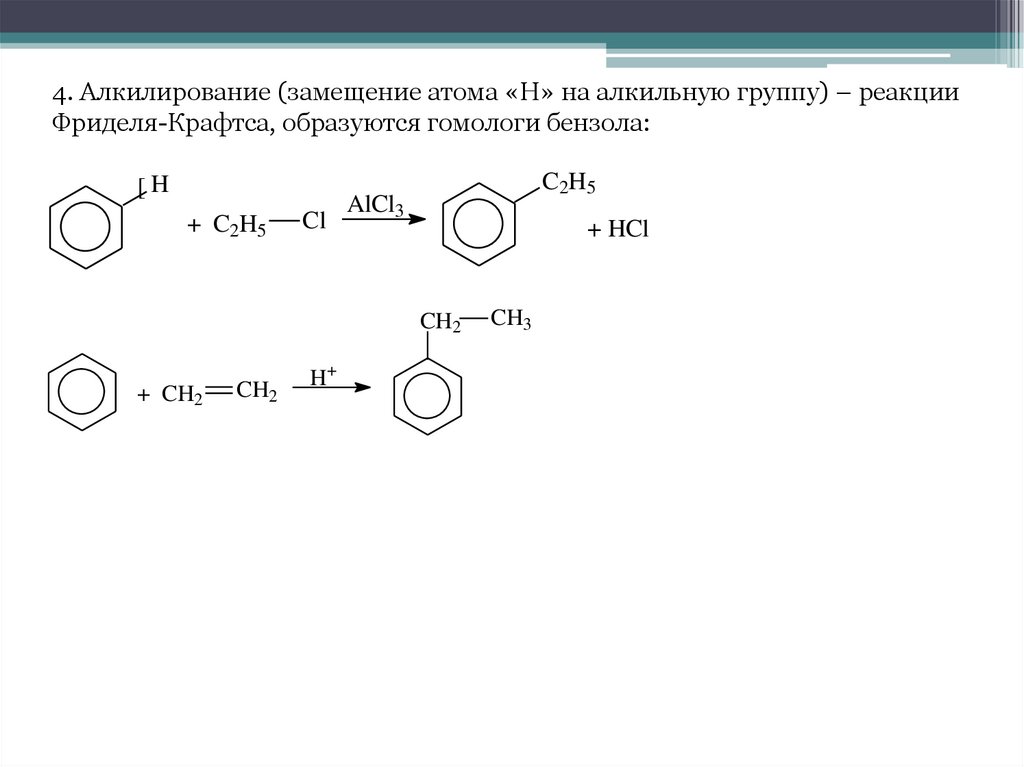
4. Алкилирование (замещение атома «Н» на алкильную группу) – реакцииФриделя-Крафтса, образуются гомологи бензола:
[H
+ C2H5
Cl
C2H5
AlCl3
+ HCl
CH2
+ CH2
CH2
H+
CH3
43.
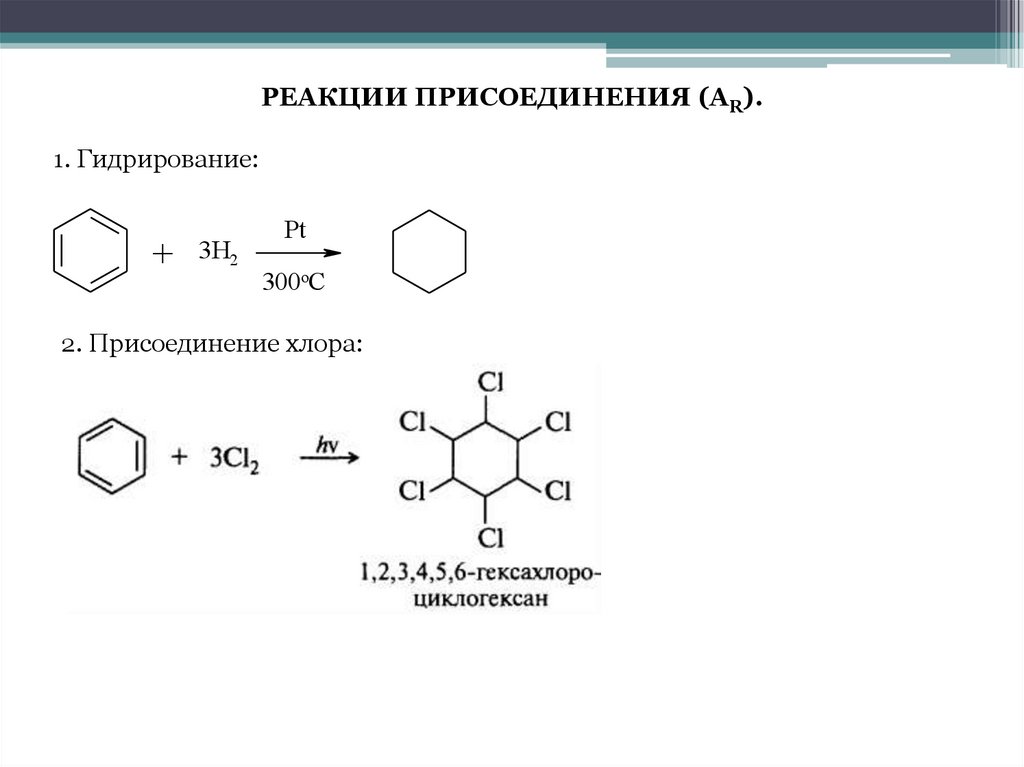
РЕАКЦИИ ПРИСОЕДИНЕНИЯ (АR).1. Гидрирование:
+
3H2
Pt
300oC
2. Присоединение хлора:
44.
РЕАКЦИИ ОКИСЛЕНИЯ.1. Горение:
2С6Н6 + 15O2 → 12СO2 + 6Н2O
2. Неполное окисление. Бензол окисляется кислородом воздуха при
400ºС в присутствии V2O5 в малеиновый ангидрид.
O
O2
V2O5, 500oC
HC C
O
HC C
+ 2 CO2 + H2O
O
малеиновый ангидрид
(ангидрид малеиновой кислоты (двухосновной карбоновой кислоты))
45.
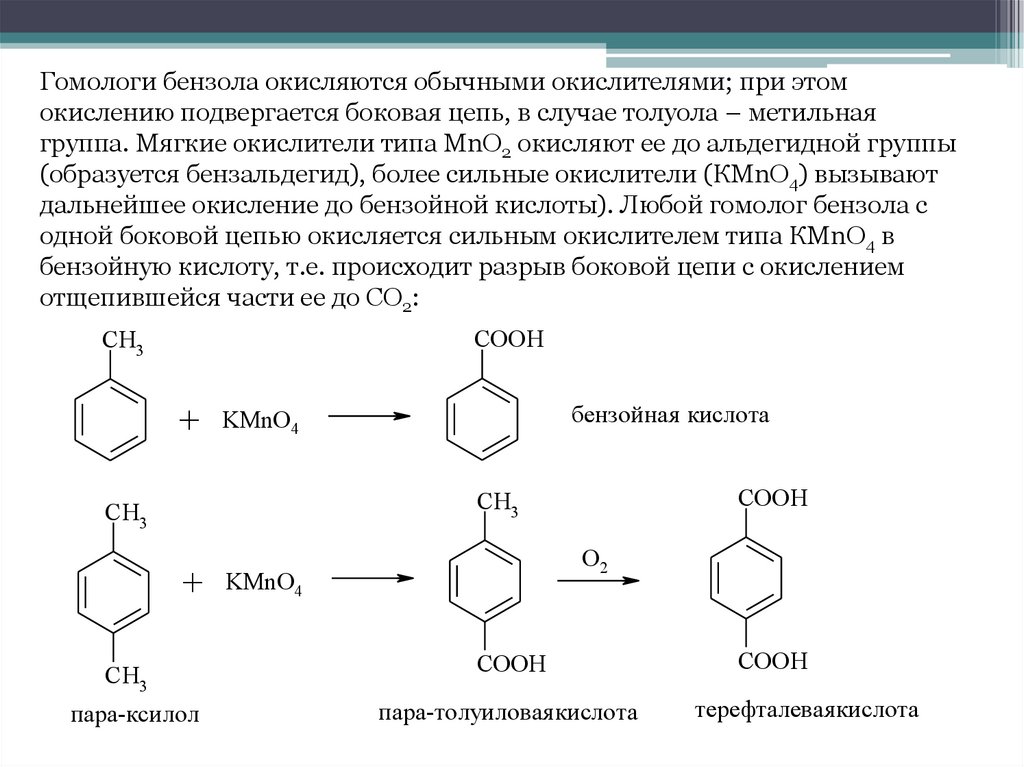
Гомологи бензола окисляются обычными окислителями; при этомокислению подвергается боковая цепь, в случае толуола – метильная
группа. Мягкие окислители типа МnO2 окисляют ее до альдегидной группы
(образуется бензальдегид), более сильные окислители (КМnO4) вызывают
дальнейшее окисление до бензойной кислоты). Любой гомолог бензола с
одной боковой цепью окисляется сильным окислителем типа КМnO4 в
бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением
отщепившейся части ее до СO2:
COOH
CH3
+ KMnO4
бензойная кислота
COOH
CH3
CH3
O2
+ KMnO4
CH3
COOH
пара-ксилол
пара-толуиловая кислота
COOH
терефталевая кислота
46.
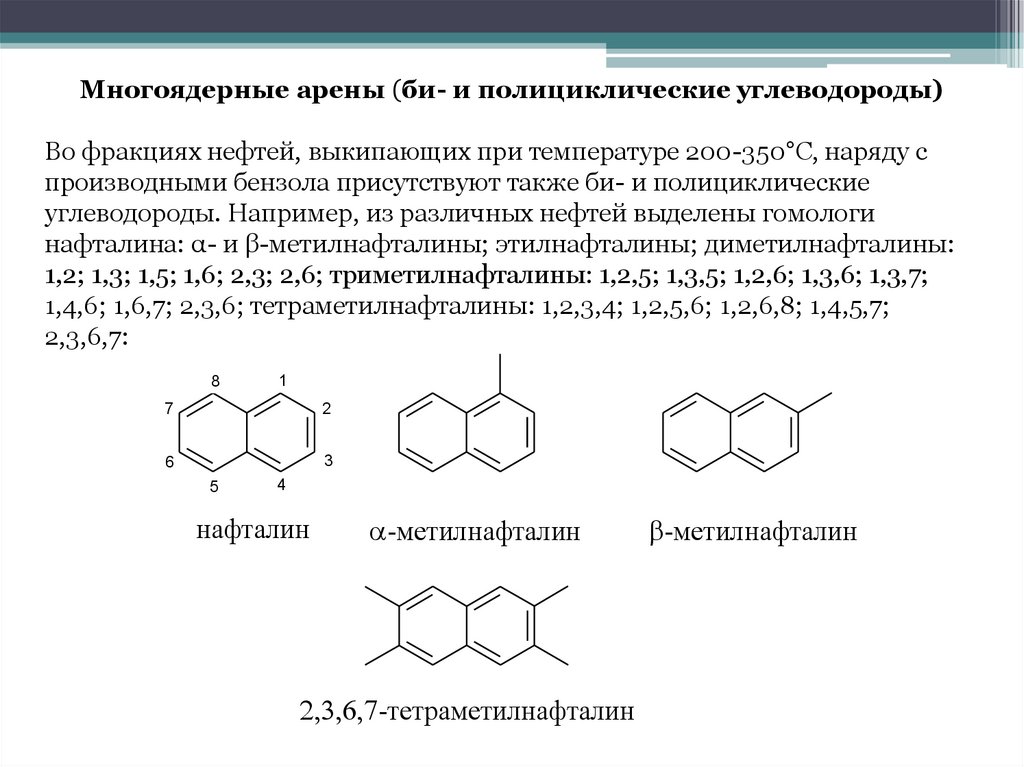
Многоядерные арены (би- и полициклические углеводороды)Во фракциях нефтей, выкипающих при температуре 200-350°С, наряду с
производными бензола присутствуют также би- и полициклические
углеводороды. Например, из различных нефтей выделены гомологи
нафталина: α- и β-метилнафталины; этилнафталины; диметилнафталины:
1,2; 1,3; 1,5; 1,6; 2,3; 2,6; триметилнафталины: 1,2,5; 1,3,5; 1,2,6; 1,3,6; 1,3,7;
1,4,6; 1,6,7; 2,3,6; тетраметилнафталины: 1,2,3,4; 1,2,5,6; 1,2,6,8; 1,4,5,7;
2,3,6,7:
8
1
7
2
6
3
5
4
нафталин
-метилнафталин
-тетраметилнафталин
-метилнафталин
47.
Содержание ароматики в керосино-газойлевых фракциях всегда нескольковыше, чем в бензиновых фракциях той же нефти и колеблется от 15 до 35%
(масс.). Ароматические углеводороды типа дифенила содержатся в
небольших количествах.
дифенил
В высококипящих фракциях нефтей содержится большое количество
углеводородов смешанного (гибридного) характера: нафтеноароматические, парафино-нафтено-ароматические.
48.
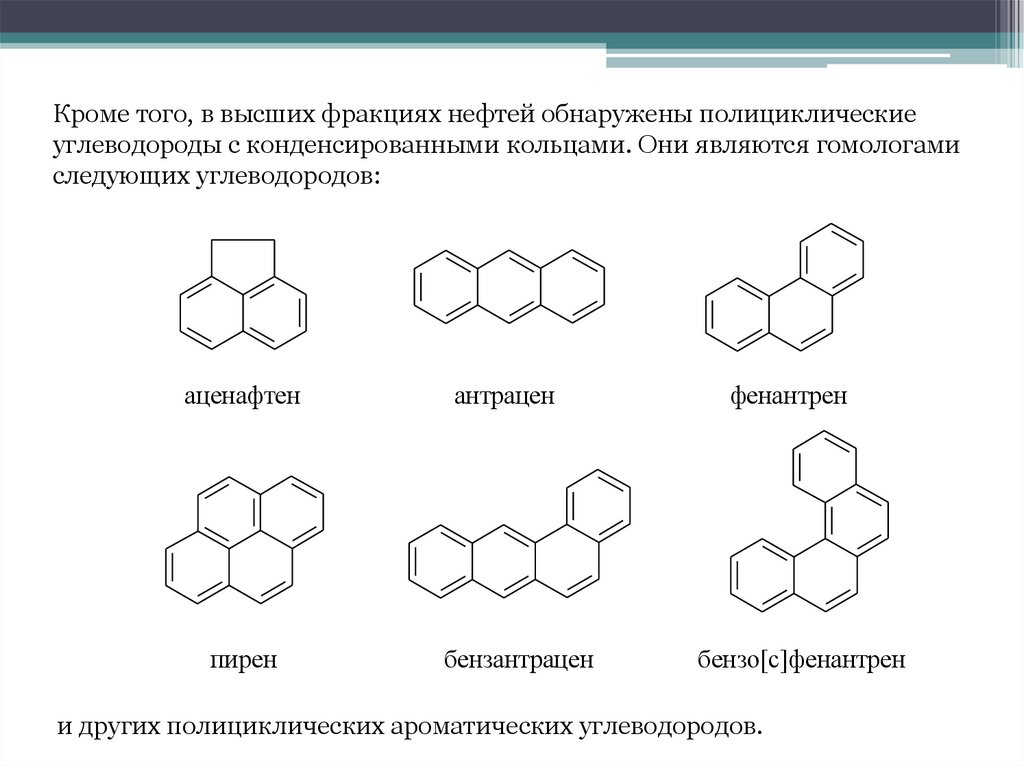
Кроме того, в высших фракциях нефтей обнаружены полициклическиеуглеводороды с конденсированными кольцами. Они являются гомологами
следующих углеводородов:
аценафтен
антрацен
фенантрен
пирен
бензантрацен
бензо[c]фенантрен
и других полициклических ароматических углеводородов.
49.
50.
Арены являются желательными компонентами карбюраторных бензинов,так как обладают высокими октановыми числами. Присутствие аренов в
значительных количествах в дизельном и реактивном топливах
нежелательно, так как ухудшает условие сгорания.
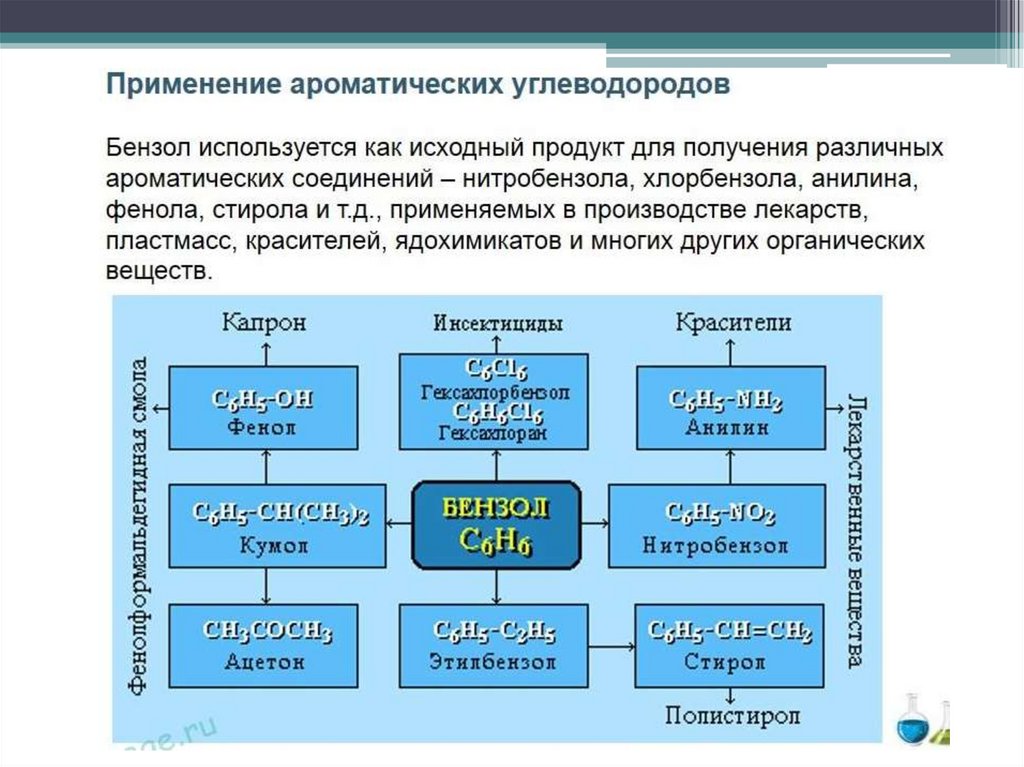
Бензол, толуол, ксилолы, этилбензол и др. основное сырье для
нефтехимической промышленности. Они являются исходным продуктом
для производства пластмасс, синтетических волокон и каучуков,
взрывчатых веществ и т.д.
51.
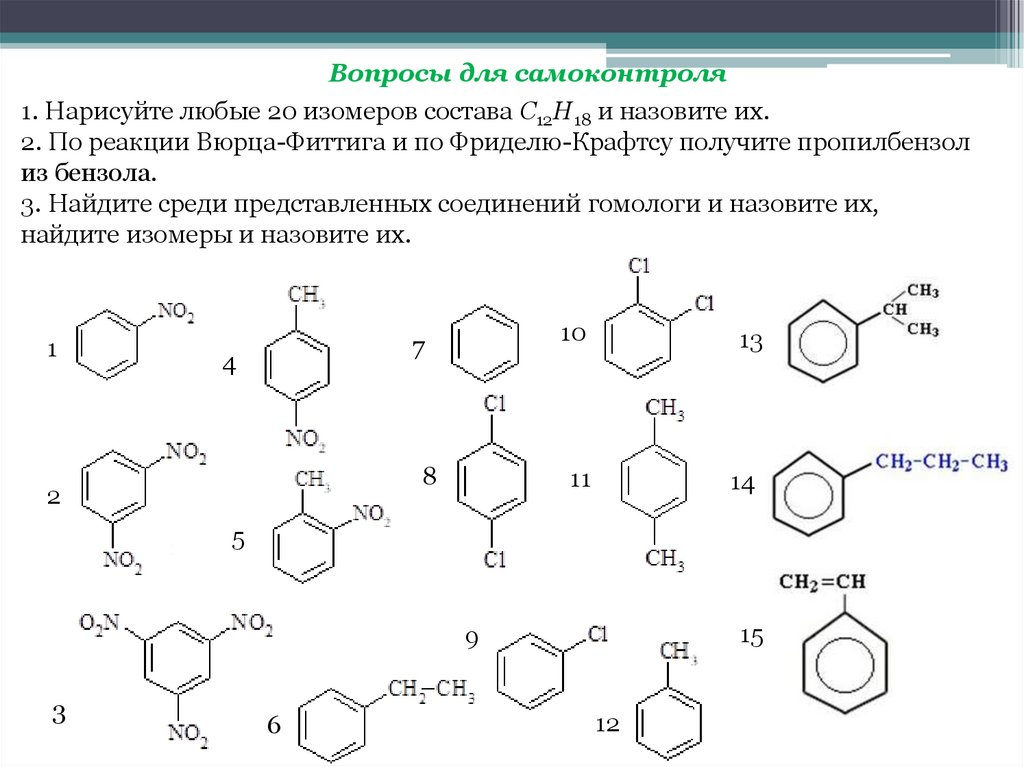
Вопросы для самоконтроля1. Нарисуйте любые 20 изомеров состава С12Н18 и назовите их.
2. По реакции Вюрца-Фиттига и по Фриделю-Крафтсу получите пропилбензол
из бензола.
3. Найдите среди представленных соединений гомологи и назовите их,
найдите изомеры и назовите их.
1
7
4
8
2
10
13
11
14
5
15
9
3
6
12

















 Химия
Химия