Похожие презентации:
Ароматические соединения. Лекция 10
1.
А.В. Мануйлов. Лекция 10Лицей 12
Ароматические соединения (окончание)
1. Какие реакции электрофильного замещения не идут из-за дезактивации кольца?
2. Как синтезировать орто-изомер без примеси пара-изомера? Защитные группы.
3. Почему метильная группа -СН3 орто-, пара-ориентант и активатор?
4. В какие реакции электрофильного замещения вступают другие
ароматические соединения?
5. Получение некоторых важных производных бензола.
6. Другие реакции бензола в кольце (реакции присоединения).
7. Реакции замещенных бензолов в боковой цепи:
а) галогенирование в бензильное положение;
бензильный радикал, его строение.
б) реакции окисления в боковой цепи.
8. Синтезы ароматических соединений.
1
2.
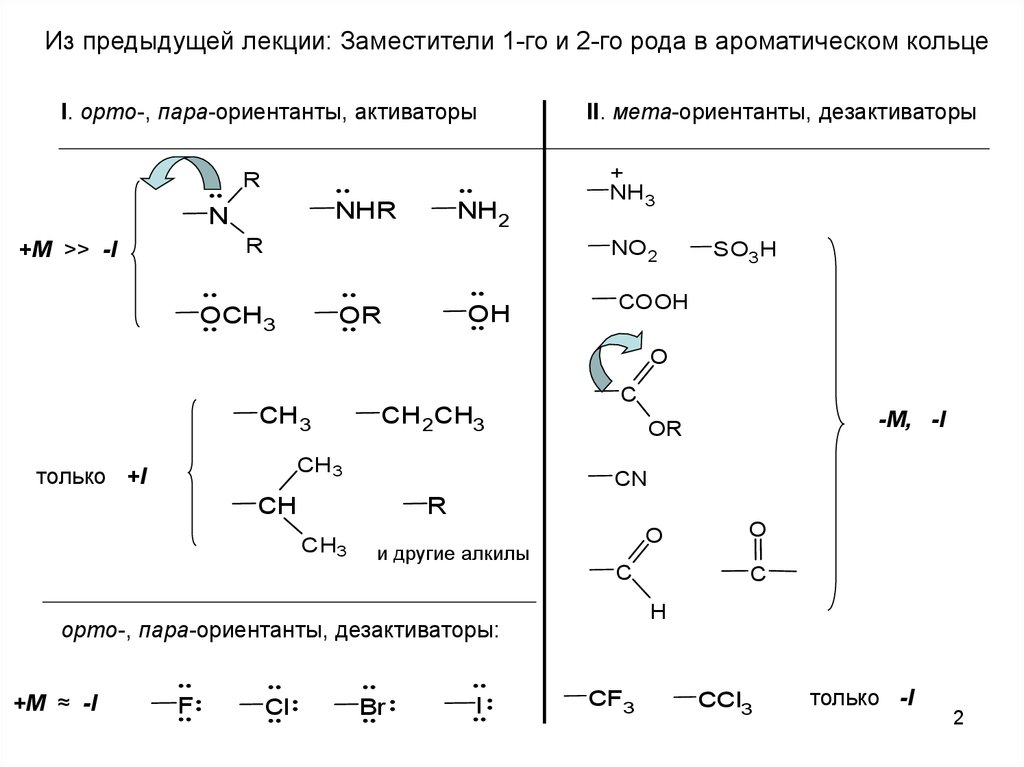
Из предыдущей лекции: Заместители 1-го и 2-го рода в ароматическом кольцеI. орто-, пара-ориентанты, активаторы
.. R
N
..
NHR
..
NH 2
R
+M >> -I
II. мета-ориентанты, дезактиваторы
+
NH 3
NO 2
..
OCH
..
3
..
OH
..
..
OR
..
SO3H
COOH
O
C
CH 3
CH 2CH3
CH3
только +I
CN
CH
R
CH3
O
и другие алкилы
C
+M ≈ -I
..
:
Cl
..
..
:
Br
..
..
:
..I
O
C
H
орто-, пара-ориентанты, дезактиваторы:
..
F
.. :
-M, -I
OR
CF3
CCl3
только -I
2
3.
Акцепторные заместители настолько дезактивируют бензольное кольцо, чтонекоторые реакции со слабыми электрофилами просто не идут:
NO 2
NO 2
+
AlCl 3
CH3Cl
+
нет реакции
HCl
CH 3
NO2
NO 2
+
CH3 CH CH2
H 3PO4
нет реакции
CH
CH3
CH3
NO 2
NO 2
O
+
CH3
AlCl 3
C
+
HCl
нет реакции
CH3
Cl
O
Невозможны такие же реакции и с сульфокислотой!
SO3H
3
4.
Как метильная группа подает электроны в кольцо?CH3
CH3
+
E
+
+
E
H
электроны С-Н связи могут сдвигаться в кольцо
E
C
C
H
C
C +
C
C
H
C
H
H
4
5.
Защитные группы в органической химии. Как получать орто-изомерыбез примеси пара-изомеров?
..
: OCH3
OCH3
H2 SO4
а)
Постановка защитной
группы
+ H 2O
o
t
SO3H
..
(+М) : OCH3
OCH3
б)
(-М, -I)
+ Cl2
SO3H
OCH 3
Cl
H2O t o
(перегретый пар)
SO3H
+ HCl
Ввод какого-нибудь
заместителя в ортоположение к -ОСН3
SO3H
OCH 3
в)
Cl
AlCl3
Cl
+ H 2SO 4
Снятие защитной
группы
5
6.
Другой вариант защитной группы - трет-бутильная группа:OCH3
OCH3
CH3
а)
+ CH3 C
Cl
AlCl 3
+ HCl
CH3
трет-бутилхлорид
CH3
C
Постановка
защитной
группы
CH3
CH3
орто-хлоранизол
OCH3
OCH3
OCH3
Cl
Cl
Cl2
б) в)
H2SO4 (р)
o
Fe
CH3
C
CH3
CH3
t
CH3
C
CH3
CH3
+
C
CH2
CH3
Снятие защитной группы
CH3
6
7.
8Нафталин
7
2
6
3
NO2
HNO3
1
4
5
+ H 2O
H2SO4
1-нитронафталин
Br
Br
Br2
+ HBr
+
CH3COOH
2-бромнафталин (1%)
1-бромнафталин (99%)
O
O
C
CH3
O
CH 3 C
C
Cl
CH3
+ HCl
+
o
AlCl3 15 C
1-ацетонафталин (75%)
2-ацетонафталин (25%)
7
8.
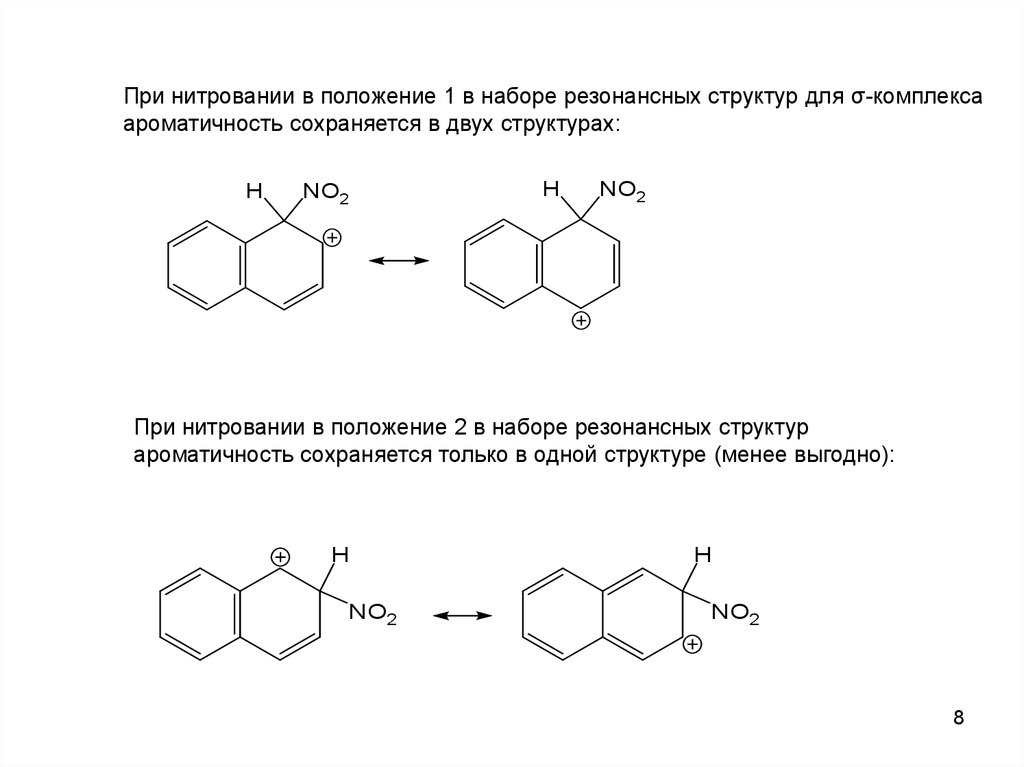
При нитровании в положение 1 в наборе резонансных структур для σ-комплексаароматичность сохраняется в двух структурах:
H
NO2
H
NO2
При нитровании в положение 2 в наборе резонансных структур
ароматичность сохраняется только в одной структуре (менее выгодно):
H
NO2
H
NO2
8
9.
Окисление нафталина - окисляется одно кольцо, другое сохраняет ароматичностьO
9/2 O2
O
+ 2 CO 2 + 2 H2O
V2O5
480 о
O
нафталин
фталевый ангидрид
O
H2O
COOH
O
COOH
O
фталевая кислота
9
10.
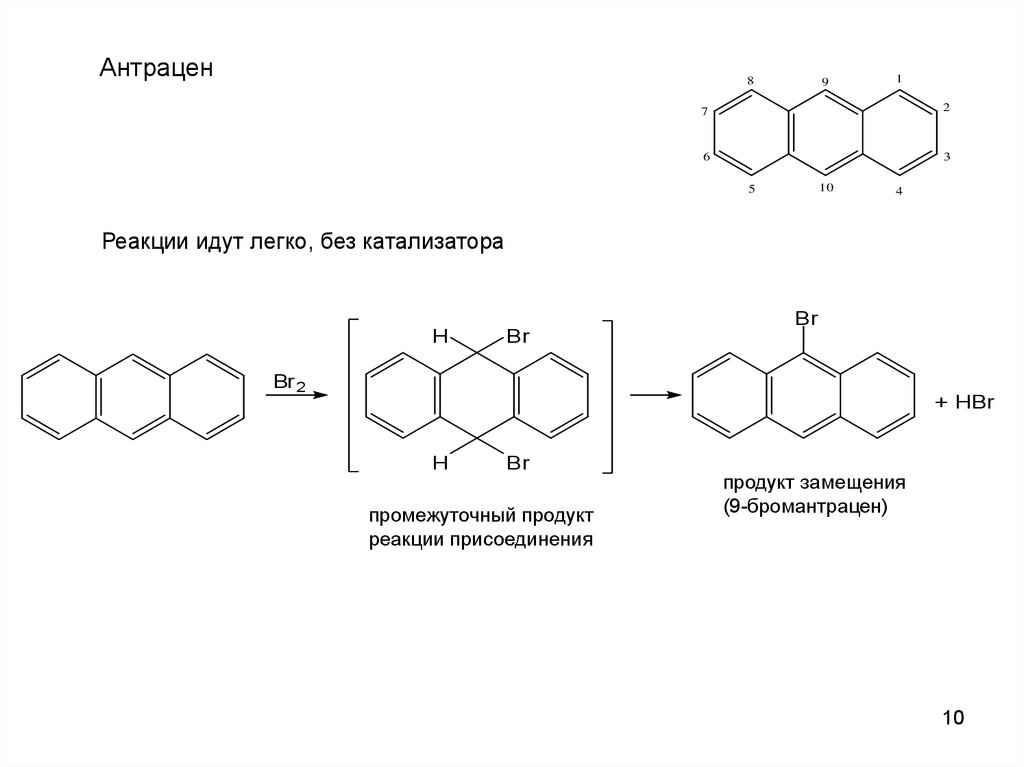
Антрацен8
9
1
7
2
6
3
10
5
4
Реакции идут легко, без катализатора
H
Br
Br
Br 2
+ HBr
H
Br
промежуточный продукт
реакции присоединения
продукт замещения
(9-бромантрацен)
10
11.
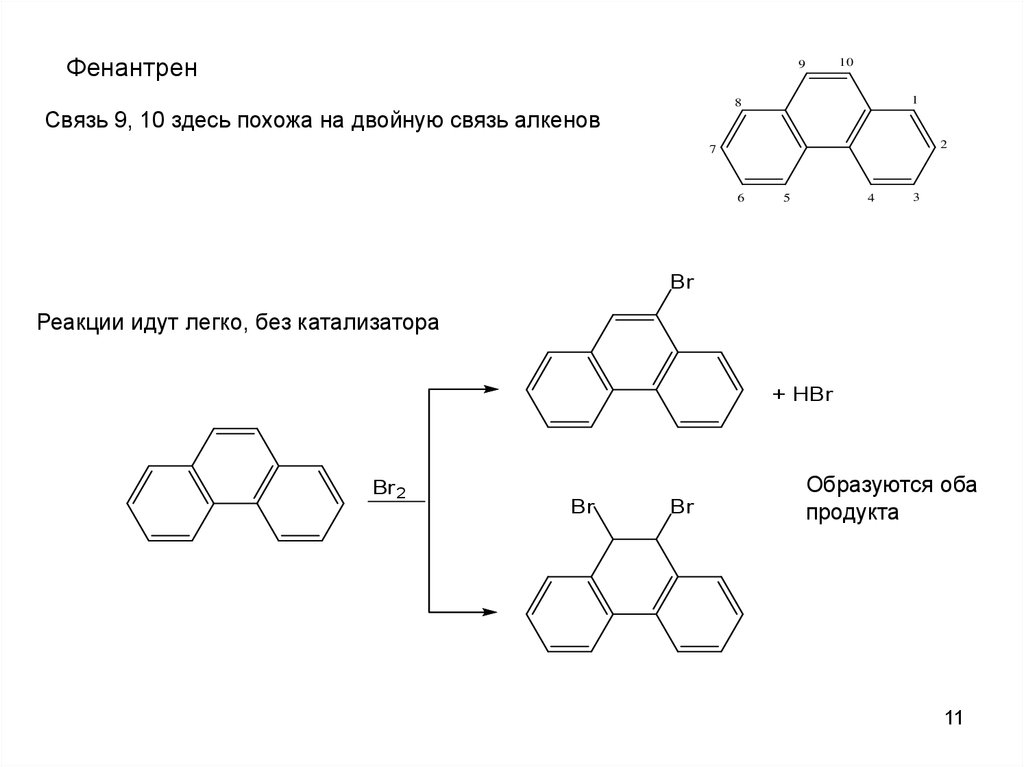
Фенантрен10
9
1
8
Связь 9, 10 здесь похожа на двойную связь алкенов
2
7
6
5
4
3
Br
Реакции идут легко, без катализатора
+ HBr
Br 2
Br
Br
Образуются оба
продукта
11
12.
Пятичленные гетероциклы..
..
..
..
пиррол
..
фуран
..
O
..
N
..
..
тиофен
..
S
..
H
Br 2
Br
бензол
+ HBr
S
S
реакция идет легко,
без катализатора
2-бромтиофен
Почему замещение идет легче в положение 2, а не 3?
H
H
Br
Br
Две структуры, из них
одна октетная
..
S
..
S
..
H
H
..
S
..
Br
..
S
..
Br
H
S
..
Три структуры, из них
одна октетная
Br
12
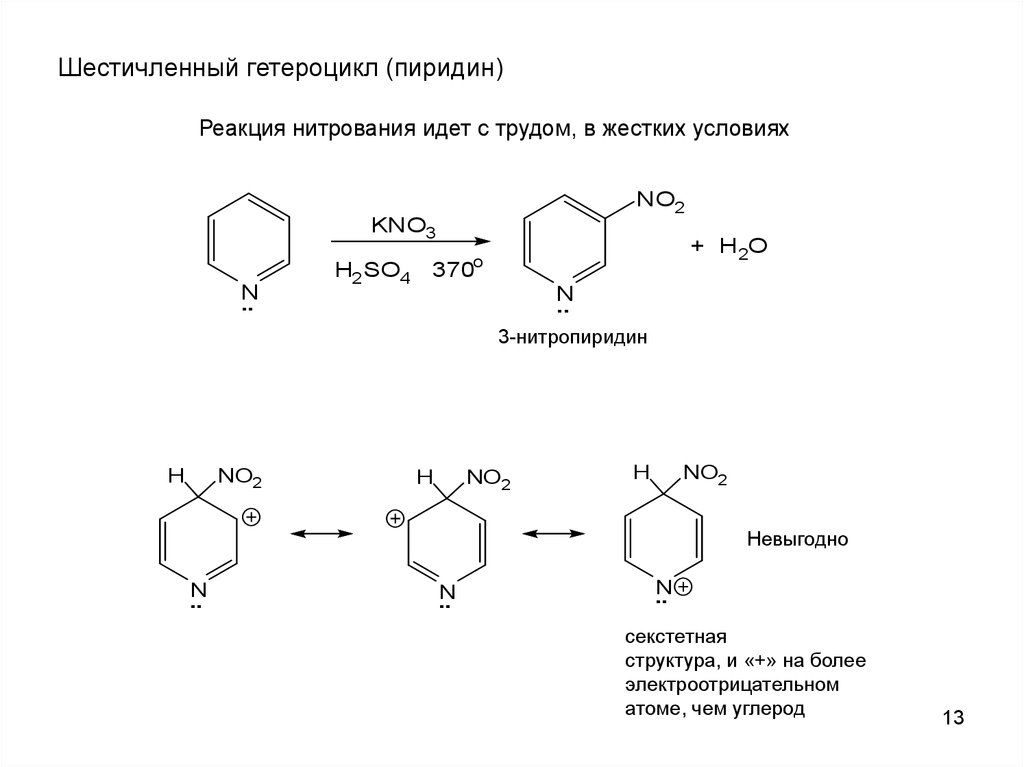
13.
Шестичленный гетероцикл (пиридин)Реакция нитрования идет с трудом, в жестких условиях
NO2
KNO3
+ H2O
o
N
..
H2SO4 370
N
..
3-нитропиридин
H
NO2
H
NO2
H
NO2
Невыгодно
N
..
N
..
N
..
секстетная
структура, и «+» на более
электроотрицательном
атоме, чем углерод
13
14.
Получение некоторых важных производных бензола:1) получение фенола:
нуклеофильное ароматическое замещение
-ОН
Cl
Cl
OH
OH
o
400
+
NaOH
давление
+
-
нуклеофильное
замещение
Реакция хлорбензола со щелочью при высокой
температуре и давлении дает соль фенола фенолят натрия. Его легко превратить в фенол
действием любой минеральной кислоты
NaCl
NaOH
ONa
фенолят натрия
14
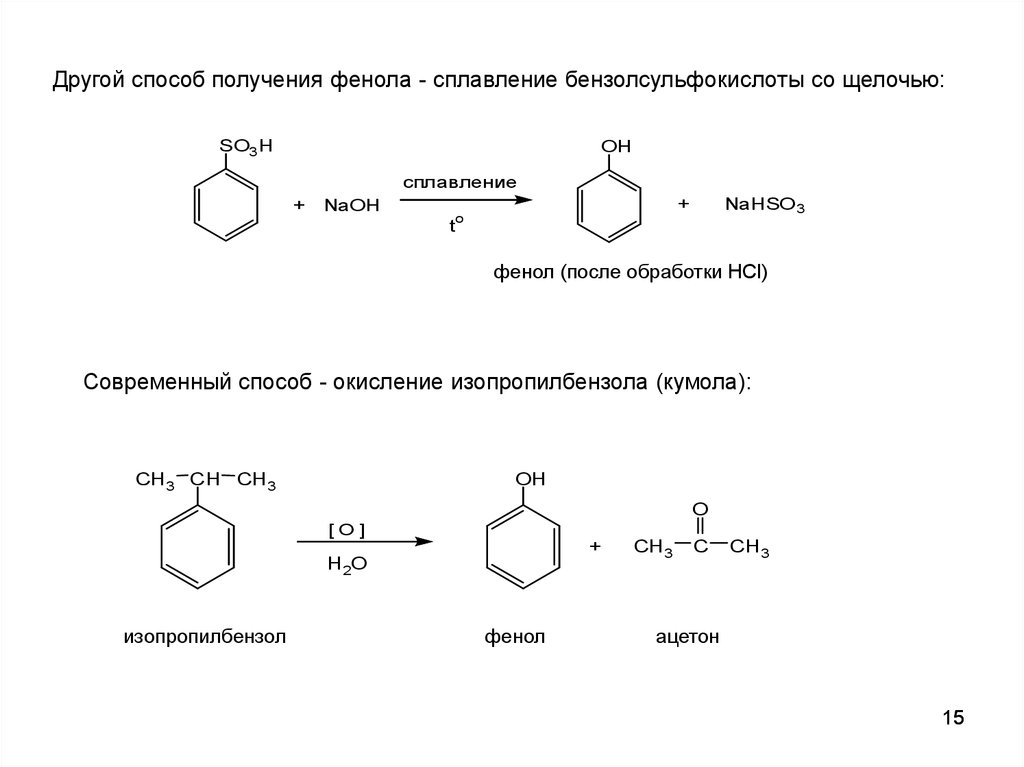
15.
Другой способ получения фенола - сплавление бензолсульфокислоты со щелочью:SO3H
OH
сплавление
+
NaOH
+
NaHSO 3
o
t
фенол (после обработки HCl)
Современный способ - окисление изопропилбензола (кумола):
CH3 CH CH3
OH
O
[O]
+
H2O
изопропилбензол
фенол
CH3
C
CH3
ацетон
15
16.
2) Получение анилина. Реакция восстановления нитробензола:NO2
NH2
6 HCl
+
3 Fe
+
нитробензол
3 FeCl2
+
2 H2O
анилин
Есть и другие способы восстановления нитробензола - водородом на Ni, железом в Н2О,
с помощью (NH4)2S (эти реакции мы изучим в теме «амины»).
3) Получение стирола. Реакция дегидрирования этилбензола:
CH2
CH
CH3
Cr2O3/Al2O3
350 o
этилбензол
CH2
+
H2
Стирол нужен для
получения полистирола
(см. лекцию 5)
стирол (винилбензол)
16
17.
4) Получение взрывчатых веществ:(+I)
CH 3
CH 3
O2N
+ 3 HNO3
NO2
H2 SO4
+ 3 H2O
to
толуол
NO 2
тринитротолуол (ТНТ)
(+M) ..
: OH
OH
to
O2N
NO2
+ 3 HNO3
фенол
+ 3 H2O
NO 2
пикриновая кислота
17
18.
Другие реакции ароматических соединений и их производных.а) реакции присоединения
Гидрирование бензола и его производных протекает в жестких условиях:
никель Ренея
CH3
H2, Ni
H2, Ni
o
100 , 100 атм
бензол С6Н6
CH3
100o, 100 атм
циклогексан С6Н12
толуол
OH
метилциклогексан
OH
H2, Ni
150o, 100 атм
фенол
циклогексанол
18
19.
А.В. Мануйлов. Лекция 8Реакция присоединения хлора к бензолу при облучении светом:
H
Cl
H
H
+
H
3 Cl2
свет
H
бензол С6Н6
Но!
H
H
H
Cl
Cl
H
Cl
H
Cl
Cl
H
H
H
Cl
H
Cl
H
Cl
H
Cl
Cl
Cl
H
H
инсектицидом является только этот
стереоизомер (линдан)
гексахлоран С6Н6Cl6
Если в бензоле есть боковая цепь, то гораздо быстрее происходит реакция
замещения в боковой цепи.
б) Реакции радикального замещения в боковой цепи:
CH
CH3
Cl
CH2 CH3
+
этилбензол
CH
Cl2
свет
CH3
+
a-хлорэтилбензол
HCl
бензильный
радикал
19
20.
Почему относительно устойчив бензильный радикал?Радикальный центр сопряжен с кольцом
(электрон делокализован)
Нет сопряжения
(электрон локализован)
>>
обычный первичный радикал
бензильный радикал
Теперь мы можем привести еще более полный ряд относительной устойчивости радикалов:
.
CH
R
.
>
CH2
CH
CH2
CH3
CH3
C.
> CH3
.
CH
CH3 > CH3
.
CH2
.
>> CH3
CH3
бензильный
аллильный
третичный
вторичный
У карбокатионов точно такой же ряд!
первичный
метильный
20
21.
в) Реакции окисления производных бензола:Боковая цепь может быть разной длины и разветвленности,
но результат один - получается бензойная кислота, а «лишние» атомы углерода
в боковой цепи превращаются в СО2.
пропилбензол
CH 2 CH2 CH3
KMnO4
COOH
H2SO4
+
CH3
CH3
CH
2 CO2 + MnSO 4 + K2SO4 + H 2O
KMnO4
H2SO4
бензойная кислота
изопропилбензол
(кумол)
21
22.
Решим задачу:6-22. В результате окисления толуола (метилбензола)
перманганатом калия в присутствии серной кислоты
образуется только одно органическое соединение.
Напишите уравнение реакции, расставьте коэффициенты
методом полуреакций или электронного баланса.
22
23.
+3COOH
-3
CH3
6 KMnO 4
5
5
+
9 H2SO4
толуол
6 MnSO4
+ 3 K2SO 4
+
14 H2O
бензойная кислота
-3
C -
6e
+7
Mn + 5e
+3
C
5
+2
Mn
6
23
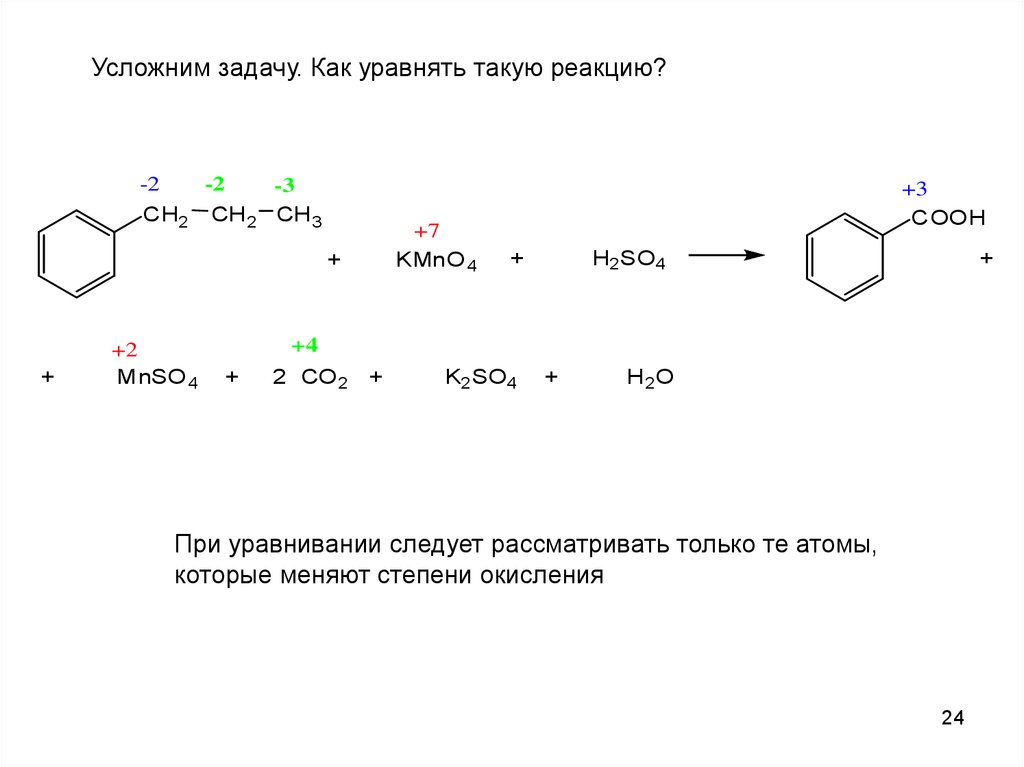
24.
Усложним задачу. Как уравнять такую реакцию?-2
-2
CH2
CH 2
-3
CH3
+7
KMnO 4
+
+
+2
MnSO 4
+3
COOH
+
H2SO4
+
+4
+
2 CO 2
+
K2SO4
+
H2O
При уравнивании следует рассматривать только те атомы,
которые меняют степени окисления
24
25.
В левой и правой частях уравнения по 114 атомов водорода и по 180 атомов кислорода-2
CH2
-2
CH 2
-3
CH3
5
+
+
18
+2
MnSO 4
18
+7
KMnO 4
+3
COOH
27 H2SO4
+
5
+
+4
+
2 CO 2 +
10
+7
9 K2SO4
+
+2
Mn + 5e
Mn
-2
5e
+3
C
6e
+4
C
7e
+4
C
C -2
C -3
C -
42 H2O
18
18e
5
25
26.
Получение фталевой кислоты - из 1,2-диметилбензола(о-ксилола):
CH3
COOH
O2
+
V2O5
CH3
H2O
COOH
фталевая кислота
1,2-диметилбензол
Из п-ксилола получается терефталевая кислота:
O2
CH3
CH3
1,4-диметилбензол
соли Co
HOOC
COOH
+
H2O
терефталевая кислота
26
27.
Получение бензола и его гомологов:а) Риформинг некоторых нефтяных фракций (на катализаторе):
CH3
CH3
Pt
CH 3
o
t
+
3 H2
CH 3
27
28.
б) Исторически известны способы получения тримеризацией ацетилена(на практике не не используются):
3 HC
CH
600o
Марселен Бертло, 1866 г.
Позже российский химик
Николай Дмитриевич Зелинский
использовал активированный уголь
в качестве катализатора. Это
позволило снизить иемпературу
до 450о.
Ni-kt
3 HC
CH
60o
Вальтер Реппе, 1948 г.
Катализаторы: Ni(CN)2, Ni(SCN)2 и т.д.
28
29.
OЗадача
Синтезируйте из бензола и любых
других реактивов такое соединение:
CH3
Cl
NO2
29






















 Химия
Химия