Похожие презентации:
Кетоны
1.
2.
Кетоны – органические соединения, молекулыкоторых содержат карбонильную группу
С О,
связанную с двумя углеводородными радикалами.
Общая
формула
O
R1
C
R2
3.
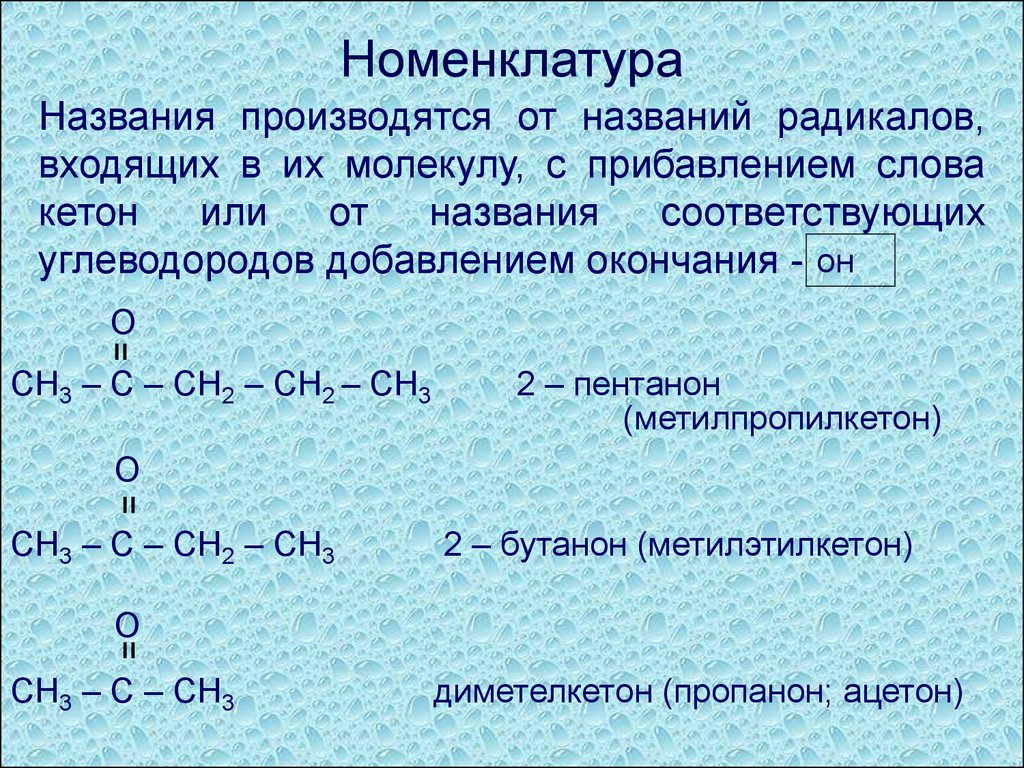
НоменклатураНазвания производятся от названий радикалов,
входящих в их молекулу, с прибавлением слова
кетон
или
от
названия
соответствующих
углеводородов добавлением окончания - он
О
СН3 – С – СН2 – СН2 – СН3
2 – пентанон
(метилпропилкетон)
О
СН3 – С – СН2 – СН3
2 – бутанон (метилэтилкетон)
О
СН3 – С – СН3
диметелкетон (пропанон; ацетон)
4.
Получение кетонов1. Дегидрогенизации спиртов
ОН
R1
CН
R2 + ½ О2
O
R1
C
R2 + Н2О
2. Сухая перегонка дерева
3. Гидратация ацетилена водяным паром
Pt
СН3 С СН + Н2О
СН3 – С – СН3
О
5.
Химические свойства1.
Окисление
О
О
СН3 – С – СН2 – СН3 + О2
О
СО2 + СН3 – С – ОН + СН3 – СН2 – С – ОН
2. Присоединение(водорода, бисульфита натрия, синильную кислоту )
О
СН3 – С – СН3 + Н2
3.
Замещение
4.
Конденсация
ОН
СН3 – СН – СН3
6.
Физические свойстваНизшие представители – жидкость,
растворимые в воде со своеобразным
запахом.
Высшие - твердые вещества, без запаха,
не растворимые в воде.
Все
кетоны
растворяются
органических растворителях
в
7.
АцетонБез цветная, горючая жидкость с характерным
запахом, температура кипения 56,20. Хорошо
растворимы в воде, спирте, эфире. Хорошо
растворяет
жиры,
смолы
и
многие
органические вещества, не дает реакции
серебренного зеркала, не взаимодействует с
перманганатом калия, но окисляется хромовой
смесью, не полимеризуется.
8.
Применение1. Растворители лабораторной практике
2. Пищевой промышленности
3. Фармацевтической промышленности
4. Производство искусственного шелка
5. Бездымного пороха
6. Химической промышленности
7. Производстве кинопленки
8. Производстве лаков







 Химия
Химия








