Похожие презентации:
Металлы.Положение в ПСХЭ Д.И.Менделеева и строение атома
1. МЕТАЛЛЫ
Положение в ПСХЭ Д.И.Менделеева истроение атома.
Изменение свойств в группах и
периодах.
Химическая связь и кристаллическое
строение.
2.
Происхождение слова «металл»Слово «металл» заимствовано из немецкого языка в
старорусский период. Отмечается в «Травнике»
Николая Любчанина, написанном в 1534 году: «...злато
и сребро всех металей одолеваетъ». Окончательно
усвоено в Петровскую эпоху. Первоначально имело
общее значение «минерал, руда, металл»;
разграничение этих понятий произошло в эпоху
М.В. Ломоносова.
Немецкое слово «metall» заимствовано из
латинского языка, где «metallum» – «рудник,
металл». Латинское в свою очередь заимствовано
из греческого языка (μεταλλον – «рудник, копь»)
3.
МЕТАЛЛЫ это химические элементы, атомы которыхотдают электроны внешнего ( предвнешнего)
электронного слоя, превращаясь в положительные
ионы.
92 элемента из 114 известных - МЕТАЛЛЫ
Na⁰ - 1e → Na⁺
ПРИЧИНА:
Mg⁰ - 2e → Mg⁺²
положение металлов в ПСХЭ
- сравнительно большие радиусы атомов
- малое число электронов на внешнем слое
4.
ЭЛЕКТРОННОЕ СТРОЕНИЕМЕТАЛЛОВ
1. s – элементы :
Na 1s²2s²2p⁶3s¹
Mg 1s²2s²2p⁶3s²
2. p – элементы:
Al 1s²2s²2p⁶3s²3p¹
3. d - элементы:
Fe 1s²2s²2p⁶3s²3p⁶4s² 3d⁶
4. f - элементы:
La ……. 5d¹6s²
5.
ЗАДАНИЕ:Напишите электронные формулы
- лития
- калия
- хрома
Li 1s²2s¹
K
1s²2s²2p⁶3s²3p⁶4s¹
Cr 1s²2s²p⁶3s²p⁶3d⁵4s¹
6.
ИЗМЕНЕНИЕ СВОЙСТВВ главной подгруппе:
В периоде:
( с увеличением порядкового номера элемента)
- число электронов на внешнем
- заряды ядер атомов
слое не изменяется
увеличиваются
- радиус атома увеличивается
- число электронов на
внешнем слое
увеличивается
- ЭО уменьшается
- ЭО увеличивается
- восстановительные свойства
усиливаются
- металлические свойства
усиливаются
- восстановительные
уменьшаются
- металлические
ослабевают
7.
1) В ряду химических элементов Li – Na – K – Rbметаллические свойства
а) усиливаются
б) не изменяются
в) ослабевают
г) изменяются периодически
ОТВЕТ:
а
2) Усиление металлических свойств элементов в
А-группах периодической системы с увеличением
порядкового номера обусловлено:
а) увеличением атомной массы элементов
б) увеличением общего числа электронов
в) увеличением атомного радиуса элемента
г) увеличением номера периода
ОТВЕТ:
в
8.
3) Наиболее ярко выражены металлические свойствау вещества с электронной формулой:
а) 2,1
б) 2,8,1
в) 2,8,8,1
г) 2,8,2
ОТВЕТ:
в
4) Наиболее активный металл:
а) 1s²2s²2p⁶3s¹
б) 1s²2s¹
в) 1s²2s²2p⁶3s²3p¹
г) 1s²2s²2p⁶3s²3p⁶4s¹
ОТВЕТ:
г
9.
5. Наименьший радиус имеет атом элемента1) кальция
2) стронция
3) бария
4) радия
6. Символ и формула высшего оксида элемента,
электронная формула внешнего и пред внешнего
энергетических уровней атома которого …..3s23p63d54s1:
1) Cr и CrO3
2) K и K2O
3) Mn и Mn2O7
4) Se и SeO3
7. Металл М образует высший оксид состава М2О3.
Электронная формула валентного энергетического
уровня атома М
1) ns2np1
2) ns2np2
3) ns2np3
4) ns2np5
ОТВЕТ: 5 -
1
6 -
2
7 -
1
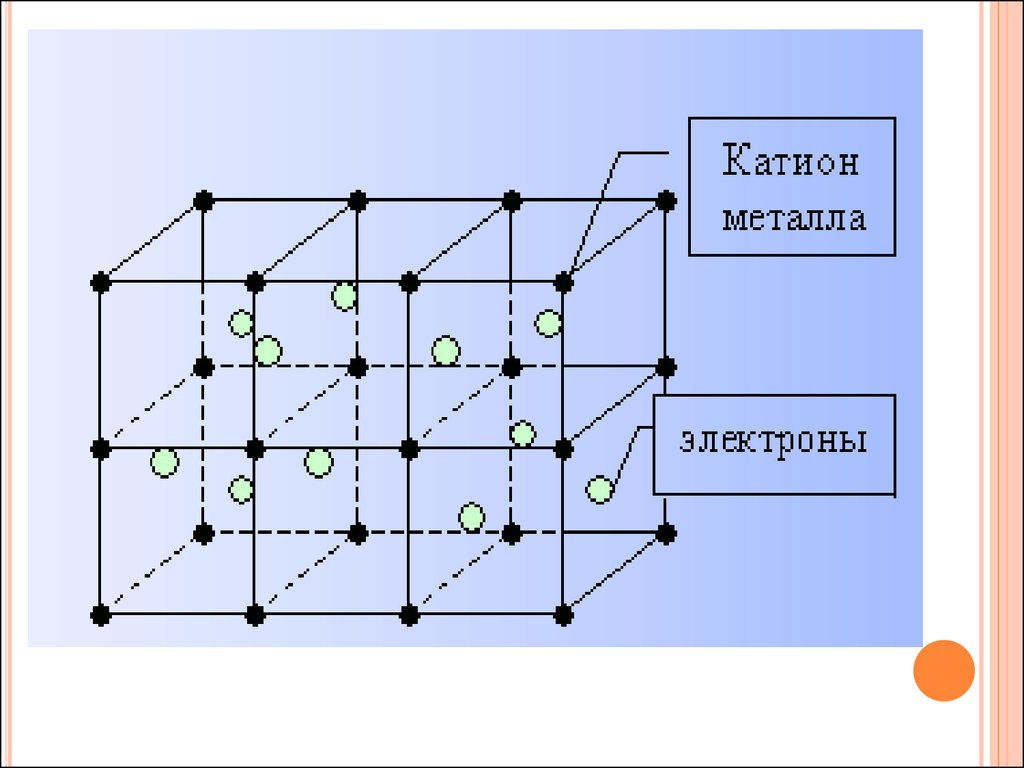
10. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ И КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
11.
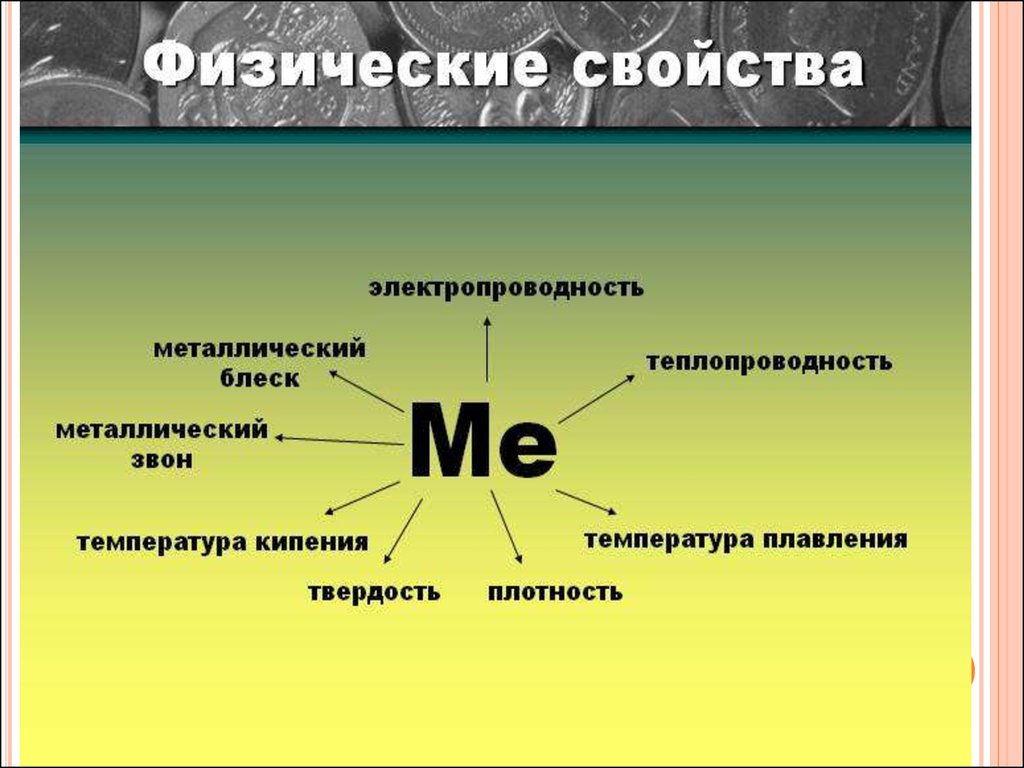
12. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
13. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
1.Агрегатное состояние:а) твердые
барий
калий
алюминий
14.
б) жидкиертуть
15.
2. Тяжелыеи
легкие металлы
( 5 г/см³)
Os : 22,5 г/ см³
Li : 0,53 г/см³
3. Легкоплавкие
и
тугоплавкие
( 1000⁰С)
Ga: 30⁰С, Cs: 28,6⁰С
W : 3410⁰С
4. Мягкие
Na, K, Pb
и
твердые
Cr, Ti, Mo
16.
17.
Какие физические свойства зависят от металлическойсвязи и типа кристаллической решетки?
• металлический блеск
• пластичность
• электропроводность
• теплопроводность
• плотность
• температура плавления
• твердость
ВОПРОСЫ:
• почему металлы пластичны?
• почему металлы имеют блеск?
• почему высока электро- и теплопроводность?
• почему механическая прочность, плотность и
температура плавления сильно отличаются?
18.
1. Электроны перемещаются по всему кристаллу,поэтому разрыв связей между слоями ион-атомов не
происходит.
2. Электроны отражают световые лучи.
3. Под воздействием приложенного электрического
напряжения хаотически движущиеся электроны
приобретают направленное движение ( эл.ток).
Подвижные свободные электроны, сталкиваясь с
колеблющимися атом-ионами, обмениваются с ними
энергией.
4. С увеличением числа электронов, связывающих
атом-ионы и уменьшением межатомного расстояния
в кристаллах показатели механической прочности,
плотности, температуры плавления возрастают.
19.
Na, K, Li - 1 валентный электрон - мягкие, легкие,легкоплавкие.
W - 5 валентных электронов - твердый, тугоплавкий,
тяжелый.
20. ЗАГАДКА
Название металла?НАТРИЙ
БАРИЙ
21.
ЗАГАДКИ•Он в теченье многих лет был причиной многих бед
•Был металл серебристо-белым, в соединении стал
мелом.
•Красит пламя в желтый цвет, в воду кинь – его уж
нет.
•К восьмой группе отнесен, в честь России назван он.
• «Камнем» назван он людьми, но попробуй-ка
возьми.
•Из него солдатик твой, не болеет он « чумой».
(Золото)
. (Литий)
(Олово)
(Кальций)
(Рутений)
(Натрий)
22.
1.Какие частицы находятся в узлах кристаллическойрешетки металлов?
а) катионы металлов
б) нейтральные атомы
в) катионы и нейтральные атомы
г) анионы и катионы
2.Какой металл наименее электропроводен?
а) W
б)Zn
в)Сг
3. У какого металла наибольшая плотность?
а)платина
б)вольфрам
в)железо
г)свинец
4.Какой металл самый легкий?
а)калий
б)олово
в)алюминий
г)медь
ОТВЕТ: 1 - В
2 - В
3 - Г
4 - А
23.
5. Что обеспечивает металлам высокуюэлектропроводность?
а) атомы металлов
б) катионы металлов
в) свободные электроны
г) катионы металлов и свободные электроны
6. Чем обусловлена ковкость металлов?
а) мягкостью металлов
б) наличием электронного газа
в) несвязанностью ионов между собой
г) наличием в кристаллической решетке катионов металлов
7. Какой из металлов наиболее твердый?
а) титан
в) никель
б) цинк
г) хром
ОТВЕТ:
5 -
В
6 -
Б
7 -
Г
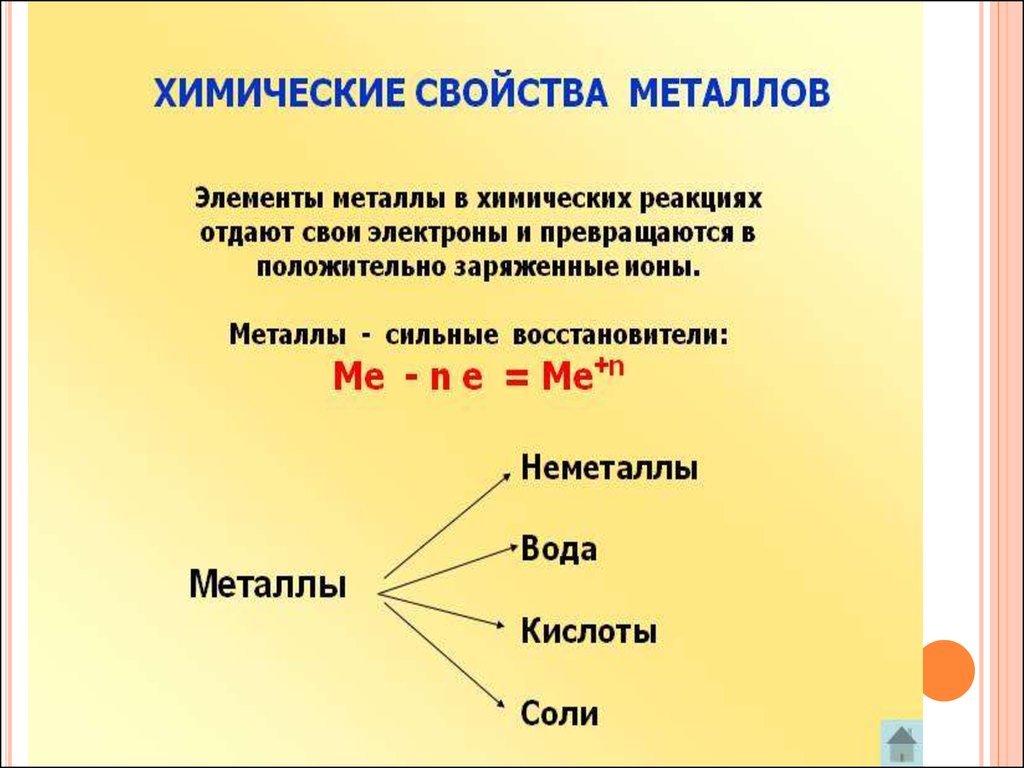
24. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
25.
26.
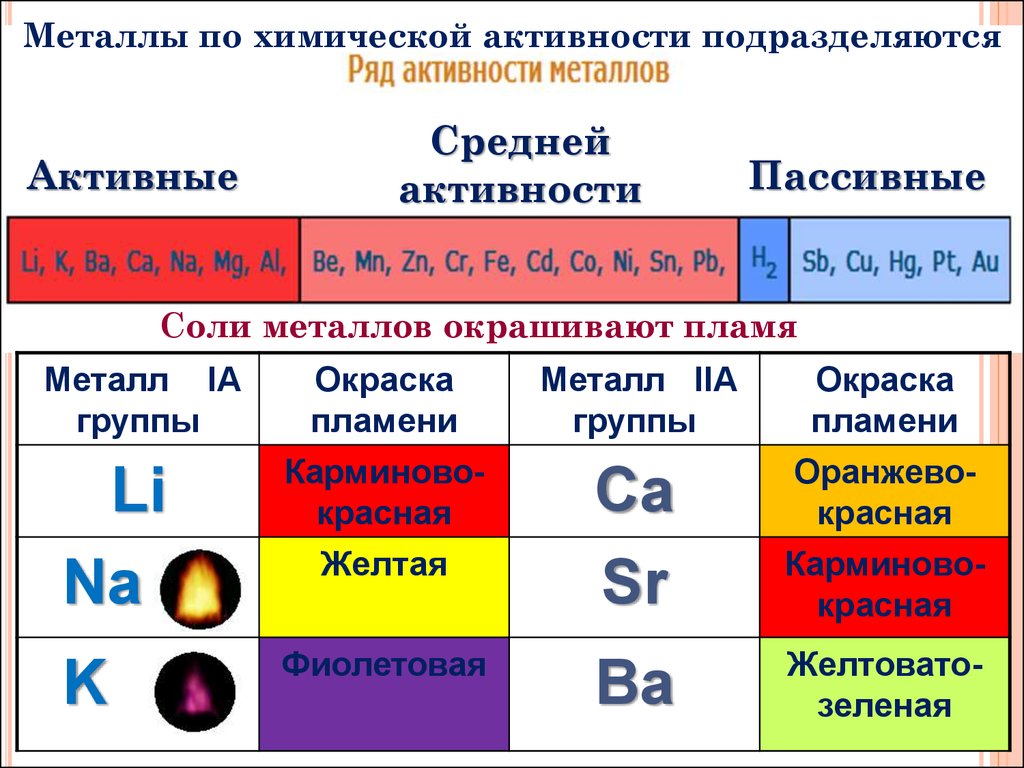
Металлы по химической активности подразделяютсяАктивные
Средней
активности
Пассивные
Соли металлов окрашивают пламя
Металл IА
группы
Окраска
пламени
Li
Na
Карминовокрасная
Желтая
K
Фиолетовая
Металл IIА
группы
Окраска
пламени
Ca
Sr
Оранжевокрасная
Карминовокрасная
Ba
Желтоватозеленая
27. Какие металлы более активные?
КАКИЕ МЕТАЛЛЫ БОЛЕЕ АКТИВНЫЕ?Каждый предыдущий активнее
последующего в ряду активности металлов
Каждый предыдущий вытесняет
последующие из растворов солей
Вытесняются
активными
металлами
28.
Все ли металлы реагируют с кислотами?С кислотами реагируют только металлы, стоящие в
ряду активности металлов до водорода.
реагируют
не
реагируют
Все ли металлы реагируют с водой?
Без
нагревания с
образованием
щелочей и
вытеснением
водорода
При нагревании с
образованием оксидов не
реагируют
и вытеснением
водорода
29. Металлы взаимодействуют с водой
Металлы реагируют с кислородом• 2Mg + O2→2MgO
Оксид магния основный
Реакция окисления, соединения, ОВР
Mg – восстановитель, кислород-окислитель
Металлы реагируют с неметаллами
• 3Br2+ 2Al→2AlBr3
бромид алюминия - соль
Реакция соединения, ОВР
Al – восстановитель, бром-окислитель
МЕТАЛЛЫ ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ
• 2Na + 2H2O→2NaOH+ H2↑
гидроксид натрия
Реакция замещения, ОВР
Na – восстановитель, катион водород-окислитель
30.
Zn + H₂O = ZnO + H₂оксид цинка
Реакция ОВР, атомы цинка - восстановители, ионы
водорода - окислители
Реакция замещения.
МЕТАЛЛЫ РЕАГИРУЮТ С СОЛЯМИ
Fe
+ CuSO₄ = FeSO₄ + Cu
Реакция ОВР, атомы железа - восстановители,
ионы меди - окислители
31.
Металлы реагируют с растворами кислотMg + 2 HCl = MgCl₂ + H₂↑
ОВР, атомы магния - восстановители; ионы водорода
- окислители
Cu + HCl ≠
Концентрированная серная кислота:
Zn + H₂SO₄ = ZnSO₄ + H₂O + S↓
составьте электронный баланс, какой
коэффициент у окислителя?
Сu + 2H₂SO₄ = CuSO₄ + 2H₂O + SO₂↑
32.
Реакциис азотной кислотой:
Cu + HNO₃ → Cu(NO₃)₂ + H₂O + NO₂↑
какой коэффициент у восстановителя?
33. Итоги: «свойства металлов»
ИТОГИ: «СВОЙСТВА МЕТАЛЛОВ»Металлы
реагируют с
1. С неметаллами с образованием соли
2.
С водой (металлы стоящие до водорода)
3.
С кислотами (металлы стоящие до водорода)
5.
С солями менее активных металлов
6.
С кислородом с образованием основных оксидов
34.
ТЕСТ1. Какой металл никогда не вытесняет водород из воды?
а) алюминий
б) цинк
в) кальций
г)ртуть
2. С какими растворами солей будут взаимодействовать
металлы?
а) Al+ Hg(NO3 )2
б) Zn+Na2SO4
в) Mg+KNO3
г) Сu+ FeCl3
3. Какой металл не вытесняет водород из кислот?
а) железо
б) платина
в) свинец
г) цинк
4. Между раствором какой соли и металлом произойдет
химическая реакция?
а) алюминий + нитрат калия б) железо + хлорид меди(II)
в) золото + нитрат серебра
г) цинк + нитрат натрия
ОТВЕТ: 1 -
Г
2 -
А
3 -
Б
4 -
Б
35.
5. Между какими веществами возможна химическаяреакция:
а) медью и водой
б) натрием и хлором
в) золотом и водородом г) железом и хлоридом натрия
6. Установите соответствие:
РЕАГЕНТЫ
ПРОДУКТЫ РЕАКЦИИ
А. Ca + H₂SO₄ →
1.
Б. Cu + Cl₂ →
2. → Ag + HgNO₃
В. Hg + AgNO₃ →
3. → H₂ + CaSO₄
Г. Li + O₂ →
4.
→ Li₂O
5. → Li₂O₂
6.
ОТВЕТ:
5 - б;
→ CuCl₂
→ CuCl
6: А – 3, Б - 1, В - 2, Г - 4
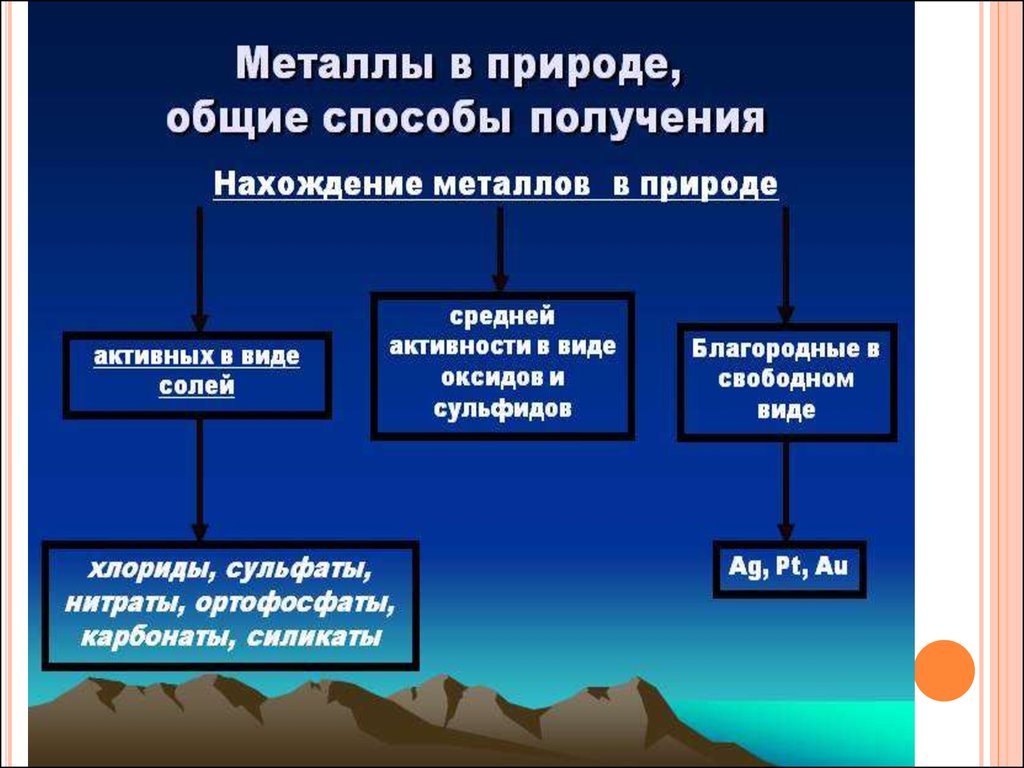
36. НАХОЖДЕНИЕ МЕТАЛЛОВ В ПРИРОДЕ И ПОЛУЧЕНИЕ
37.
38.
39.
40.
МЕТОДЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ1. Пирометаллургия - восстановление металлов из
руд при высоких температурах
с помощью C, CO, H₂, Al, Mg
SnO₂ + 2C = Sn + 2CO↑
Cu₂O + C = 2Cu + CO↑
CuO + H₂↑ = Cu + H₂O
}
из ОКСИДОВ
a) 2ZnS + 3O₂ = 2ZnO + 2SO₂↑ } из
б) ZnO + C = Zn + CO↑
СУЛЬФИДОВ
Металлотермия:
TiO₂ + 2Mg = Ti + 2MgO
3MnO₂ + 4Al = 3Mn + 2Al₂O₃
41.
2. Гидрометаллургия – это восстановление металловиз их солей в растворе.
а) получение раствора соли
б) используют более активный металл или электролиз
а) CuO + H₂SO₄ = CuSO₄ + H₂O
б) CuSO₄ + Fe = Cu + FeSO₄
или электролизом
Так получают Zn, Ag, Mo, Au, U
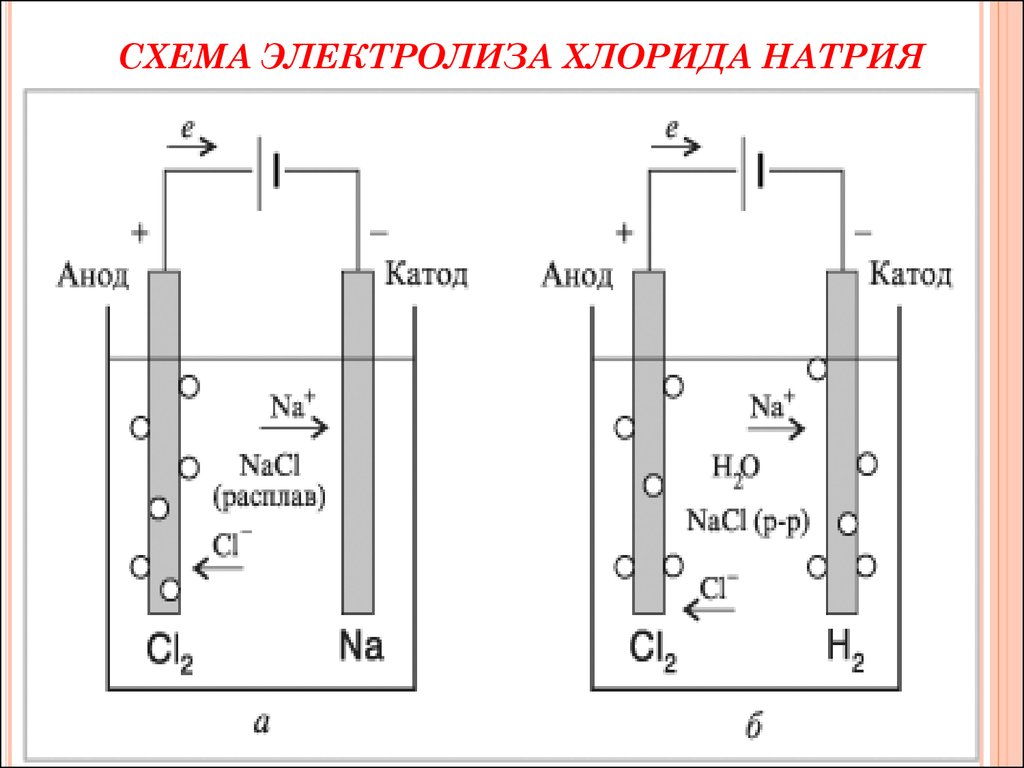
3.Электрометаллургия - восстановление металлов
в процессе электролиза растворов
или расплавов их соединений
42.
СХЕМА ЭЛЕКТРОЛИЗА ХЛОРИДА НАТРИЯ43.
44.
К⁻:Cu⁺² + 2e → Cu⁰↓
А⁺: 2Cl⁻ - 2 ∙ 1e → Cl⁰₂↑
CuCl₂ = Cu↓ + Cl₂↑
( раствор, расплав)
45.
1.Какой металл является самым распространенным вземной коре?
а) медь
б) железо
в) алюминий
г) натрий
2.Какие металлы встречаются в природе только в виде
соединений?
а) серебро, магний б) натрий, калий
в) ртуть, медь
3. Укажите промышленный способ получения натрия:
а) восстановление металла из оксида
б) электролиз расплава оксида
в) электролиз раствора хлорида натрия
г) электролиз расплава хлорида натрия
ОТВЕТ:
1 - б
2 - б
3 -
г
46.
As, B, ? , Ni, Zr, Mn, Ba, Cu, C , N, Sn, At47.
натриймагний
никель









































 Химия
Химия