Похожие презентации:
Структура периодической системы химических элементов
1.
Тема урока:«Структура периодической
системы химических элементов»
Cl2
O2
2.
Историческая справкаОткрыта 1 марта 1969 Д. И. Менделеевым
Является графическим отображением периодического закона
Известны более 400 вариантов, но самые используемые
короткий и длинный вариант
3.
1 марта 1869 года Менделеев сформулировалПериодический закон
“Свойства элементов, а также
образуемых ими простых и
сложных веществ находятся в
периодической зависимости от
зарядов ядер этих элементов”.
4.
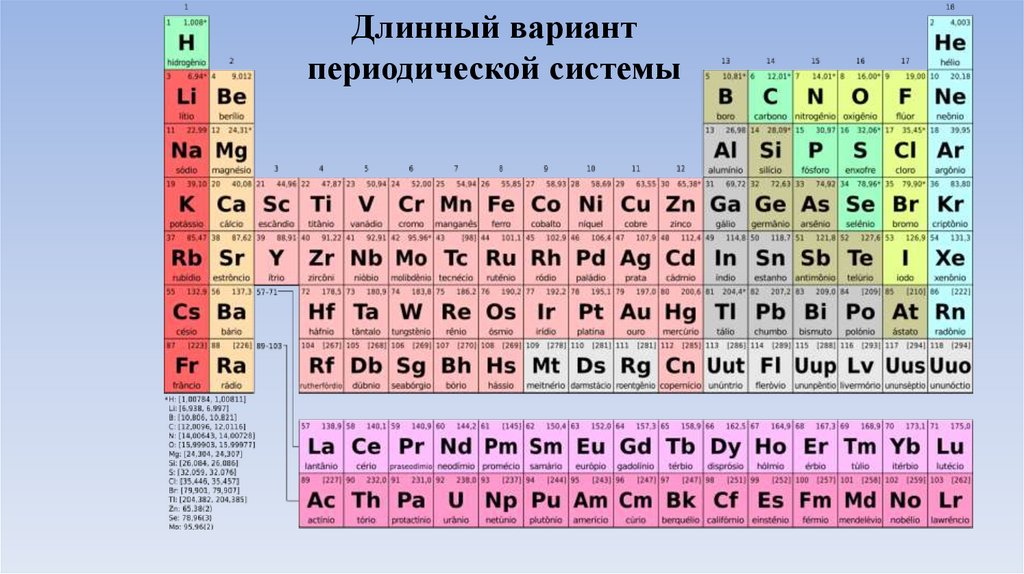
Длинный вариантпериодической системы
5.
6.
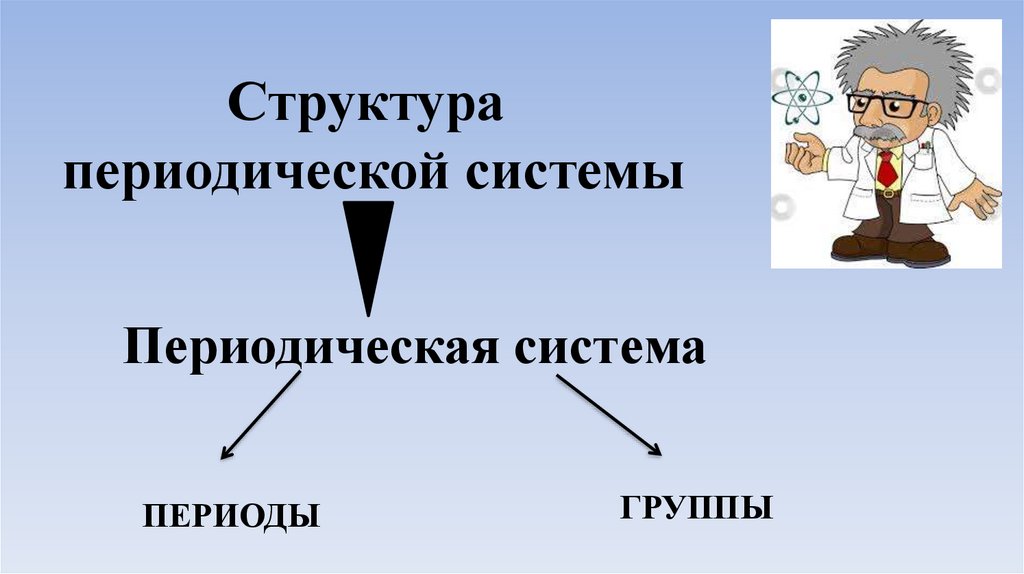
Структурапериодической системы
Периодическая система
ПЕРИОДЫ
ГРУППЫ
7.
ПериодыМалые
1- H-He
2- Li-Ne
3- Na-Ar
Большие
4- K-Kr
5-Rb-Xe
6-Cs-Rn
7-Fr- Mt
8.
Малые периоды- 1 ряд элементов(2,8-элементов)
Большие периоды-2 ряда элементов:
а) чётный ряд – только металлы
б) нечётный ряд
( 18,32-элемента)
9.
Периоды обозначаютсяарабскими цифрами-1, 2...
Номер периода показывает
количество энергетических
уровней в атоме.
10.
11.
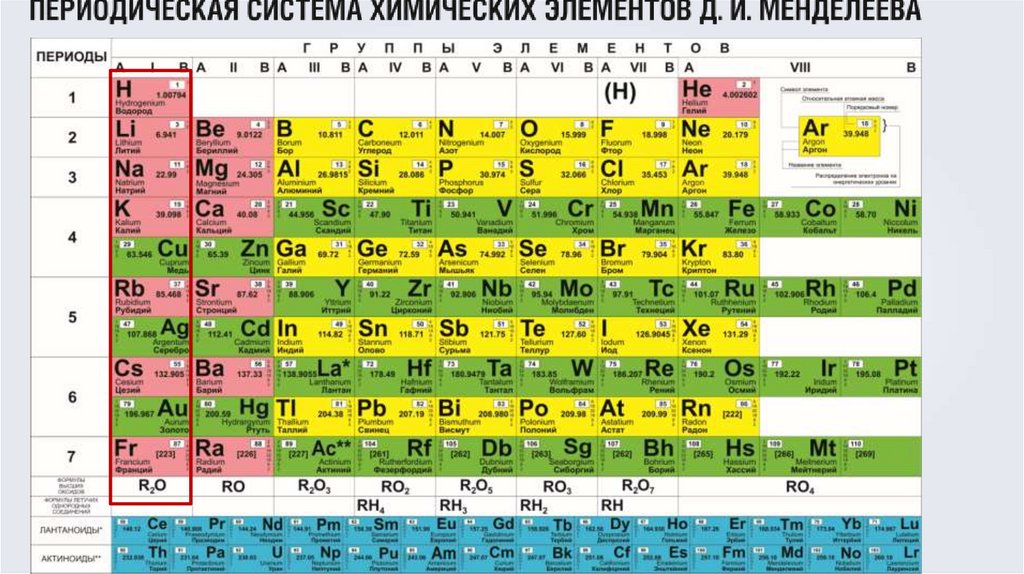
Период – это:а)горизонтальный ряд элементов,
б)расположенных в порядке возрастания
относительных атомных масс,
в)начинающийся щелочным металлом и
заканчивающийся инертным газом.
Исключение 1- период. ?
12.
13.
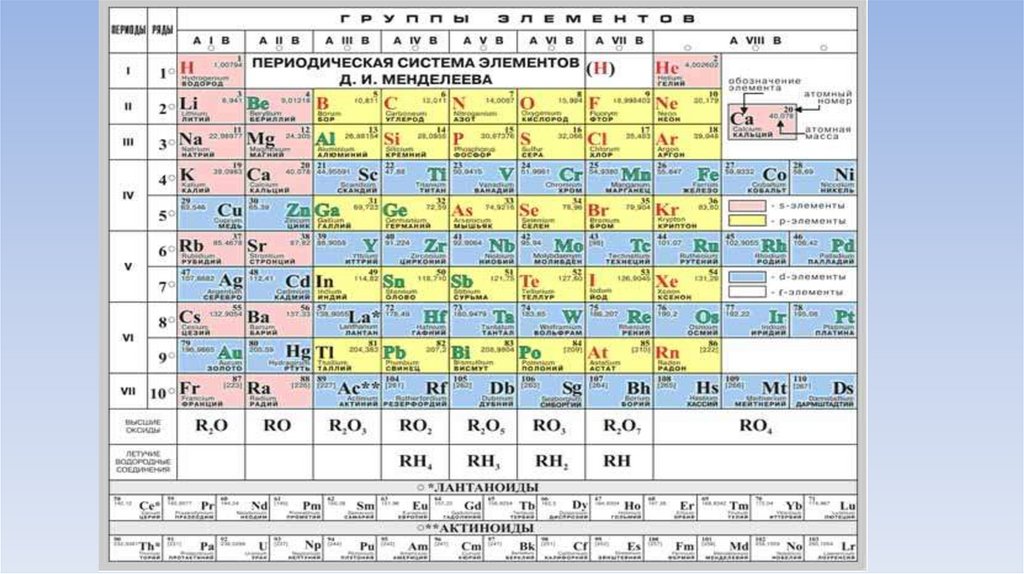
ГруппыВертикальные ряды сходных по свойствам
элементов.
• Всего 8
• Делятся на главные (A) и побочные (B)
Обозначаются римскими цифрами:
I,II,III,IV,V, VI. VII, VIII/
• Номер группы показывает:
а) количество эхлектронов на внешнем уровне
атомов ( для элементов главных подгрупп)
б)высшую валентность атома
14.
Периоды
малые
Группа-I
А-главная
подгруппа
1
H
2
Li
3
Na
4
K
Б-побочная
подгруппа
Cu
5
Rb
Ag
большие
6
Cs
Au
7
Fr
Rg
большие
15.
16.
17.
18.
19.
Домашнее задание1.Прочитать § 28
2. Дать характеристику химическим
элементам по положению в ПСХЭ
№ 17, № 20















 Химия
Химия








