Похожие презентации:
Аминокислоты и белки
1.
Лекция: «Аминокислоты и белки»1. Определение и классификация аминокислот
2. Изомерия, номенклатура аминокислот
3. Способы получения аминокислот
4. Физические и химические свойства
5. Качественные реакции на аминокислоты
6. Понятие, классификация и биологические
функции белков
7.Строение белка
8. Свойства белков
2.
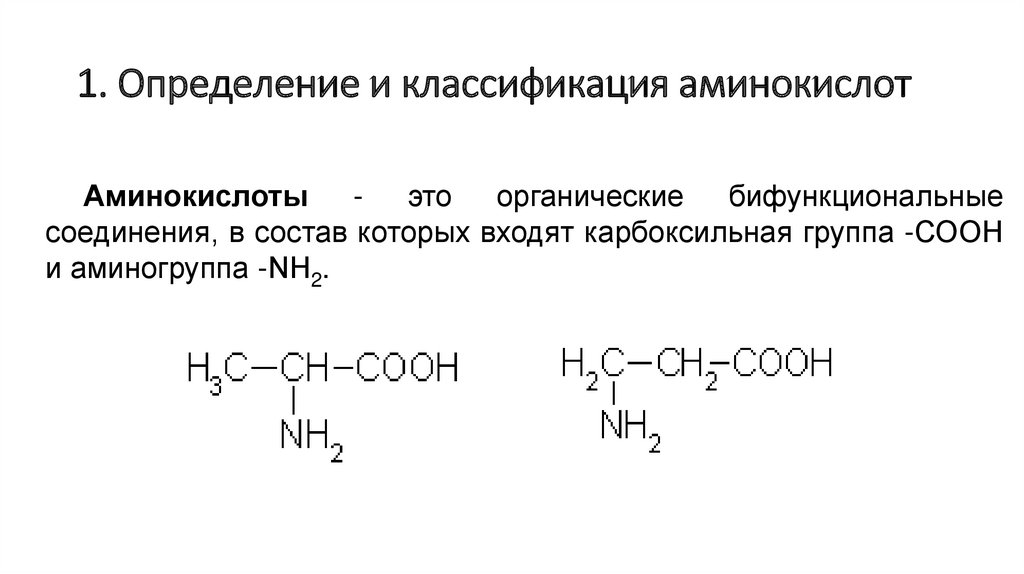
1. Определение и классификация аминокислотАминокислоты - это органические бифункциональные
соединения, в состав которых входят карбоксильная группа -СООН
и аминогруппа -NН2.
3.
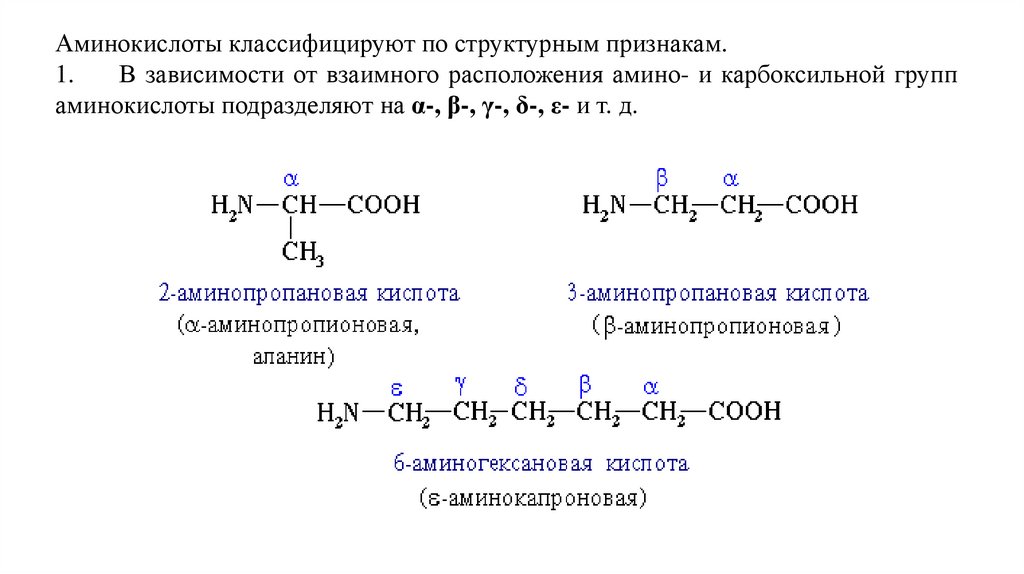
Аминокислоты классифицируют по структурным признакам.1.
В зависимости от взаимного расположения амино- и карбоксильной групп
аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
4.
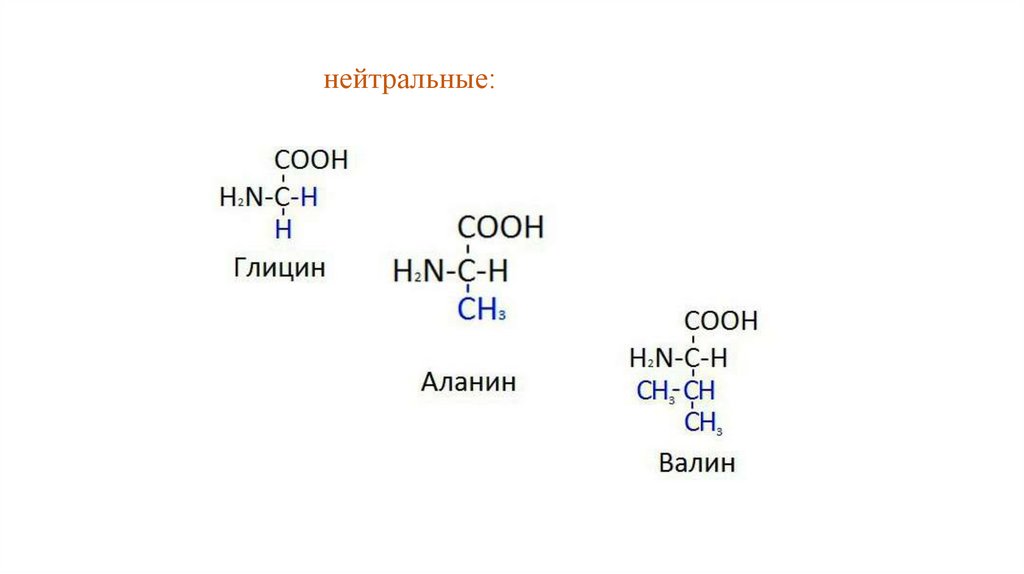
2.В зависимости от количества функциональных групп
различают кислые, нейтральные и основные:
кислые:
2.
В зависимости от
количества
функциональных групп
различают
кислые,
нейтральные
и
основные:
5.
нейтральные:6.
основные:основные
лизин
7.
3.По характеру углеводородного радикала различают алифатические
(жирные), ароматические, серосодержащие и гетероциклические
аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Примером ароматической аминокислоты может служить парааминобензойная
кислота:
Примером гетероциклической аминокислоты может служить триптофан –
незаменимая α- аминокислота:
8.
МетионинЦистеин
9.
Аминокислоты , синтезируемые в организме из кетокислот иоксикислот, называются заменимыми. Соответственно, аминокислоты,
которые организм не способен синтезировать, называются
незаменимыми. Незаменимые аминокислоты организм должен
получать с пищей.
Для разных животных и человека набор незаменимых
аминокислот неодинаков, он определяется видовой принадлежностью
организма, его возрастом и другими факторами.
Корма животных, не содержащие хотя бы одну
незаменимую аминокислоту, считаются неполноценными.
10.
11.
ПРИМЕНЕНИЕ1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых
построены все растительные и животные белки; аминокислоты,
необходимые для построения белков организма, человек и
животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после
тяжелых операций;
4) их используют для питания больных;
5) аминокислоты необходимы в качестве лечебного средства при
некоторых болезнях (например, глутаминовая кислота используется
при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для
подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая
кислоты образуют синтетические волокна – капрон и энант.
12.
2. Изомерия, номенклатура аминокислотПо систематической номенклатуре названия аминокислот образуются
из названий соответствующих кислот прибавлением приставки амино- и
указанием места расположения аминогруппы по отношению к
карбоксильной группе. Нумерация углеродной цепи с атома углерода
карбоксильной группы.
13.
Часто используется также другой способ построения названийаминокислот, согласно которому к тривиальному названию карбоновой
кислоты добавляется приставка амино- с указанием положения
аминогруппы буквой греческого алфавита.
Пример:
14.
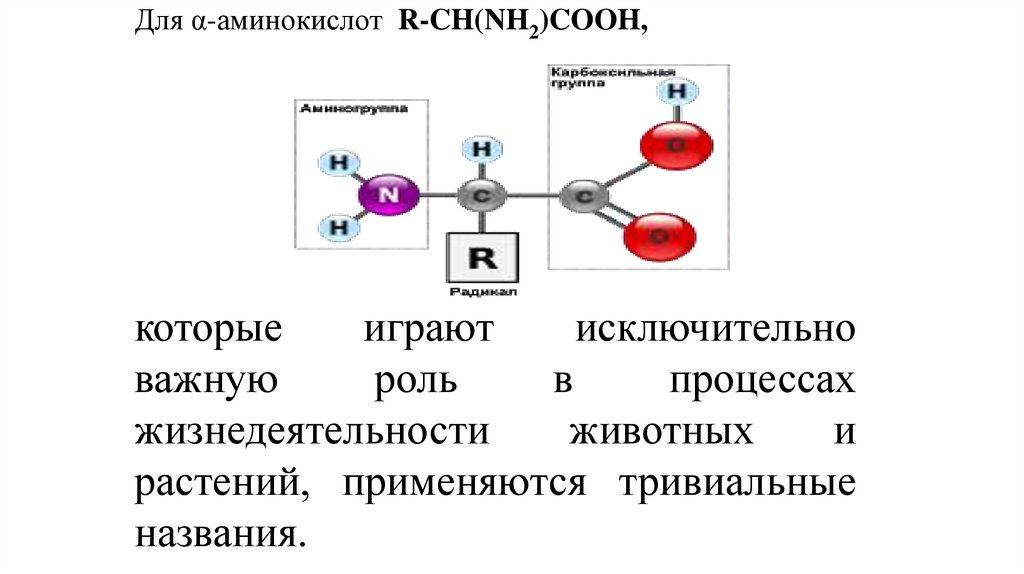
Для α-аминокислот R-CH(NH2)COOH,которые
играют
исключительно
важную
роль
в
процессах
жизнедеятельности
животных
и
растений, применяются тривиальные
названия.
15.
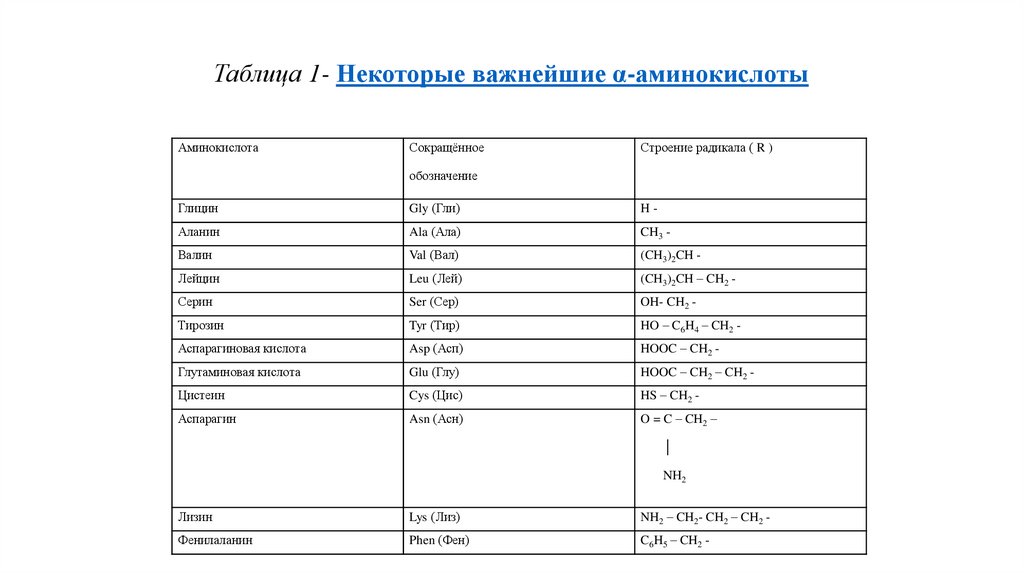
Таблица 1- Некоторые важнейшие α-аминокислотыАминокислота
Сокращённое
Строение радикала ( R )
обозначение
Глицин
Gly (Гли)
H-
Аланин
Ala (Ала)
CH3 -
Валин
Val (Вал)
(CH3)2CH -
Лейцин
Leu (Лей)
(CH3)2CH – CH2 -
Серин
Ser (Сер)
OH- CH2 -
Тирозин
Tyr (Тир)
HO – C6H4 – CH2 -
Аспарагиновая кислота
Asp (Асп)
HOOC – CH2 -
Глутаминовая кислота
Glu (Глу)
HOOC – CH2 – CH2 -
Цистеин
Cys (Цис)
HS – CH2 -
Аспарагин
Asn (Асн)
O = C – CH2 –
│
NH2
Лизин
Lys (Лиз)
NH2 – CH2- CH2 – CH2 -
Фенилаланин
Phen (Фен)
C6H5 – CH2 -
16.
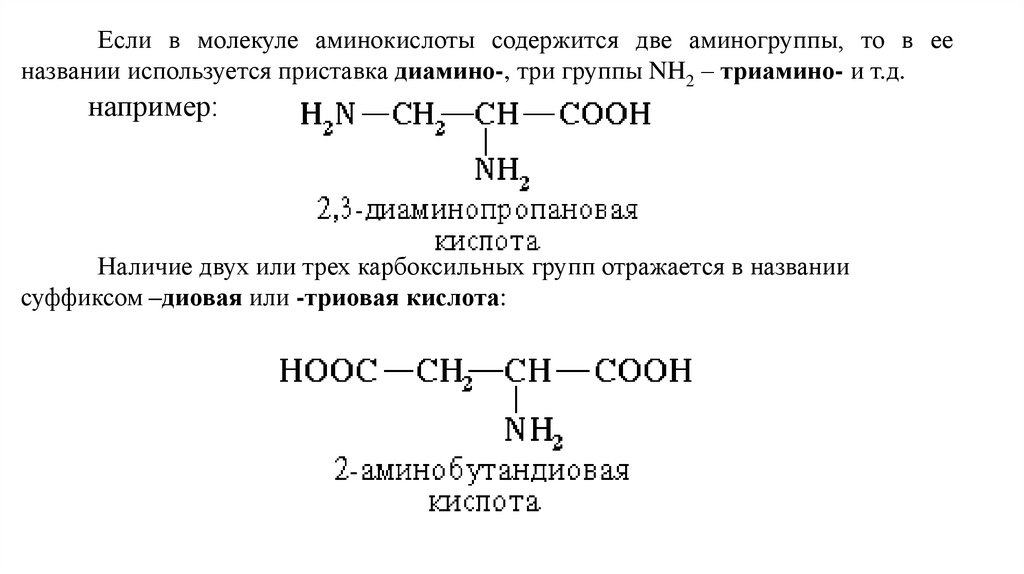
Если в молекуле аминокислоты содержится две аминогруппы, то в ееназвании используется приставка диамино-, три группы NH2 – триамино- и т.д.
например:
Наличие двух или трех карбоксильных групп отражается в названии
суффиксом –диовая или -триовая кислота:
17.
Виды изомерии1. Изомерия углеродного скелета
2. Изомерия положения функциональных групп
18.
3. Оптическая изомерияОптическую изомерию имеют все α-аминокислоты, кроме
глицина NН2-CH2-COOH.
19.
3. Способы получения аминокислот20.
3. Циангидринный метод:Важной реакцией получения α-аминокислот является действие
аммиака на циангидрины альдегидов и кетонов:
с последующим омылением аминонитрила в аминокислоту:
21.
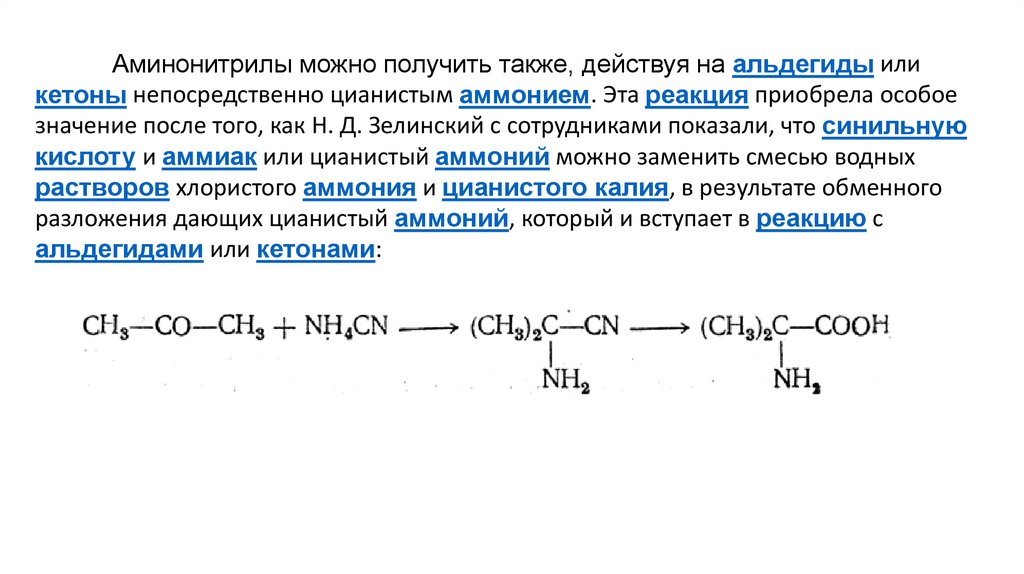
Аминонитрилы можно получить также, действуя на альдегиды иликетоны непосредственно цианистым аммонием. Эта реакция приобрела особое
значение после того, как Н. Д. Зелинский с сотрудниками показали, что синильную
кислоту и аммиак или цианистый аммоний можно заменить смесью водных
растворов хлористого аммония и цианистого калия, в результате обменного
разложения дающих цианистый аммоний, который и вступает в реакцию с
альдегидами или кетонами:
22.
4. Восстановление нитрозамещенных карбоновых кислот:5. Микробиологический синтез:
Известны
микроорганизмы,
которые
в
процессе
жизнедеятельности продуцируют α - аминокислоты белков.
23.
4. Физические и химические свойстваФизические свойства:
Аминокислоты представляют собой кристаллические вещества с
высокими (выше 250°С) температурами плавления, которые мало
отличаются у индивидуальных аминокислот и поэтому нехарактерны.
Плавление сопровождается разложением вещества. Аминокислоты хорошо
растворимы в воде и нерастворимы в органических растворителях, чем
они похожи на неорганические соединения. Многие аминокислоты
обладают сладким вкусом.
24.
Химические свойства:Аминокислоты амфотерные органические соединения, для них характерны кислотноосновные свойства.
I. Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что
молекулы аминокислот существуют в виде внутренних солей, которые образуются за
счет переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную
среду в зависимости от количества функциональных групп.
25.
2. Поликонденсация → образуются полипептиды (белки):При взаимодействии двух α-аминокислот образуется дипептид.
3. Декарбоксилирование:
NH2-CH2-COOH
декарбоксилаза
→
NH2-CH3 + CO2↑
26.
4. Дезаминирование: в организме идет под действием фермента гидрогеназа27.
5. Переаминирование:аминотрансфераза
28.
II. Свойства карбоксильной группы (кислотность)1. С основаниями:
NH2-CH2-COOH + NaOH
→
NH2-CH2-COONa + H2O
натриевая соль 2-аминоуксусной кислоты
2. Со спиртами (реакция этерификации):
NH2-CH2-COOH + CH3OH
→ NH2-CH2-COOCH3 + H2O
метиловый эфир
2- аминоуксусной кислоты
HCl(газ)
29.
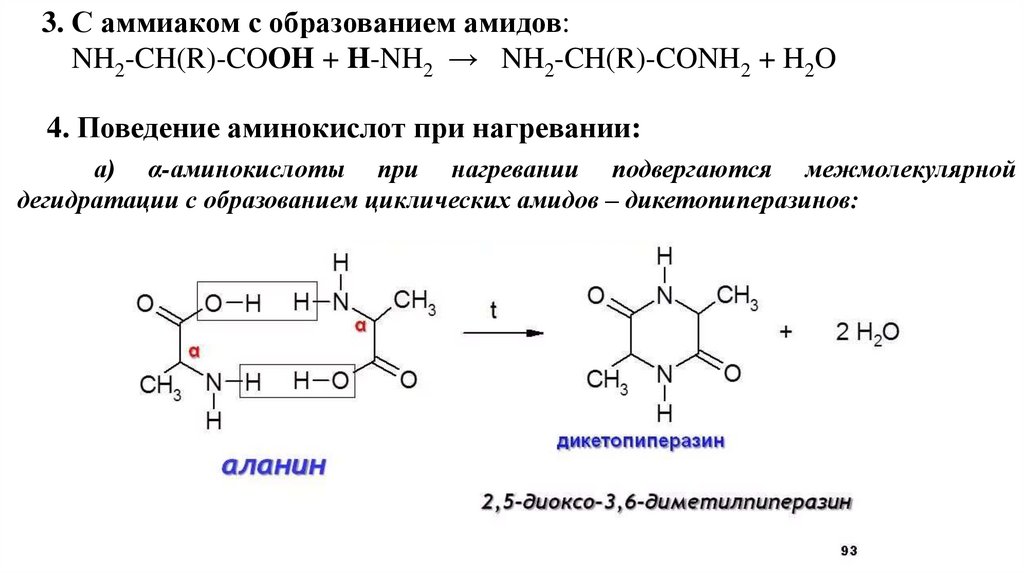
3. С аммиаком с образованием амидов:NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
4. Поведение аминокислот при нагревании:
а) α-аминокислоты при нагревании подвергаются межмолекулярной
дегидратации с образованием циклических амидов – дикетопиперазинов:
30.
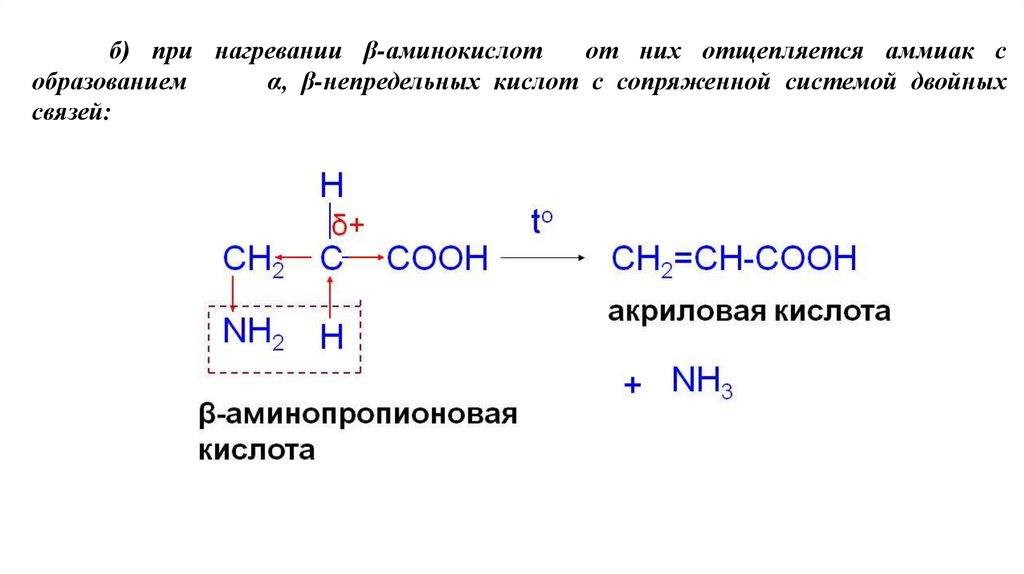
б) при нагревании β-аминокислотот них отщепляется аммиак с
образованием
α, β-непредельных кислот с сопряженной системой двойных
связей:
31.
в) нагревание γ-, δ-, ε- и т.д. аминокислот сопровождается внутримолекулярнойдегидратацией и образованием внутренних циклических амидов – лактамов:
Практическое значение имеет внутримолекулярное взаимодействие функциональных
групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам
(полупродукт для получения капрона):
32.
III. Свойства аминогруппы (основность)1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl или HOOC-CH2NH2·HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить
количество аминокислоты (метод Ван-Слайка)
33.
5. Качественные реакции1. Все аминокислоты окисляются нингидрином с образованием
продуктов сине-фиолетового цвета!
34.
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексныесоли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для
обнаружения α-аминокислот.
2. С ионами тяжелых металлов α-аминокислоты образуют
внутрикомплексные соли. Комплексы меди (II), имеющие
глубокую синюю окраску, используются для обнаружения αаминокислот.
35.
2. С ионами тяжелых металлов αаминокислотыобразуют
внутрикомплексные
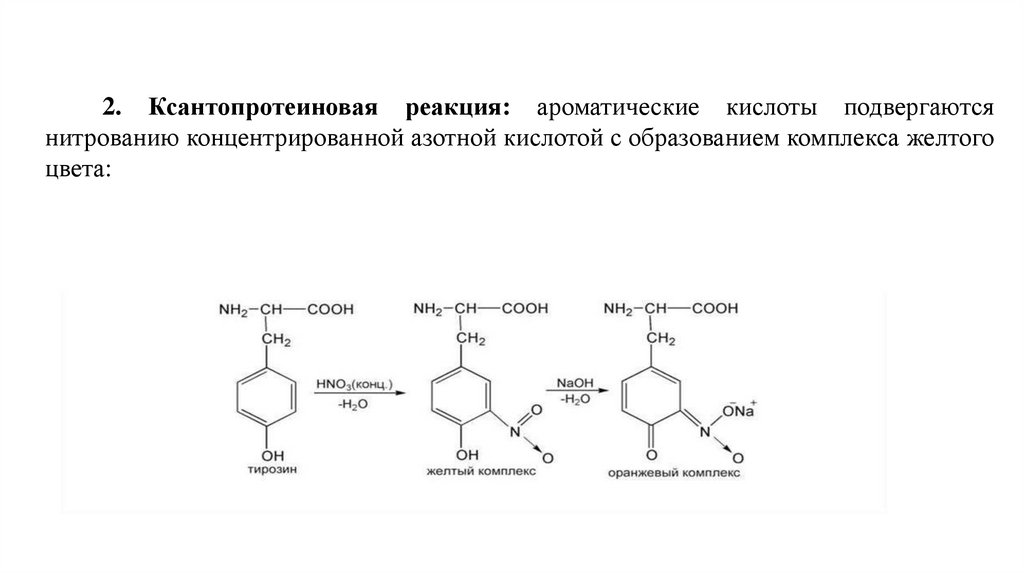
2. Ксантопротеиновая
реакция: ароматические
кислоты подвергаются
нитрованию концентрированной азотной кислотой с образованием комплекса желтого
соли.
Комплексы
меди
(II),
имеющие
глубокую
цвета:
синюю
окраску,
используются
для
обнаружения α-аминокислот.
36.
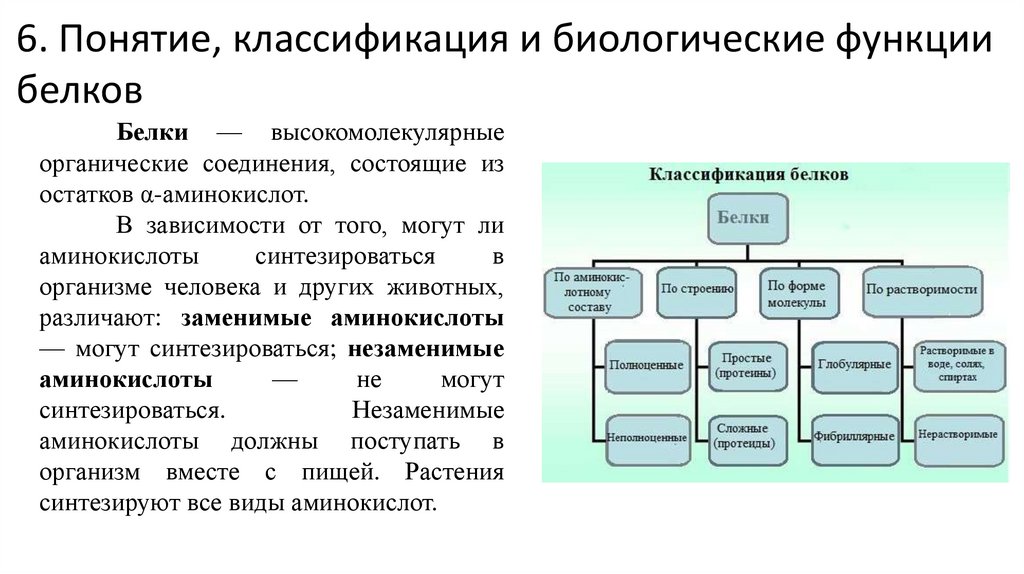
6. Понятие, классификация и биологические функциибелков
Белки — высокомолекулярные
органические соединения, состоящие из
остатков α-аминокислот.
В зависимости от того, могут ли
аминокислоты
синтезироваться
в
организме человека и других животных,
различают: заменимые аминокислоты
— могут синтезироваться; незаменимые
аминокислоты
—
не
могут
синтезироваться.
Незаменимые
аминокислоты должны поступать в
организм вместе с пищей. Растения
синтезируют все виды аминокислот.
37.
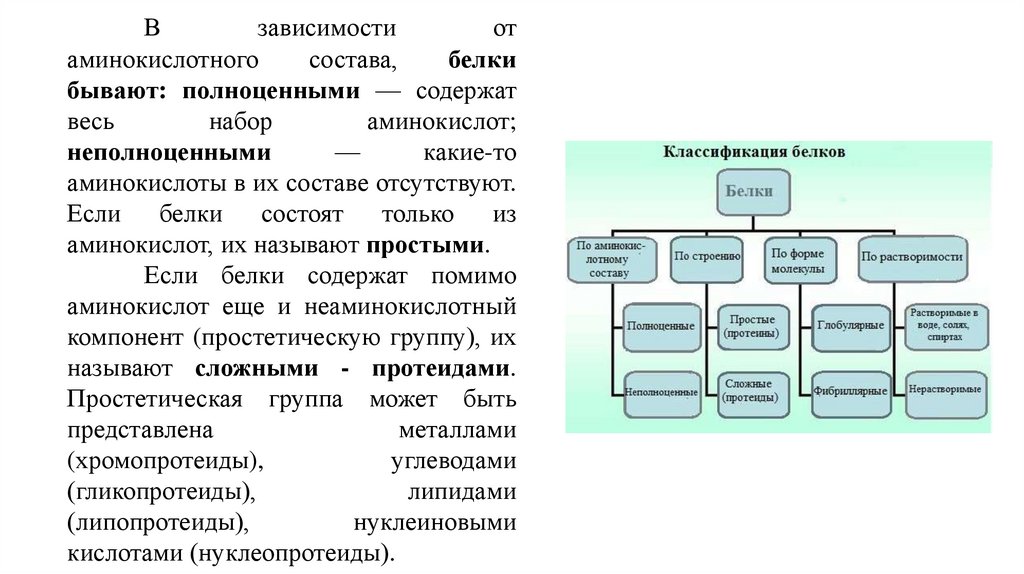
Взависимости
от
аминокислотного
состава,
белки
бывают: полноценными — содержат
весь
набор
аминокислот;
неполноценными
—
какие-то
аминокислоты в их составе отсутствуют.
Если белки состоят только из
аминокислот, их называют простыми.
Если белки содержат помимо
аминокислот еще и неаминокислотный
компонент (простетическую группу), их
называют сложными - протеидами.
Простетическая группа может быть
представлена
металлами
(хромопротеиды),
углеводами
(гликопротеиды),
липидами
(липопротеиды),
нуклеиновыми
кислотами (нуклеопротеиды).
38.
По растворимости протеины делятся на:1) альбумины – водорастворимые белки преимущественно животного происхождения. К
ним относятся альбумины сыворотки крови, лактальбумин молока, овальбумин яичного
белка, миоальбумин мышц животных, а также лейкозин пшеницы, ржи и ячменя,
легуменин гречихи и сои, рицин касторовых бобов. Характерным свойством
альбуминов является их высокая адсорбционная способность. Альбумины связывают
токсичные соединения – алкалоиды, тяжелые металлы, билирубин. Благодаря высокой
гидрофильности альбумины играют важную роль в поддержании осмотического
давления крови (80% осмотическое давление крови от всех других сывороточных
белков). Альбумины выполняют в организме питательную, транспортную,
обезвреживающую функции;
2) глобулины – не растворимы в воде, но растворимы в слабых растворах солей. В горохе
содержится белок легумин, в сое – глиципин, в семенах фасоли - фазеолин, в картофеле
- туберин, в крови - фибриноген, в молоке - лактоглобулин, в яйцах - яичный глобулин, в
конопле – эдестин. Глобулины в организме выполняют питательную, защитную,
транспортную функции;
39.
3) протамины – хорошо растворяются в воде, кислой среде, но осаждаются в щелочнойсреде. Выполняют главным образом структурную функцию, поэтому и присутствуют в
клетках не способных к делению;
4) проламины – спирторастворимые белки. К ним относятся глиадин (белок пшеницы,
ржи), гордеин (белок ячменя), зеин (белок кукурузы), авенин (белокян овса), эдестин (белок
конопли). Проламины практически отсутствуют в бобовых и масличных культурах;
5) гистоны – растворимы в воде и разбавленных кислотах, нерастворимы в водном аммиаке
и не свертываются при нагревании, содержатся в ядрах клеток высших организмов в
соединении с нуклеиновыми кислотами, образуя нуклеопротеиды, играют важную роль в
регуляции генной активности;
6) глютелины – растворяются в разбавленных кислотах и щелочах, не растворяются в воде,
спирте и разбавленных солевых растворах. Это белки растительного происхождения,
имеющие высокую питательную ценность. Они присутствуют в семенах злаковых культур
вместе с проламинами.
7) протеиноиды – белки опорных тканей (костей, хрящей, сухожилий, связок). Они
представлены коллагеном, эластином и кератином, не растворяются в воде, солевых
растворах, разведенных кислотах и щелочах. Не перевариваются в желудочно-кишечном
тракте большинства животных и человека и поэтому не могут выполнять питательную
40.
Ссылка на фильм https://himija-online.ru/organicheskayaximiya/belki/funkcii-belkov-v-organizme.html41.
1. Каталитическая (ферментативная) функцияАбсолютно все биохимические процессы в организме протекают в присутствии
катализаторов – ферментов. Они ускоряют реакции в миллионы раз, причем для каждой
реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются
биологическими катализаторами. Например, фермент пепсин расщепляет белки в процессе
пищеварения.
2. Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать)
различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы
металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины,
гормоны и др. Например, альбумины крови транспортируют липиды и высшие жирные
кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом,
превращаясь в оксигемоглобин. Достигая с током крови органов и тканей,
оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения
окислительных процессов в тканях.
42.
3. Защитная функцияЗащитную функцию выполняют специфические белки (антитела —
иммуноглобулины), которые вырабатываются иммунной системой организма. Они
обеспечивают физическую, химическую и иммунную защиту организма путем
связывания и обезвреживания веществ, поступающих в организм или появляющихся в
результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови
(образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки.
Интерфероны — универсальные противовирусные белки.
4. Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит
данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных
сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве,
сокращение и расслабление сердца, движение других внутренних органов.
43.
5. Структурная функцияБелки играют большую роль в формировании всех клеточных структур. Из них
построены опорные, мышечные, покровные ткани. Некоторые из них (коллаген
соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов,
фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи. В
комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных
образований.
6. Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам, которые регулируют различные
физиологические процессы. Например, инсулин регулирует содержание глюкозы в крови.
При недостатке инсулина в организме возникает заболевание, известное как сахарный
диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза,
предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев
находится белок резилин, обладающий почти идеальной эластичностью. В одном из
африканских растений синтезируется белок монеллин с очень сладким вкусом.
44.
7. Питательная (запасная) функция осуществляется резервными белками, которыезапасаются в качестве источника энергии и вещества. Например: казеин, яичный
альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат
источником питания для новорожденного.
8. Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану,
способны изменять свою структуру под воздействием внешней среды. Так происходит
прием сигналов извне и передача информации в клетку. Например, действие света на
сетчатку
глаза
воспринимается
фоторецептором
родопсином.
Рецепторы,
активизируемые низкомолекулярными веществами типа ацетилхолина, передают
нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников
энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические
нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
45.
7.Строение белкаБелки имеют 4 основных структуры: первичную, вторичную, третичную,
четвертичную:
46.
1. Под первичной структурой понимают последовательность аминокислотных остатковв полипептидной цепи. Она уникальна для любого белка и определяет его форму,
свойства и функции. Значительное совпадение первичной структуры характерно для
белков, выполняющих сходные функции. Замена всего лишь одной аминокислоты в
одной из цепей может изменить функцию молекулы белка. Например, замена
глутаминовой кислоты на валин приводит к образованию аномального гемоглобина и
к заболеванию, которое называется серповидноклеточная анемия:
Симптомы: потеря трудоспособности,
постоянная
отдышка,
учащенное
сердцебиение, пониженный иммунитет.
Одним из признаков серповидноклеточной
анемии
является
желтизна
кожных
покровов.
2. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль
(имеет вид растянутой пружины). Витки спирали укрепляются водородными связями,
возникающими между карбоксильными группами и аминогруппами. Практически все СОи NН-группы принимают участие в образовании водородных связей.
47.
3. Третичная структура – укладка полипептидных цепей в глобулы, возникающая врезультате возникновения химических связей (водородных, ионных, дисульфидных) и
установления гидрофобных взаимодействий между радикалами аминокислотных
остатков.
4. Четвертичная структура характерна для сложных белков, молекулы которых
образованы двумя и более глобулами.
48.
Утрата белковой молекулой своей природной структуры называетсяденатурацией. Она может возникнуть при воздействии температуры, химических
веществ, при нагревании и облучении.
Если при денатурации не нарушены первичные структуры, то при
восстановлении нормальных условий белок способен воссоздать свою структуру.
Этот процесс носит название ренатурация.
Следовательно, все особенности строения белка определяются первичной
структурой!
49.
8. Свойства белков1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как
молекула любого белка содержит на одном конце группу -NH2, а на другом конце –
группу -СООН. Так, при действии щелочей белок реагирует в форме аниона –
соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет
свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное
свойство белков, т.е. способность связывать как кислоты, так и основания, и
поддерживать постоянное значение рН различных систем живого организма.
50.
2. Денатурация белка (необратимое осаждение, свертывание)Денатурация – это разрушение вторичной и третичной структуры белка
(полное или частичное) и изменение его природных свойств с сохранением первичной
структуры белка. Сущность денатурации белка сводится к разрушению связей,
обусловливающих вторичную и третичную структуры молекулы (водородных, солевых
и других мостиков). А это приводит к дезориентации конфигурации белковой
молекулы.
Денатурация бывает обратимой и необратимой. Обратимая денатурация
белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов,
как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой
температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+,
Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при
варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
51.
https://himija-online.ru/videoopyty-2/svertyvanie-belkov-pri-nagrevanii.htmlСсылки на видео по денатурации:
https://himija-online.ru/videoopyty-2/osazhdenie-belkov-solyami-tyazhelyx-metallov.html
https://himija-online.ru/videoopyty-2/osazhdenie-belkov-spirtom.html
3. Гидролиз белков - это необратимое разрушение первичной структуры в
кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный
состав белков.
Переваривание белков в организме по своей сути представляет
ферментативный гидролиз белковых молекул. В лабораторных условиях и в
промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей.
Гидролиз белка имеет ступенчатый характер:
52.
4. Цветные (качественные) реакции на белки:а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные
кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают
желтое окрашивание при действии концентрированной азотной кислоты.
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при
действии на них солей меди (II) в щелочном растворе.
Ссылка на видео опыт ы https://himija-online.ru/videoopyty-2/kachestvennye-reakcii-nabelki-biuretovaya-i-ksantoproteinovaya.html
53.
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Ссылка на видеоопыт: https://himija-online.ru/videoopyty-2/kachestvennoe-opredelenie-azota-v-organicheskixsoedineniyax.html









































 Химия
Химия








