Похожие презентации:
Углерод. Оксиды углерода
1.
Углеродpptcloud.r
2.
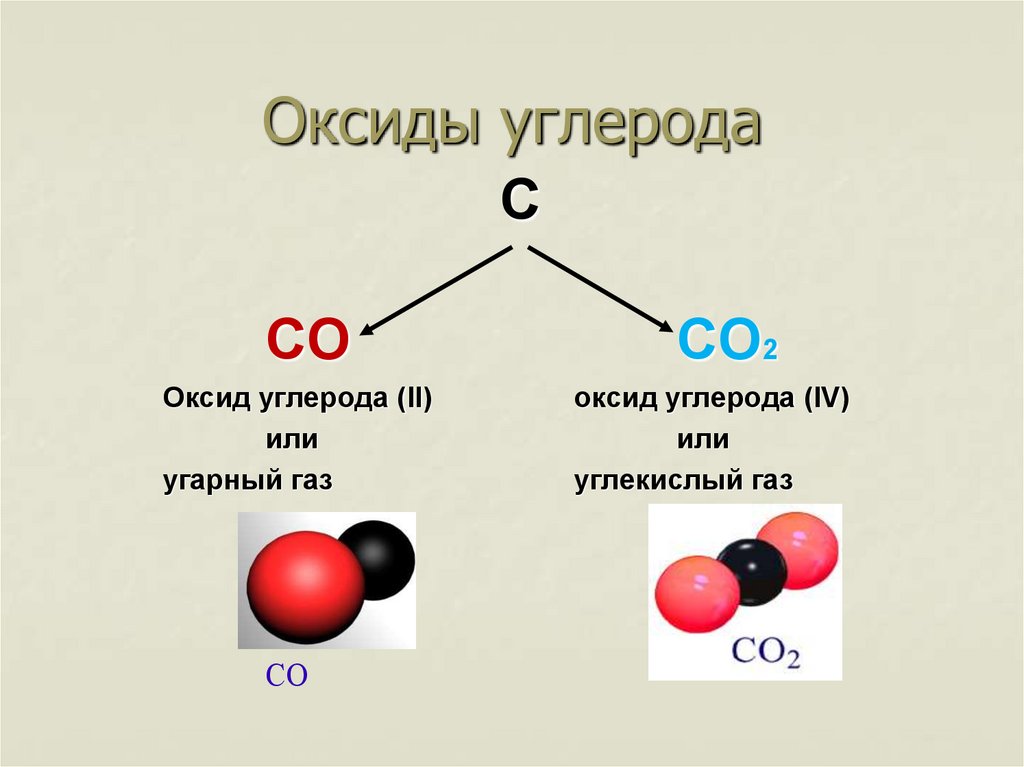
Оксиды углеродаС
СО
СО2
Оксид углерода (II)
или
угарный газ
оксид углерода (IV)
или
углекислый газ
СО
3.
Сравнение оксидов углерода..
Признаки сравнения
Оксид углерода (II)
Оксид углерода (IV)
Формула и название
СО (угарный газ)
СО2 (углекислый газ)
Получение
2С + О2 = 2СО
(недостаток О2 )
СО2 + С = 2СО
С + О2 = СО2 (при полном горении С)
С + 2СuО = СО2 + 2Си
CaCO3 + 2HCl = CaCI2 + CO2 + H2O.
CaCO3 = CaO + CO2 .
Физические свойства Бесцветный газ, без запаха, Бесцветный газ, слегка кисловатый на
плохо растворимый в воде. вкус, в 1,5 раза тяжелее воздуха. Растворим
в воде.
1. Не поддерживает горение.
Химические свойства 1.Горит синим пламенем
2. Горение магния в среде углекислого газа
2СО+ О2 =2СО2 +Q
2. Восстанавливает металлы СО2 + 2М g = 2М g О +С
Окислитель
СО +СuО =Cu +CO2
восстановитель
3. Взаимодействие со щелочами
2СО+ Н2 =С+ Н2О
окислитель
3.Не взаимодействует со
СО2 + 2NaOH =Na 2CO3 +H 2O
щелочами, основными
оксидами
СО2 +Са(ОН) 2 = СаСО3 + Н2 О
СО2 +NaOH =NaHCO3
4.С основными оксидами
СО2 +СaO=СaCO3
Физиологическое
Очень ядовит. Смертельная В малых дозах стимулирует дыхание, в
действие на организм концентрация угарного газа – больших – вызывает торможение
0,1%.
дыхательного центра.
Применение


 Химия
Химия








