Похожие презентации:
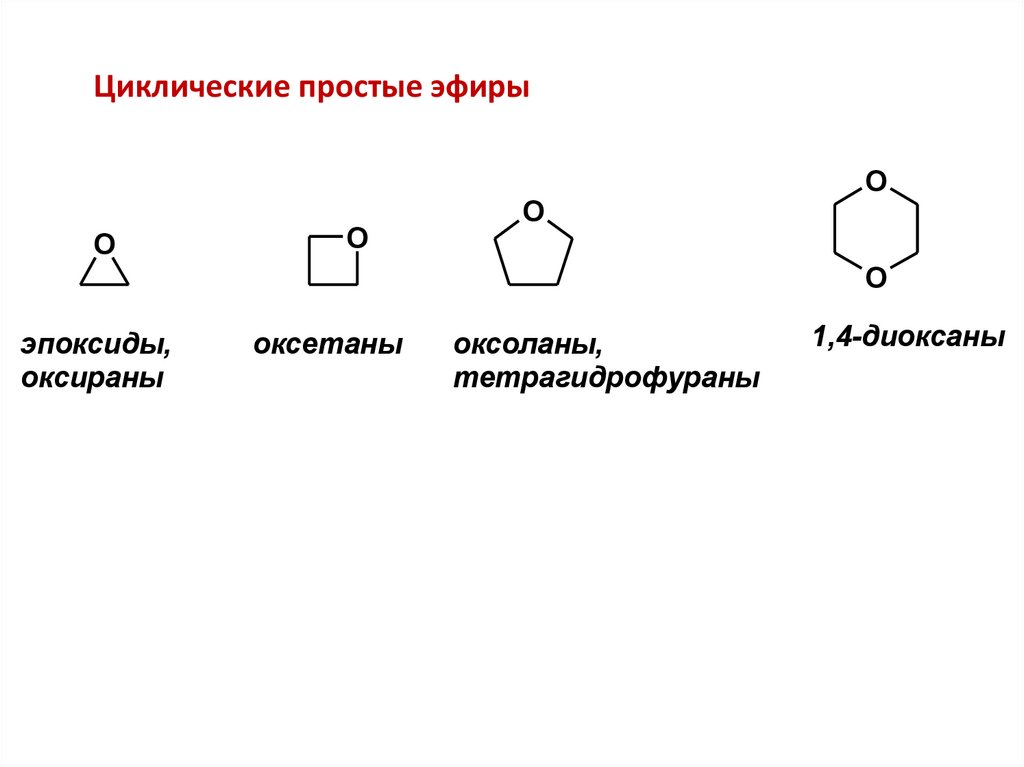
Циклические простые эфиры
1.
Циклические простые эфирыO
O
O
O
O
эпоксиды,
оксираны
оксетаны
оксоланы,
тетрагидрофураны
1,4-диоксаны
2.
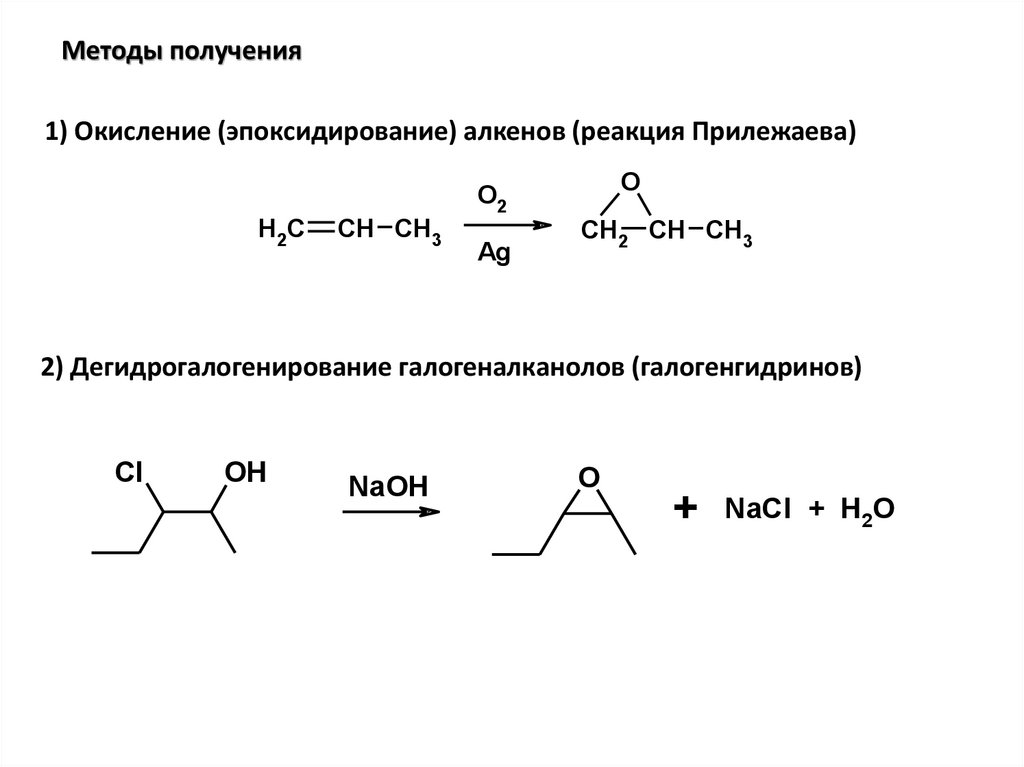
Методы получения1) Окисление (эпоксидирование) алкенов (реакция Прилежаева)
O
O2
H2C
CH CH3
Ag
CH2 CH CH3
2) Дегидрогалогенирование галогеналканолов (галогенгидринов)
Cl
OH
NaOH
O
+
NaCl + H2O
3.
Химические свойства эпоксидов (оксиранов)HO
CN Нитрил β-гидроксикислоты
HCN
CH3
HO
NH
CH3-NH2
HOH
O
HO
T, P
Аминоспирт
H2S
H
HO
+
CH3
HO
меркаптоспирт
диол
CH3OH
SH
OH
O
Простой эфир диола
4.
5.
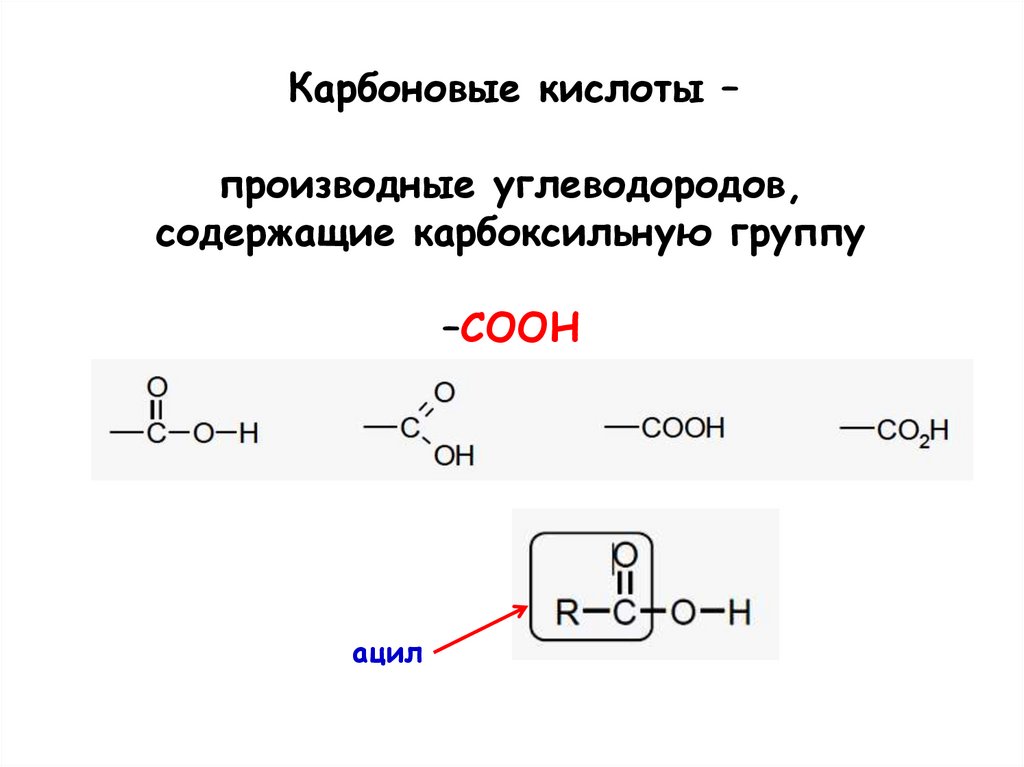
Карбоновые кислоты –производные углеводородов,
содержащие карбоксильную группу
–COOH
ацил
6.
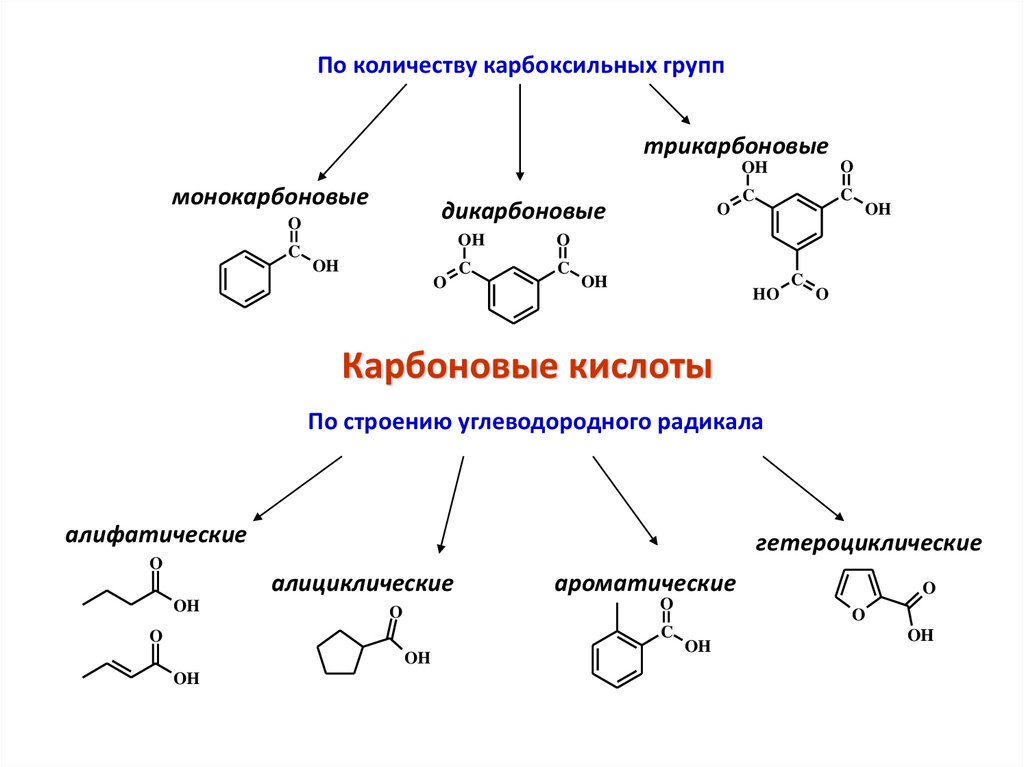
По количеству карбоксильных групптрикарбоновые
монокарбоновые
дикарбоновые
O
C
OH
O
OH
O
C
C
O
OH
OH
O
C
C
HO
C
OH
O
Карбоновые кислоты
По строению углеводородного радикала
алифатические
O
гетероциклические
алициклические
OH
ароматические
O
O
C
O
OH
OH
O
O
OH
OH
7.
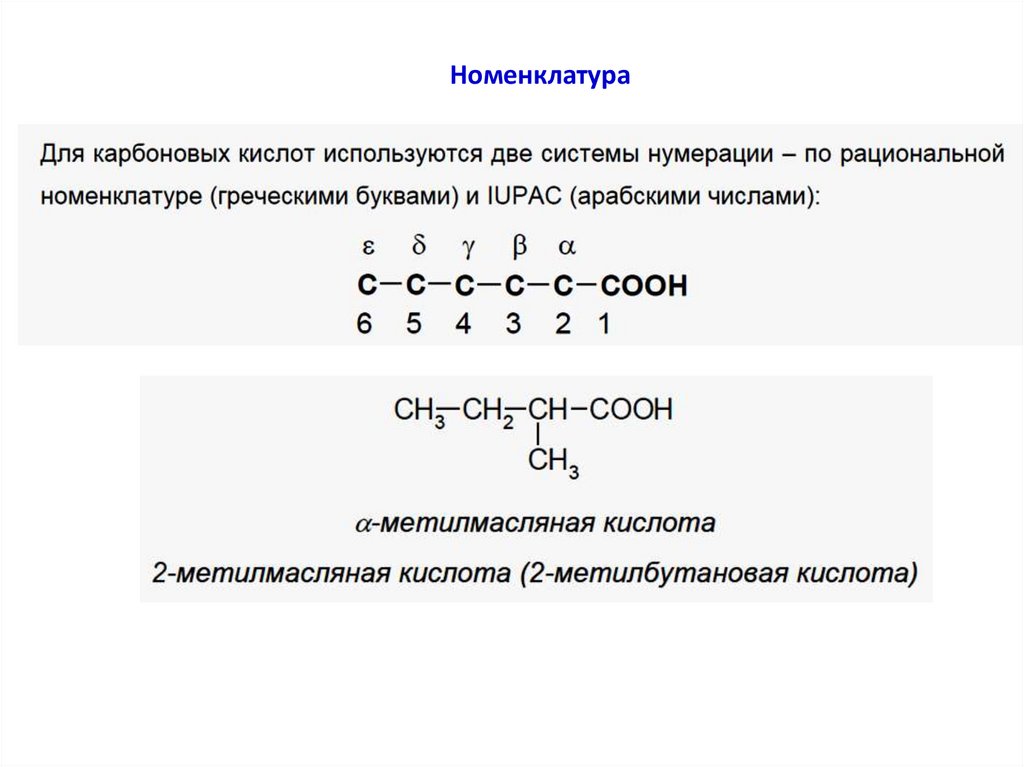
Номенклатура8.
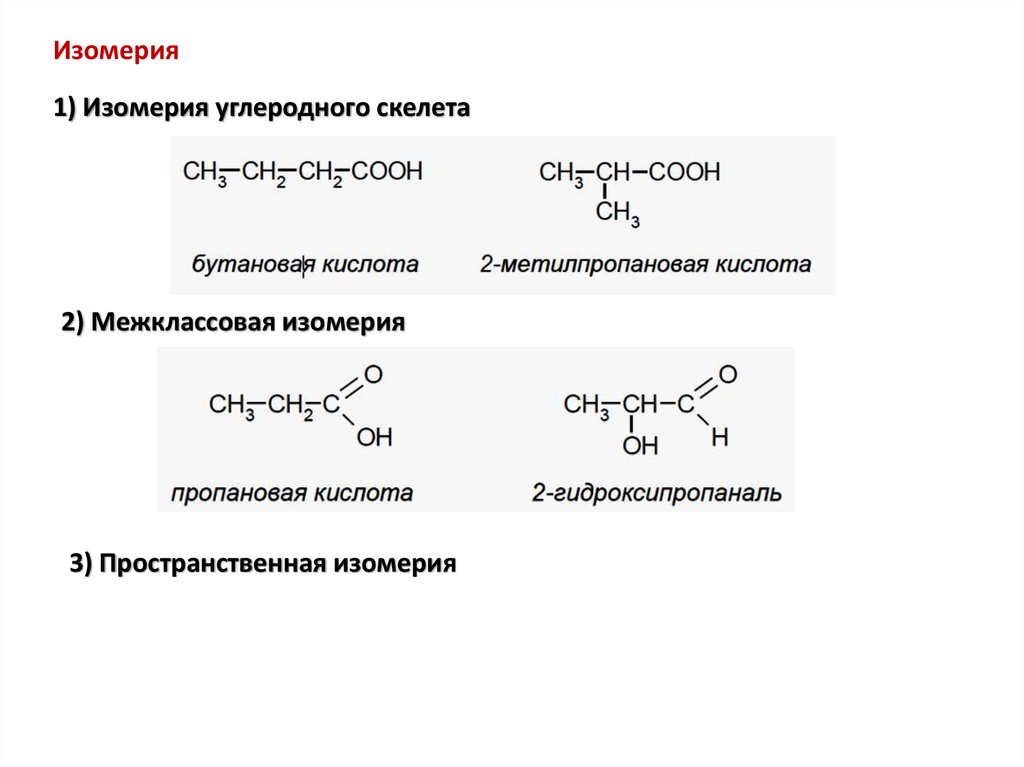
Изомерия1) Изомерия углеродного скелета
2) Межклассовая изомерия
3) Пространственная изомерия
9.
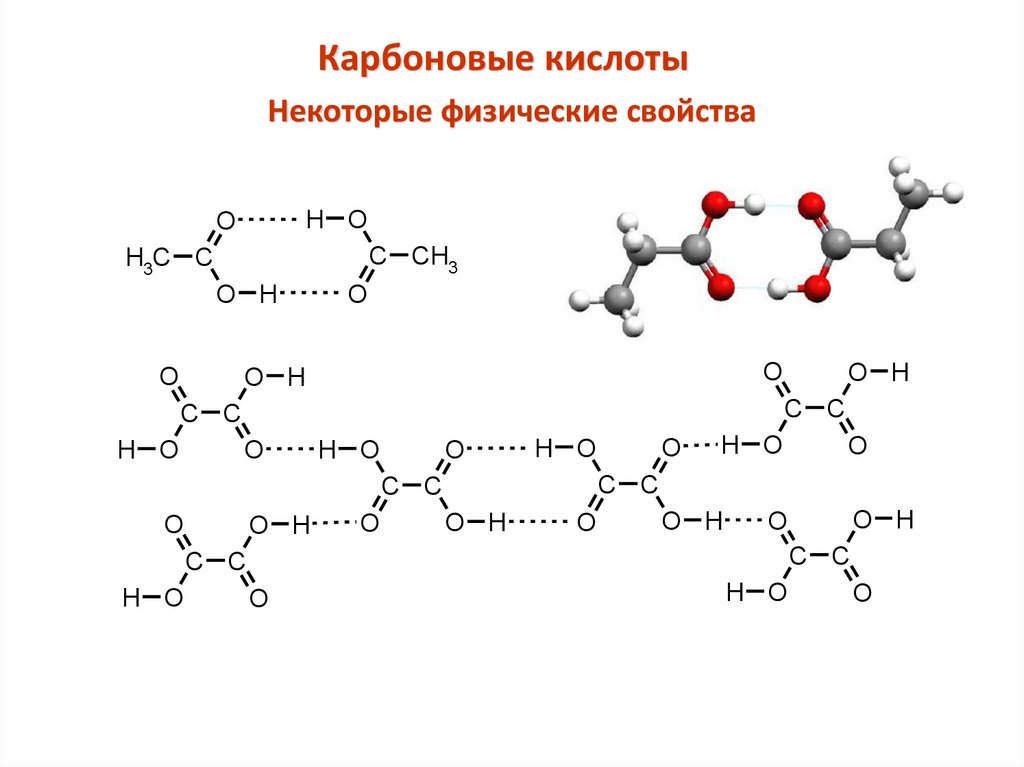
Карбоновые кислотыНекоторые физические свойства
H O
O
C CH3
H3C C
O H
O
O
O
O H
C C
C C
H O
O H
O
O
H O
O H
O
H O
O H
O
O H
O H
O
C C
C C
H O
O
C C
C C
O
O
H O
O
H O
O
10.
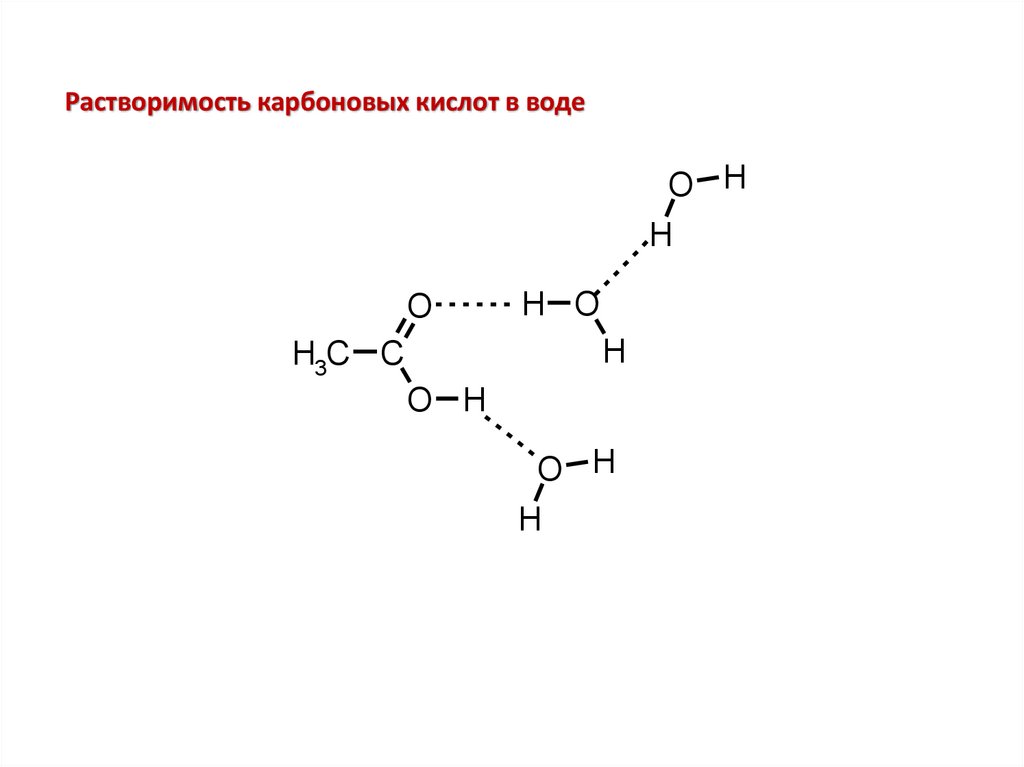
Растворимость карбоновых кислот в водеO H
H
O
H O
H
H3C C
O H
O H
H
11.
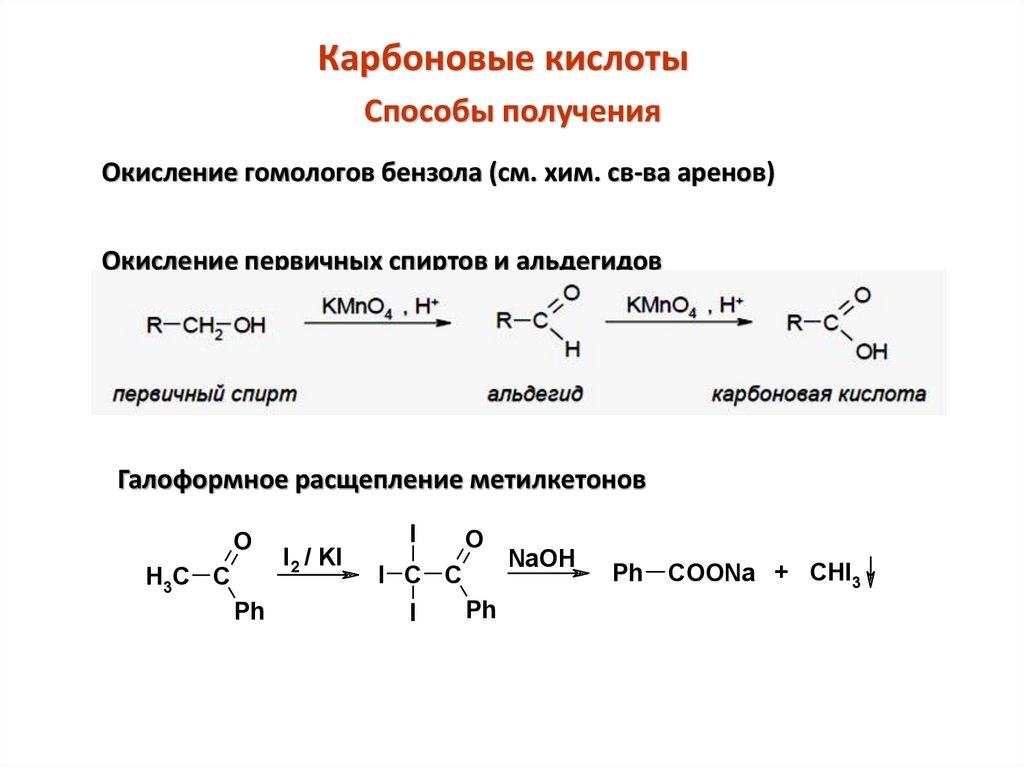
Карбоновые кислотыСпособы получения
Окисление гомологов бензола (см. хим. св-ва аренов)
Окисление первичных спиртов и альдегидов
Галоформное расщепление метилкетонов
O
H3C C
Ph
I2 / KI
I
O
I C C
I
Ph
NaOH
Ph COONa + CHI3
12.
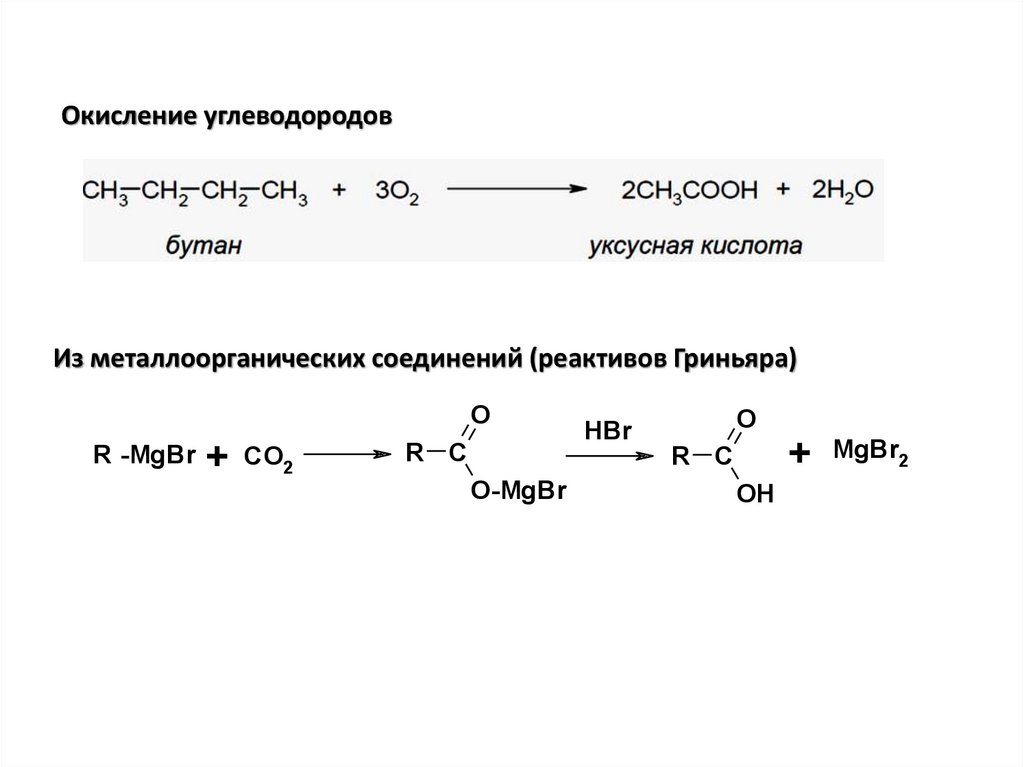
Окисление углеводородовИз металлоорганических соединений (реактивов Гриньяра)
O
R -MgBr
+
CO2
R C
O-MgBr
HBr
O
R C
OH
+
MgBr2
13.
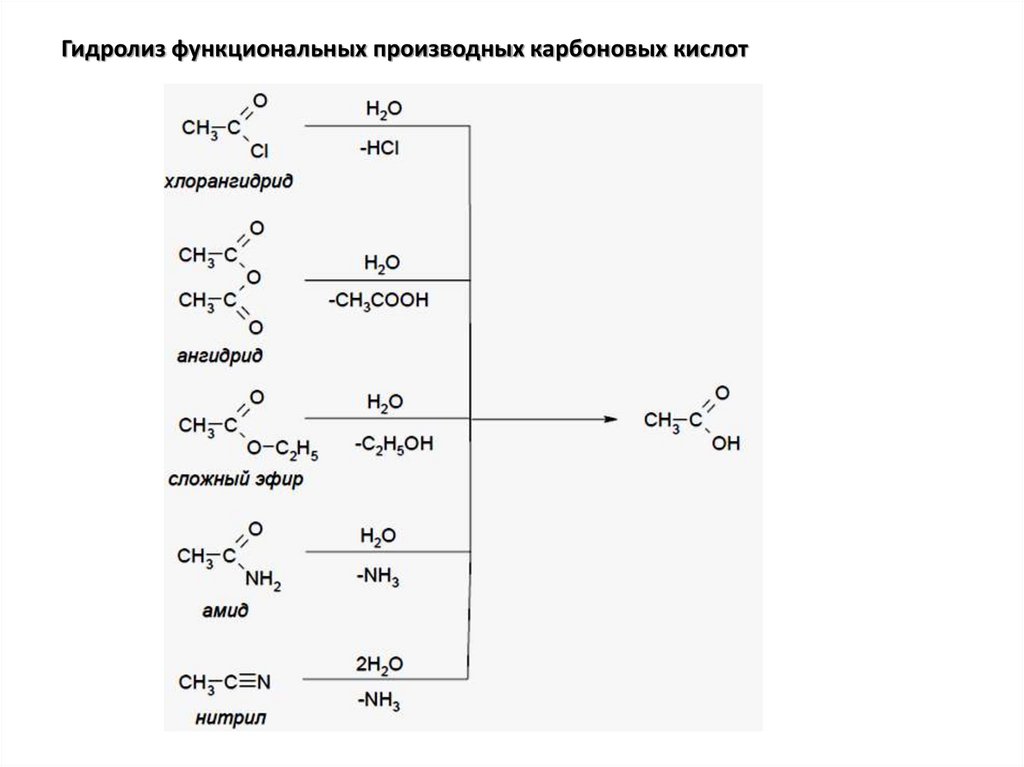
Гидролиз функциональных производных карбоновых кислот14.
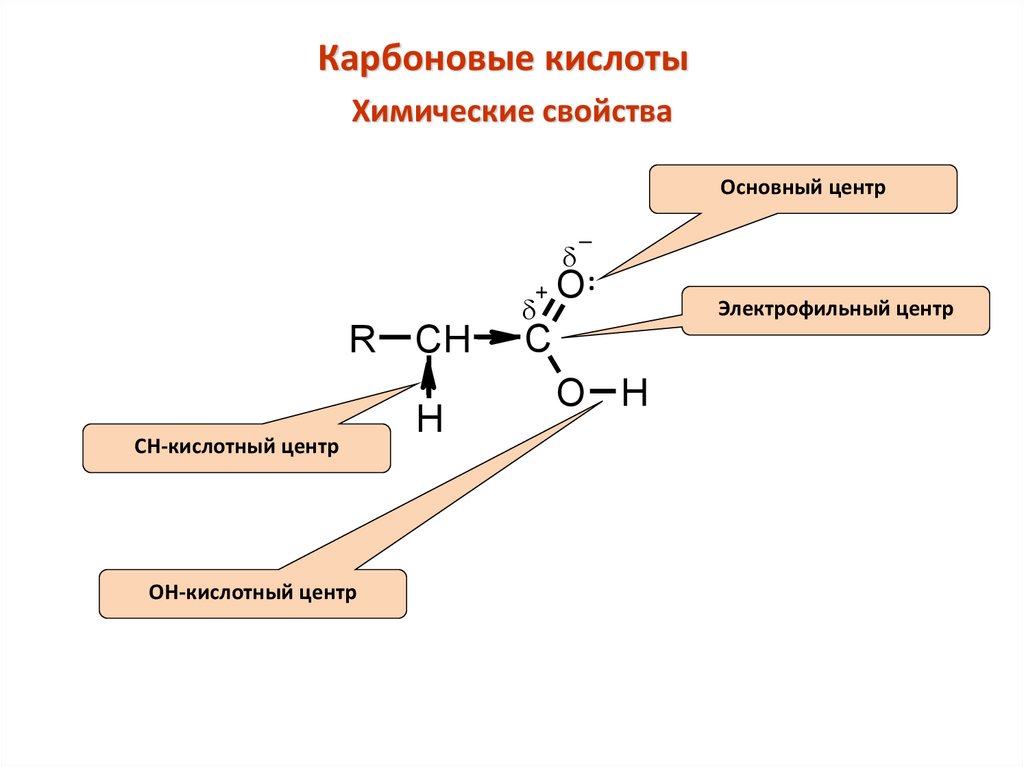
Карбоновые кислотыХимические свойства
Основный центр
d
+
R
CH-кислотный центр
ОН-кислотный центр
CH
H
d
_
O:
C
O H
Электрофильный центр
15.
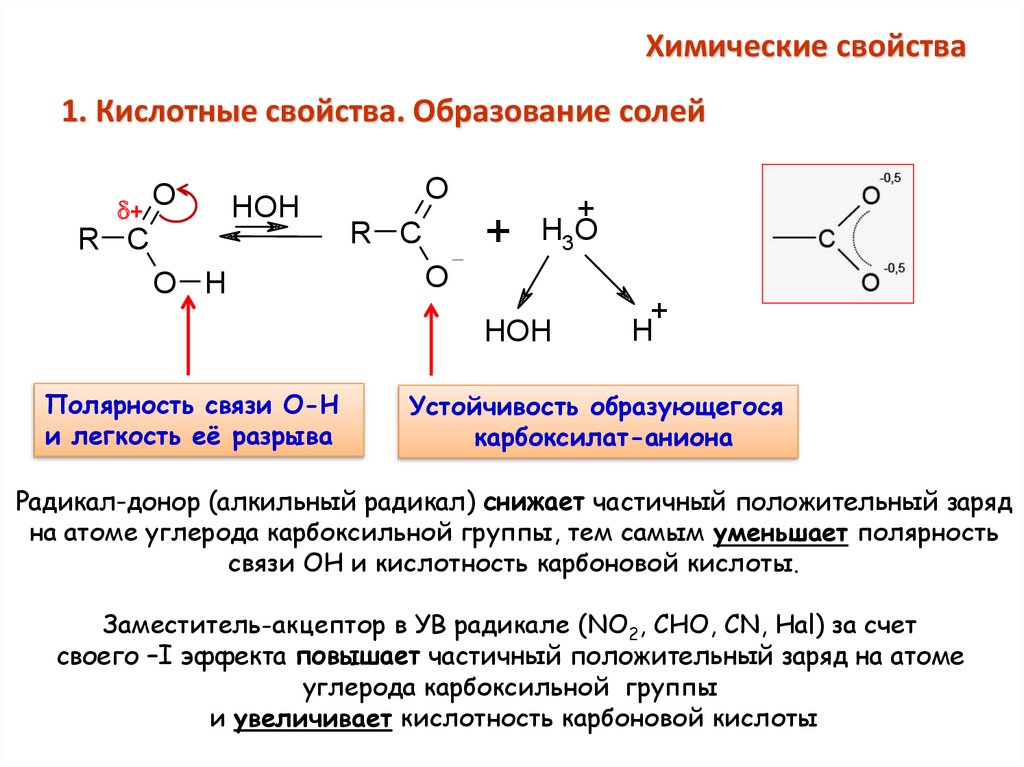
Химические свойства1. Кислотные свойства. Образование солей
d+
O
R C
HOH
O H
O
R C
+
+
H3O
O
HOH
Полярность связи О-Н
и легкость её разрыва
+
H
Устойчивость образующегося
карбоксилат-аниона
Радикал-донор (алкильный радикал) снижает частичный положительный заряд
на атоме углерода карбоксильной группы, тем самым уменьшает полярность
связи ОН и кислотность карбоновой кислоты.
Заместитель-акцептор в УВ радикале (NO2, CHO, CN, Hal) за счет
своего –I эффекта повышает частичный положительный заряд на атоме
углерода карбоксильной группы
и увеличивает кислотность карбоновой кислоты
16.
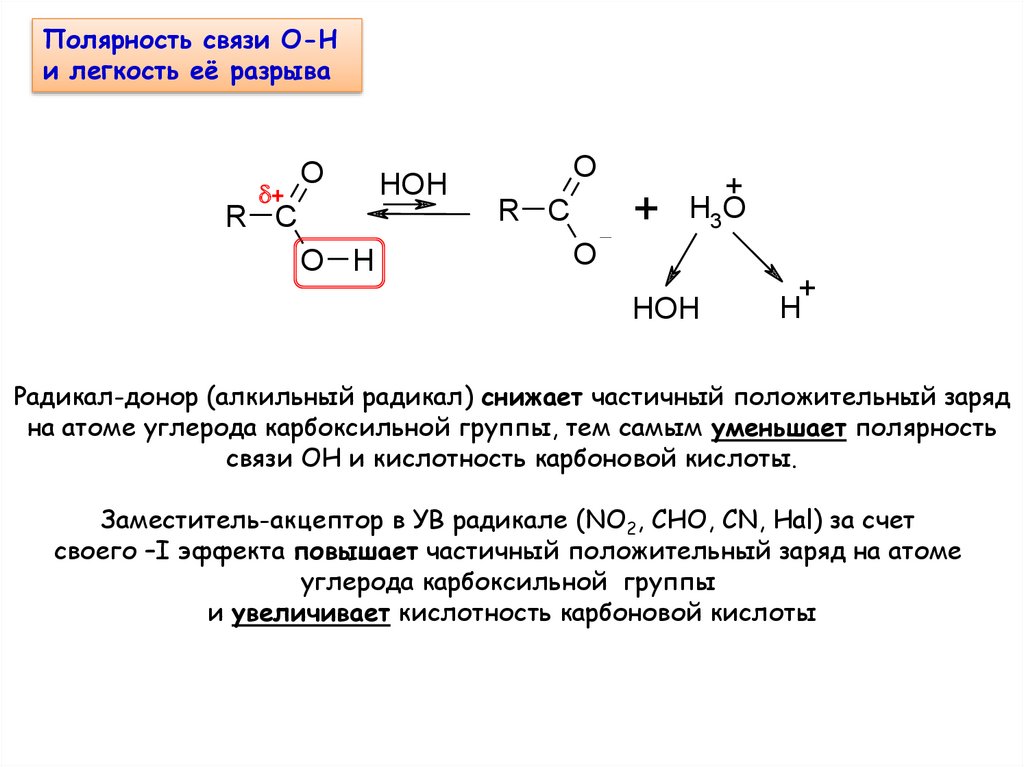
Полярность связи О-Ни легкость её разрыва
d+
O
R C
O H
HOH
O
R C
+
+
H3O
O
HOH
+
H
Радикал-донор (алкильный радикал) снижает частичный положительный заряд
на атоме углерода карбоксильной группы, тем самым уменьшает полярность
связи ОН и кислотность карбоновой кислоты.
Заместитель-акцептор в УВ радикале (NO2, CHO, CN, Hal) за счет
своего –I эффекта повышает частичный положительный заряд на атоме
углерода карбоксильной группы
и увеличивает кислотность карбоновой кислоты
17.
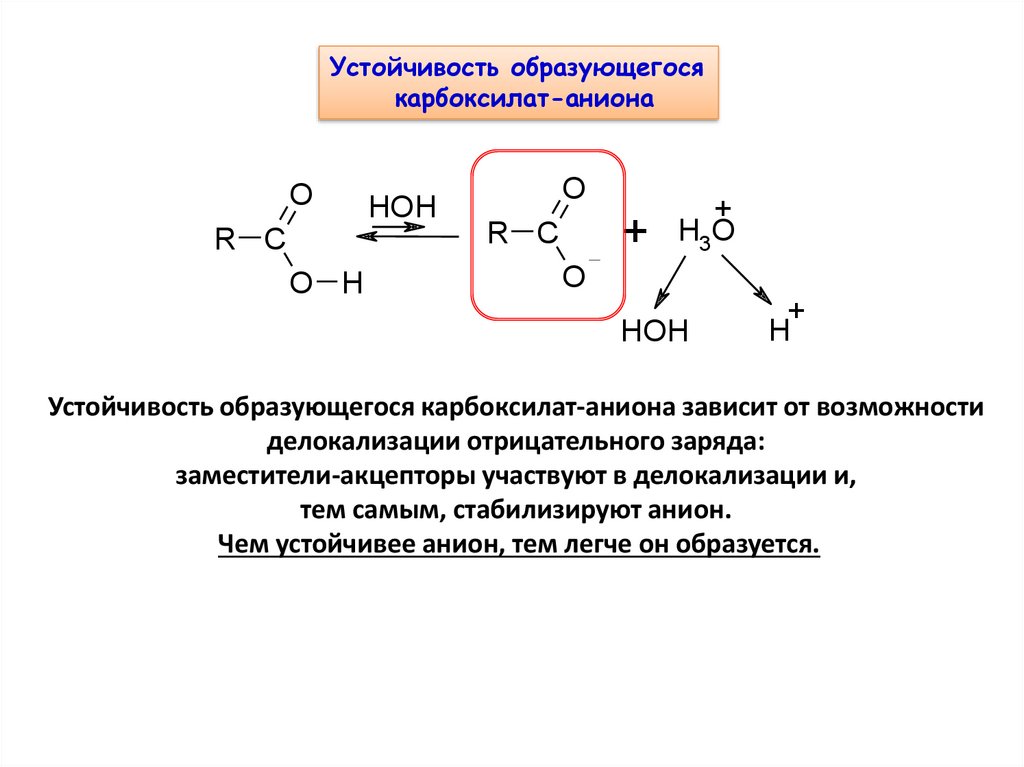
Устойчивость образующегосякарбоксилат-аниона
O
R C
O H
HOH
O
R C
+
+
H3O
O
HOH
+
H
Устойчивость образующегося карбоксилат-аниона зависит от возможности
делокализации отрицательного заряда:
заместители-акцепторы участвуют в делокализации и,
тем самым, стабилизируют анион.
Чем устойчивее анион, тем легче он образуется.
18.
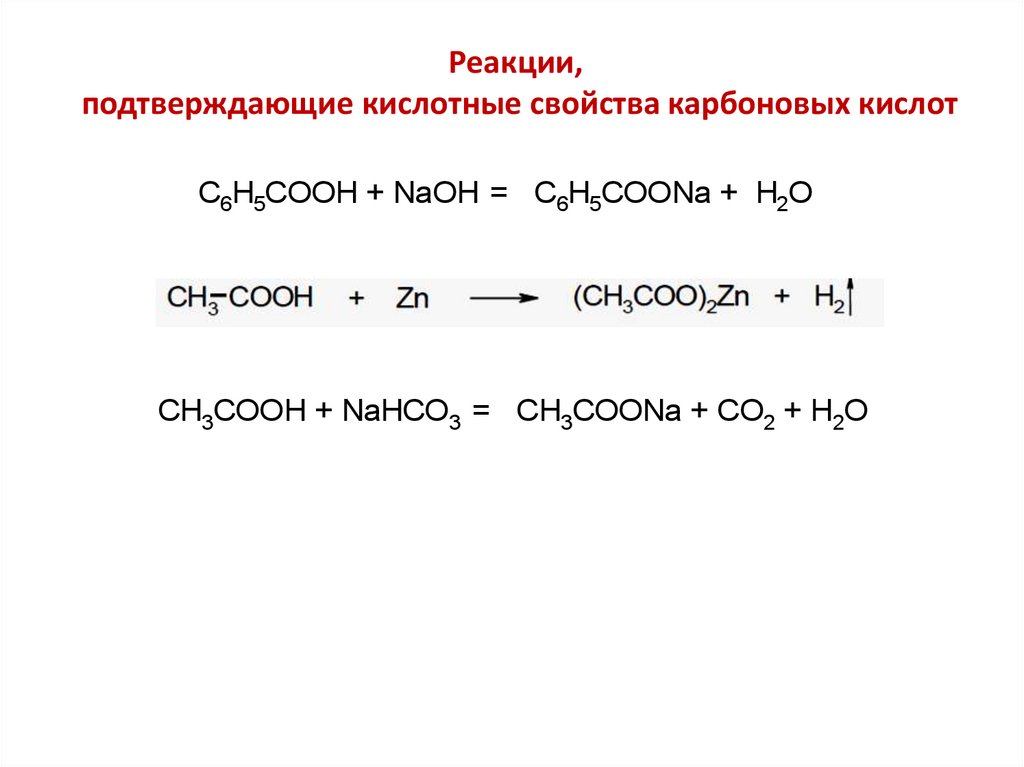
Реакции,подтверждающие кислотные свойства карбоновых кислот
C6H5COOH + NaOH = C6H5COONa + H2O
CH3COOH + NaHCO3 = CH3COONa + CO2 + H2O
19.
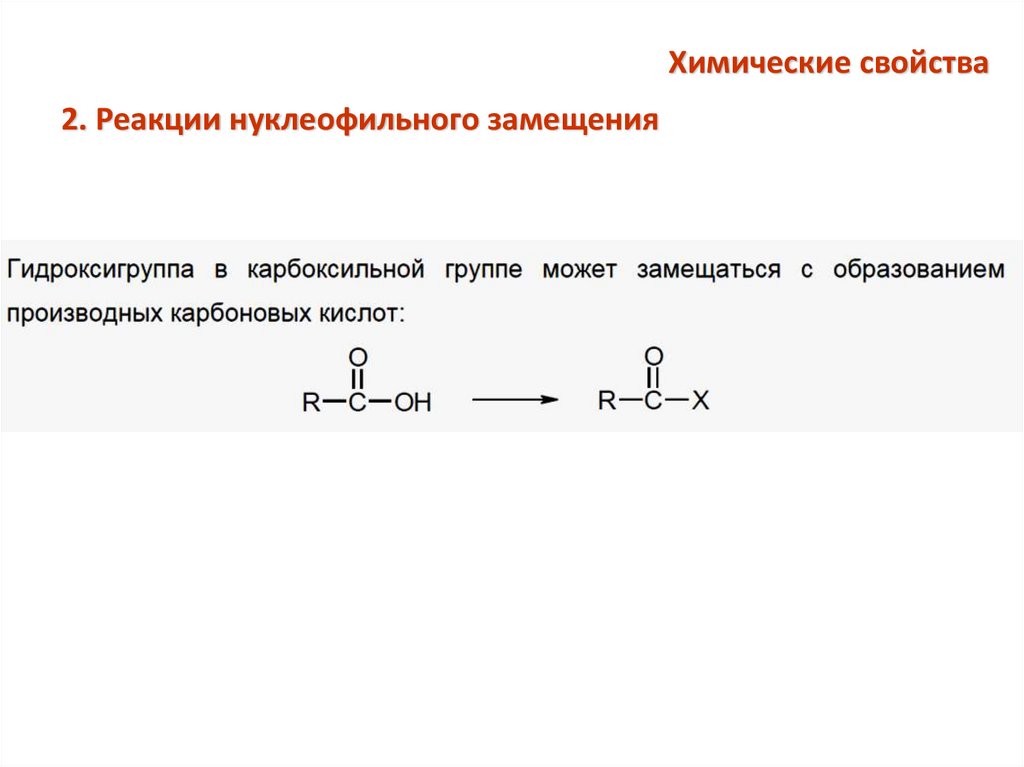
Химические свойства2. Реакции нуклеофильного замещения
20.
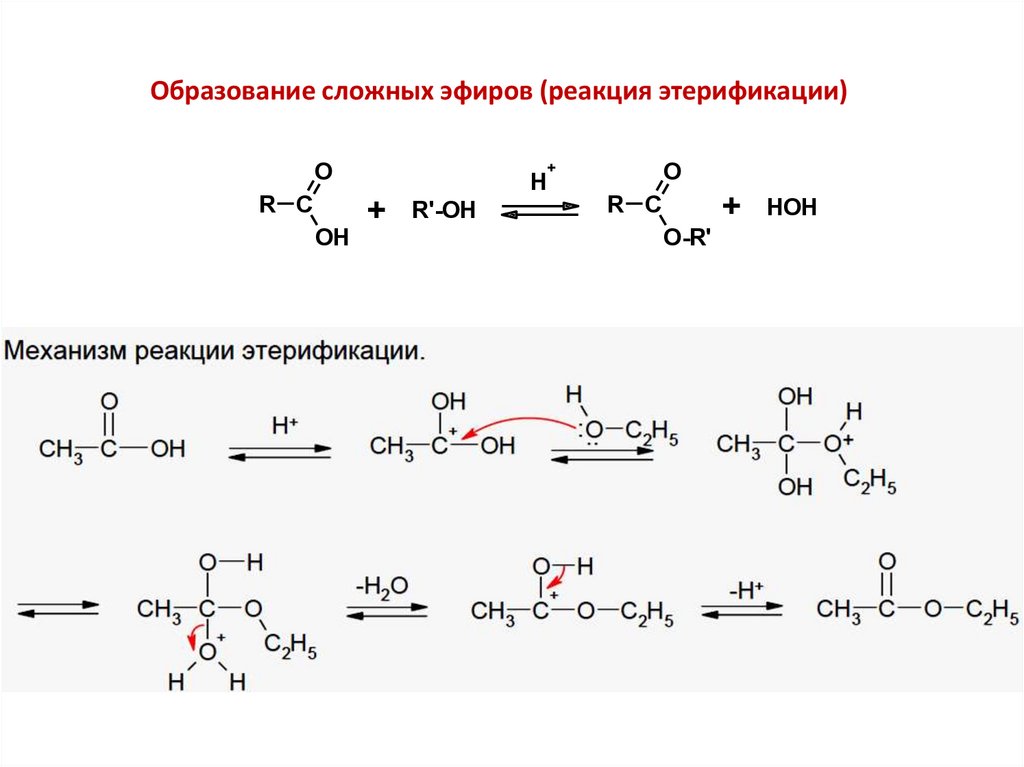
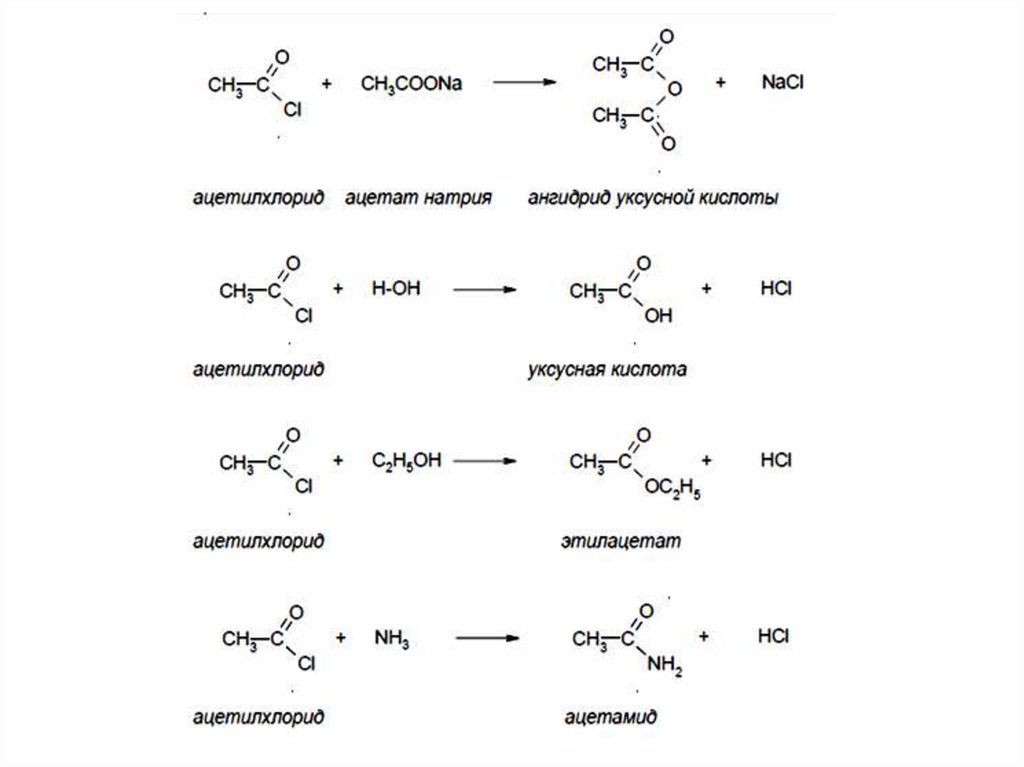
Образование сложных эфиров (реакция этерификации)O
R C
OH
+
H
R'-OH
O
+
+
R C
O-R'
HOH
21.
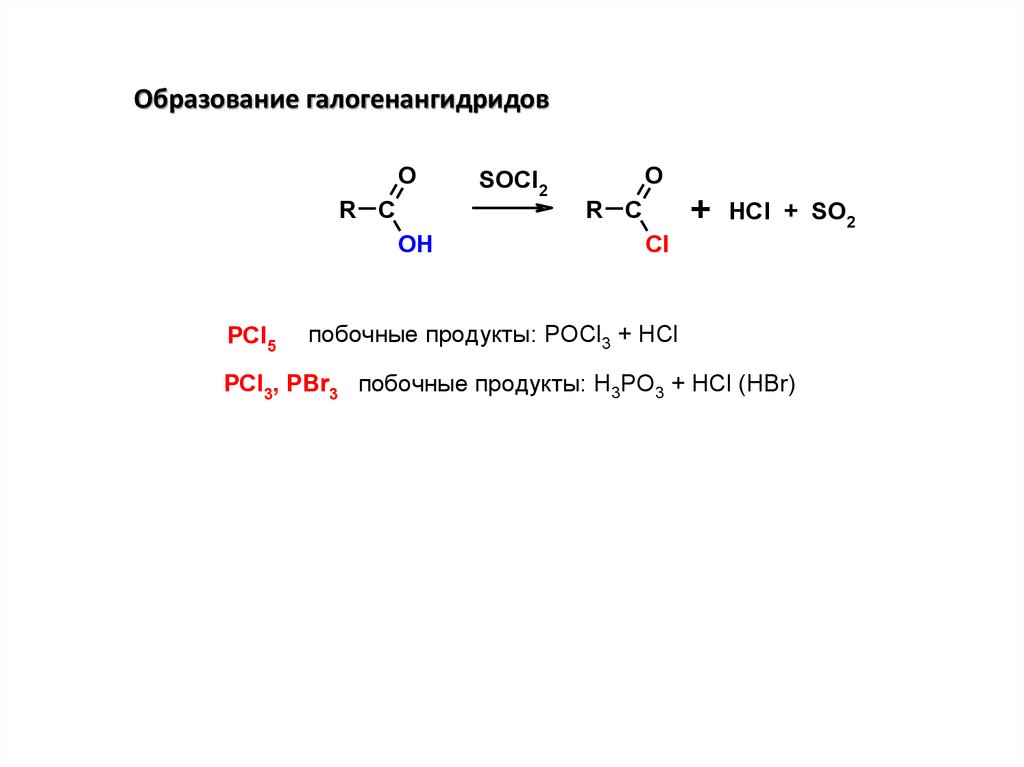
Образование галогенангидридовO
R C
OH
PCl5
SOCl2
O
+
R C
Cl
HCl + SO2
побочные продукты: POCl3 + HCl
PCl3, PBr3 побочные продукты: H3PO3 + HCl (HBr)
22.
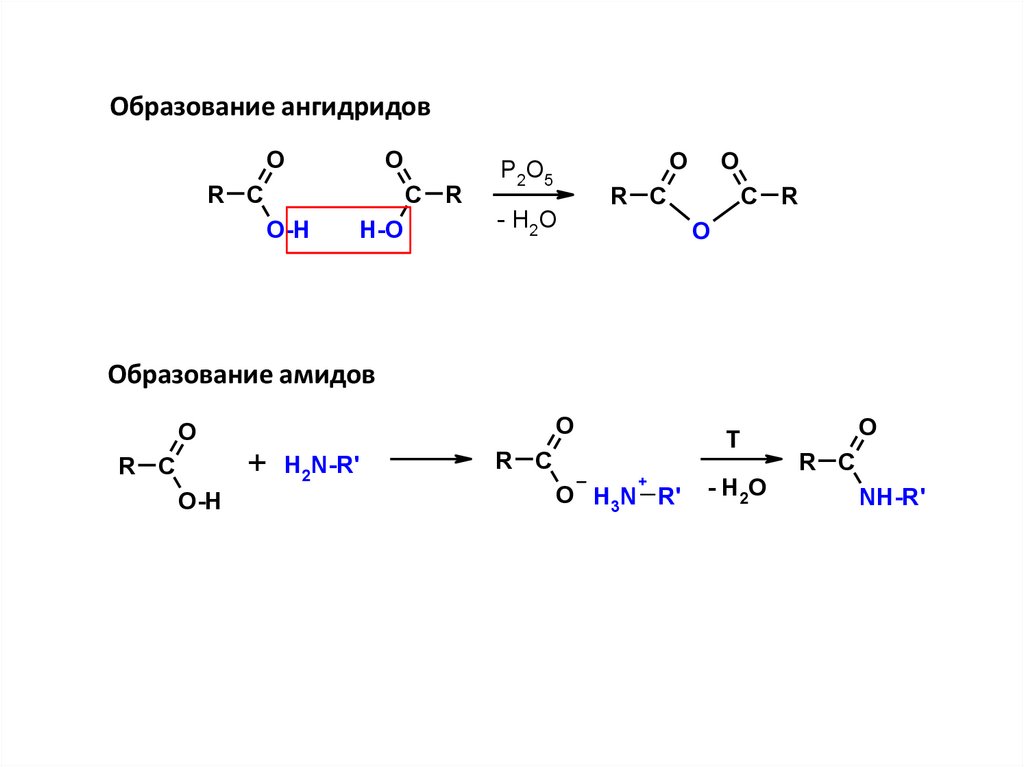
Образование ангидридовO
O
R C
C R
O-H
H-O
O
P2O5
- H2O
O
R C
C R
O
Образование амидов
O
R C
O-H
O
+
H2N-R'
R C
T
+
O H3N R'
- H2 O
O
R C
NH-R'
23.
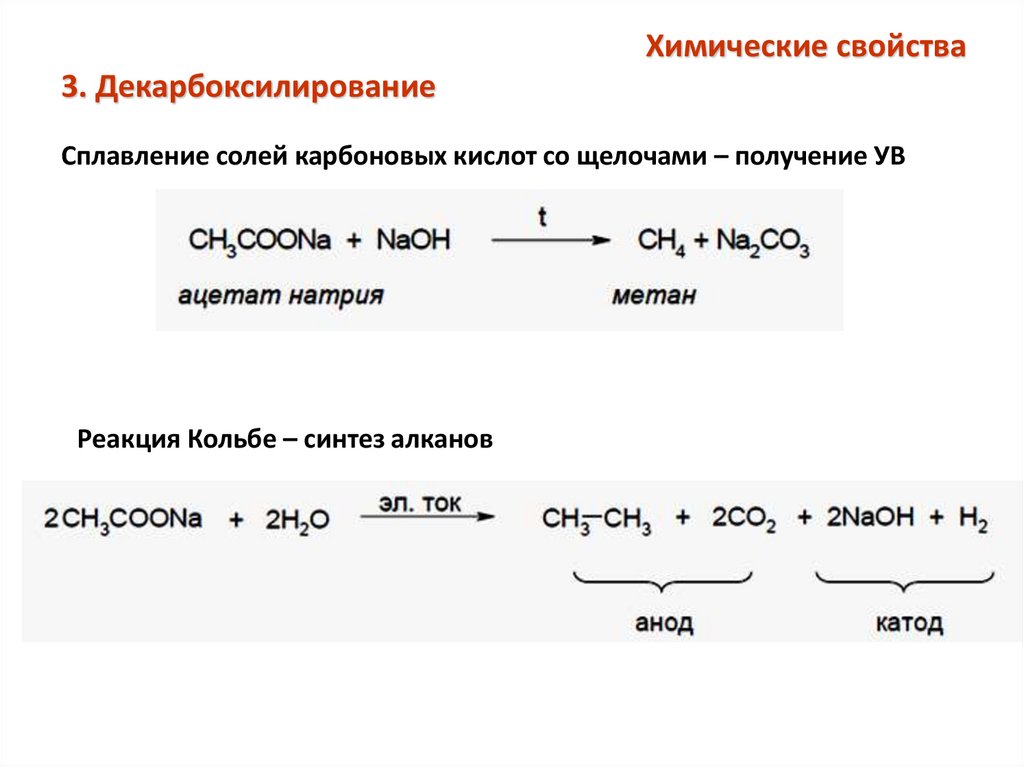
Химические свойства3. Декарбоксилирование
Сплавление солей карбоновых кислот со щелочами – получение УВ
Реакция Кольбе – синтез алканов
24.
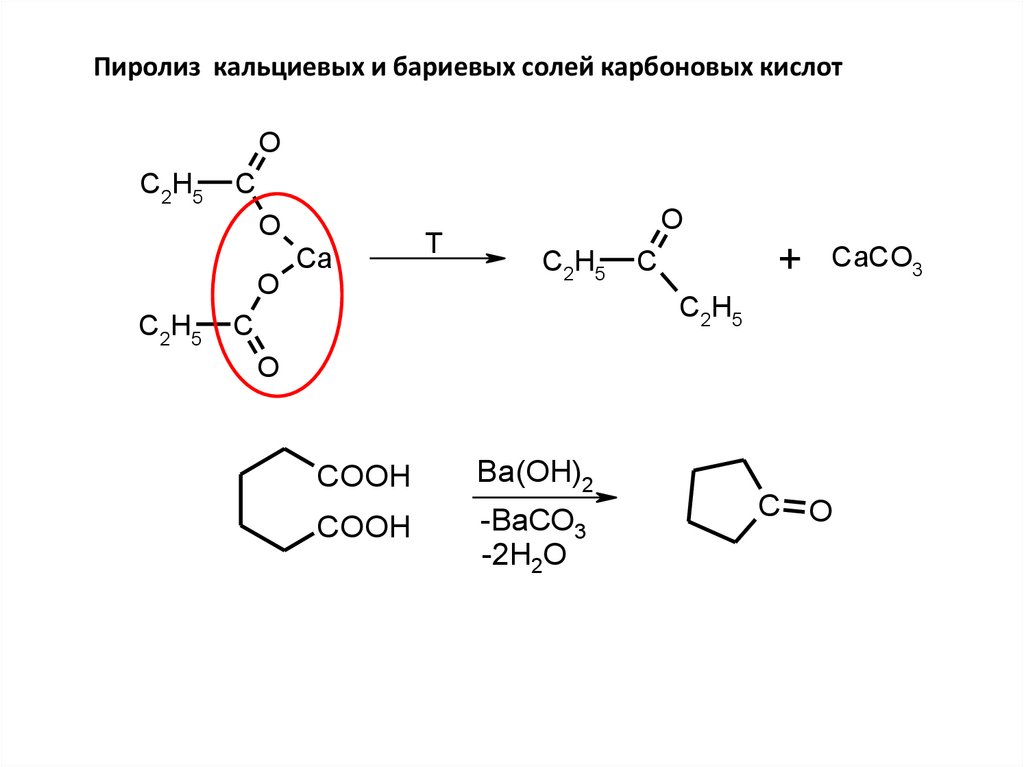
Пиролиз кальциевых и бариевых солей карбоновых кислотO
C2H5
C
O
O
C2H5
Ca
T
O
C2H5
C
+
CaCO3
C2H5
C
O
COOH
Ba(OH)2
COOH
-BaCO3
-2H2O
C O
25.
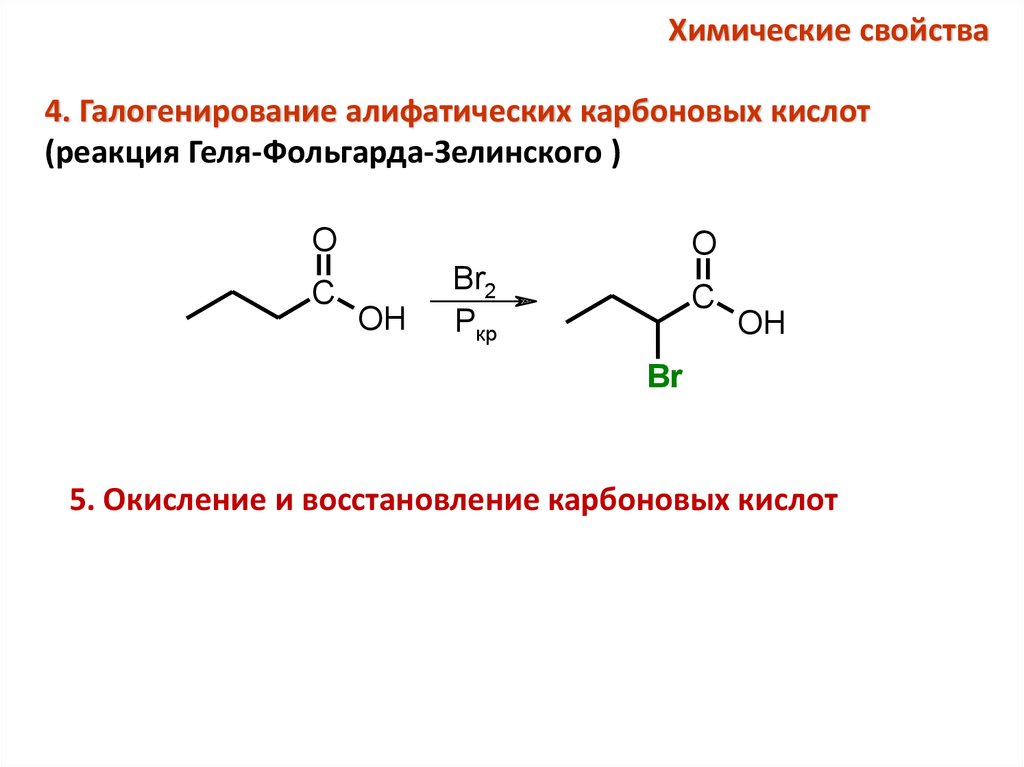
Химические свойства4. Галогенирование алифатических карбоновых кислот
(реакция Геля-Фольгарда-Зелинского )
O
C
OH
O
Br2
Pкр
C
OH
Br
5. Окисление и восстановление карбоновых кислот
26.
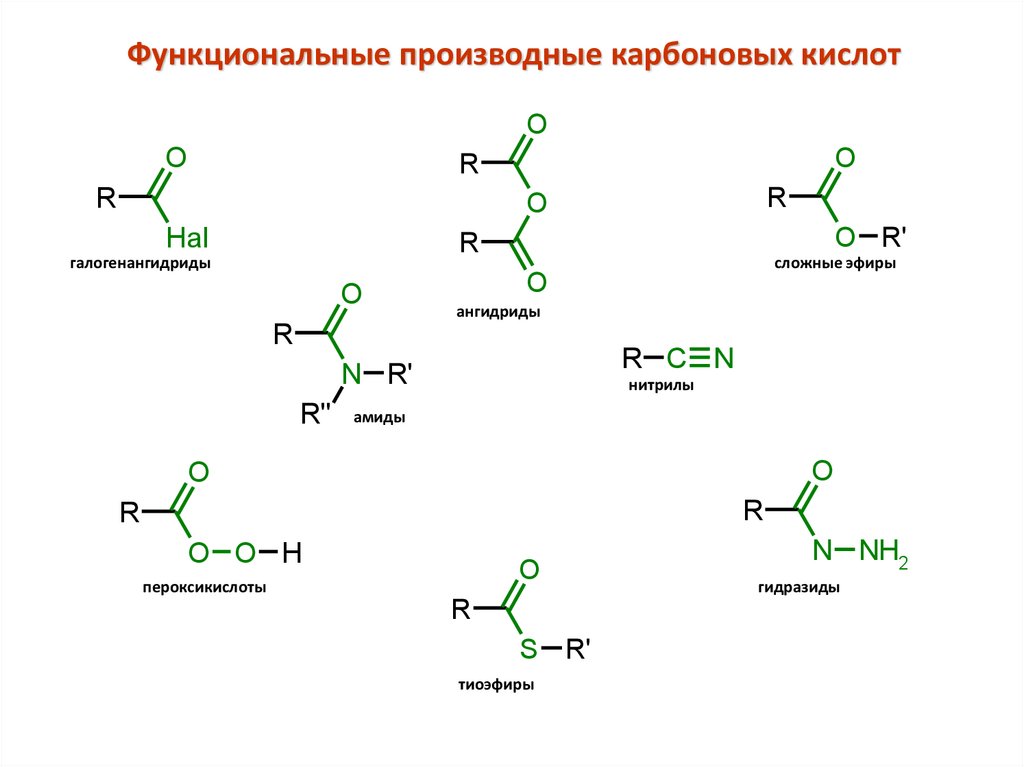
Функциональные производные карбоновых кислотO
O
O
R
R
R
O
Hal
O R'
R
галогенангидриды
O
R
O
ангидриды
R C N
N R'
R''
сложные эфиры
нитрилы
амиды
O
O
R
R
O O H
пероксикислоты
O
R
S R'
тиоэфиры
N NH2
гидразиды
27.
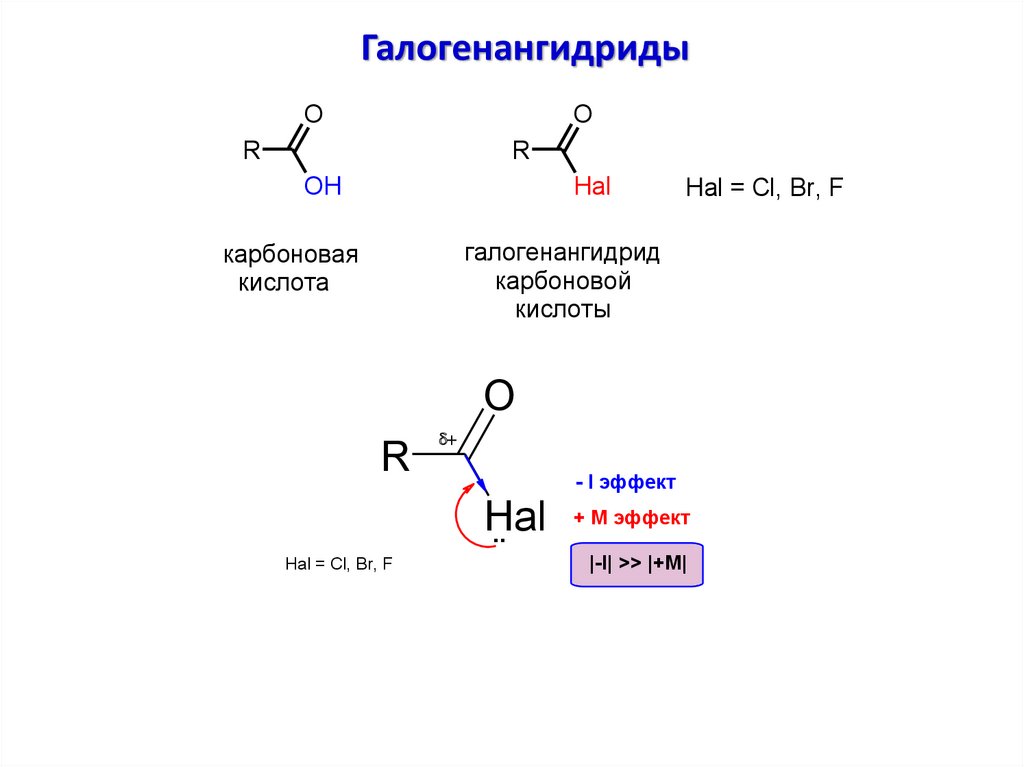
ГалогенангидридыO
O
R
R
OH
Hal
Hal = Cl, Br, F
галогенангидрид
карбоновой
кислоты
карбоновая
кислота
O
R
d
Hal
..
Hal = Cl, Br, F
- I эффект
+ М эффект
|-I| >> |+M|
28.
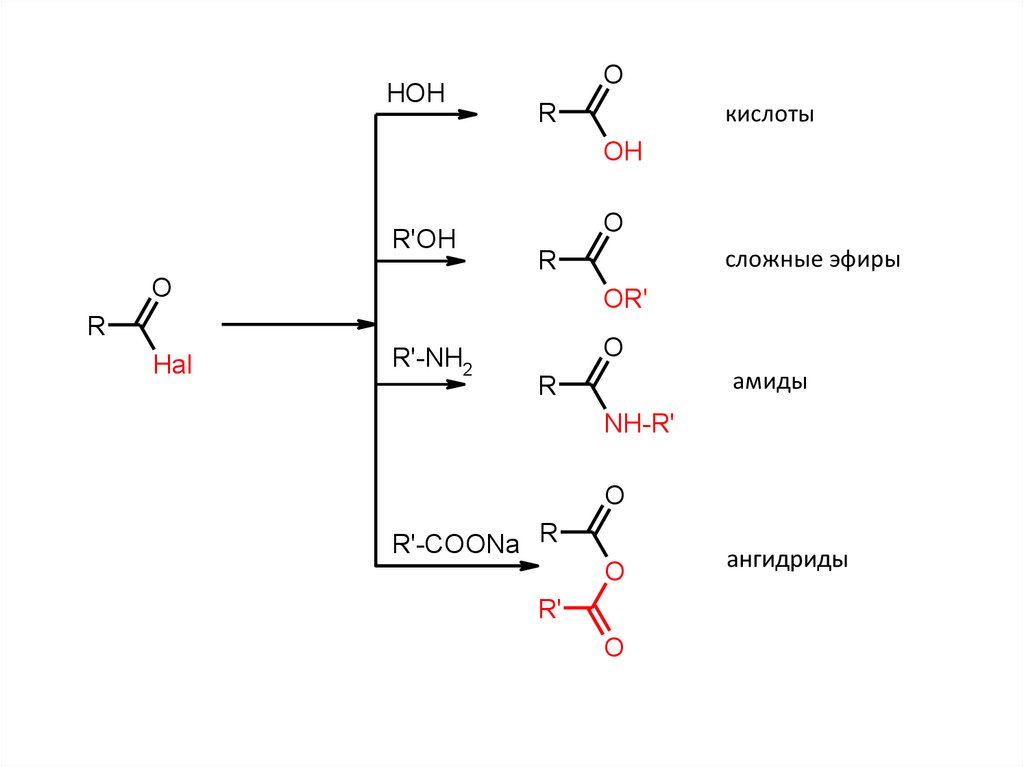
HOHO
R
кислоты
OH
R'OH
O
O
R
OR'
R
Hal
сложные эфиры
R'-NH2
O
амиды
R
NH-R'
O
R'-COONa R
O
R'
O
ангидриды
29.
30.
АнгидридыO
O
R
R
OH
O
R
карбоновая
кислота
O
O
R
d
O
R
O
- I эффект
+ М эффект
ангидрид
карбоновой
кислоты
31.
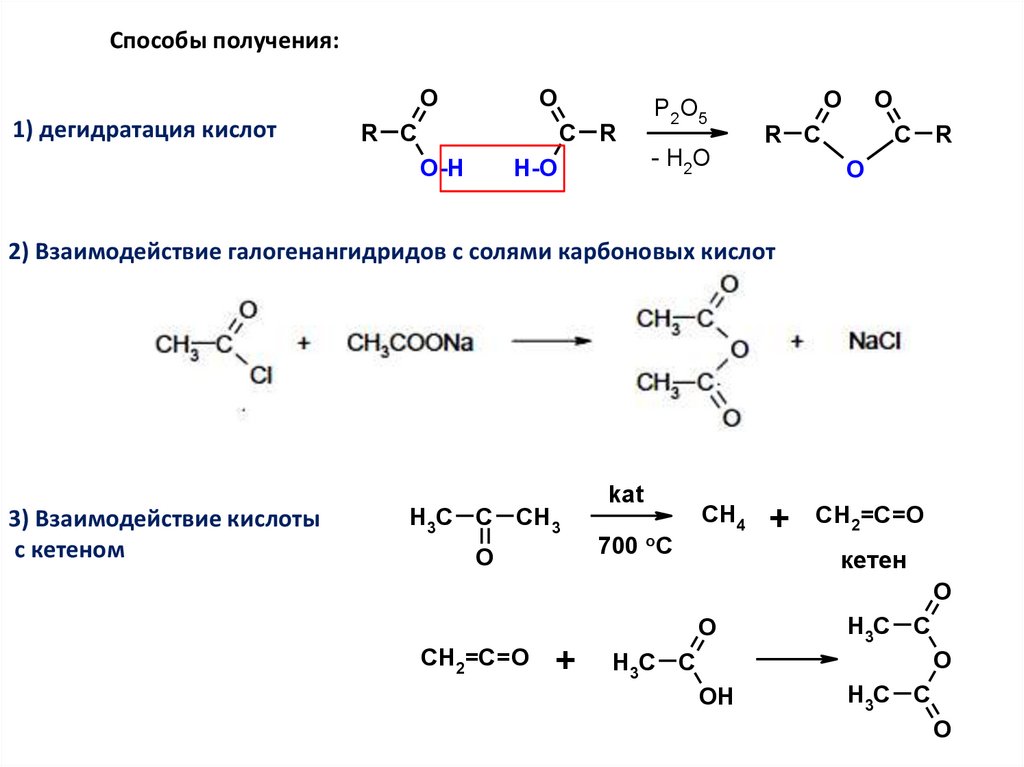
Способы получения:O
1) дегидратация кислот
O
R C
C R
O-H
H-O
P2O5
- H2O
O
O
R C
C R
O
2) Взаимодействие галогенангидридов с солями карбоновых кислот
3) Взаимодействие кислоты
с кетеном
H3C C CH3
O
kat
700 oC
CH4
+
CH2=C=O
кетен
O
CH2=C=O
+
O
H3C C
O
H3C C
OH
H3C C
O
32.
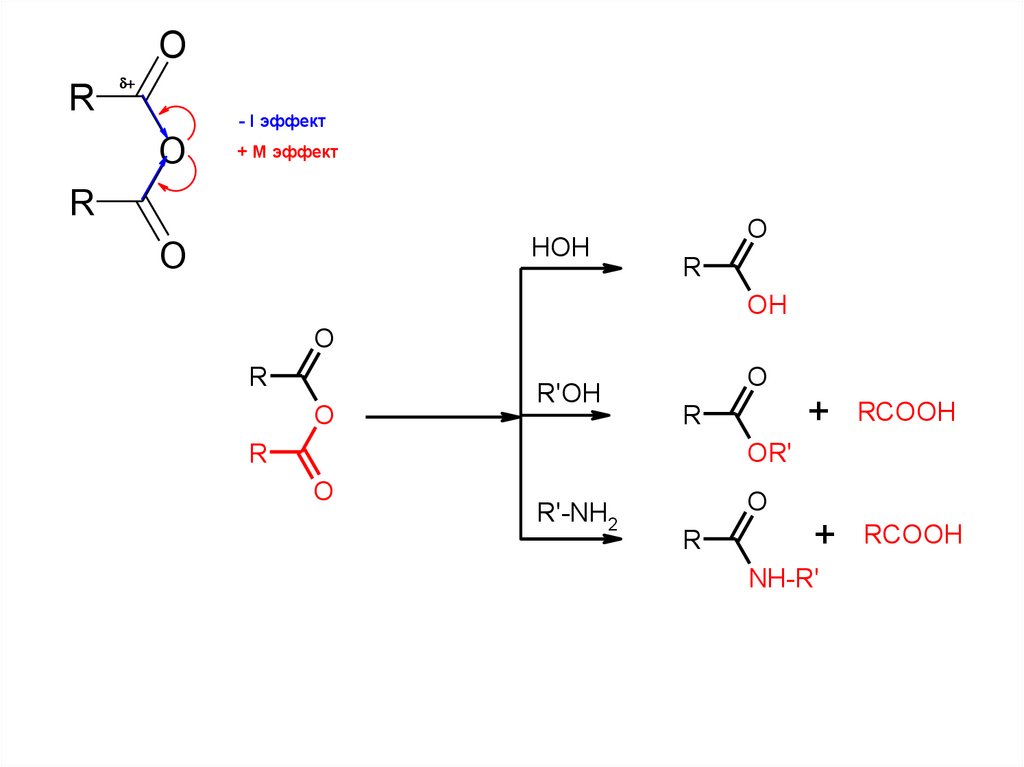
OR
d
O
- I эффект
+ М эффект
R
HOH
O
O
R
OH
O
R
O
R'OH
O
R
+
RCOOH
+
RCOOH
OR'
R
O
R'-NH2
O
R
NH-R'
33.
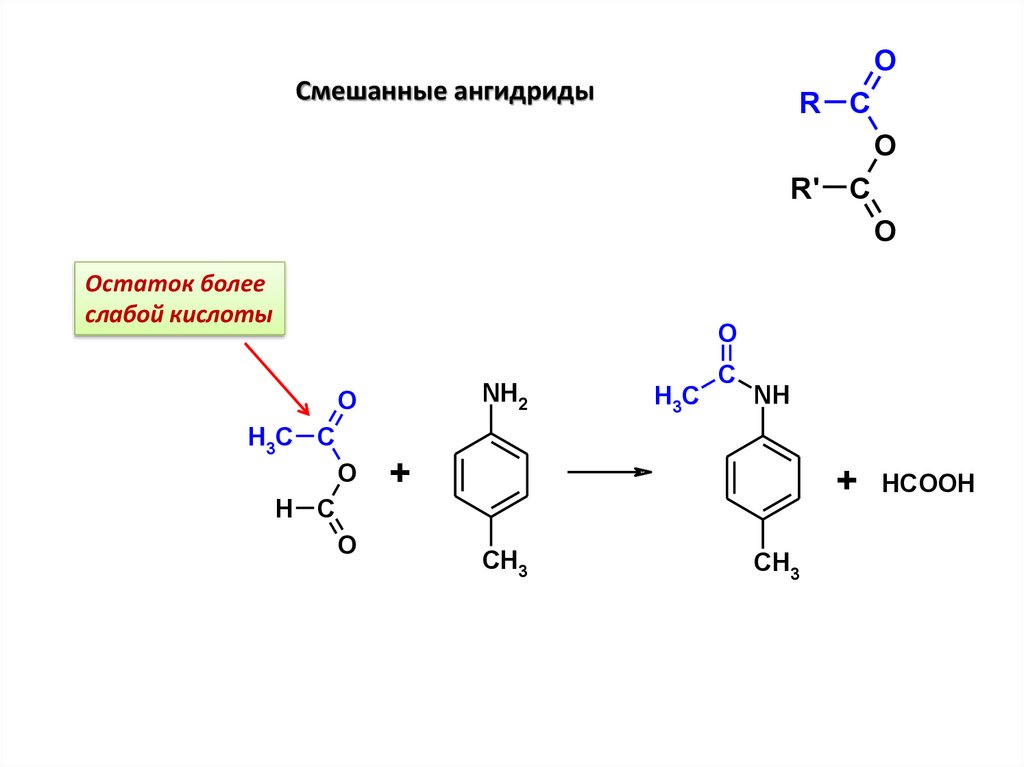
OСмешанные ангидриды
R C
O
R' C
O
Остаток более
слабой кислоты
O
NH2
O
H3C C
O
H3C
C
NH
+
+
H C
O
CH3
CH3
HCOOH
34.
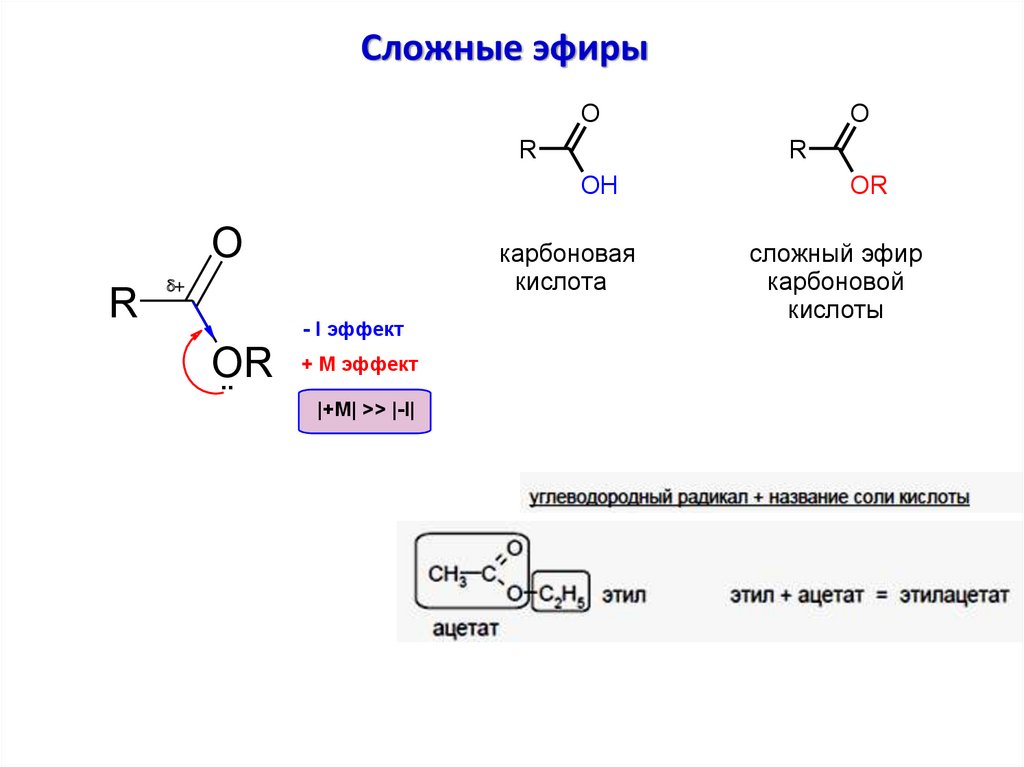
Сложные эфирыO
R
R
OH
O
R
карбоновая
кислота
d
OR
..
- I эффект
+ М эффект
|+M| >> |-I|
O
OR
сложный эфир
карбоновой
кислоты
35.
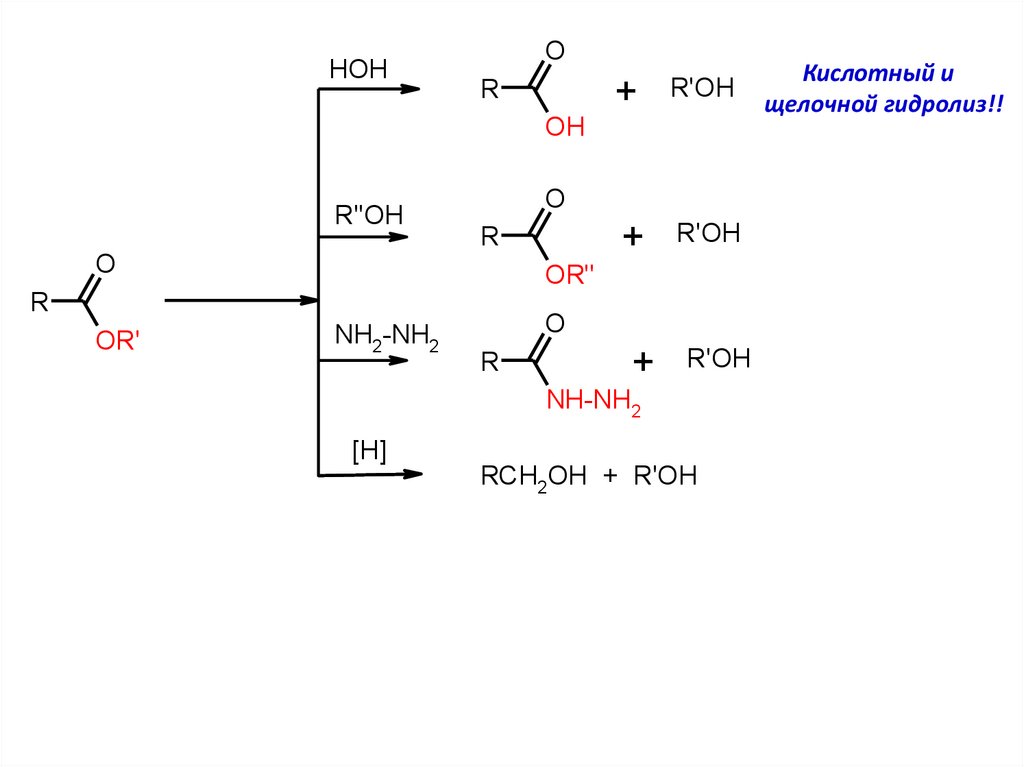
HOHO
R
OH
R''OH
O
+
R'OH
O
R
OR"
R
OR'
+
R'OH
NH2-NH2
O
R
+
R'OH
NH-NH2
[H]
RCH2OH + R'OH
Кислотный и
щелочной гидролиз!!
36.
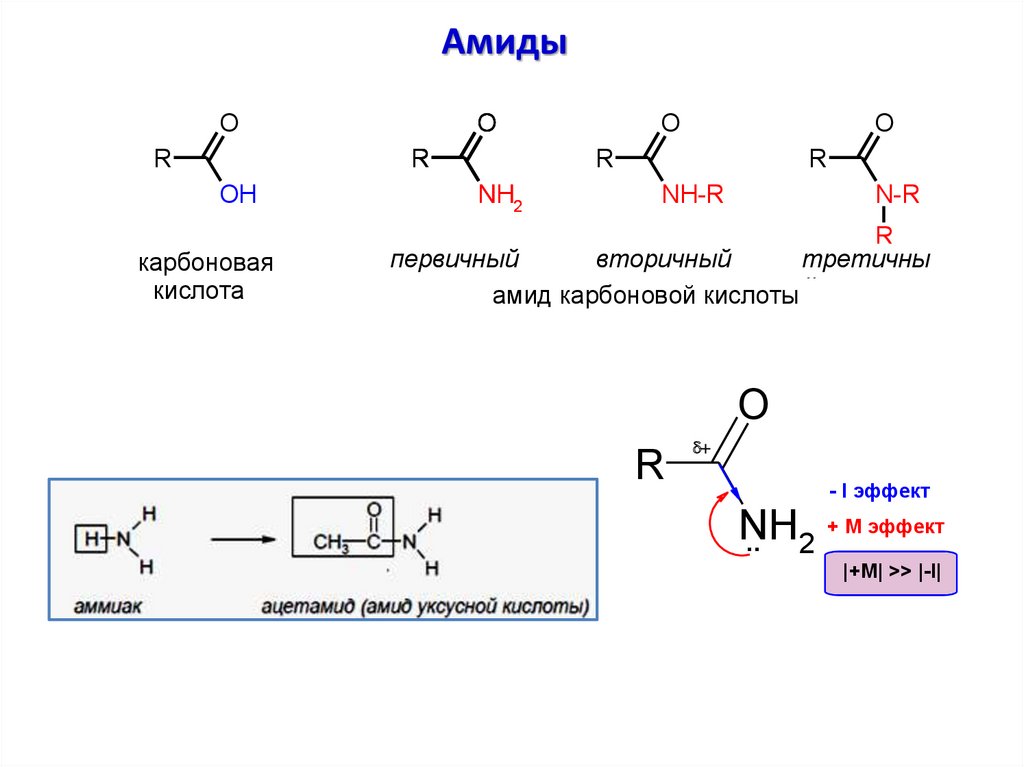
АмидыO
R
O
R
OH
карбоновая
кислота
O
O
R
NH2
R
NH-R
N-R
R
первичный
вторичный
третичны
амид карбоновой кислоты й
O
R
d
NH
..
2
- I эффект
+ М эффект
|+M| >> |-I|
37.
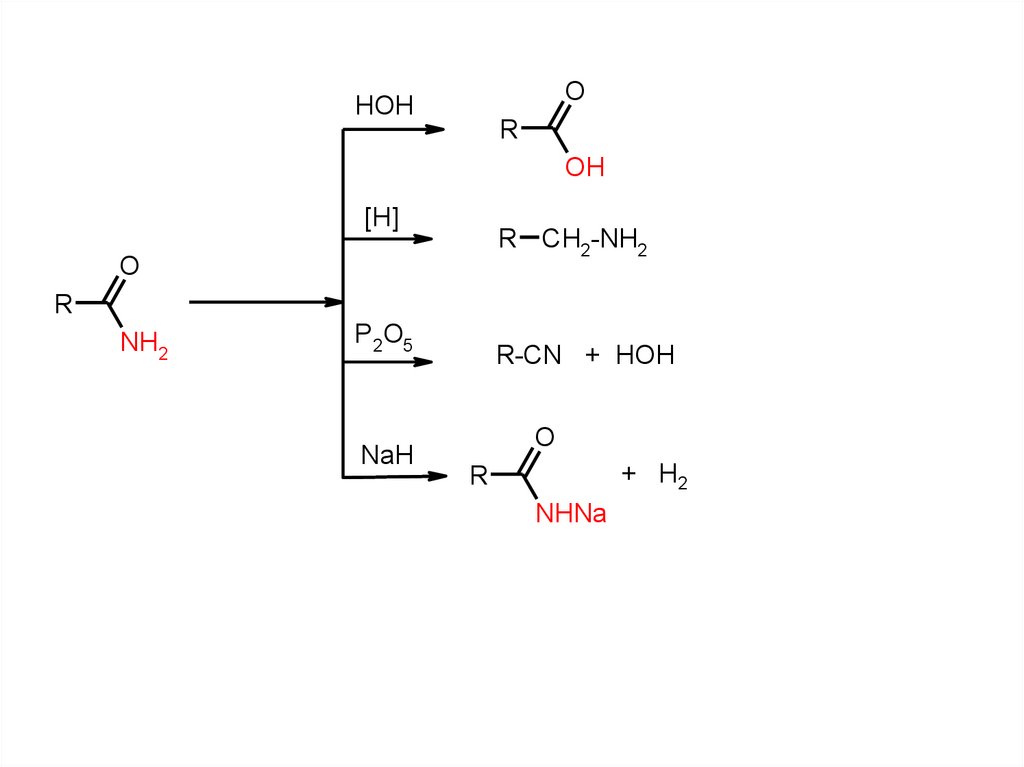
OHOH
R
OH
[H]
R CH2-NH2
O
R
NH2
P2O5
NaH
R-CN + HOH
O
+ H2
R
NHNa
38.
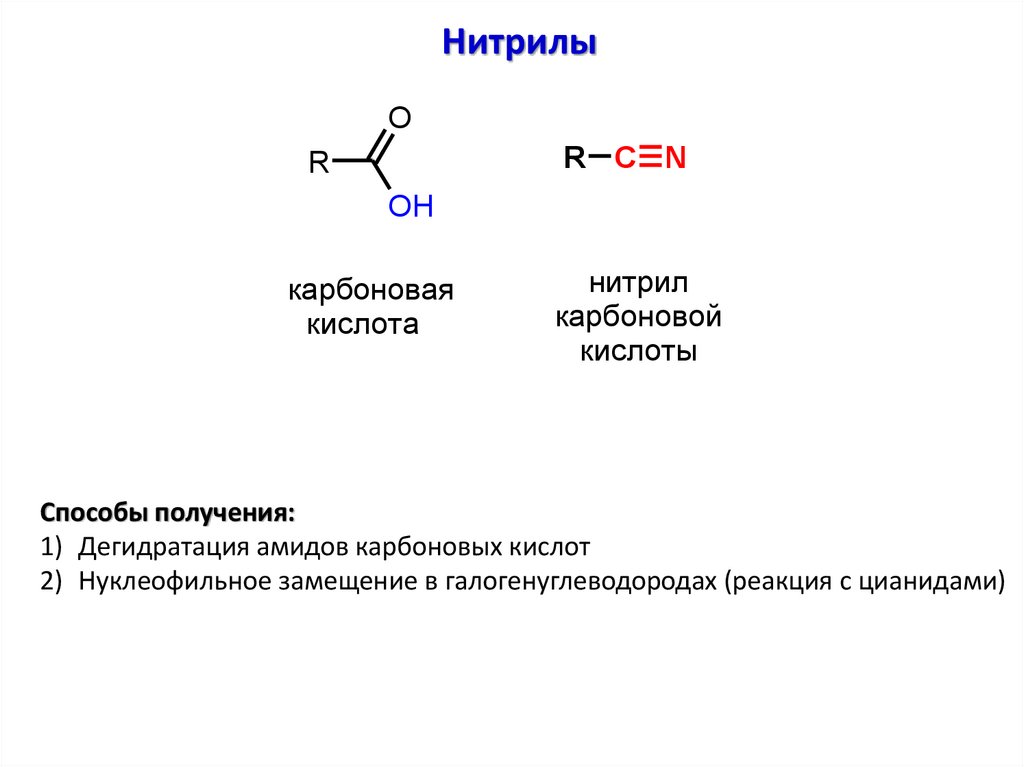
НитрилыO
R C N
R
OH
карбоновая
кислота
нитрил
карбоновой
кислоты
Способы получения:
1) Дегидратация амидов карбоновых кислот
2) Нуклеофильное замещение в галогенуглеводородах (реакция с цианидами)
39.
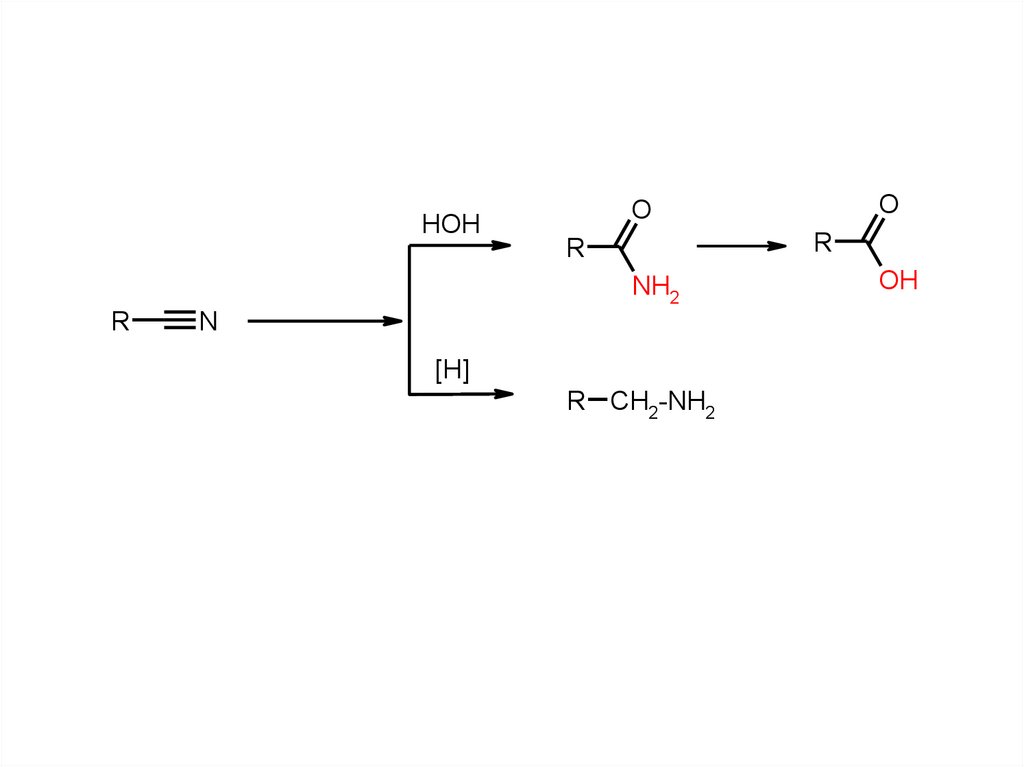
HOHR
R
R
NH2
N
O
O
[H]
R CH2-NH2
OH



 Химия
Химия








