Похожие презентации:
Спирты, фенолы, простые эфиры
1.
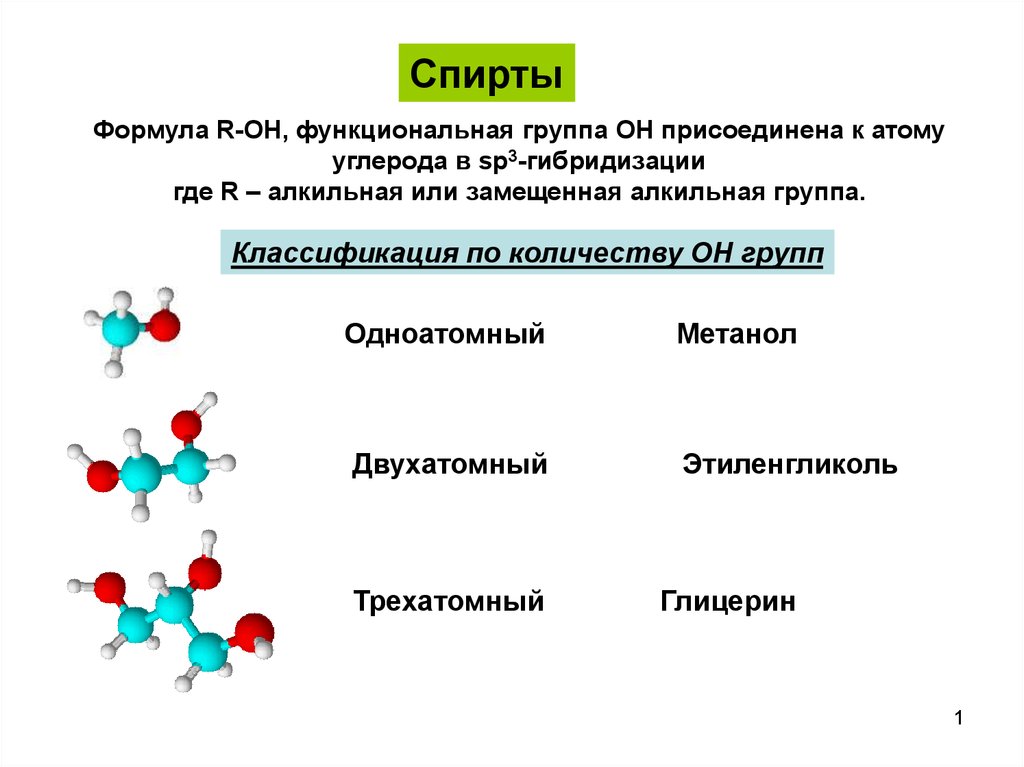
СпиртыФормула R-OH, функциональная группа OH присоединена к атому
углерода в sp3-гибридизации
где R – алкильная или замещенная алкильная группа.
Классификация по количеству OH групп
Одноатомный
Метанол
Двухатомный
Этиленгликоль
Трехатомный
Глицерин
1
2.
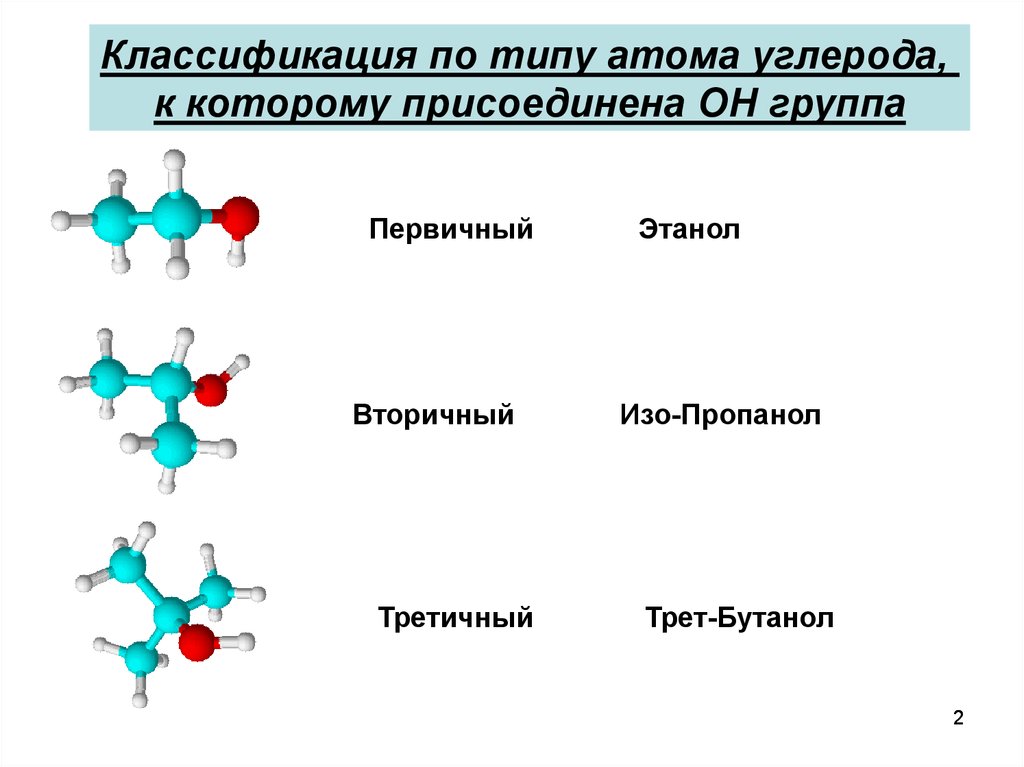
Классификация по типу атома углерода,к которому присоединена OH группа
Первичный
Вторичный
Третичный
Этанол
Изо-Пропанол
Трет-Бутанол
2
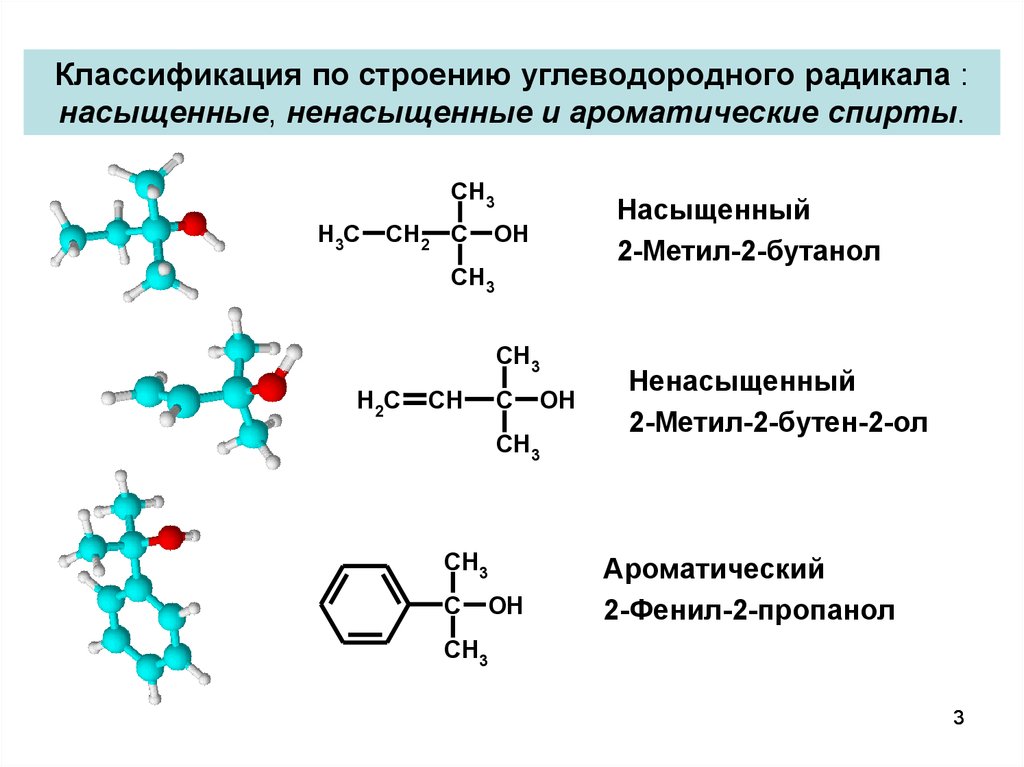
3. Классификация по строению углеводородного радикала : насыщенные, ненасыщенные и ароматические спирты.
CH3H3C
CH2 C
Насыщенный
2-Метил-2-бутанол
OH
CH3
CH3
H2C
CH
C
OH
CH3
CH3
C
OH
Ненасыщенный
2-Метил-2-бутен-2-ол
Ароматический
2-Фенил-2-пропанол
CH3
3
4.
НоменклатураПо номенклатуре IUPAC насыщенные спирты называют
алканолами. В названии присутствует суффикс «ОЛ».
5
Н3С
Br
4
С
3
СН
СН3 СН2
2
СН
1
СН3
5
СН3
4
СН
ОН
3
СН
2
СН
1
СН3
ОН
СН3
4-Бром-4-метил-3-этил-2-пентанол
3-Пентен-2-ол
В соответствии с радикально-функциональной номенклатурой
название спиртов составляется из названия радикала и слова
спирт.
СН3ОН
Метиловый
спирт
СН3СНСН3
ОН
Изопропиловый
спирт
СН2ОН
Бензиловый
спирт
ОН
Циклогексиловый
спирт
4
5.
Способы полученияГидратация алкенов
H2C
CH CH3
+H O
Н+
2
H3C
CH
CH3
OH
Механизм AdE,
пр.Марковникова
возможна перегруппировка
Гидролиз галогеналканов
Br
H3C
CH CH3
NaOH, H2O, T
-NaBr
OH
H3C
CH CH3
Механизм SN1, SN2
Если SN1, возможна
перегруппировка.
Конкурирующая реакция:
отщепление (E1,E2)
5
6.
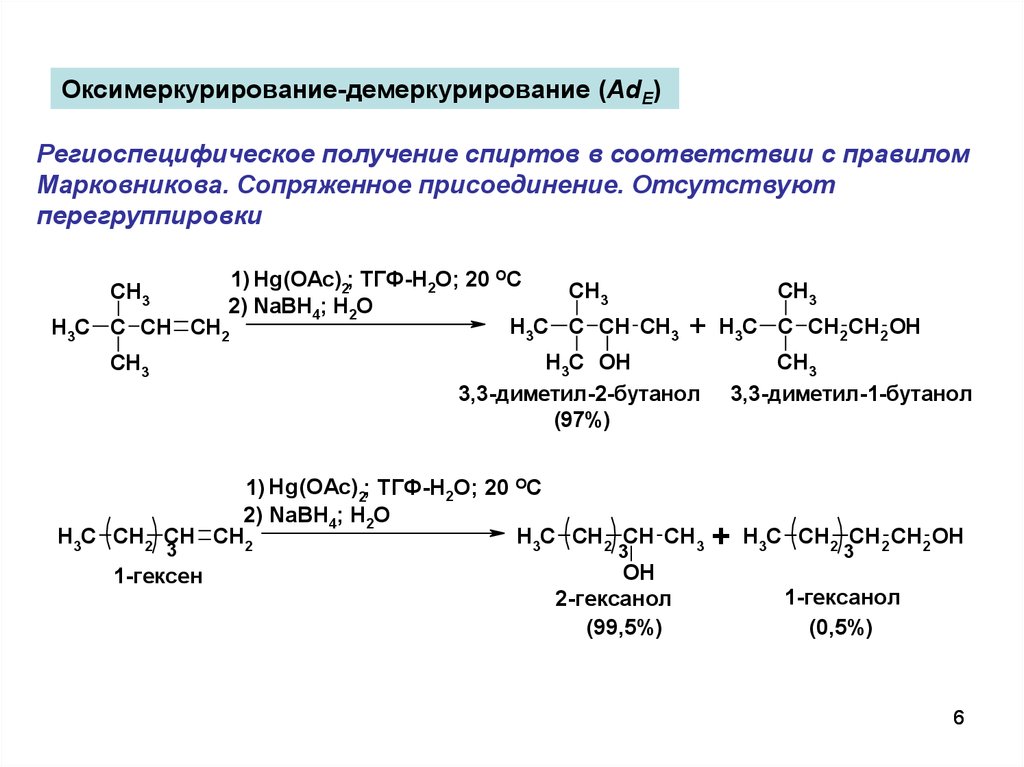
Оксимеркурирование-демеркурирование (AdE)Региоспецифическое получение спиртов в соответствии с правилом
Марковникова. Сопряженное присоединение. Отсутствуют
перегруппировки
1) Hg(OAc)2; ТГФ-H2O; 20 OC
CH3
2) NaBH4; H2O
H3C C CH CH3
H3C C CH CH2
CH3
+
H3C OH
3,3-диметил-2-бутанол
(97%)
CH3
1) Hg(OAc)2; ТГФ-H2O; 20 OC
2) NaBH4; H2O
H3C CH2 CH CH2
H3C CH2 CH CH3
3
1-гексен
3
OH
2-гексанол
(99,5%)
CH3
H3C C CH2 CH2 OH
CH3
3,3-диметил-1-бутанол
+
H3C CH2 CH2 CH2 OH
3
1-гексанол
(0,5%)
6
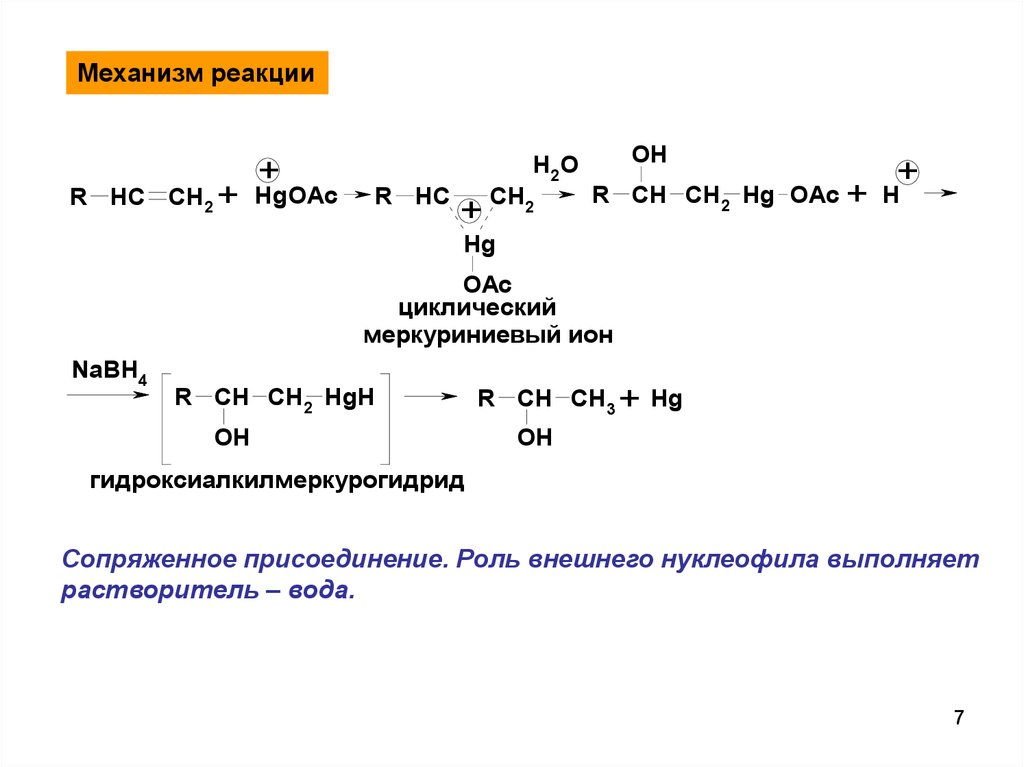
7.
Механизм реакцииR HC CH2 +
+
HgOAc
R HC
H2 O
+
CH2
OH
+
R CH CH2 Hg OAc + H
Hg
OAc
циклический
меркуриниевый ион
NaBH4
R CH CH2 HgH
OH
R CH CH3 + Hg
OH
гидроксиалкилмеркурогидрид
Сопряженное присоединение. Роль внешнего нуклеофила выполняет
растворитель – вода.
7
8.
Синтез с помощью реактива ГриньяраРеакция с альдегидами и кетонами. AdN
(H) R1
+
С
(H) R2
О
R3
(абс. эф.) (H) R1
+
MgBr
(H) R2
H2O, HCl
С
О
R3
MgBr
-MgBrCl
(H) R1
(H) R2
С
ОH
R3
Формальдегид→первичный спирт
Альдегиды→вторичный спирт
Кетоны→третичный спирт
абс.
H
H2O, HCl
эфир
CH3CH2CH2OMgBr
C O + CH3CH2MgBr
CH3CH2CH2OH
H
пропоксимагний1-пропанол
бромид
абс.
CH3
CH3
H3C
эфир
H2O, HCl
C O + CH3CH2MgBr
H3C H2C HC OMgBr
H3C H2C HC OH MgClBr
H
2-бутоксимагний2-бутанол
бромид
абс.
CH3
CH3
H3C
H2O, HCl
эфир
C O + CH3CH2MgBr
H3C H2C C OMgBr
H3C H2C C OH
H3C
CH3
CH3
2-метил-2-бутоксимагний2-метил-2-бутанол
бромид
8
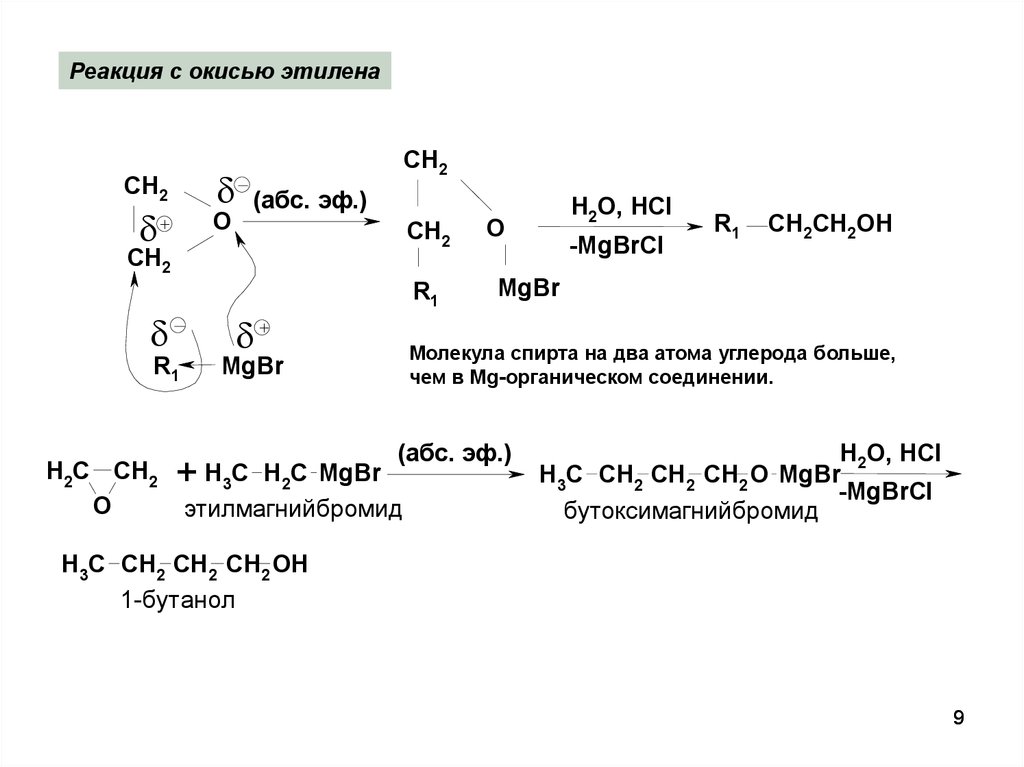
9.
Реакция с окисью этиленаСН2
О
+
СН2
(абс. эф.)
СН2
СН2
R1
R1
H2C CH2
O
+
MgBr
H2O, HCl
О
-MgBrCl
R1
CH2СН2OH
MgBr
Молекула спирта на два атома углерода больше,
чем в Mg-органическом соединении.
(абс. эф.)
MgBr
H
C
H
C
+ 3 2
этилмагнийбромид
H2O, HCl
H3C CH2 CH2 CH2 O MgBr
-MgBrCl
бутоксимагнийбромид
H3C CH2 CH2 CH2 OH
1-бутанол
9
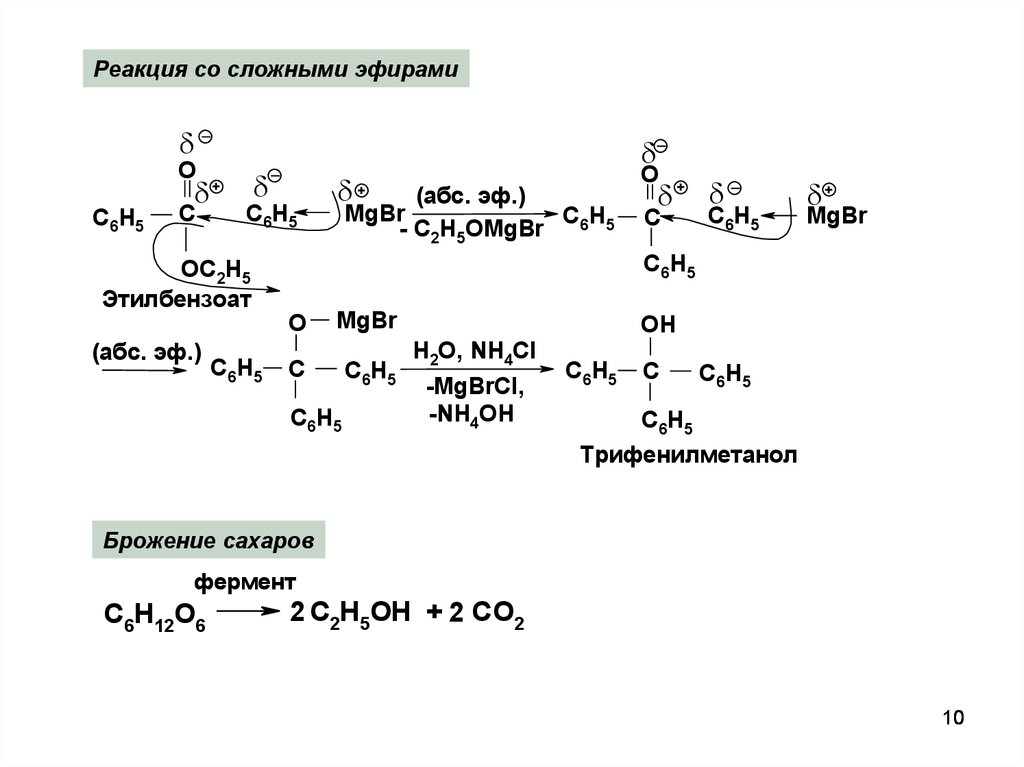
10.
Реакция со сложными эфирамиO
С6Н5
+
С
С6Н5
ОС2Н5
Этилбензоат
(абс. эф.)
С6Н5
+
(абс. эф.)
MgBr
С6Н5
- С2Н5ОMgBr
O
+
С
С6Н5
+
MgBr
С6Н5
О
MgBr
С
С6Н5
С6Н5
ОН
H2O, NH4Cl
-MgBrCl,
-NH4OH
С6Н5
С
С6Н5
С6Н5
Трифенилметанол
Брожение сахаров
фермент
C6H12O6
2 C2H5OH + 2 CO2
10
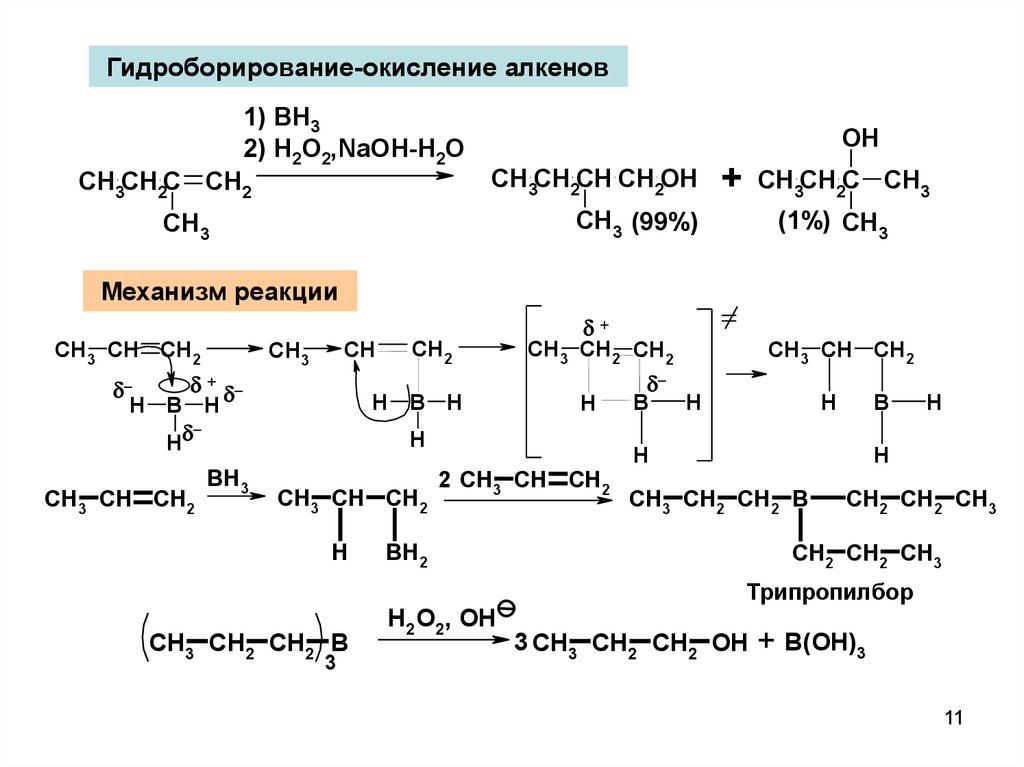
11.
Гидроборирование-окисление алкенов1) BH3
2) H2O2,NaOH-H2O
OH
CH3CH2CH CH2OH
CH3CH2C CH2
+
CH3CH2C CH3
CH3 (99%)
CH3
(1%) CH3
Механизм реакции
CH3 CH CH2
CH
CH3
H B H
H
CH2
CH3 CH2 CH2
CH3 CH CH2
BH3
H B H
H
H
CH3 CH CH2
H
CH3 CH2 CH2 B
3
2 CH3 CH CH2
CH3 CH CH2
B
H
H
H
H
H
CH3 CH2 CH2 B
BH2
H2O2, OH
B
CH2 CH2 CH3
CH2 CH2 CH3
Трипропилбор
3 CH3 CH2 CH2 OH
+ B(OH)3
11
12.
Механизм реакцииq-заряды на атомах
q = - 0,2260
q = - 0,1619
CH3
CH3
CH CH2
H BH2
Электроотрицательность
водорода 2,1 > бора 1,9
Стерический фактор
CH3
CH3
CH2
H
BH2
CH3
CH
H
CH2
H
ПС1
BH2
CH
+
CH2
H2B
Rбора > Rводорода
+
CH
+
CH
Локализация положительного
заряда на вторичном атоме
углерода (ПС1) более выгодна,
чем на первичном (ПС2)
CH2
BH2
H
CH3
ПС2
CH
CH2
H
BH2
12
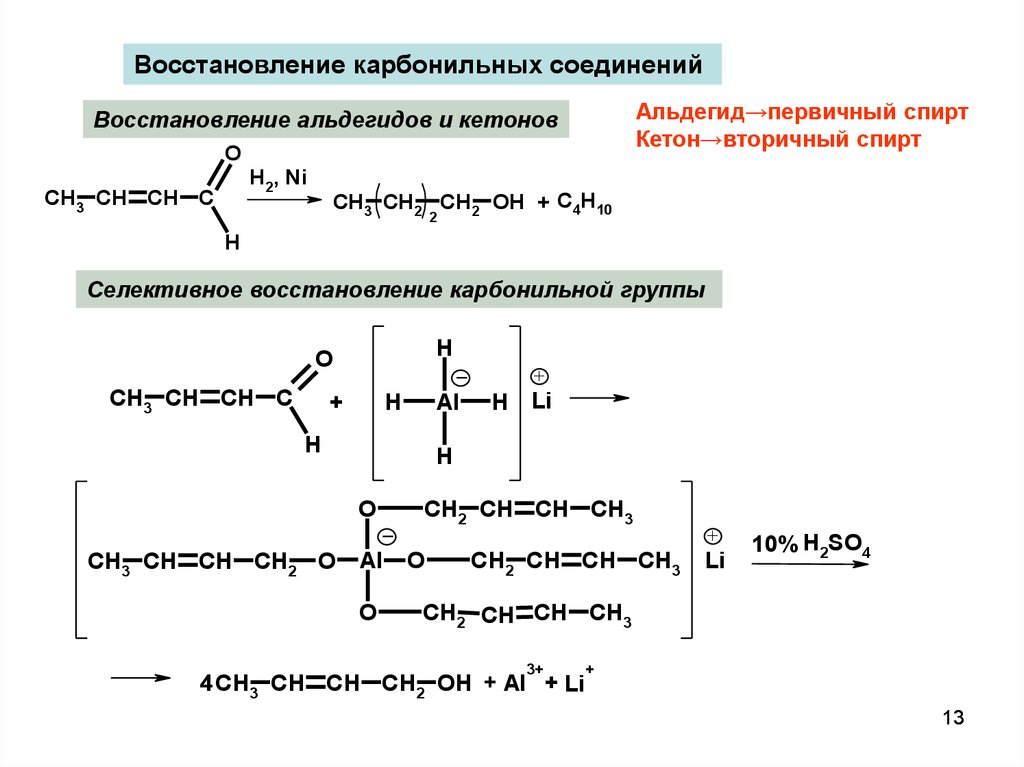
13.
Восстановление карбонильных соединенийАльдегид→первичный спирт
Кетон→вторичный спирт
Восстановление альдегидов и кетонов
O
H2, Ni
CH3 CH CH C
CH3 CH2 CH2 OH + C4H10
2
H
Селективное восстановление карбонильной группы
H
O
CH3 CH CH C
+
+
H
Al
H
Li
H
O
CH3 CH CH CH2 O
H
Al
O
CH2 CH CH CH3
O
CH2 CH CH CH3
+
Li
10% H2SO4
CH2 CH CH CH3
3+
4 CH3 CH CH CH2 OH + Al + Li
+
13
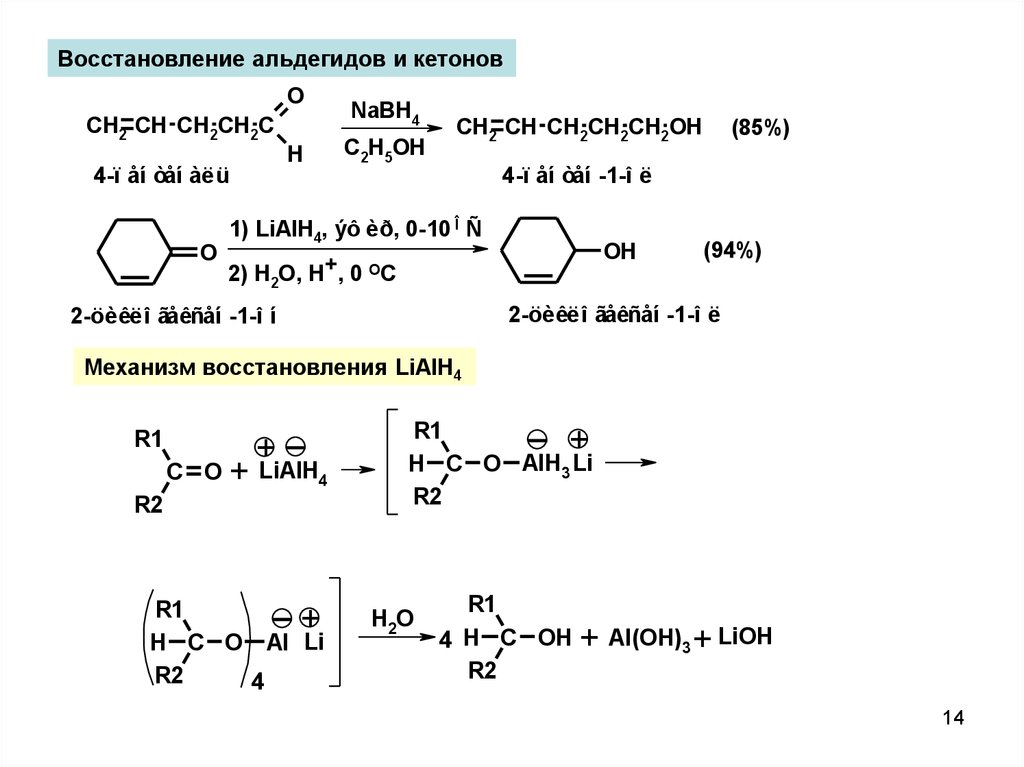
14.
Восстановление альдегидов и кетоновO
CH2 CH CH2CH2C
H
NaBH4
C2H5OH
CH2 CH CH2CH2CH2OH
4-ï åí òåí -1-î ë
4-ï åí òåí àëü
O
(85%)
1) LiAlH4, ýô èð, 0-10 Î Ñ
OH
2) H2O, H+, 0 OC
(94%)
2-öèêëî ãåêñåí -1-î ë
2-öèêëî ãåêñåí -1-î í
Механизм восстановления LiAlH4
R1
C O
+
+ LiAlH4
R2
R1
+
H C O Al Li
R2
4
R1
+
H C O AlH3 Li
R2
H 2O
R1
4 H C OH
R2
+ Al(OH)3 + LiOH
14
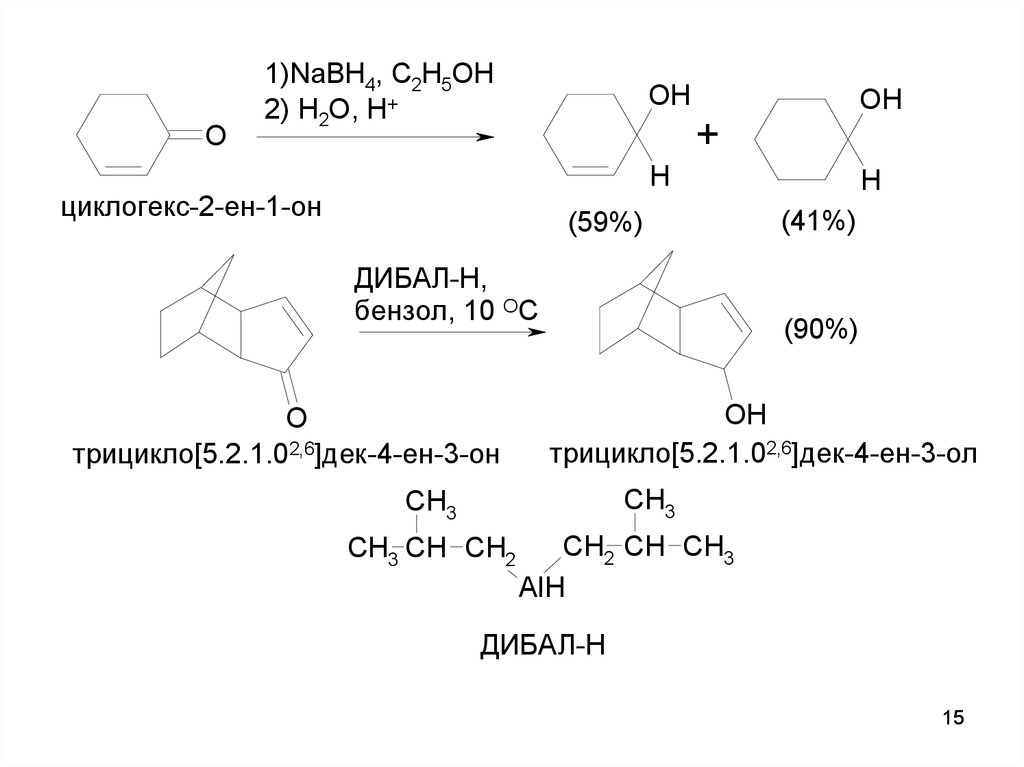
15.
O1)NaBH4, C2H5OH
2) H2O, H+
OH
OH
+
H
циклогекс-2-ен-1-он
(59%)
ДИБАЛ-Н,
бензол, 10 ОС
O
трицикло[5.2.1.02,6]дек-4-ен-3-он
H
(41%)
(90%)
OH
трицикло[5.2.1.02,6]дек-4-ен-3-ол
CH3
CH3
CH3 CH CH2
CH2 CH CH3
AlH
ДИБАЛ-Н
15
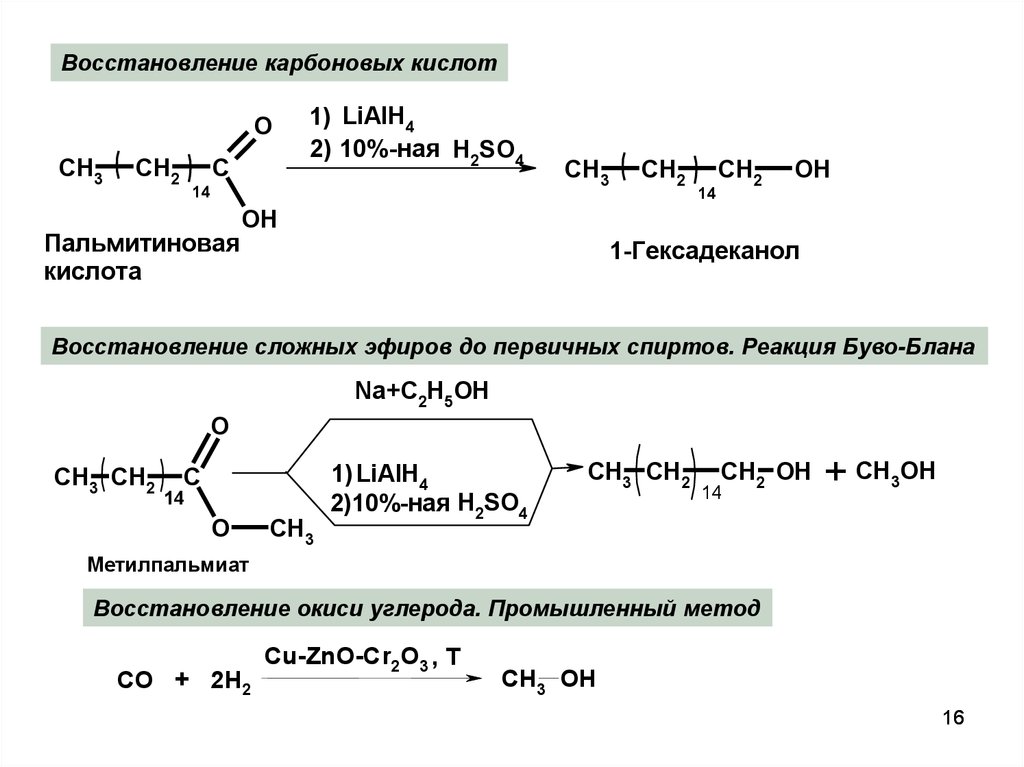
16.
Восстановление карбоновых кислотO
CH3
CH2
C
1) LiAlH4
2) 10%-ная H2SO4
14
Пальмитиновая
кислота
CH3
CH2
14
CH2
OH
OH
1-Гексадеканол
Восстановление сложных эфиров до первичных спиртов. Реакция Буво-Блана
Na+C2H5OH
O
CH3 CH2
C
14
O
CH3
1) LiAlH4
2)10%-ная H2SO4
CH3 CH2
CH2 OH
14
+ CH3OH
Метилпальмиат
Восстановление окиси углерода. Промышленный метод
СО + 2Н2
Cu-ZnO-Cr2O3 , Т
CH3 OH
16
17.
Физические свойстваСравнение физических свойств спиртов и углеводородов
Спирт
Углеводород
Молекуляр Тпл. ОС
ная масса
Ткип. ОС
Растворимость в
100 мл воды, мл
СН3ОН
СН3 СН3
32
30
-98,0
-172,0
65,0
-89,0
Неограниченная
4,7
СН3СН2ОН
СН3СН2СН3
45
44
-117,3
-189,9
78,5
-42,2
Неограниченная
6,5
СН3СН2СН2ОН
СН3СН2СН2CH3
60
58
-127,0
-135,0
97,2
-0,6
Неограниченная
15,0
17
18.
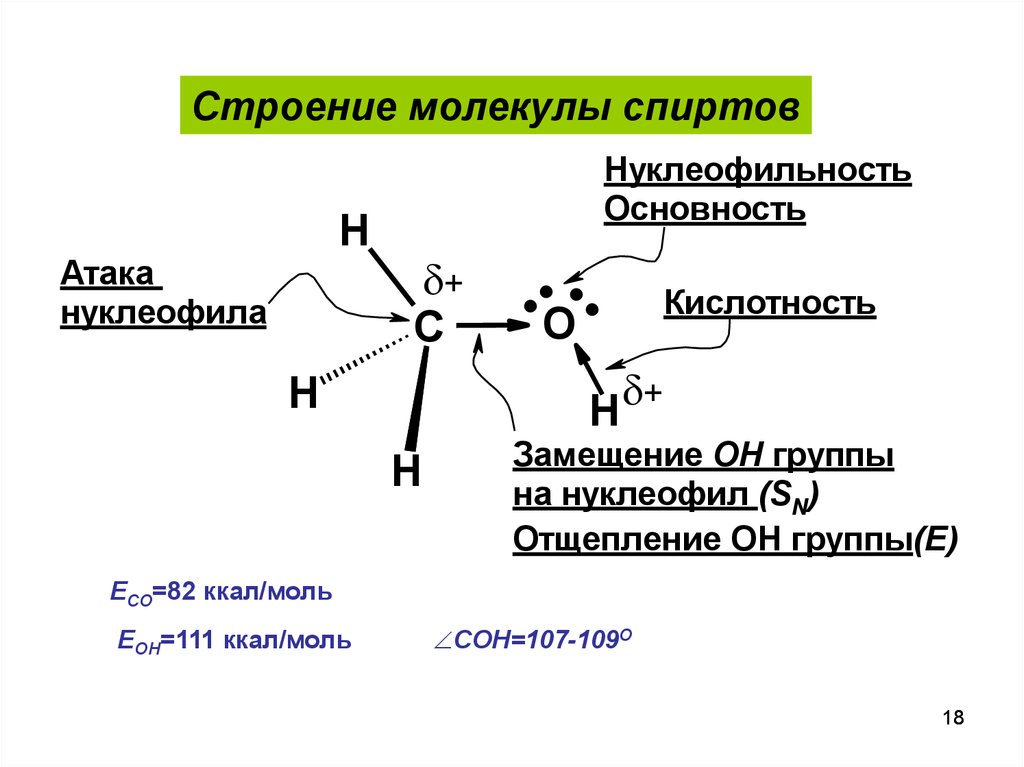
Строение молекулы спиртовH
Атака
нуклеофила
Нуклеофильность
Основность
+
C
....
O
Кислотность
H +
H
H
Замещение OH группы
на нуклеофил (SN)
Отщепление OH группы(E)
ECO=82 ккал/моль
EOH=111 ккал/моль
COH=107-109О
18
19.
Водородные связиE=3-6 ккал/моль
19
20.
Химические свойства1. Кислотность спиртов
CH2
CH3
CH2
OH
CH2
CH3
OH
CH3
+ Na
O
CH2
CH3
+
ONa
H
+
+ 1/2 H2
Этоксид Na
Этилат Na
CH2
CH3
ONa
+
H2O
Более сильная
кислота, чем
этанол
CH2
CH3
OH + NaOH
Менее сильная
кислота, чем
вода
20
21.
Кислотность спиртов в водных растворахR OH
R
O
+
H
+
pKa
трет-Бутанол
18,0
Этанол
15,9
Метанол
15,5
Вода
15,7
FCH2CH2OH
13,9
CF3CH2OH
12,4
(CF3)3COH
5,0
Ka
[RO ][H ]
[ROH]
pKa=-lgKa
+I-эффект
алкильных групп
-M-эффект F
21
22.
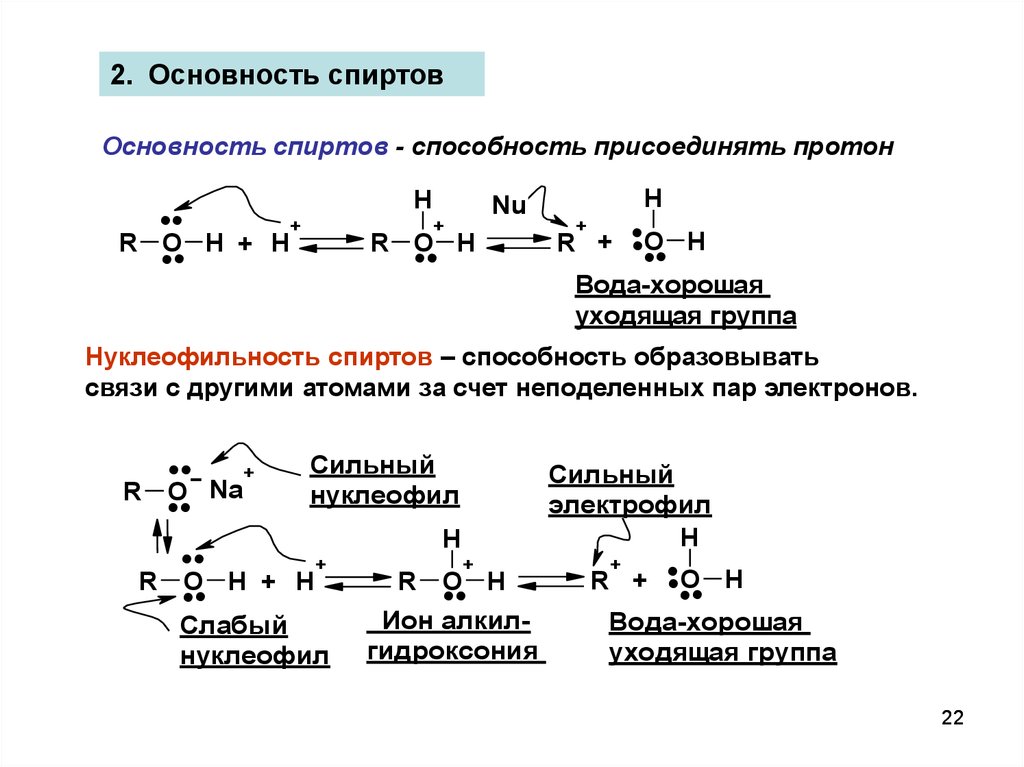
2. Основность спиртовОсновность спиртов - способность присоединять протон
....
H
R O H + H
..
+
+
R O H
...
H
Nu
+
R +
O H
Вода-хорошая
уходящая группа
Нуклеофильность спиртов – способность образовывать
связи с другими атомами за счет неподеленных пар электронов.
....
....
R O Na
+
Сильный
нуклеофил
R O H + H
H
+
Слабый
нуклеофил
..
+
R O H
Ион алкилгидроксония
Сильный
электрофил
H
+
R +
...
O H
Вода-хорошая
уходящая группа
22
23.
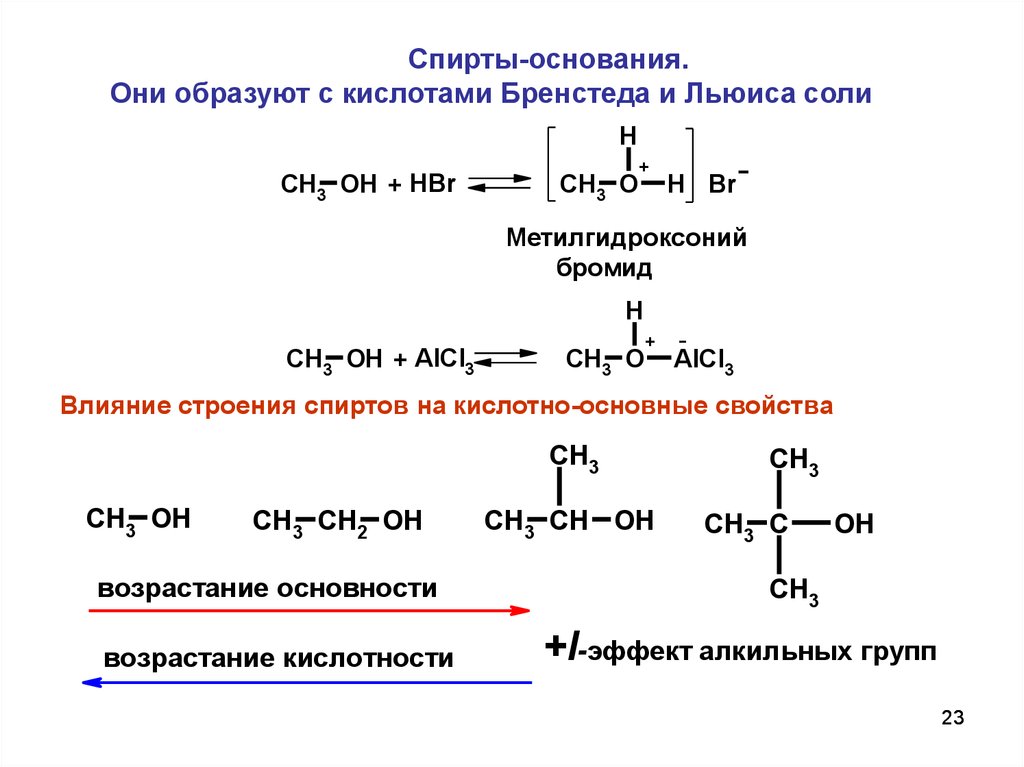
Спирты-основания.Они образуют с кислотами Бренстеда и Льюиса соли
H
CH3 OH + HBr
+
CH3 O
H Br
Метилгидроксоний
бромид
H
CH3 OH + AlCl3
+
CH3 O
AlCl3
Влияние строения спиртов на кислотно-основные свойства
CH3
CH3 OH
CH3 CH2 OH
возрастание основности
возрастание кислотности
CH3 CH OH
CH3
CH3 C
OH
CH3
+I-эффект алкильных групп
23
24.
3. Спирты-нуклеофильные агентыПолучение простых эфиров
СH3СH2OH + HOCH2CH3
H
Механизм реакции SN2ac
H
CH3CH2O :
CH3
C
H
Нуклеофил
+
CH3CH2O
H
H
H
H
+
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Конкурирующая реакция E
Реакция обратима
CH3
+
OH2
H
Субстрат
CH3
C
+
+
СH3СH2OH2
+
СH3СH2OH +
Первичные спирты.
Межмолекулярная дегидратация
H 2O
'
CH3CH2O
C
'
OH2
-H2O
H
H
H
Переходное состояние
CH3CH2 O
CH2CH3
+
+
H 3O
24
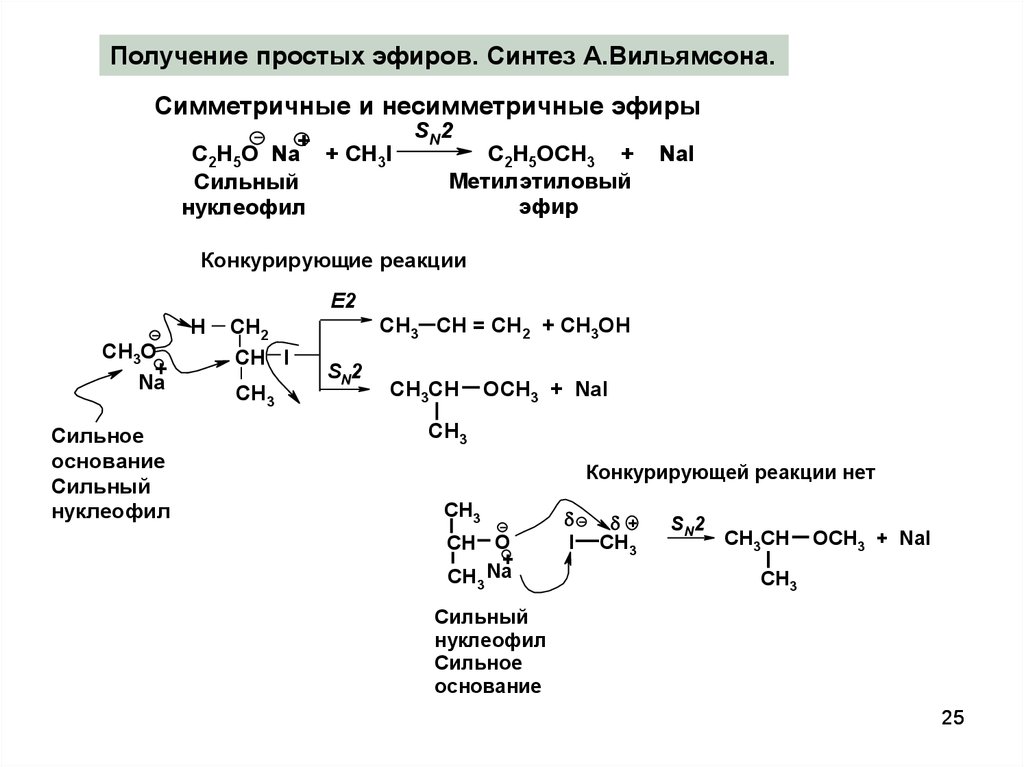
25.
Получение простых эфиров. Синтез А.Вильямсона.Симметричные и несимметричные эфиры
SN2
+
С2Н5О Na + CH3I
C2H5OCH3 +
Метилэтиловый
Сильный
эфир
нуклеофил
NaI
Конкурирующие реакции
E2
H
CH3О
+
Na
Сильное
основание
Сильный
нуклеофил
CH2
CH I
CH3
CH3 CH = CH2 + CH3OH
SN2
CH3CH
OCH3 + NaI
CH3
Конкурирующей реакции нет
CH3
CH О
+
CH Na
3
I
+
CH3
SN2
CH3CH
OCH3 + NaI
CH3
Сильный
нуклеофил
Сильное
основание
25
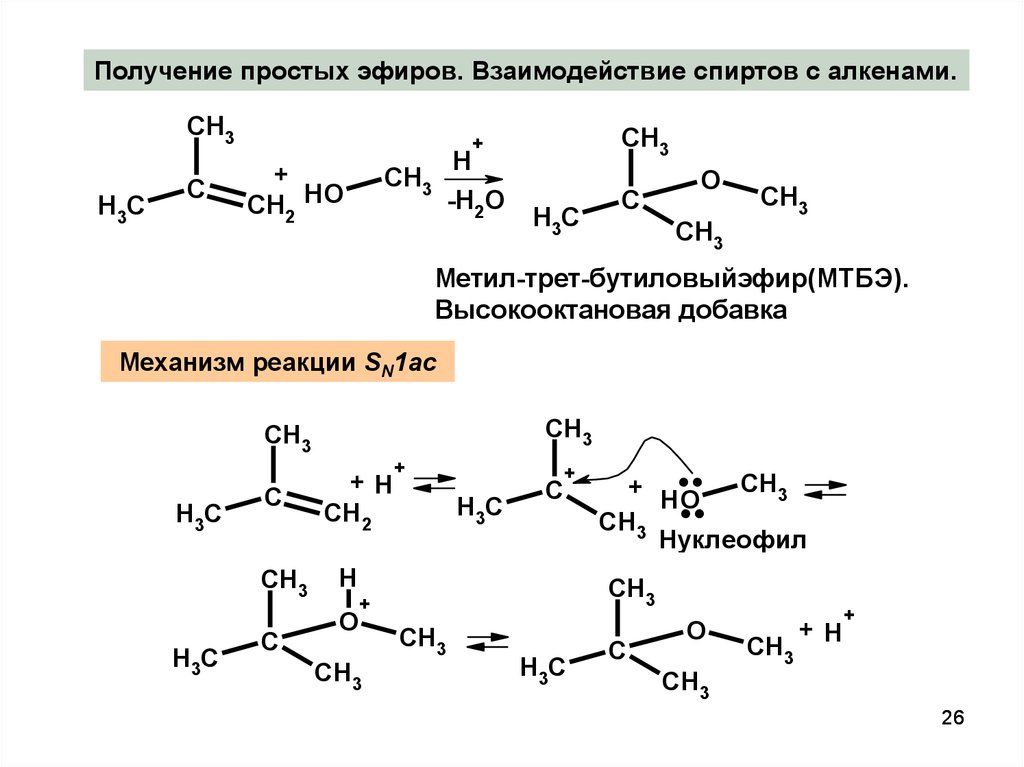
26.
Получение простых эфиров. Взаимодействие спиртов с алкенами.CH3
H3C
C
CH3
+
+
CH2 HO
H
-H2O
CH3
H3C
C
O
CH3
CH3
Метил-трет-бутиловыйэфир(МТБЭ).
Высокооктановая добавка
Механизм реакции SN1ac
H3C
C
CH3
H3C
C
....
CH3
CH3
+H
CH2
+
H3C
C
+
H
CH3
+
O
CH3
CH3
+
HO
CH3
Нуклеофил
CH3
H3C
C
O
CH3
+H
+
CH3
26
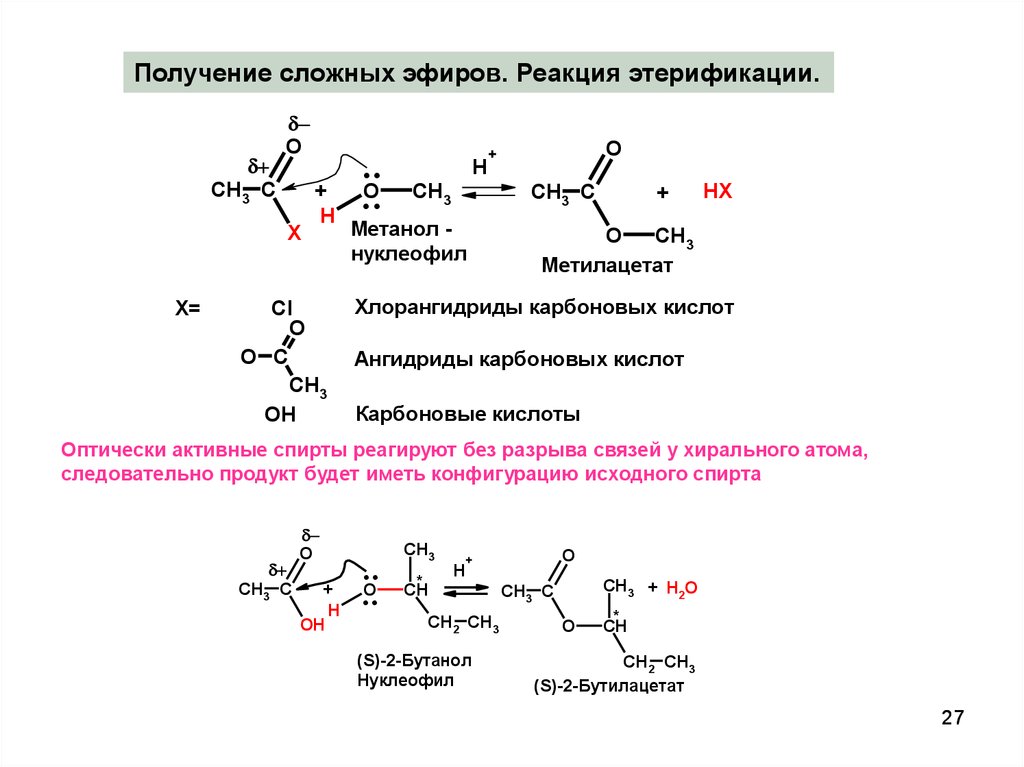
27.
Получение сложных эфиров. Реакция этерификации.CH3 C
O
X
X=
+
H
Cl
O
O C
CH3
OH
..
O
..
H
O
+
CH3
CH3 C
Метанол нуклеофил
+
HX
O
CH3
Метилацетат
Хлорангидриды карбоновых кислот
Ангидриды карбоновых кислот
Карбоновые кислоты
Оптически активные спирты реагируют без разрыва связей у хирального атома,
следовательно продукт будет иметь конфигурацию исходного спирта
CH3 C
O
+
H
OH
..
O
..
CH3
*
CH
H
O
+
CH2 CH3
(S)-2-Бутанол
Нуклеофил
CH3 + H2O
CH3 C
O
*
CH
CH2 CH3
(S)-2-Бутилацетат
27
28.
Сложные эфиры минеральных кислотO
2 CH3OH
+
H2SO4
H3C O S O CH3
+
2 H 2O
O
O
2 CH3OH
+
ClSO2OH
H3C O S O CH3
Õëî ðñóëüô î í î âàÿ
êèñëî òà
O
+
H 2O
+ HCl
Äèì åòèëñóëüô àòàëêèëèðóþ ù èé àãåí ò
O
CH3OH
+
ClSO2OH
Õëî ðñóëüô î í î âàÿ
êèñëî òà
CH3OH
+ HNO3
H3C O S OH
+
H 2O
+ HCl
O
Måòèëñóëüô àòàëêèëèðóþ ù èé àãåí ò
H3C O NO2 + H2O
Ì åòèëí èòðàòâçðû â÷àòî å
âåù åñòâî
28
29.
4. Нуклеофильное замещение OH-группыПревращение спиртов в галогенпроизводные
Реагенты:
Галогенводороды (HCl, HBr, Na(K)Br+H2SO4, Na(K)I+H2SO4)
Хлориды-, бромиды фосфора (PCl3 PBr3)
Хлористый тионил (SOCl2)
Смесь фосфора и йода
Хлорокись фосфора (POCl3)
CH3CH2CH2CH2OH
CH3CH2CH CH3
OH
CH3
CH3 C OH
2ч
NaBr+H2SO4, 60 OC
HCl, H2O, 20 OC
CH3
CH3
OH
48% HBr+H2SO4, 120 OC
10 мин
HCl (газ.), 0 OC
эфир
CH3CH2CH2CH2 Br + H2O
(95%)
CH3CH2CH CH3 + NaHSO4+ H2O
(60%) Br
CH3
CH3 C Cl + H2O
CH3
CH3
(90%) + H2O
Cl
29
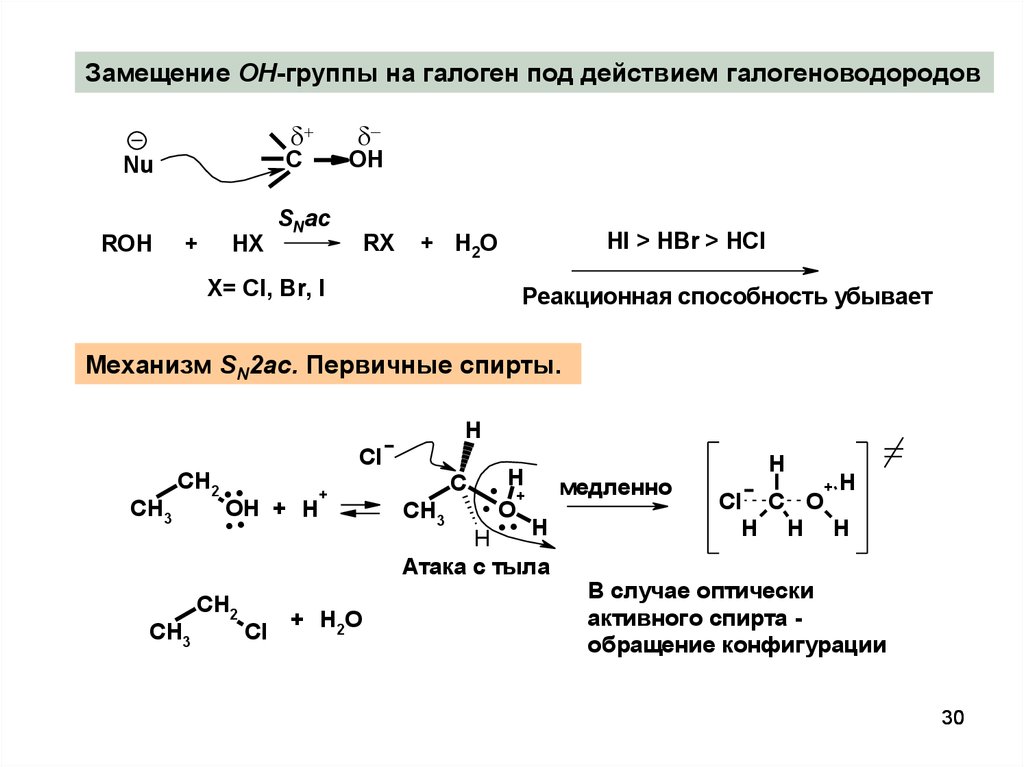
30.
Замещение OH-группы на галоген под действием галогеноводородовC
Nu
ROH
+
HX
SNac
OH
RХ
HI > HBr > HCl
+ H2O
X= Cl, Br, I
Реакционная способность убывает
Механизм SN2ac. Первичные спирты.
H
CH2 . .
+
+ H
OH
CH3
.
Cl
.
CH3
CH2
Cl
+ H 2O
H
H
C . + медленно
+H
Cl
C
O
.
O.
CH3
.
H
H H H
H
Атака с тыла
В случае оптически
активного спирта обращение конфигурации
30
31.
Механизм SN1ac. Вторичные, третичные спирты.H
C2H5
*CH OH
+
Оптически
CH3
активный
спирт
медленно
-H2O
H
+
+
C2H5 *CH O H
CH3
H
C
Cl
+
C2H5 *CH
C2H5
Cl
CH3
Рацемат
CH3
Карбокатион,
атака нуклеофила
с двух сторон
Перегруппировка
CH3
CH3CH CH CH3
H
+
CH3C
H
1,2-H-сдвиг
CH CH3
+
CH3CH CH CH3
H
OH
CH3
CH3
+
O
медленно
-H2O
НСМО карбокатиона
H
CH3
CH3
+
+
H3C C CH2 CH3 Br
более устойчивый
третичный карбокатион
H3C
C
CH2CH3
Br
31
32.
Реакционная способность спиртов по отношению к галогенводородамБензиловый, аллиловый > третичный > вторичный >первичный > метанол
SN1
Устойчивость карбокатиона возрастает, реакционная
способность увеличивается
SN2
Пространственные
препятствия для атаки
с тыла уменьшаются,
реакционная
способность
увеличивается
32
33.
Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3,тионилхлоридом SOCl2.
CH3
Br
CH
PBr3
CH3
OH
CH
CH3
CH
CH3
CH3
PCl5
+
P(OH)3
CH3
Cl
CH
CH
CH
CH3
SOCl2
CH3
CH3
3-Метил-2-бутанол
CH3
Cl
CH
CH3
+ POCl3 + HCl
CH
+
SO2
+ HCl
CH3
33
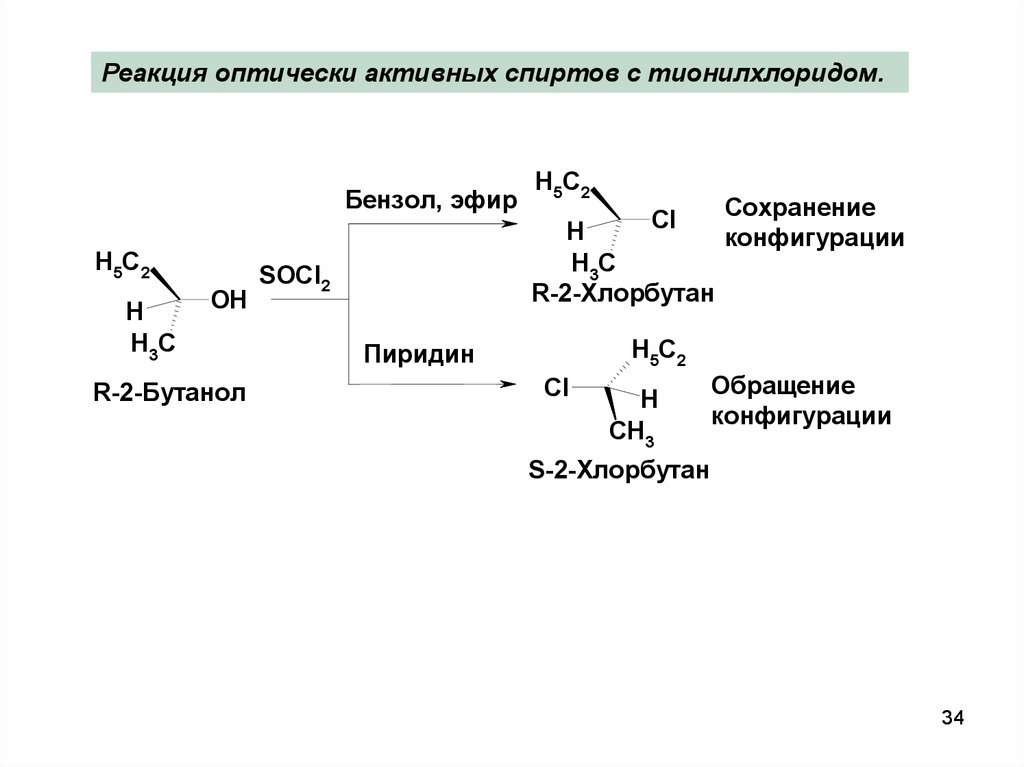
34.
Реакция оптически активных спиртов с тионилхлоридом.Бензол, эфир
H5C2
H
H3C
OH
R-2-Бутанол
H5C2
Cl
H
H3C
R-2-Хлорбутан
SOCl2
Сохранение
конфигурации
H5C2
Пиридин
Cl
H
CH3
Обращение
конфигурации
S-2-Хлорбутан
34
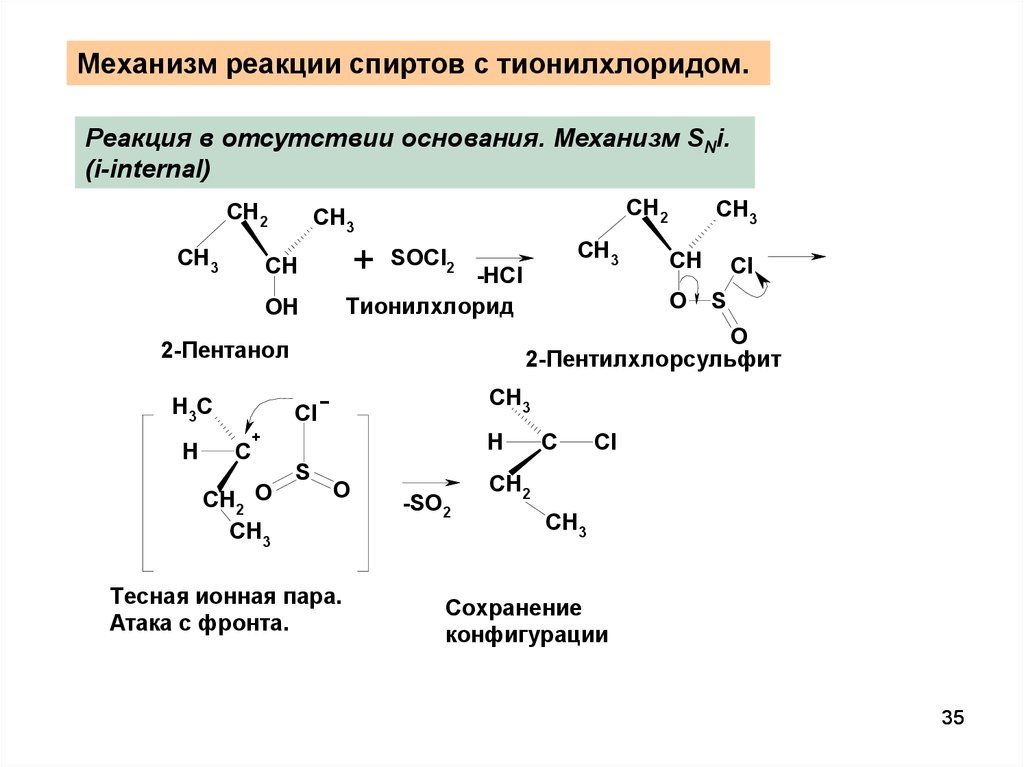
35.
Механизм реакции спиртов с тионилхлоридом.Реакция в отсутствии основания. Механизм SNi.
(i-internal)
CH2
CH3
CH2
CH3
+
CH
-HCl
Тионилхлорид
OH
H
+
CH2 O
CH3
O
Cl
S
CH3
Cl
C
CH
O
2-Пентилхлорсульфит
2-Пентанол
H3C
CH3
SOCl2
CH3
H
S
O
Тесная ионная пара.
Атака с фронта.
-SO2
C
Cl
CH2
CH3
Сохранение
конфигурации
35
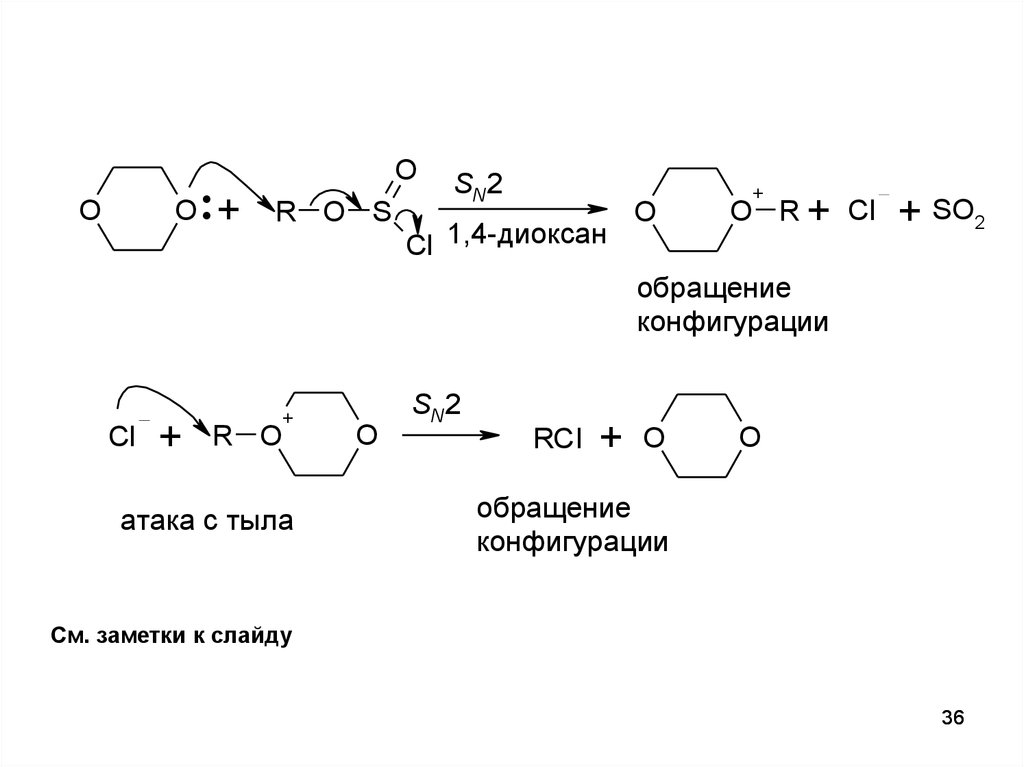
36.
.O. +
O
O
R O S
SN2
Cl 1,4-диоксан
O
+
O R + Cl
+ SO2
обращение
конфигурации
Cl
+
R O
+
атака с тыла
O
SN2
RCl
+
O
O
обращение
конфигурации
См. заметки к слайду
36
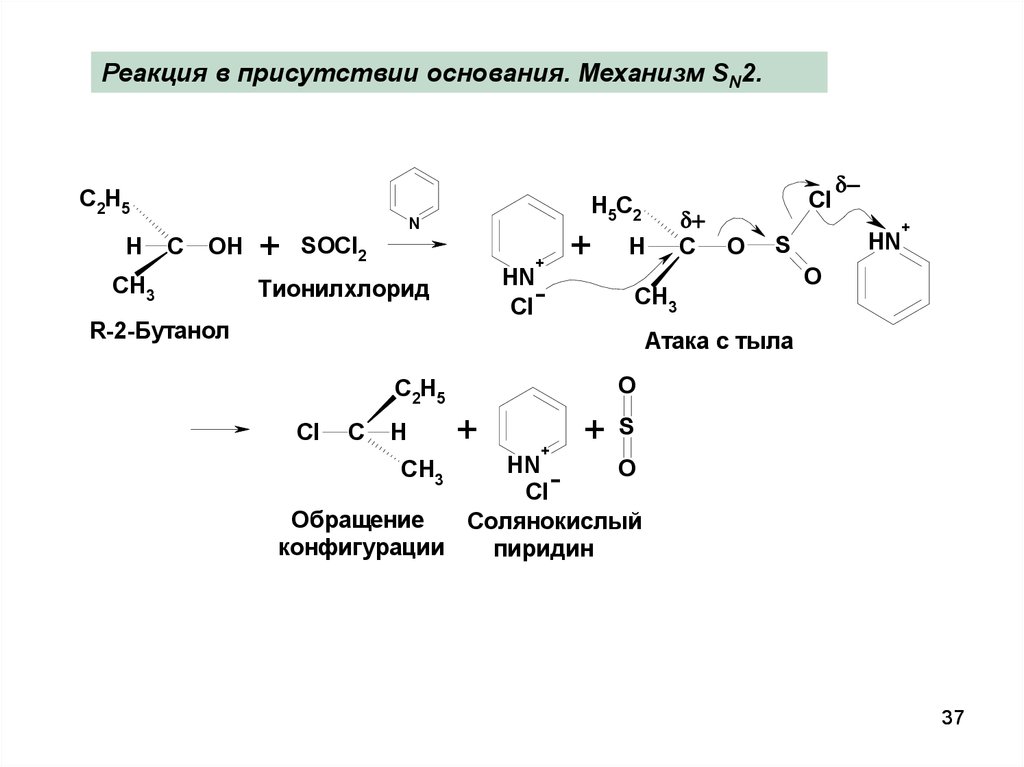
37.
Реакция в присутствии основания. Механизм SN2.C2H5
H
C
OH
CH3
+
H5C2
N
SOCl2
HN
Cl
Тионилхлорид
R-2-Бутанол
+
+
H
C O
Cl
HN
S
CH3
+
O
Атака с тыла
O
C2H5
Cl
C
H
+
+
+
S
HN
O
Cl
Обращение
Солянокислый
конфигурации
пиридин
CH3
37
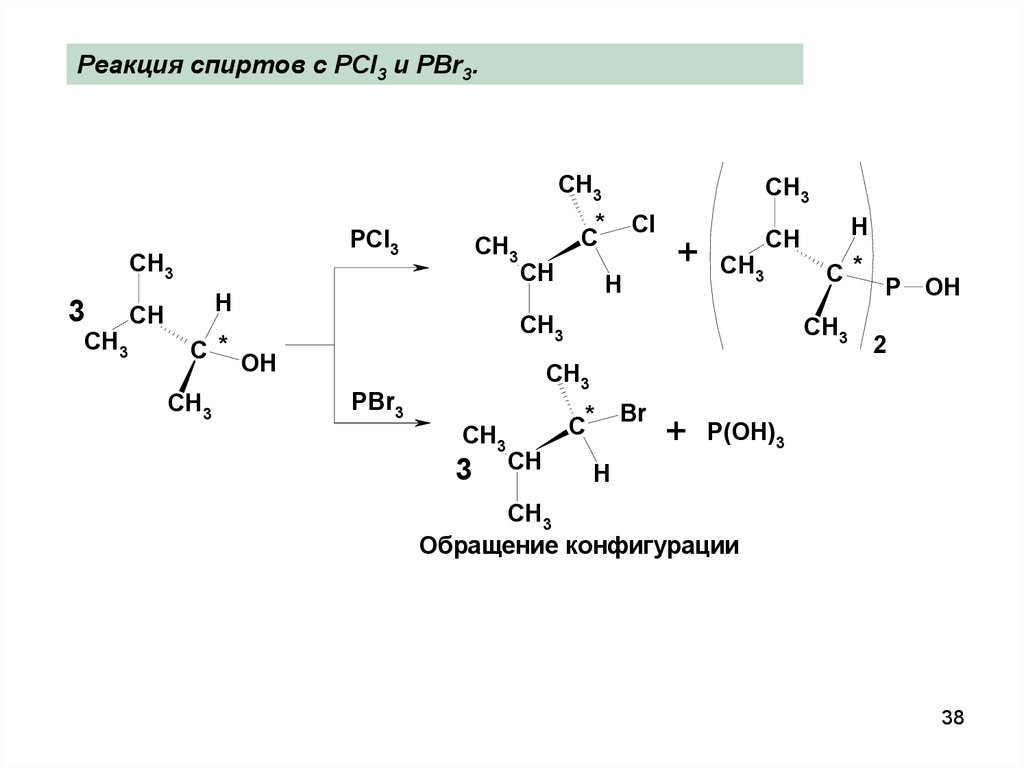
38.
Реакция спиртов с PCl3 и PBr3.CH3
PCl3
CH3
3
CH3
CH3
H
CH
C *
CH3
CH3
*
C
CH
Cl
H
+
CH3
CH
CH3
OH
PBr3
H
C*
CH3
P OH
2
CH3
CH3
3
C*
CH
Br
+
P(OH)3
H
CH3
Обращение конфигурации
38
39.
Механизм реакции спиртов с PBr3.H3C
3
H3C
C
+
OH
H
C3H7-i
PBr3
C
-3 HBr
R-3-Метил-2-бутанол
CH3
Br
C
H
O P
C3H7-i
H
C3H7-i
H3C
+
O P
H Br 3 Br
SN2
3
три(1,3-диметилпропил)фосфит
H
C3H7-i
3
CH3
C
Переходное состояние
P
Последовательно
три раза атака Brаниона с тыла
CH3
H
C3H7-i
C O
3 Br
2
C
H
C3H7-i
+
P(OH)3
Обращение конфигурации
Анион BrΘ более активный нуклеофил, чем анион ClΘ
39
40.
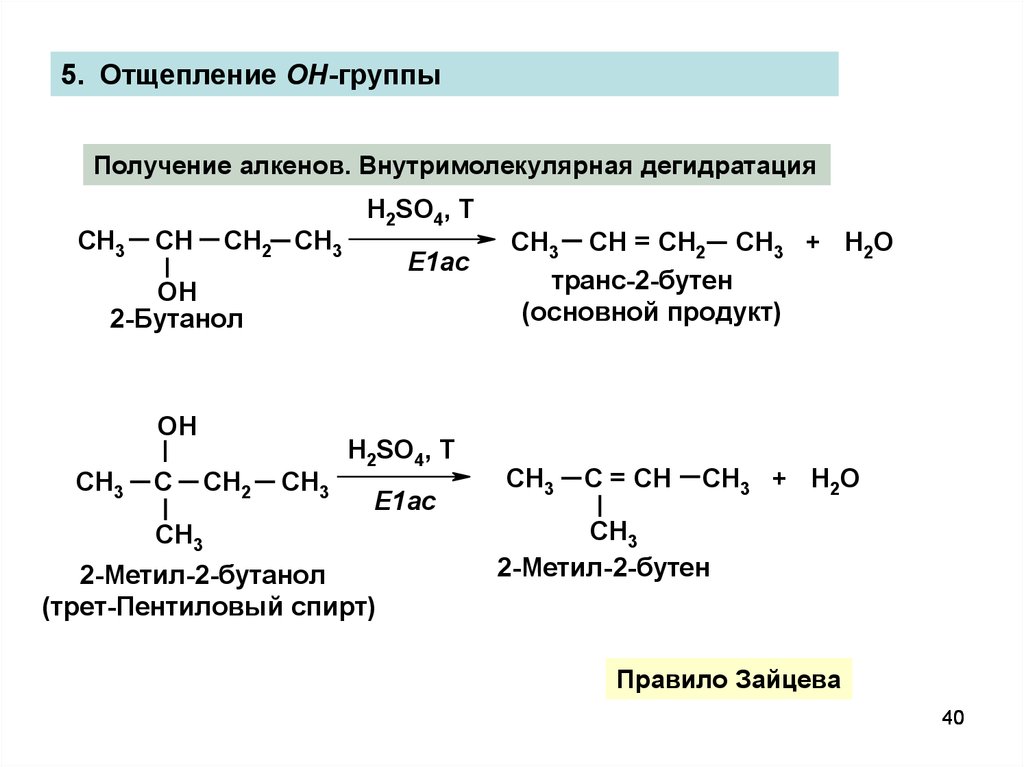
5. Отщепление OH-группыПолучение алкенов. Внутримолекулярная дегидратация
H2SO4, T
CH3
CH
CH2 CH3
E1ac
OH
2-Бутанол
ОН
CH3
C
H2SO4, T
CH2
CH3
E1ac
СН3
2-Метил-2-бутанол
(трет-Пентиловый спирт)
CH3 CH = CH2 CH3 + H2O
транс-2-бутен
(основной продукт)
CH3
C = CH
CH3 + Н2О
СН3
2-Метил-2-бутен
Правило Зайцева
40
41.
Первичные спирты.CH2
CH3
OH
CH2
96% H2SO4, 180OC
H3C
HC CH2
-H2O
Механизм реакции E2ac
..
..
1) CH3 CH2 OH + H
+
CH2 CH2
H
..H
..O H
+
H2C
CH2 + H2O + H2SO4
OSO2OH
Синхронно: отрыв воды
и протона
O
2) RCH2CH2OH + H2SO4
O
RCH2CH2
HSO4-
O S OH + H2O
O
RCH CH2 + H2SO4 + HSO4R CH CH2 O S OH
170 - 190 OC
O
H
41
42.
Вторичные, третичные спирты.Механизм E1ac. Возможна перегруппировка
CH3
C
CH3
CH3
CH3
CH3
H2SO4, 80 ОС
CH
OH
3-Метил-2-бутанол
CH3
CH3
CH
CH
CH3
+ OH
C
+
CH
CH3
Более устойчивый
третичный карбокатион CH3
C
CH3
+
1,2-CН3-сдвиг
CH3
H
2
CH3
CH3
CH3
CH3
-H+
C
CH3
CH
CH3
Более устойчивый, более
алкилированный алкен
Правило Зайцева
Основным продуктом реакции отщепления от галогеналканов с
двумя неэквивалентными С -атомами является наиболее
устойчивый (наиболее алкилированный, термодинамически
устойчивый) алкен.
42
43.
Направление реакции каталитической дегидратации спиртовH3C
CH2 CH2
5
CH CH3
OH
300-400 OC
ThO2
Al2O3
H3C
CH2 CH
5
по Зайцеву
CH CH3
H3C
CH2 CH2 CH
5
CH2
по Гофману
43
44.
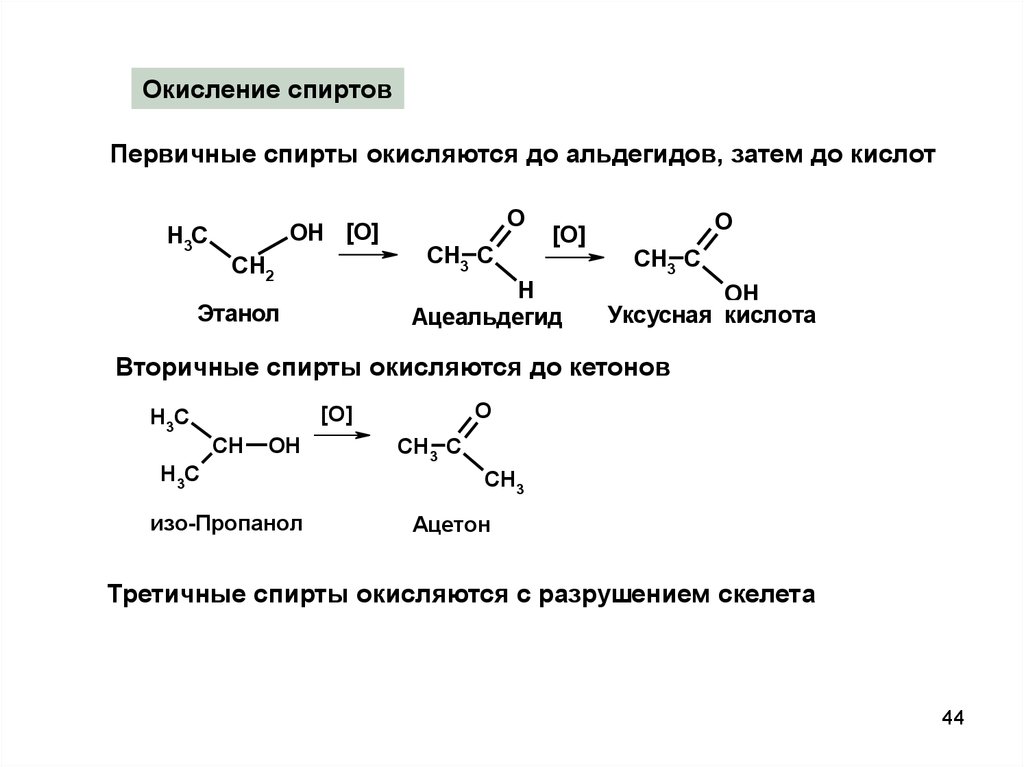
Окисление спиртовПервичные спирты окисляются до альдегидов, затем до кислот
H3C
OH [O]
CH2
O
CH3 C
[O]
H
Ацеальдегид
Этанол
O
CH3 C
OH
Уксусная кислота
Вторичные спирты окисляются до кетонов
H3C
O
[O]
CH
OH
H3C
изо-Пропанол
CH3 C
CH3
Ацетон
Третичные спирты окисляются с разрушением скелета
44
45.
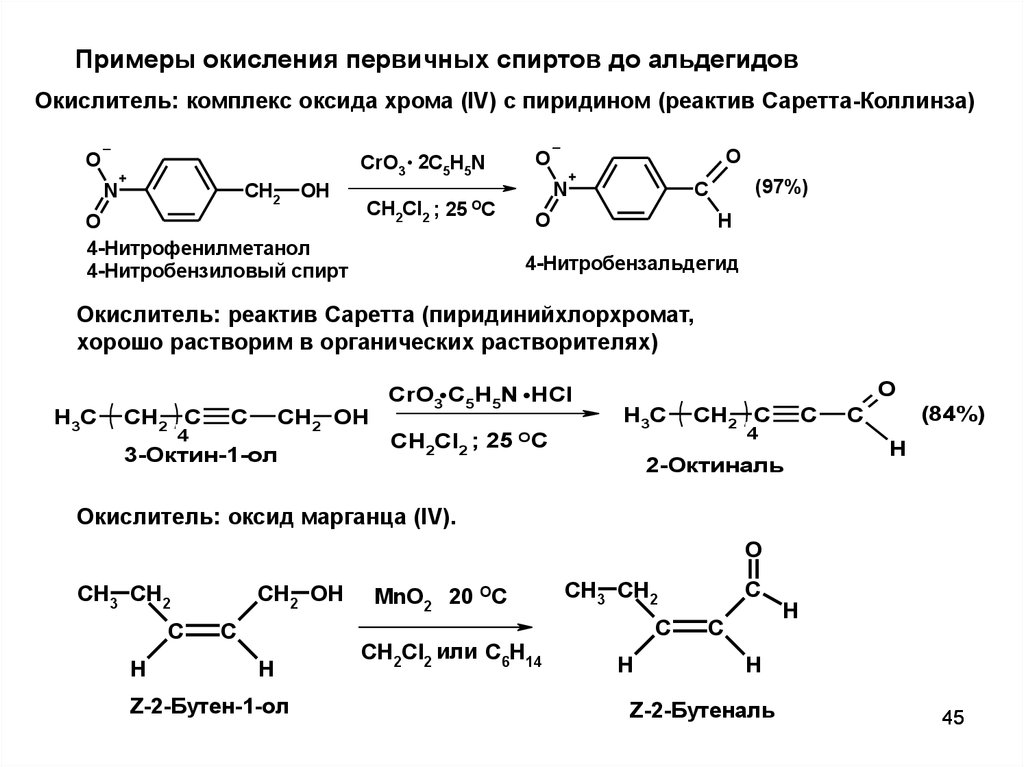
Примеры окисления первичных спиртов до альдегидовОкислитель: комплекс оксида хрома (IV) с пиридином (реактив Саретта-Коллинза)
.
O
N
+
CH2
OH
O
4-Нитрофенилметанол
4-Нитробензиловый спирт
CH2Cl2 ;
O
O
CrO3 2C5H5N
N
25 OC
+
(97%)
C
O
H
4-Нитробензальдегид
Окислитель: реактив Саретта (пиридинийхлорхромат,
хорошо растворим в органических растворителях)
H3C
CH2 C
4
C
CH2 OH
3-Октин-1-ол
.
.
CrO3 C5H5N HCl
CH2Cl2 ; 25
OC
O
H3C
CH2 C
C
4
2-Октиналь
(84%)
C
H
Окислитель: оксид марганца (IV).
O
CH2 OH
CH3 CH2
C
H
C
H
Z-2-Бутен-1-ол
MnO2 20 OC
CH2Cl2 или C6H14
C
CH3 CH2
C
H
C
H
H
Z-2-Бутеналь
45
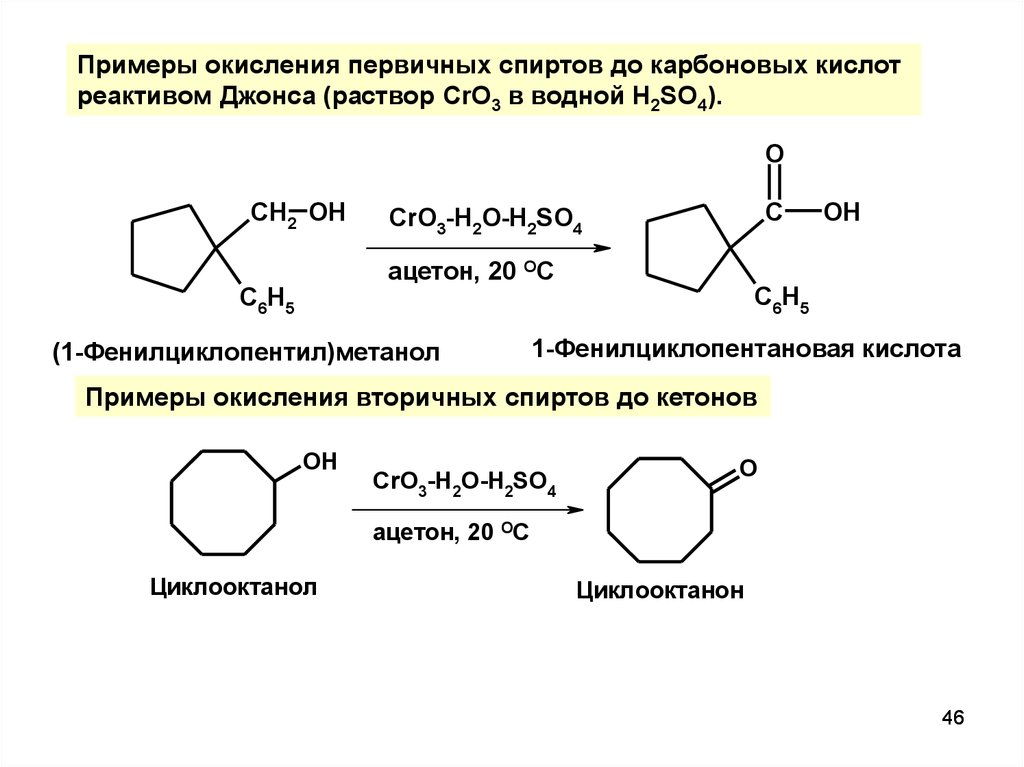
46.
Примеры окисления первичных спиртов до карбоновых кислотреактивом Джонса (раствор CrO3 в водной H2SO4).
O
CH2 OH
C
CrO3-H2O-H2SO4
ацетон, 20 ОС
C6H5
(1-Фенилциклопентил)метанол
OH
C6H5
1-Фенилциклопентановая кислота
Примеры окисления вторичных спиртов до кетонов
OH
CrO3-H2O-H2SO4
O
ацетон, 20 ОС
Циклооктанол
Циклооктанон
46
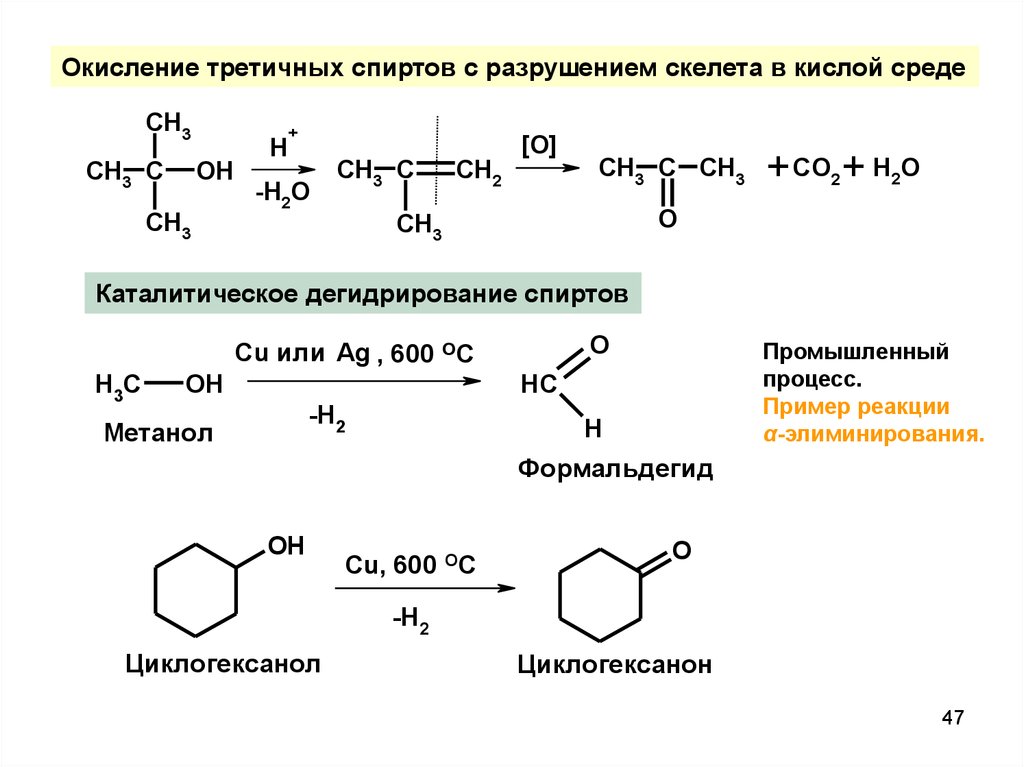
47.
Окисление третичных спиртов с разрушением скелета в кислой средеCH3
CH3 C
OH
CH3
H
+
-H2O
CH3 C
CH2
[O]
CH3 C CH3
+ CO2 + H2O
O
CH3
Каталитическое дегидрирование спиртов
O
Cu или Ag , 600 ОС
H3C
OH
Промышленный
процесс.
Пример реакции
α-элиминирования.
HC
-H2
Метанол
H
Формальдегид
OH
Cu, 600 OC
O
-H2
Циклогексанол
Циклогексанон
47
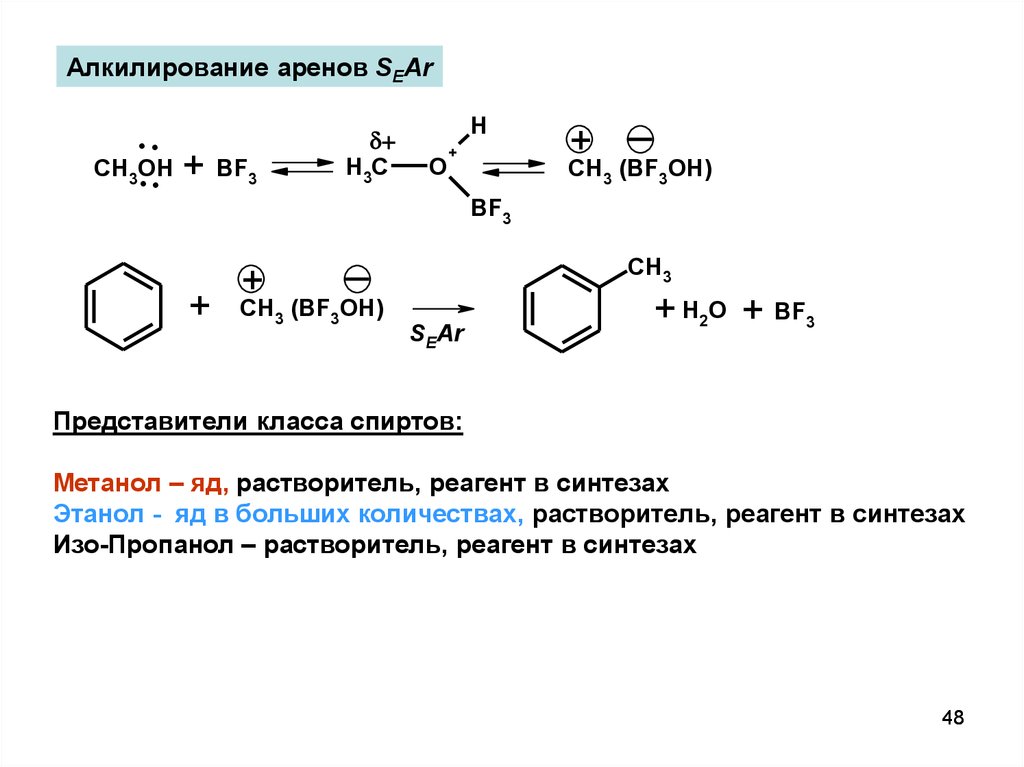
48.
Алкилирование аренов SEAr..
CH .OH
. + BF
3
3
+
H3C
H
O
+
CH3 (BF3OH)
BF3
CH3
+
CH3 (BF3OH)
+
SEAr
+ H2O + BF3
Представители класса спиртов:
Метанол – яд, растворитель, реагент в синтезах
Этанол - яд в больших количествах, растворитель, реагент в синтезах
Изо-Пропанол – растворитель, реагент в синтезах
48
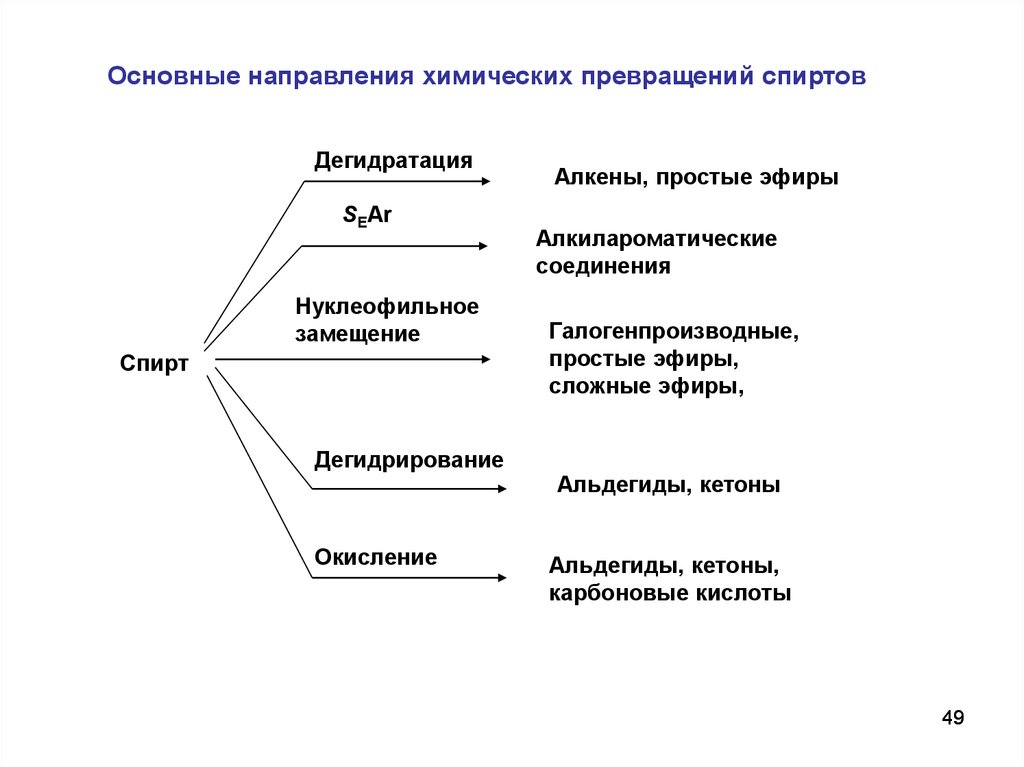
49.
Основные направления химических превращений спиртовДегидратация
SEAr
Нуклеофильное
замещение
Спирт
Дегидрирование
Окисление
Алкены, простые эфиры
Алкилароматические
соединения
Галогенпроизводные,
простые эфиры,
сложные эфиры,
Альдегиды, кетоны
Альдегиды, кетоны,
карбоновые кислоты
49
50.
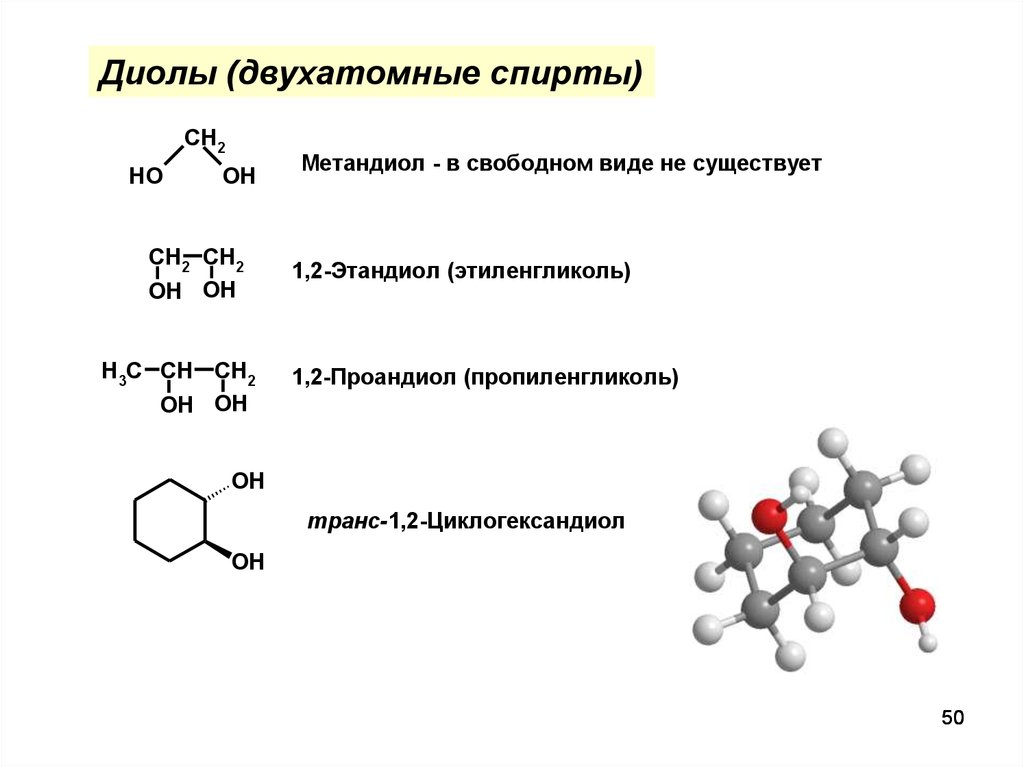
Диолы (двухатомные спирты)CH2
HO
OH
CH2 CH2
OH OH
H3C CH CH2
OH OH
Метандиол - в свободном виде не существует
1,2-Этандиол (этиленгликоль)
1,2-Проандиол (пропиленгликоль)
OH
транс-1,2-Циклогександиол
OH
50
51.
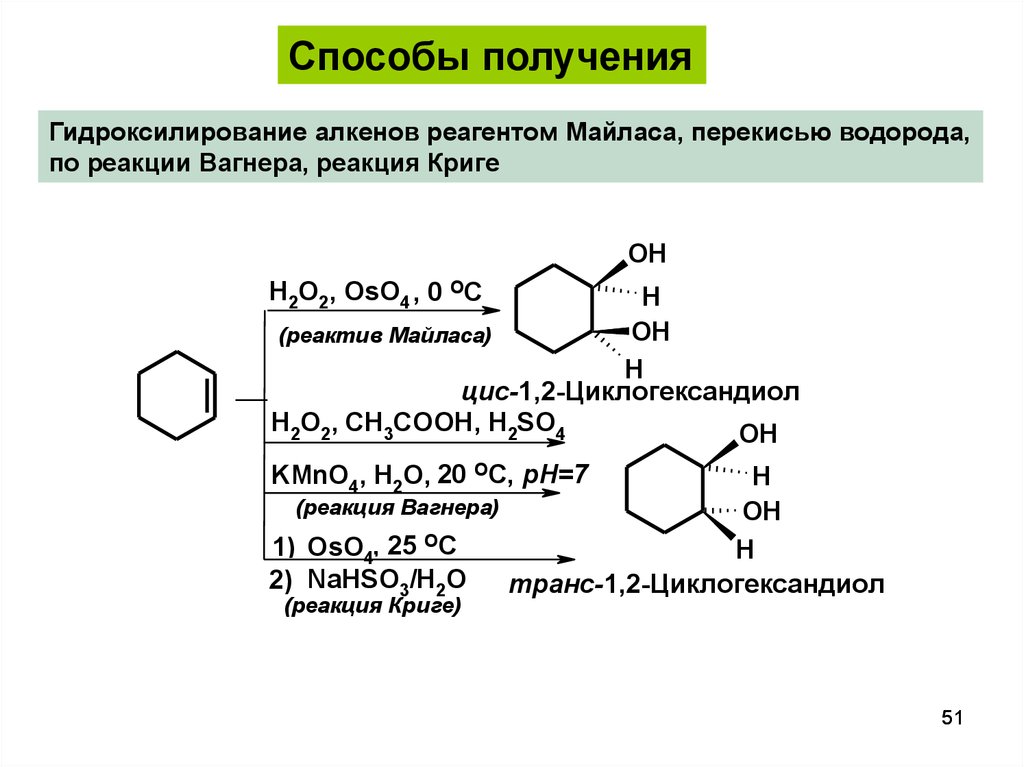
Способы полученияГидроксилирование алкенов реагентом Майласа, перекисью водорода,
по реакции Вагнера, реакция Криге
OH
H2O2, OsO4 , 0 OC
H
OH
(реактив Майласа)
H
цис-1,2-Циклогександиол
H2O2, CH3COOH, H2SO4
OH
KMnO4, H2O, 20 OC, pH=7
H
(реакция Вагнера)
OH
1) OsO4, 25 OC
H
2) NaHSO3/H2O
транс-1,2-Циклогександиол
(реакция Криге)
51
52.
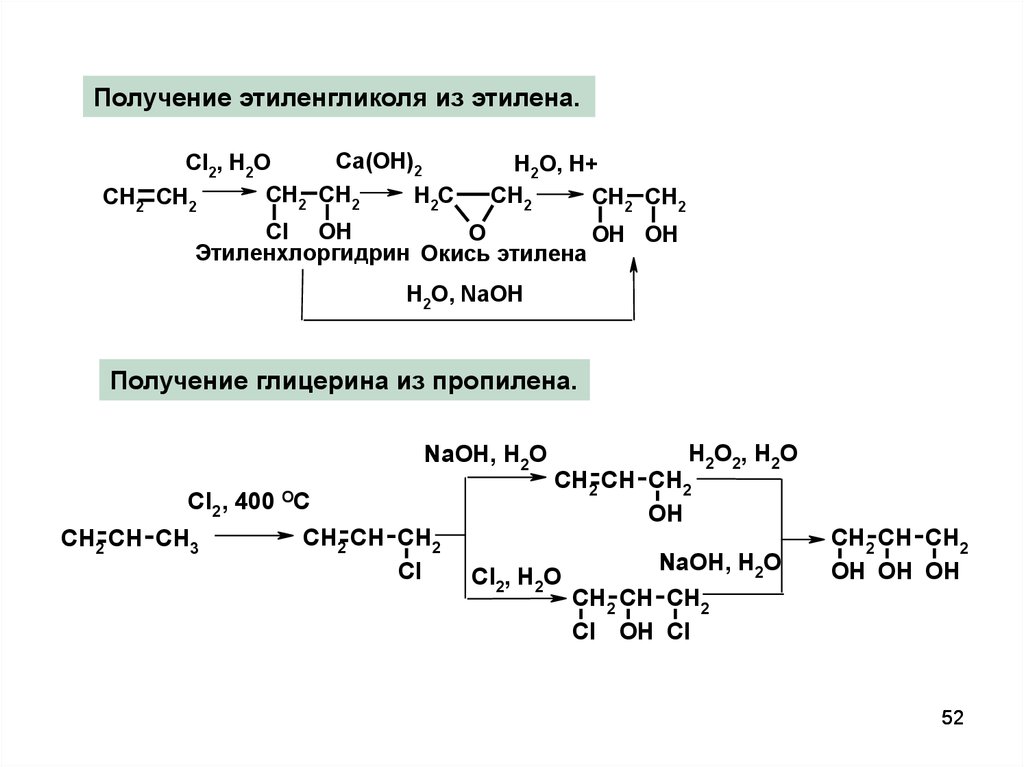
Получение этиленгликоля из этилена.Ca(OH)2
Cl2, H2O
CH2 CH2
H2C
CH2 CH2
H2O, H+
CH2
CH2 CH2
Cl OH
O
OH OH
Этиленхлоргидрин Окись этилена
H2O, NaOH
Получение глицерина из пропилена.
NaOH, H2O
Cl2 , 400
CH2 CH CH3
OC
CH2 CH CH2
Cl
H2O2, H2O
CH2 CH CH2
OH
Cl2, H2O
NaOH, H2O
CH2 CH CH2
OH OH OH
CH2 CH CH2
Cl OH Cl
52
53.
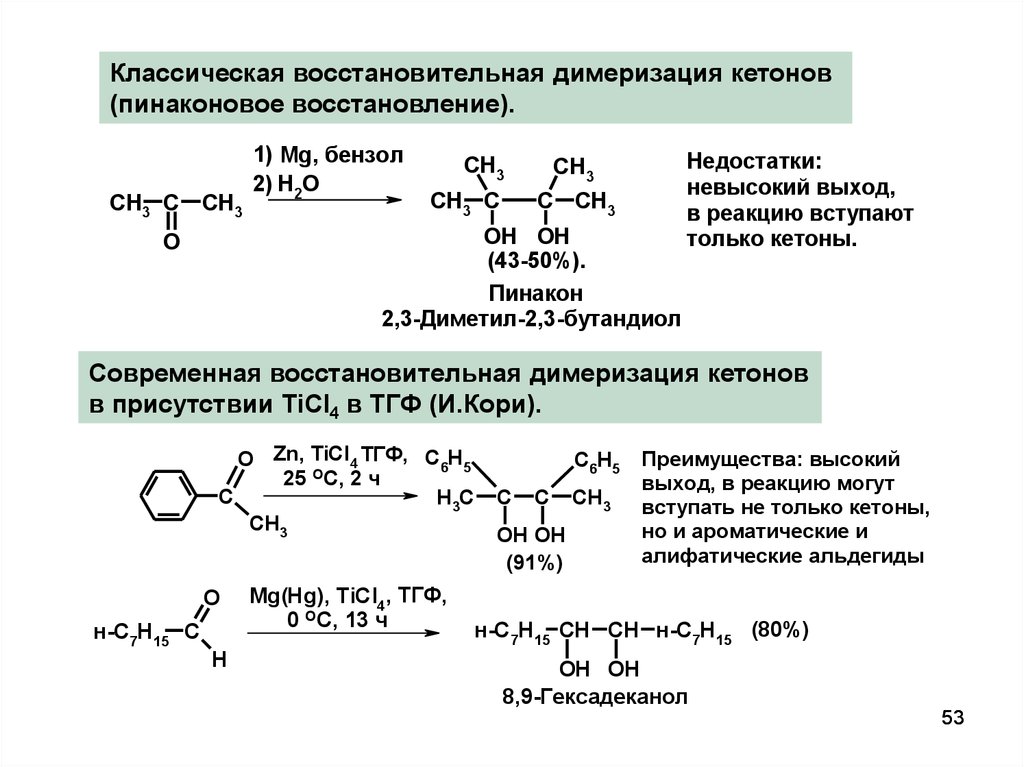
Классическая восстановительная димеризация кетонов(пинаконовое восстановление).
CH3 C
CH3
1) Mg, бензол
2) H2O
CH3
CH3 C
CH3
C CH3
OH OH
(43-50%).
Пинакон
2,3-Диметил-2,3-бутандиол
O
Недостатки:
невысокий выход,
в реакцию вступают
только кетоны.
Современная восстановительная димеризация кетонов
в присутствии TiCl4 в ТГФ (И.Кори).
O Zn, TiCl4 ТГФ, C6H5
25 ОС, 2 ч
C
H3C
CH3
O
н-C7H15 C
H
Mg(Hg), TiCl4, ТГФ,
0 ОС, 13 ч
C6H5
C
C
OH OH
(91%)
CH3
Преимущества: высокий
выход, в реакцию могут
вступать не только кетоны,
но и ароматические и
алифатические альдегиды
н-C7H15 CH CH н-C7H15 (80%)
OH OH
8,9-Гексадеканол
53
54.
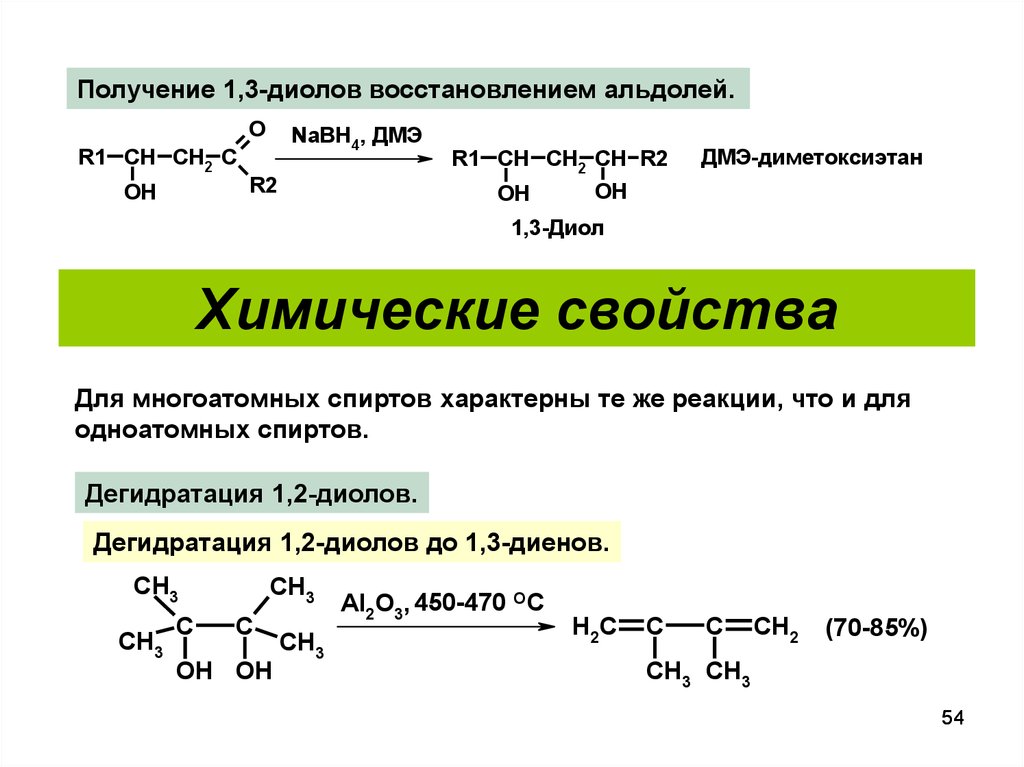
Получение 1,3-диолов восстановлением альдолей.O
R1 CH CH2 C
OH
NaBH4, ДМЭ
R2
R1 CH CH2 CH R2
OH
OH
ДМЭ-диметоксиэтан
1,3-Диол
Химические свойства
Для многоатомных спиртов характерны те же реакции, что и для
одноатомных спиртов.
Дегидратация 1,2-диолов.
Дегидратация 1,2-диолов до 1,3-диенов.
CH3
CH3
C
CH3
C
OH OH
CH3
Al2O3, 450-470 OC
H2C
C
C
CH2
(70-85%)
CH3 CH3
54
55.
Дегидратация 1,2-диолов с перегруппировкой(пинаколиновая перегруппировка 1,2-диолов).
CH3 CH3
CH3 C
C
CH3
H2SO4, t OC
CH3
CH3 C
OH OH
C
CH3 + H2O
Реакция Р.Фиттига.
O CH3
Пинаколин
Пинакон
35%-я H2SO4, t OC
CH3 CH CH CH3
CH3 C
OH OH
CH2 CH3
(81%)
O
Бутанон
Механизм пинаколиновой перегруппировки.
R1
R C
R1
C
H
+
R
R
OH OH
R1
R1
C
C
R
R
R
C
C
+
+ OH
R1
R
H
C
+
C
..OH
OH OH2
R1
R1
-H2O
R
R1
R1
+
R
C
C
O
R1
R
55
56.
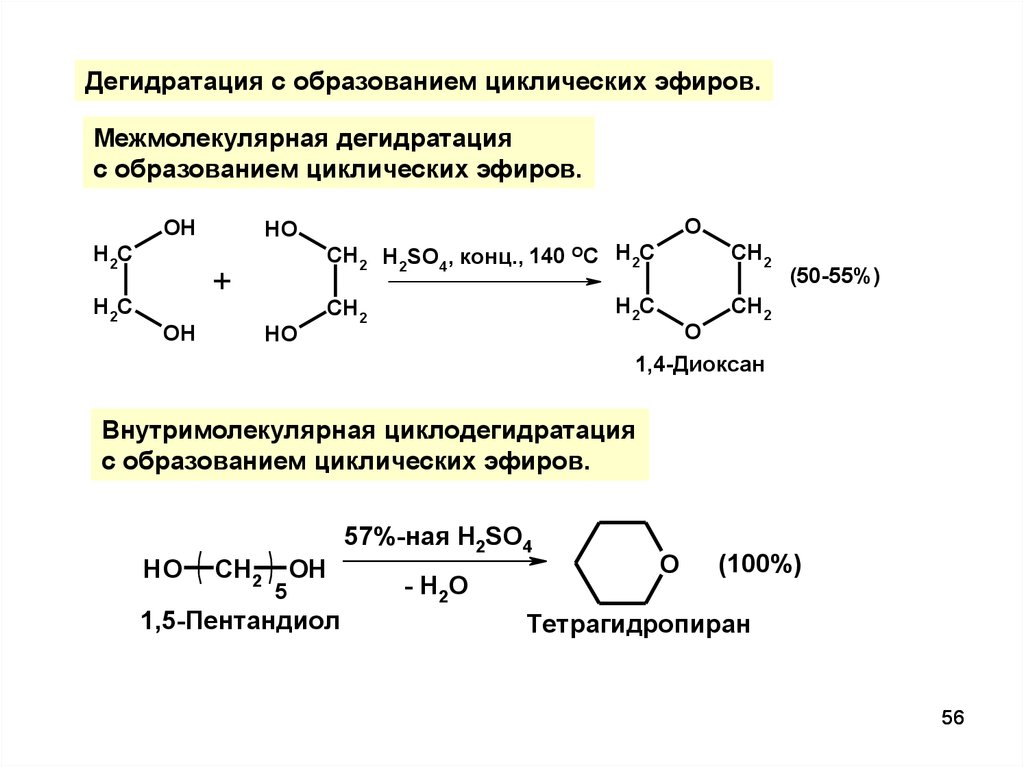
Дегидратация с образованием циклических эфиров.Межмолекулярная дегидратация
с образованием циклических эфиров.
OH
H2C
H2C
HO
+
OH
HO
O
CH2 H2SO4, конц., 140 ОС H2C
CH2
H2C
CH2
CH2
(50-55%)
O
1,4-Диоксан
Внутримолекулярная циклодегидратация
с образованием циклических эфиров.
HO
CH2
5
OH
1,5-Пентандиол
57%-ная H2SO4
- H2O
O
(100%)
Тетрагидропиран
56
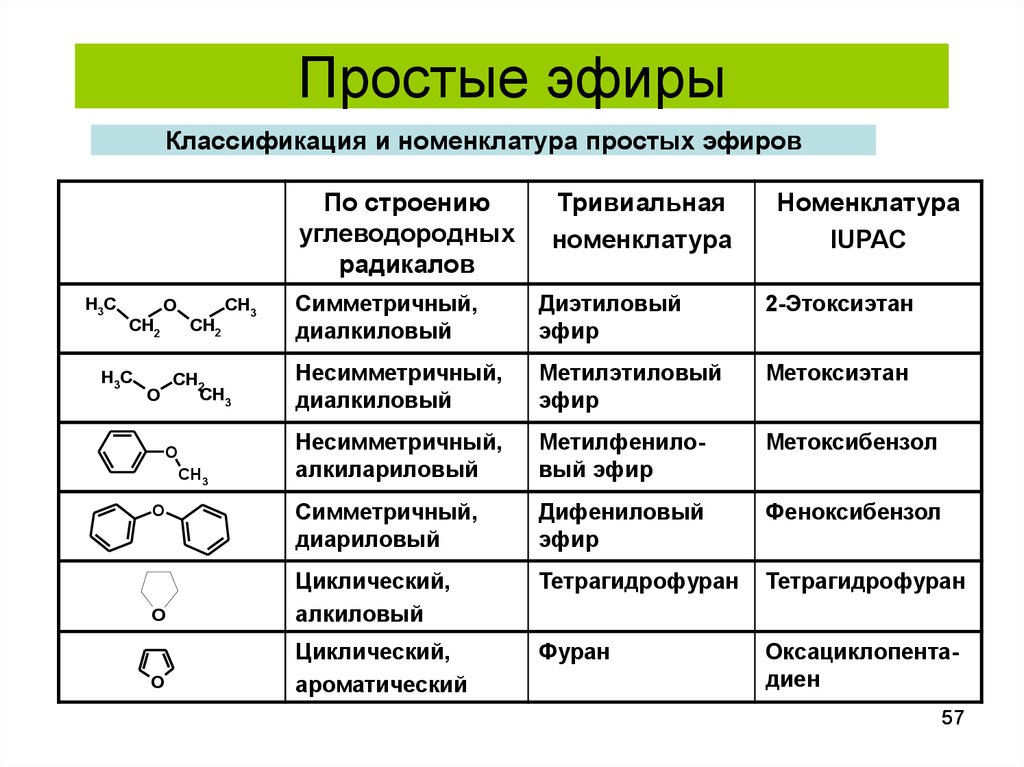
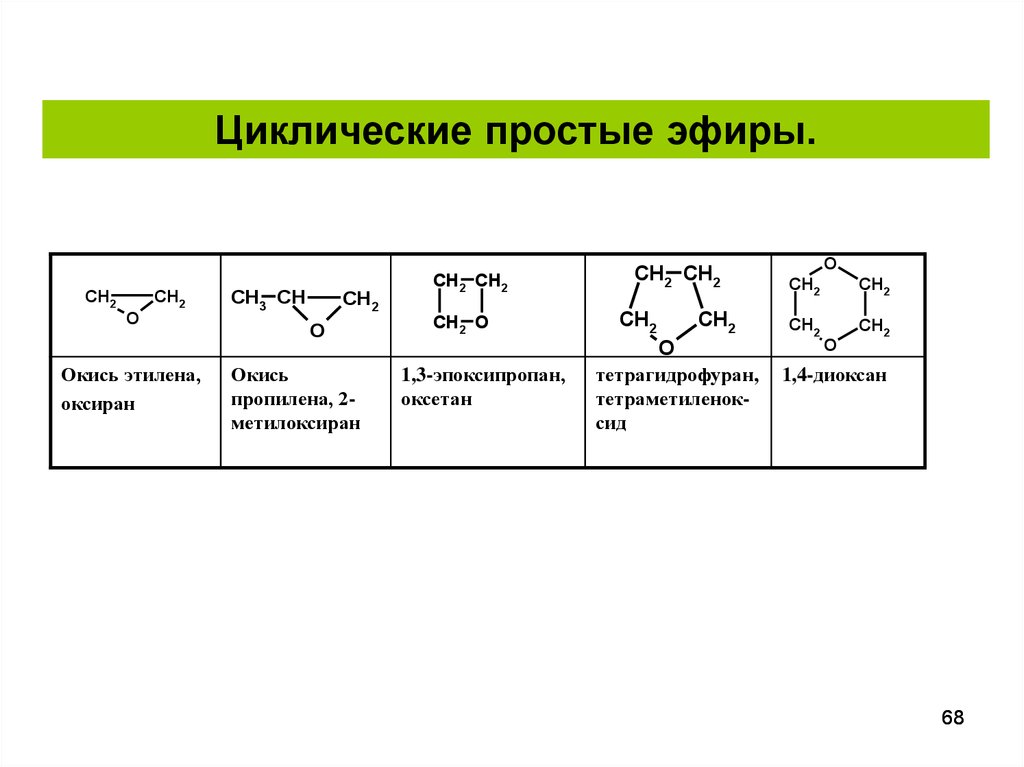
57. Классификация и номенклатура простых эфиров
Простые эфирыКлассификация и номенклатура простых эфиров
По строению
углеводородных
радикалов
H3C
Номенклатура
IUPAC
Симметричный,
диалкиловый
Диэтиловый
эфир
2-Этоксиэтан
Несимметричный,
диалкиловый
Метилэтиловый
эфир
Метоксиэтан
Несимметричный,
алкилариловый
Метилфениловый эфир
Метоксибензол
Симметричный,
диариловый
Дифениловый
эфир
Феноксибензол
Тетрагидрофуран
Тетрагидрофуран
O
Циклический,
алкиловый
Фуран
O
Циклический,
ароматический
Оксациклопентадиен
O
CH2
CH2
H3C
Тривиальная
номенклатура
CH3
CH2
CH3
O
O
CH3
O
57
58.
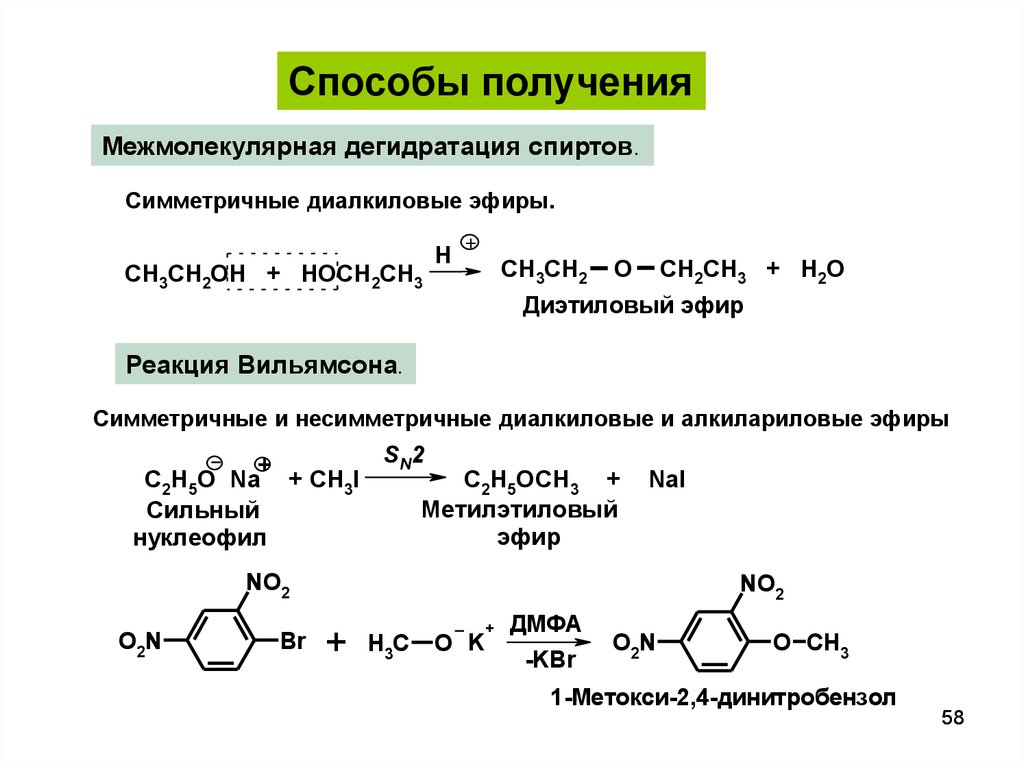
Способы полученияМежмолекулярная дегидратация спиртов.
Симметричные диалкиловые эфиры.
СH3СH2OH + HOCH2CH3
H
+
СH3СH2
O
CH2CH3 + H2O
Диэтиловый эфир
Реакция Вильямсона.
Симметричные и несимметричные диалкиловые и алкилариловые эфиры
SN2
+
С2Н5О Na + CH3I
C2H5OCH3 +
Метилэтиловый
Сильный
эфир
нуклеофил
NaI
NO2
O2N
Br
NO2
+
H3C
O K
+
ДМФА
-KBr
O2N
O CH3
1-Метокси-2,4-динитробензол
58
59.
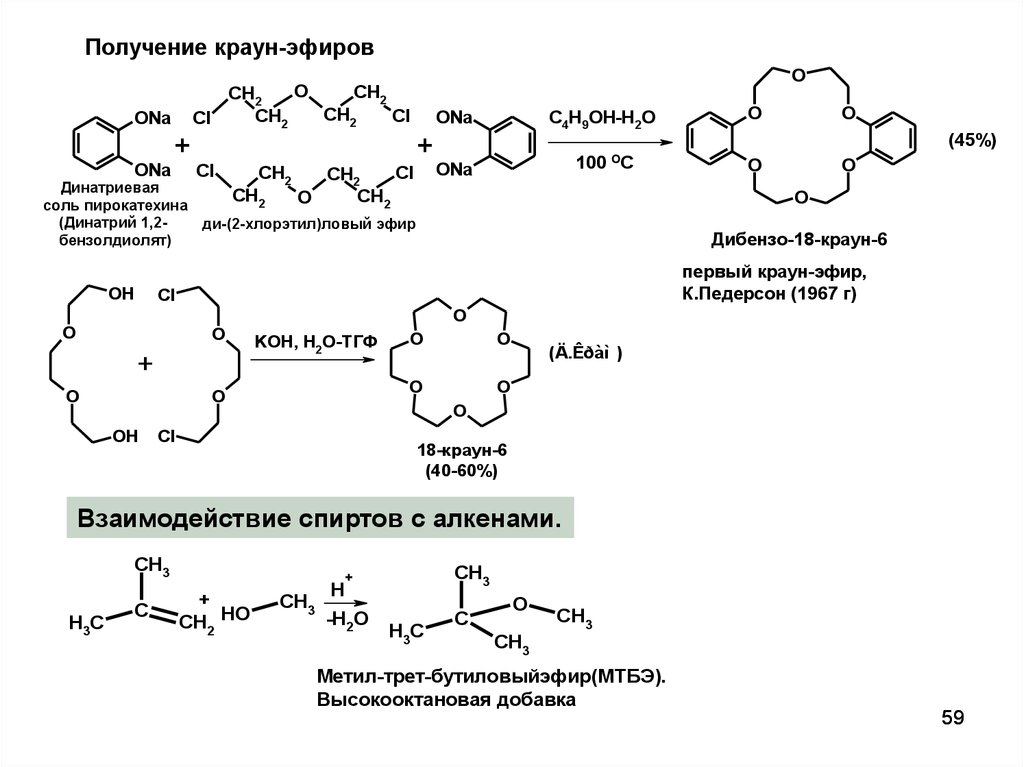
Получение краун-эфировONa
ONa
+
O
CH2
CH2
CH2
CH2
Cl
Cl
Cl
CH2
O
+
Cl
CH2
CH2
O
Динатриевая
CH2
соль пирокатехина
(Динатрий 1,2ди-(2-хлорэтил)ловый эфир
бензолдиолят)
OH
C4H9OH-H2O
ONa
100
ONa
OC
+
O
O
Дибензо-18-краун-6
O
KOH, H2O-ТГФ
O
OH
(45%)
первый краун-эфир,
К.Педерсон (1967 г)
O
O
O
O
Cl
O
O
O
O
O
O
(Ä.Êðàì )
O
Cl
18-краун-6
(40-60%)
Взаимодействие спиртов с алкенами.
CH3
H3C
C
CH3
+
+
CH2 HO
H
CH3
-H2O
H3C
C
O
CH3
CH3
Метил-трет-бутиловыйэфир(МТБЭ).
Высокооктановая добавка
59
60.
Физические свойства.Т пл., ОС
Т кип., ОС
CH3OCH3
-138,5
-23,2
CH3CH2OH
-117,3
64,7
CH3CH2OCH2CH3
-116,3
34,6
CH3CH2CH2CH2OH
-89,5
117,7
Строение молекулы эфиров
.. ..
H
Слабые основания
Слабые нуклеофилы
0,142 нм
H
O
C
111О
C
H
1)Реакции у атома кислорода
2)Реакции у a-углеродного атома
3)Реакции расщепления связи С-О
H
H
H
60
61.
Химические свойстваРеакции у атома кислорода
R
R1
..
O. . + HX
R
X=Cl, HSO4 R1
..
O.
.
Протонирование под действием
слабых кислот. Образование
водородных связей.
HX
Образование комплексов с переносом заряда (КПЗ) с сильными кислотами.
R
..
O. . + HX
R1
(C2H5)2O
X=Br, I
+ BF3
+
R
O.
.
H X
Кислоты Бренстеда
R1
Диалкилоксоневый катион
+
(C2H5)2O
BF3
Кислоты Льюиса
Эфират трехфтористого
бора. Комплекс с переносом
заряда (КПЗ)
61
62.
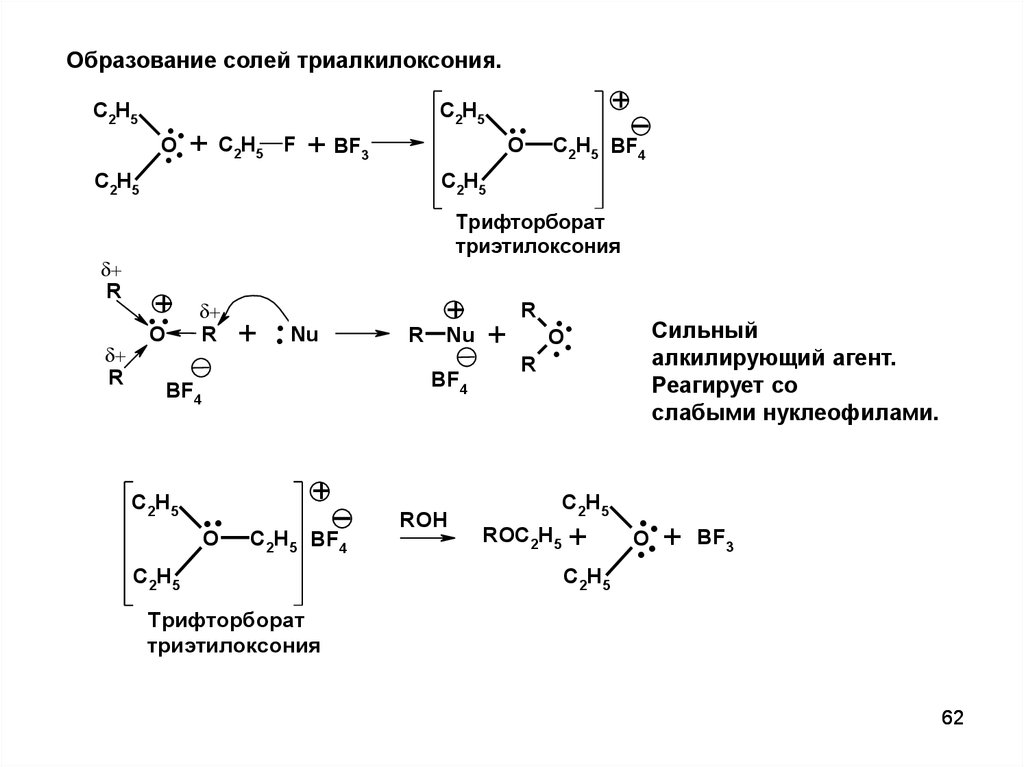
Образование солей триалкилоксония.C2H5
..
.. + C H
O
C2H5
R
R
2
5
F
C2H5
+ BF3
..
O
+
C2H5 BF4
C2H5
Трифторборат
триэтилоксония
.O+.
R
+ .. Nu
Nu
BF4
BF4
C2H5
R
+
..
O
+
R
..
..
R
+
C2H5 BF4
C2H5
ROH
Сильный
алкилирующий агент.
Реагирует со
слабыми нуклеофилами.
O
C2H5
ROC2H5
+
C2H5
..
.. +
O
BF3
Трифторборат
триэтилоксония
62
63.
Реакции у a-углеродного атомаАлкоксильный радикал – более
стабильный, чем алкильный,
за счет делокализации неспаренного электрона.
Механизм SR.
R
..
O
..
H
H
C
R1
+
H
R
R
-HR
..
O
.. C.
R1
Радикальное галогенирование
CH3
CH2
O
CH2
CH3 +
Cl2
h , -20
Cl
OC
-HCl
CH
CH3
O
CH2
CH3
1-Хлор-1-этоксиэтан
63
64.
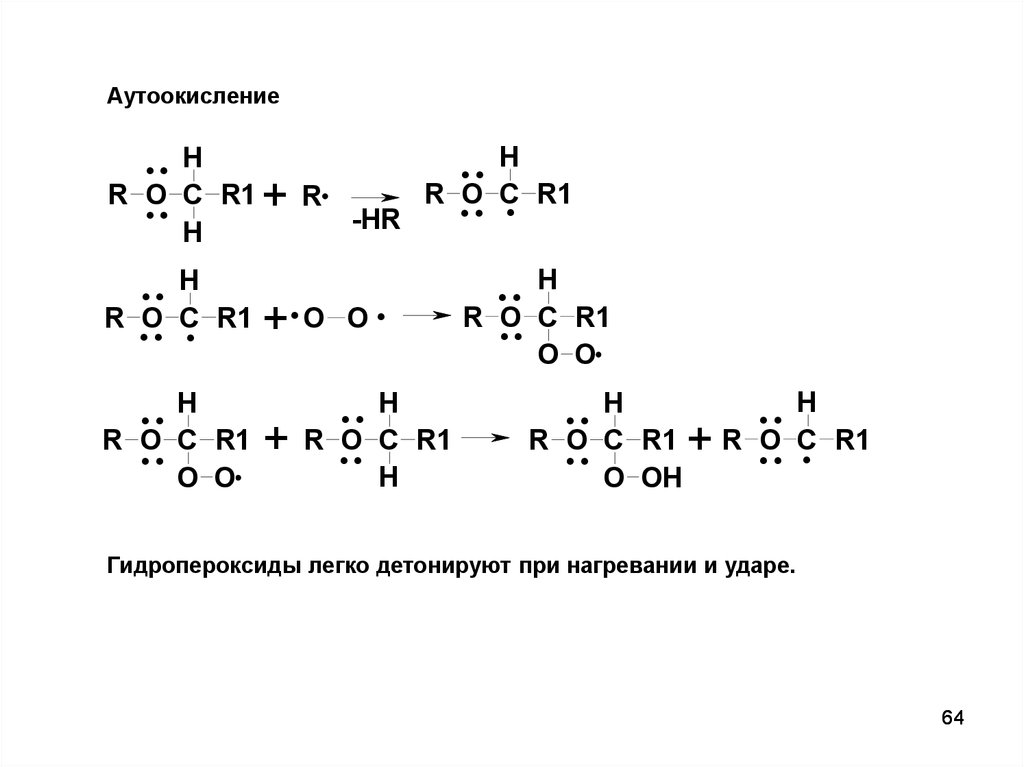
АутоокислениеR
.. H
O
.. C
R1
H
R
.. H
O C.
..
R
.. H
O
.. C
R1
R1
O O
+R
-HR
+. O
O.
+R
.. H
O C
..
H
R
.. H
O C.
..
R
R1
R1
.. H
O C
..
R1
O O
R
.. H
O C
..
R1
O OH
+R
.. H
O C
.
..
R1
Гидропероксиды легко детонируют при нагревании и ударе.
64
65.
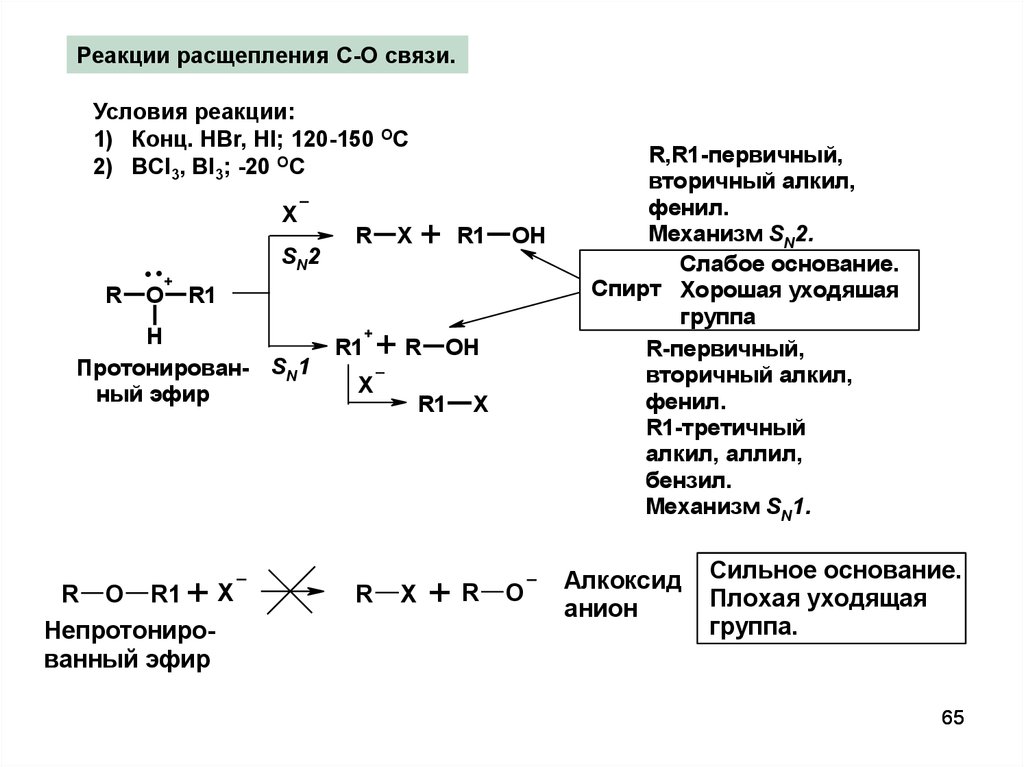
Реакции расщепления С-О связи.Условия реакции:
1) Конц. HBr, HI; 120-150 OC
2) BCl3, BI3; -20 ОC
X
R
..
O
+
SN2
R
X
+
R1
OH
R1
H
Протонирован- SN1
ный эфир
+
R O R1 X
Непротонированный эфир
R1
+
+R
X
R
OH
R1
X
X
+R
O
R,R1-первичный,
вторичный алкил,
фенил.
Механизм SN2.
Слабое основание.
Спирт Хорошая уходяшая
группа
R-первичный,
вторичный алкил,
фенил.
R1-третичный
алкил, аллил,
бензил.
Механизм SN1.
Алкоксид
анион
Сильное основание.
Плохая уходящая
группа.
65
66.
....SN2
+H
C6H5 O C2H5
Этоксибензол
Фенетол
..
H3C
Br
H
H
C
..
+
+
C6H5 O
H
CH3
Br
+
O
C
H
H
C2H5
..
O C6H5
H
CH3
Br
H
C
H
H
+
HO
C6H5
SN1
....
CH3
CH3 C
O
CH3
+
H
CH3
..
CH3 C
+
O
CH3
H3C H
медленно -CH3OH
МТБЭ
CH3
CH3 C
+
CH3
OH
CH3
+
+ CH3
CH3
CH3 C
+
CH3
+
Br
быстро
CH3
CH3 C
Br
CH3
66
67.
Простые эфиры не реагируют с Na при низких температурах.При повышенной температуре простые эфиры (особенно высшие гомологи)
расщепляются по уравнению
R
O
R1
+ 2 Na
R ONa
алкоксид Na
+
R1 Na
алкилнатрий
Активный алкил натрий может вступать в реакцию
с диэтиловым эфиром (П.П.Шорыгин)
H5C2
O
C2H5
+HC
5
2
Na
H5C2 ONa
этоксид Na
+
C2H6
+
C2H4
Применение простых эфиров.
Растворители. Синтез различных комплексов. Антидетонационные добавки
к топливу.
67
68.
Циклические простые эфиры.CH2
CH2
O
Окись этилена,
оксиран
CH3 CH
CH2
O
Окись
пропилена, 2метилоксиран
CH2 CH2
CH2 O
1,3-эпоксипропан,
оксетан
CH2 CH2
CH2
CH2
O
тетрагидрофуран,
тетраметиленоксид
O
CH2
CH2
CH2
O
CH2
1,4-диоксан
68
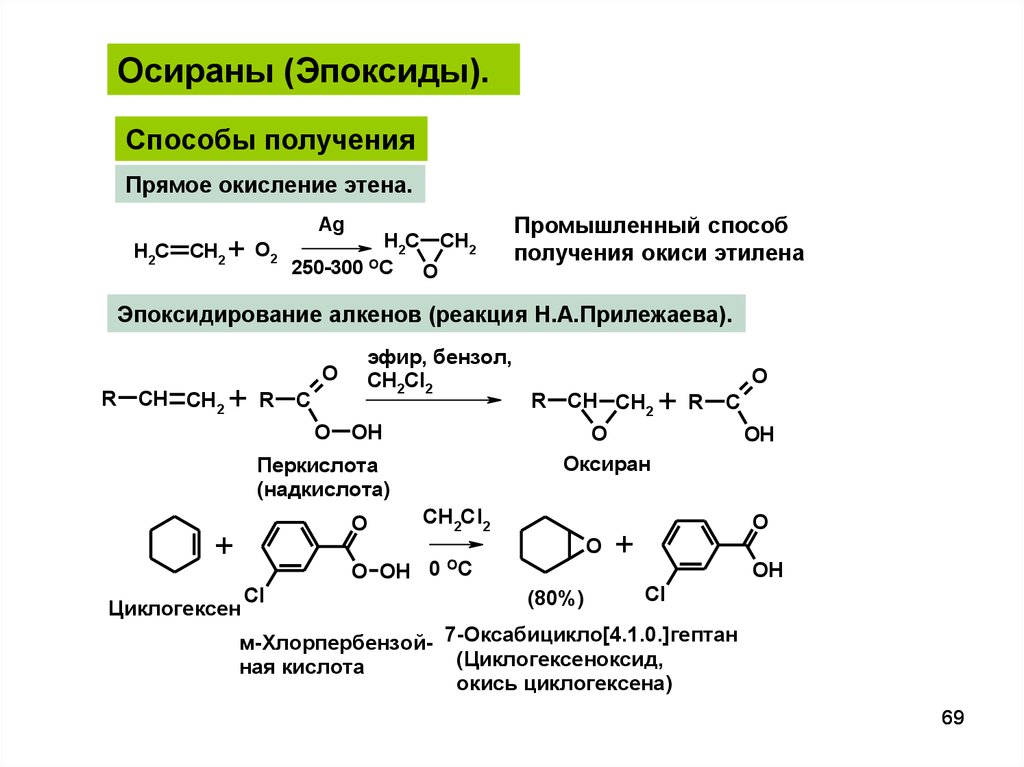
69.
Осираны (Эпоксиды).Способы получения
Прямое окисление этена.
H2C
CH2
+ O2
Ag
H2C CH2
250-300 OC O
Промышленный способ
получения окиси этилена
Эпоксидирование алкенов (реакция Н.А.Прилежаева).
R
CH CH2
+
O
R
C
O
эфир, бензол,
CH2Cl2
OH
+
CH2Cl2
O OH 0
Циклогексен
Cl
CH CH2
+
R
C
O
Оксиран
Перкислота
(надкислота)
O
R
O
O
OC
(80%)
OH
O
+
OH
Cl
м-Хлорпербензой- 7-Оксабицикло[4.1.0.]гептан
(Циклогексеноксид,
ная кислота
окись циклогексена)
69
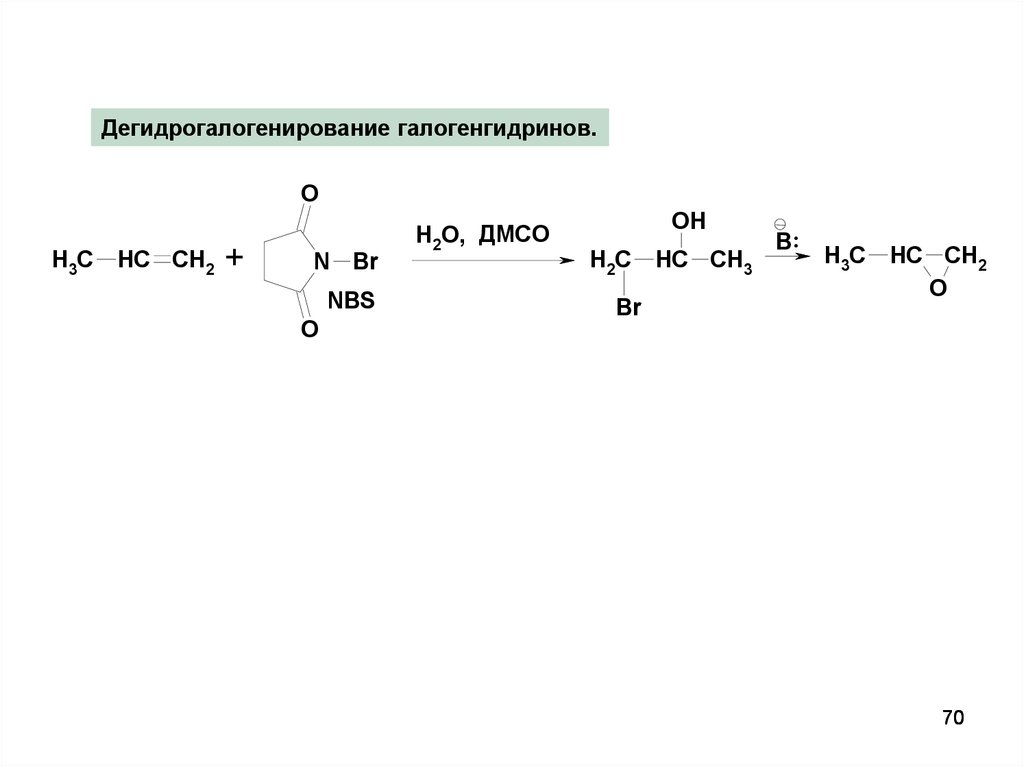
70.
Дегидрогалогенирование галогенгидринов.O
H3C
HC CH2
+
N Br
NBS
O
H2O, ДМСО
OH
H2C
Br
HC CH3
B ..
H3C
HC CH2
O
70
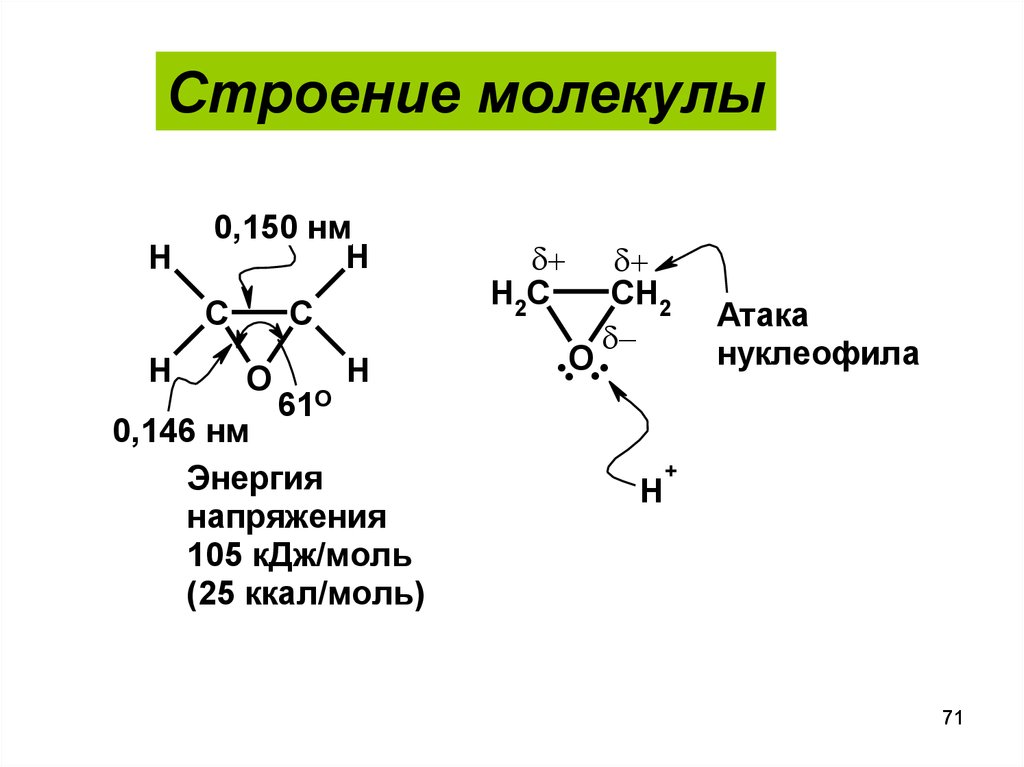
71.
Строение молекулыH
0,150 нм
H
C
H
C
O
61О
H
0,146 нм
Энергия
напряжения
105 кДж/моль
(25 ккал/моль)
H2C
CH2
..O..
H
Атака
нуклеофила
+
71
72.
Химические свойстваВзаимодействие с нуклеофилами
Реакции со слабыми нуклеофилами. Катализ кислотами
+
H2C
H , H 2O
CH2
O
CH2 1,2-этандиол
Этиленгликоль
OH OH
H2C
+
H3C HC
CH2
H , CH3OH
H3C HC
O
CH2 O CH3
OH
1-Метокси-2-пропанол
Метилцеллозольв
Механизм SN2
CH2 + H
R HC
O
+
R HC
..
CH2 + HO
H
CH3
+O
H
Атака нуклеофилом более
доступного по стерическим
соображениям атома
R
+
CH CH2 O
OH
CH3 -H+
R
CH CH2 O
CH3
OH
72
73.
Механизм SN1H3C
H3C
+
CH
C
2
OH
Менее устойчивый
первичный карбокатион
быстро
H3C
C
H3C
CH2
H
O
+
H3C
H3C
медленно
CH2
C
H3C
+
O
H
H
H3C
O
C
+
CH3
H
+
H3C
+
C
CH2
+
.
.
HO
CH3
OH
более устойчивый
третичный карбокатион
CH3
CH3
CH2 OH
H3C
O
C
CH2 OH
CH3
2-Метил-2-метокси-1-пропанол
73
74.
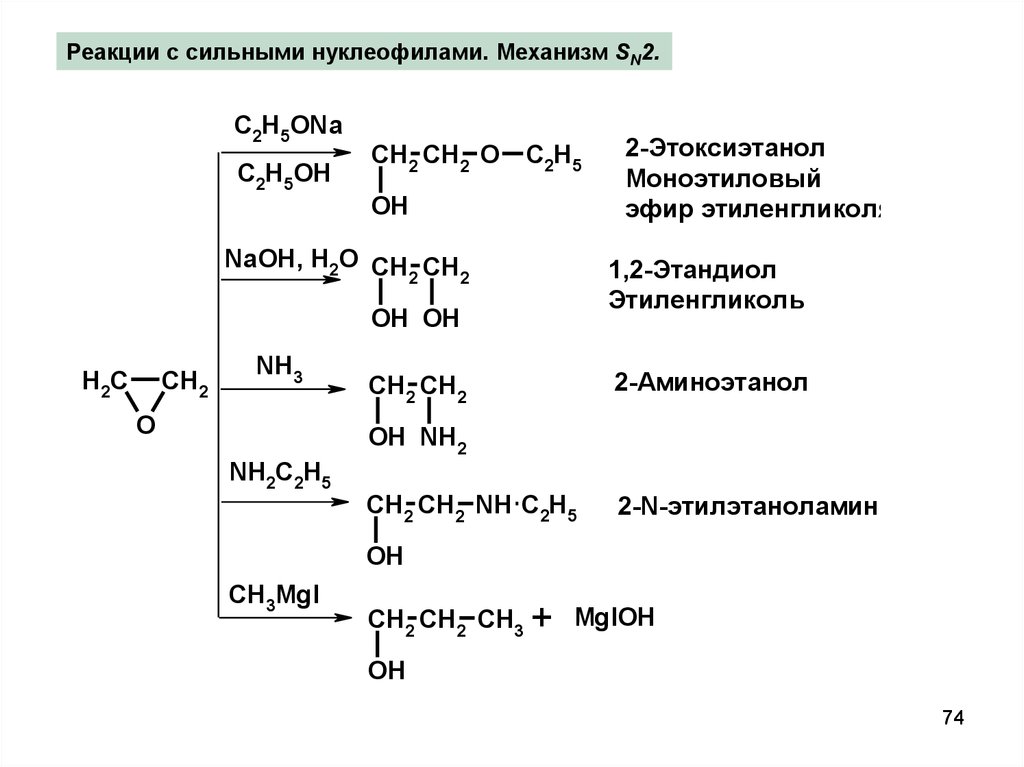
Реакции с сильными нуклеофилами. Механизм SN2.C2H5ONa
C2H5OH
CH2 CH2 O C2H5
OH
NaOH, H2O CH CH
2
2
OH OH
H2C
CH2
NH3
O
CH2 CH2
2-Этоксиэтанол
Моноэтиловый
эфир этиленгликоля
1,2-Этандиол
Этиленгликоль
2-Аминоэтанол
OH NH2
NH2C2H5
CH2 CH2 NH C2H5
2-N-этилэтаноламин
OH
CH3MgI
CH2 CH2 CH3 + MgIOH
OH
74
75.
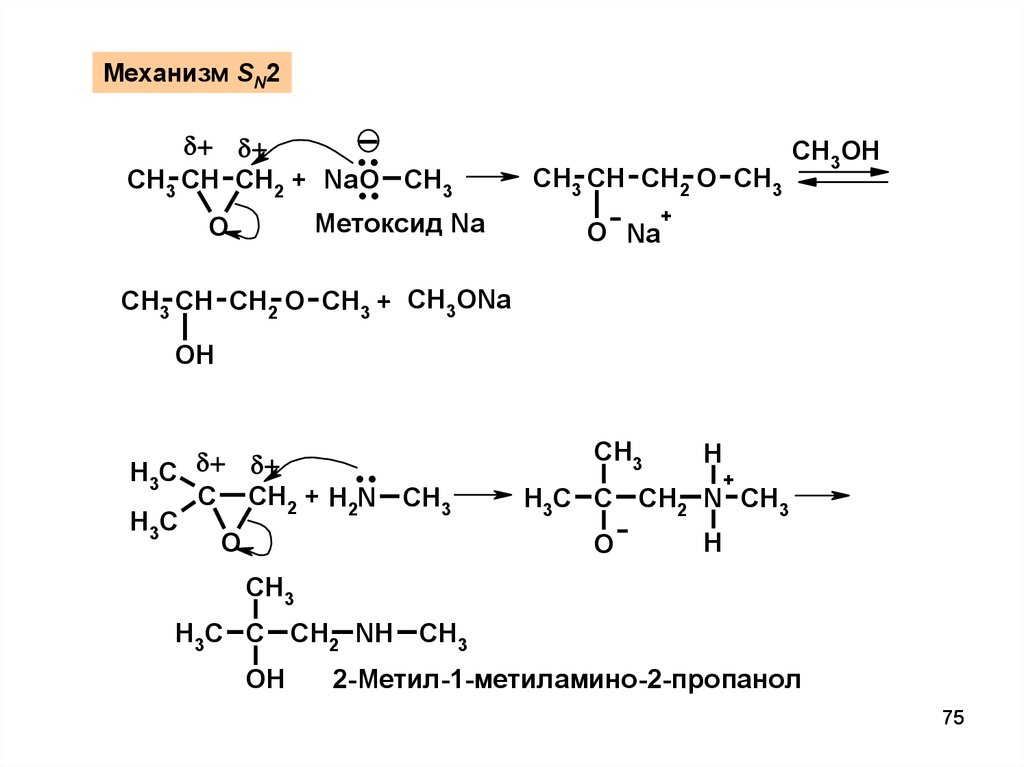
Механизм SN2..
..
CH3 CH CH2 + NaO CH3
Метоксид Na
O
CH3 CH CH2 O CH3
O Na
CH3OH
+
CH3 CH CH2 O CH3 + CH3ONa
OH
..
H3C
C CH2 + H2N CH3
H3C
O
CH3
H
+
H3C C CH2 N CH3
O
H
CH3
H3C C CH2 NH CH3
OH
2-Метил-1-метиламино-2-пропанол
75
76.
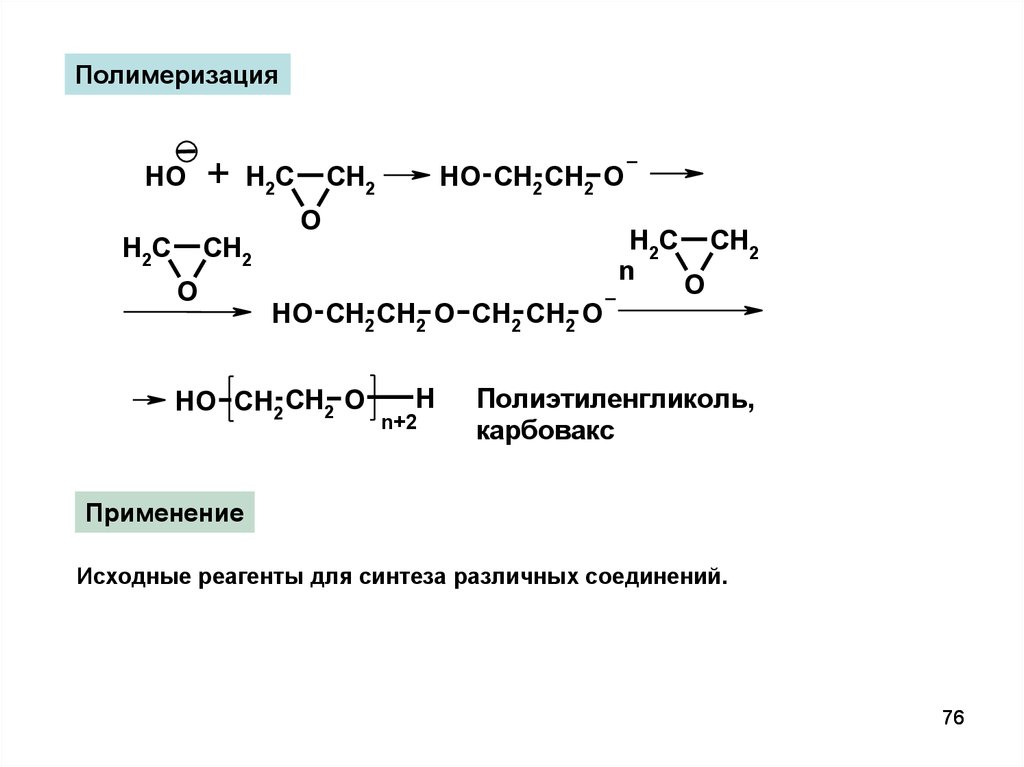
ПолимеризацияHO
+
H2C
CH2
HO CH2 CH2 O
O
H2C
H2C
n
CH2
O
CH2
O
HO CH2 CH2 O CH2 CH2 O
HO CH2 CH2 O
H
n+2
Полиэтиленгликоль,
карбовакс
Применение
Исходные реагенты для синтеза различных соединений.
76
77.
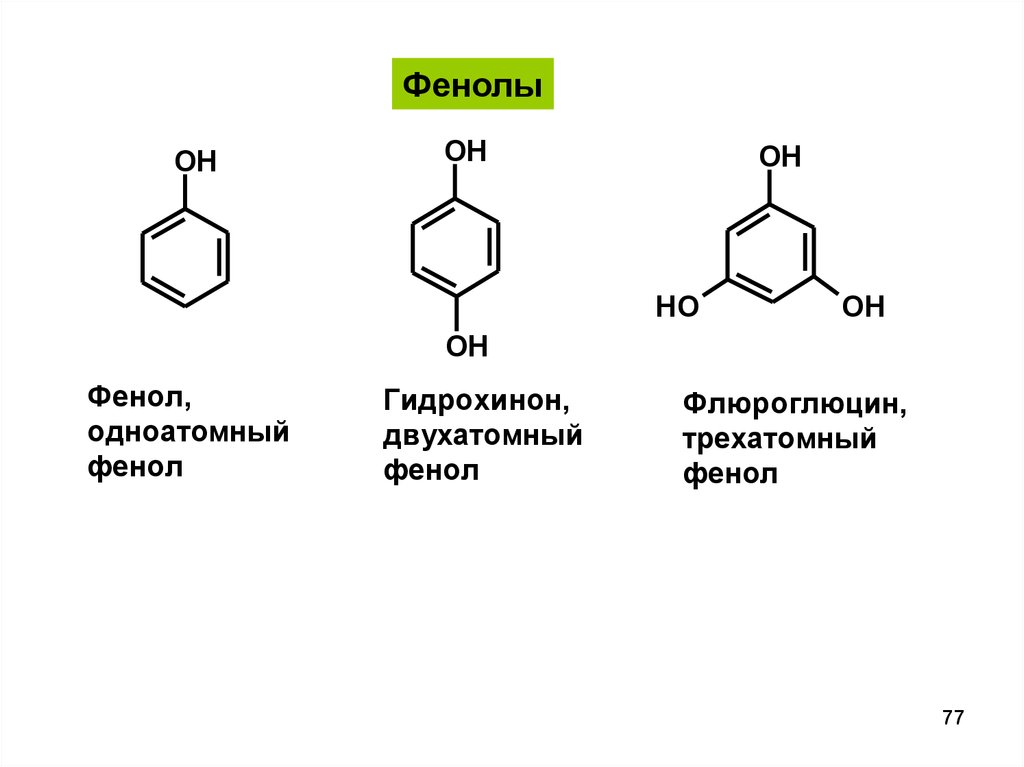
ФенолыOH
OH
OH
HO
OH
OH
Фенол,
одноатомный
фенол
Гидрохинон,
двухатомный
фенол
Флюроглюцин,
трехатомный
фенол
77
78.
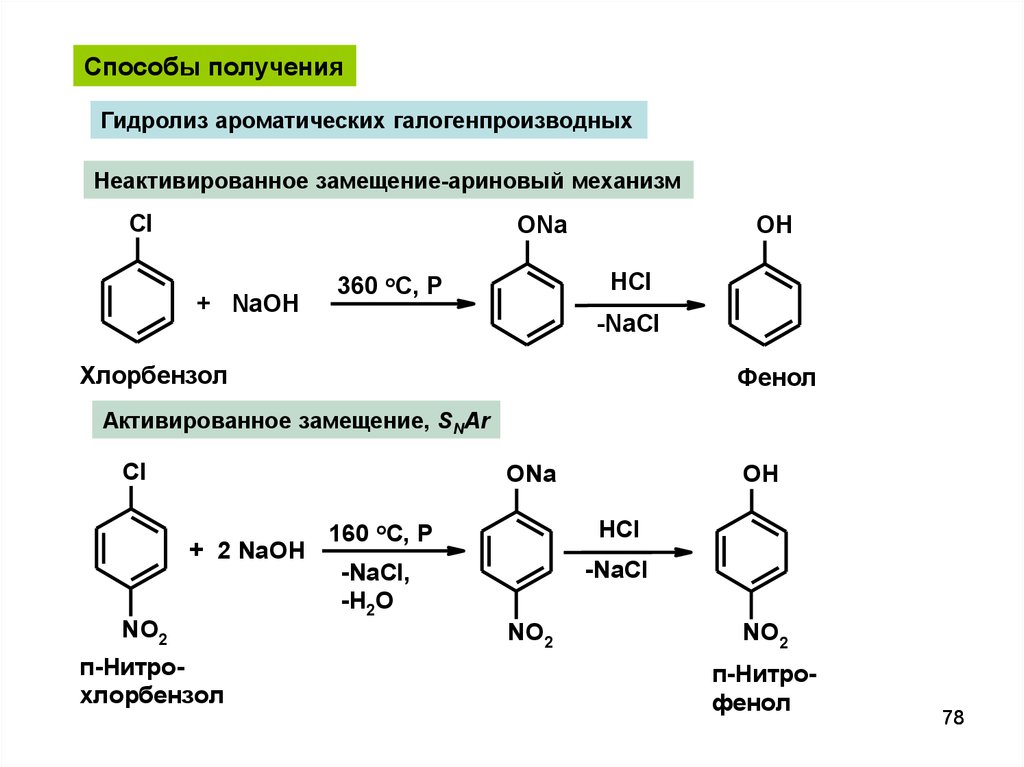
Способы полученияГидролиз ароматических галогенпроизводных
Неактивированное замещение-ариновый механизм
Cl
ONa
+ NaOH
OH
HCl
360 oC, P
-NaCl
Хлорбензол
Фенол
Активированное замещение, SNAr
Cl
ONa
+ 2 NaOH
NO2
п-Нитрохлорбензол
OH
160 oC, P
HCl
-NaCl,
-H2O
-NaCl
NO2
NO2
п-Нитрофенол
78
79.
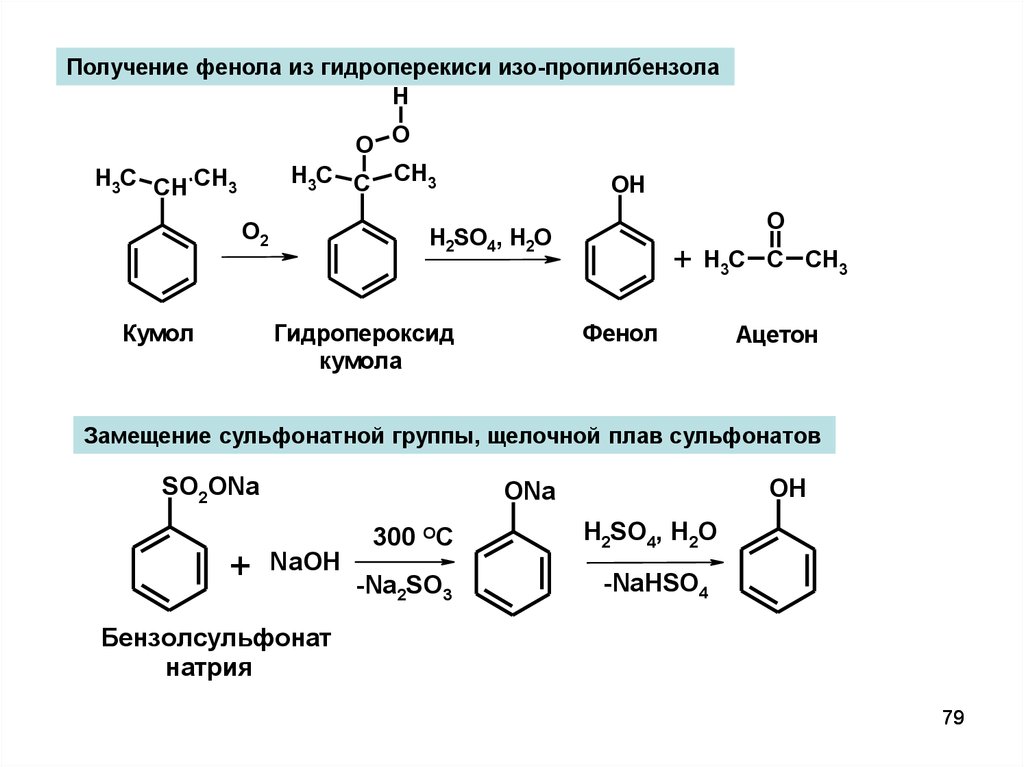
Получение фенола из гидроперекиси изо-пропилбензолаH
O O
H3C C CH3
H3C CH CH3
О2
OH
Гидропероксид
кумола
Кумол
O
Н2SO4, H2O
+
H3C C CH3
Фенол
Ацетон
Замещение сульфонатной группы, щелочной плав сульфонатов
SO2ONa
300 OC
+
OH
ONa
NaOH
-Na2SO3
H2SO4, Н2О
-NaHSO4
Бензолсульфонат
натрия
79
80.
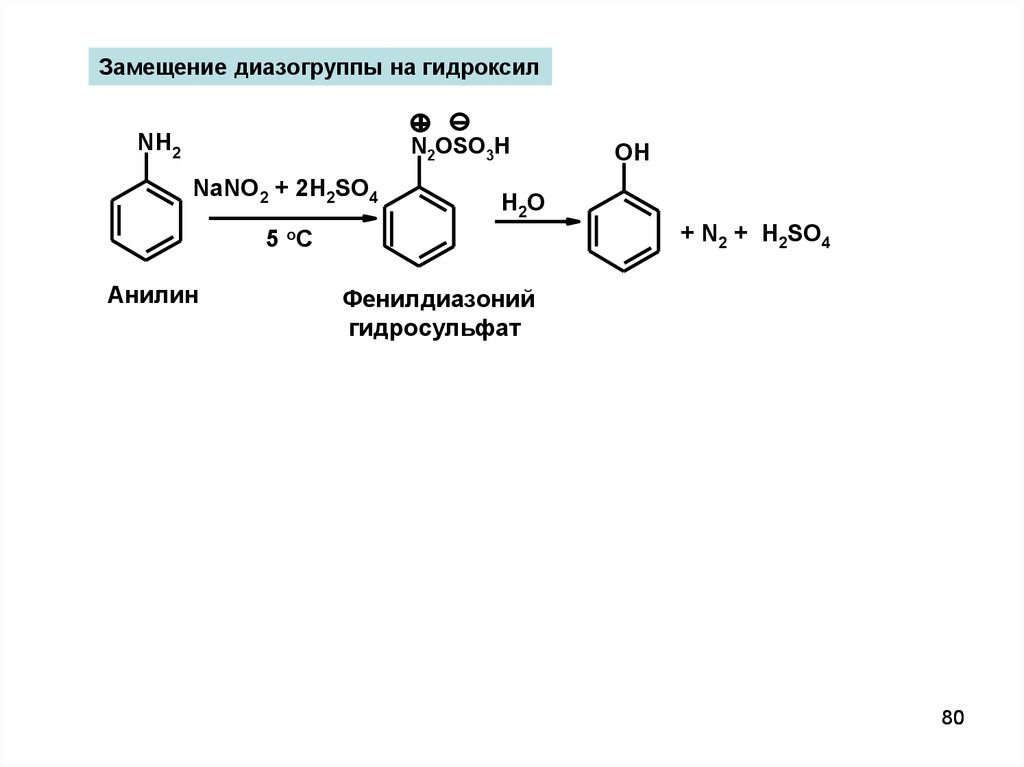
Замещение диазогруппы на гидроксил+
NH2
N2OSO3H
NaNO2 + 2H2SO4
H2O
+ N2 + H2SO4
5 oC
Анилин
OH
Фенилдиазоний
гидросульфат
80
81.
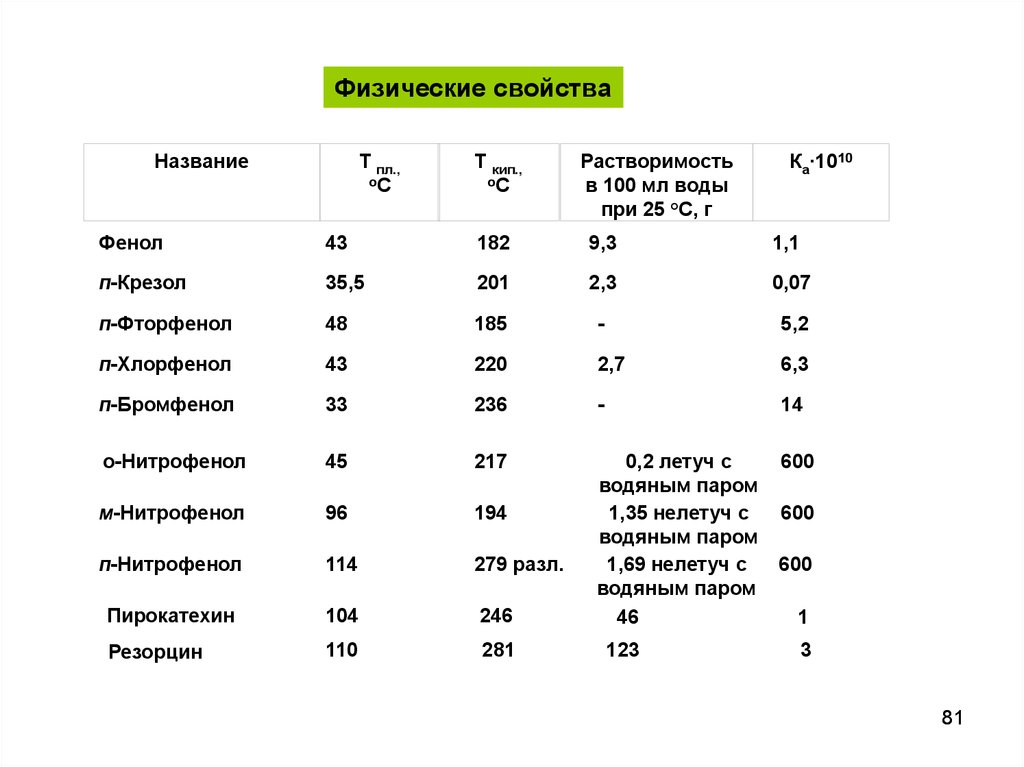
Физические свойстваНазвание
Т пл.,
оС
Т кип.,
оС
Растворимость
в 100 мл воды
при 25 °С, г
Ка∙1010
Фенол
43
182
9,3
1,1
п-Крезол
35,5
201
2,3
0,07
п-Фторфенол
48
185
-
5,2
п-Хлорфенол
43
220
2,7
6,3
п-Бромфенол
33
236
-
14
о-Нитрофенол
45
217
600
м-Нитрофенол
96
194
п-Нитрофенол
114
279 разл.
Пирокатехин
104
246
0,2 летуч с
водяным паром
1,35 нелетуч с
водяным паром
1,69 нелетуч с
водяным паром
46
Резорцин
110
281
123
600
600
1
3
81
82.
Водородные связиH
O
N
O
O
N
O
O
O
N
H
O
H
O
O
Ассоциированный п-нитрофенол
H
H
O
H
O
O
H
+
C O
N O
O
H
H
O
O
Строение молекулы
..O. H
.
.
+M>-I
.
.
.
.
. .. ..
O
sp2-î ðáèòàëü
H
2pz-î ðáèòàëü
82
83.
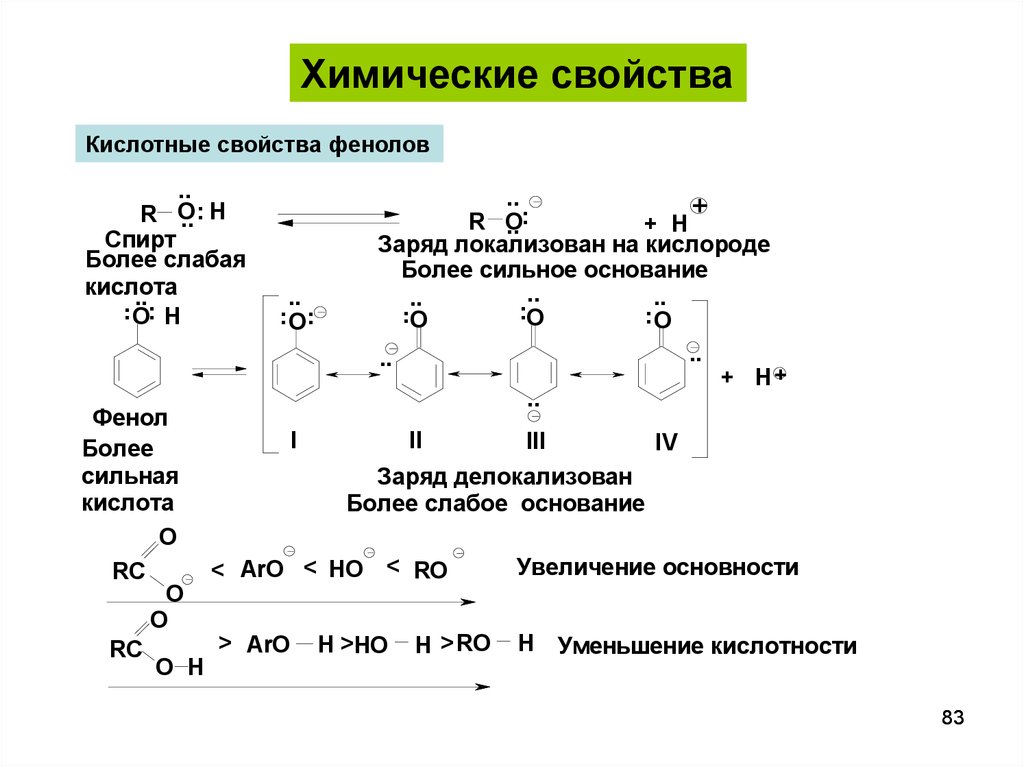
Химические свойстваКислотные свойства фенолов
..
O
R .. .. H
Спирт
Более слабая
кислота
.. ....
O H
.. .. ..
O
.. .
+
R O
+ H
.. .
Заряд локализован на кислороде
Более сильное основание
..
....
....
.
.O
O
O
..
..
+ H+
..
Фенол
I
II
III
IV
Более
сильная
Заряд делокализован
кислота
Более слабое основание
O
Увеличение основности
< ArO < HO < RO
RC
O
O
> ArO H >HO H > RO H Уменьшение кислотности
RC
O H
83
84.
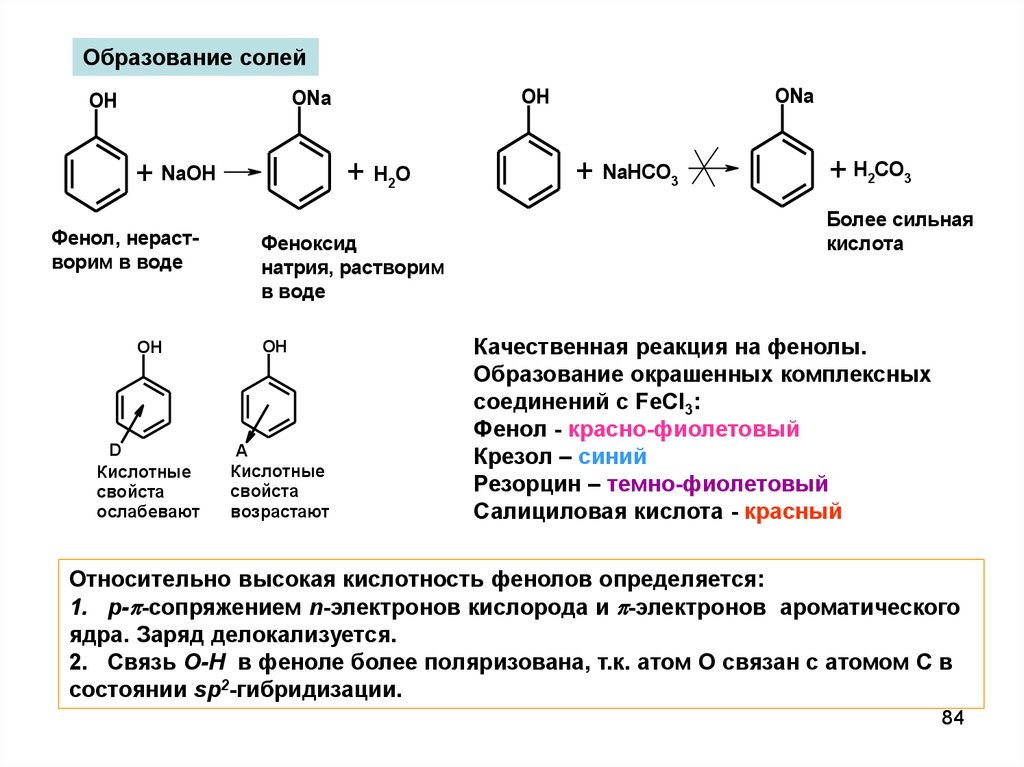
Образование солей+ H2O
+ NaOH
Фенол, нерастворим в воде
OH
D
Кислотные
свойста
ослабевают
Феноксид
натрия, растворим
в воде
OH
A
Кислотные
свойста
возрастают
ONa
OH
ONa
OH
+ NaHCO3
+ H2CO3
Более сильная
кислота
Качественная реакция на фенолы.
Образование окрашенных комплексных
соединений с FeCl3:
Фенол - красно-фиолетовый
Крезол – синий
Резорцин – темно-фиолетовый
Салициловая кислота - красный
Относительно высокая кислотность фенолов определяется:
1. p-p-сопряжением n-электронов кислорода и p-электронов ароматического
ядра. Заряд делокализуется.
2. Связь О-Н в феноле более поляризована, т.к. атом О связан с атомом С в
состоянии sp2-гибридизации.
84
85.
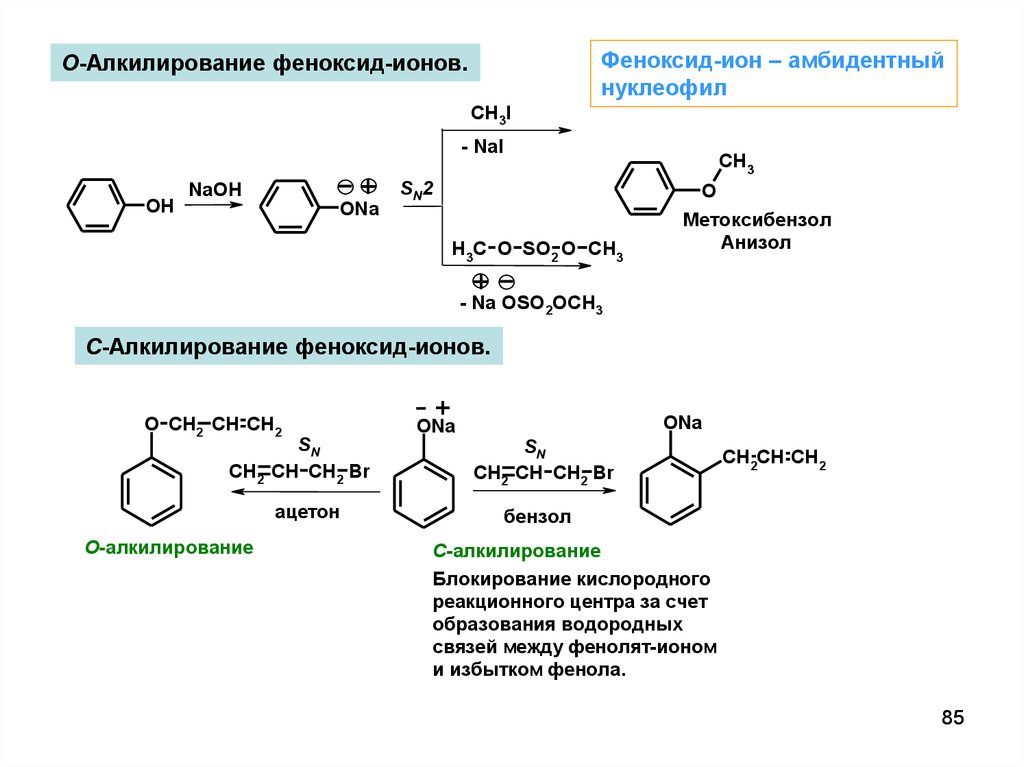
Феноксид-ион – амбидентныйнуклеофил
O-Алкилирование феноксид-ионов.
CH3I
- NaI
OH
+
NaOH
ONa
CH3
SN2
H3C O SO2 O CH3
O
Метоксибензол
Анизол
+
- Na OSO2OCH3
С-Алкилирование феноксид-ионов.
O CH2 CH CH2
SN
CH2 CH CH2 Br
ацетон
О-алкилирование
+
ONa
ONa
SN
CH2 CH CH2 Br
CH2CH CH2
бензол
С-алкилирование
Блокирование кислородного
реакционного центра за счет
образования водородных
связей между фенолят-ионом
и избытком фенола.
85
86.
O-Ацилирование феноксид-ионов (SN).O
H3C C
..
HO
..
O
H3C C
+
OH
+
O
..
HO
..
O
CH2 CH3
+
H3C C
H2O HO=+1,5 ккал/моль
H2O HO=-4,6 ккал/моль
O CH2 CH3
O
H3C
NaOH,
Н2О
OH
Нейтральная
молекуласлабый
нуклеофил
C
Cl
H3C CO O CO CH3 , H+
O
H3C
C
O
+
O Na
SO2Cl
Анионсильный
нуклеофил
Фенилaцетат
SO2 O
Фенилбензолсульфонат
86
87.
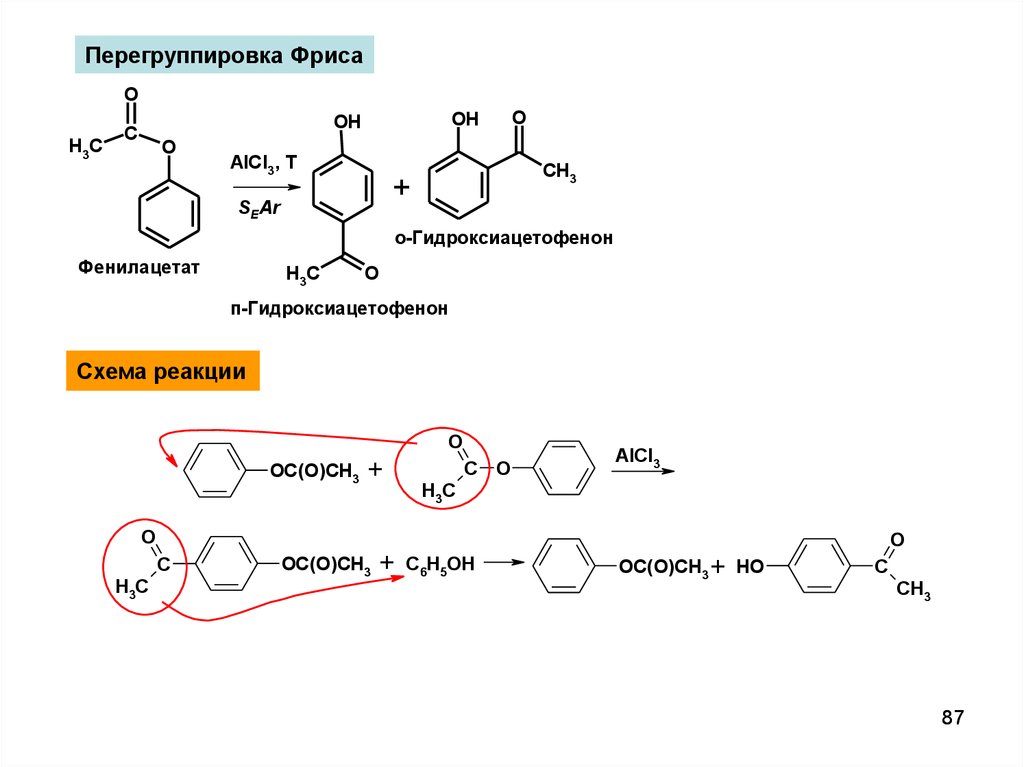
Перегруппировка ФрисаO
H3C
OH
OH
C
O
AlCl3, T
CH3
+
SEAr
O
о-Гидроксиацетофенон
Фенилацетат
H3C
O
п-Гидроксиацетофенон
Схема реакции
O
OC(O)CH3
+
O
C
H3C
OC(O)CH3
+
C O
AlCl3
H3C
O
C6H5OH
OC(O)CH3 + H O
C
CH3
87
88.
Пергруппировка КляйзенаПример сигматропной перегруппировки – перемещение s-связи
O
CH2
CH
O
CH2
CH2 190-220 OC
=
OH
O
CH
CH2 CH CH2
CH2
H
Аллилфениловый эфир
Аллилоксибензол
Циклогексадиенон
O CH2 CH CH CH3
220 ОС
CH2 CH CH2
2-Аллилфенол
OH
CH HC CH2
CH3
фенил-(1-бут-2-енил)овый
эфир
1-(бут-2-енилокси)бензол
2-(1-метилаллил)фенол
88
89.
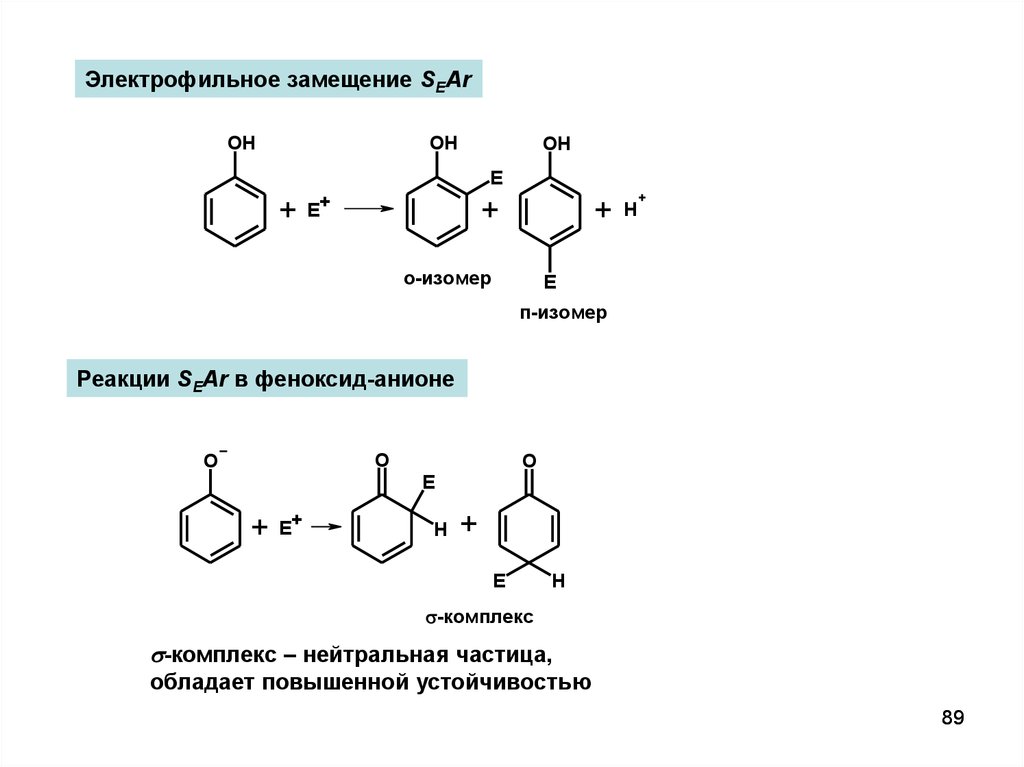
Электрофильное замещение SEArOH
OH
OH
E
+ E+
+
+
о-изомер
H
+
E
п-изомер
Реакции SEAr в феноксид-анионе
O
O
O
E
+
E+
H
+
E
H
s-комплекс
s-комплекс – нейтральная частица,
обладает повышенной устойчивостью
89
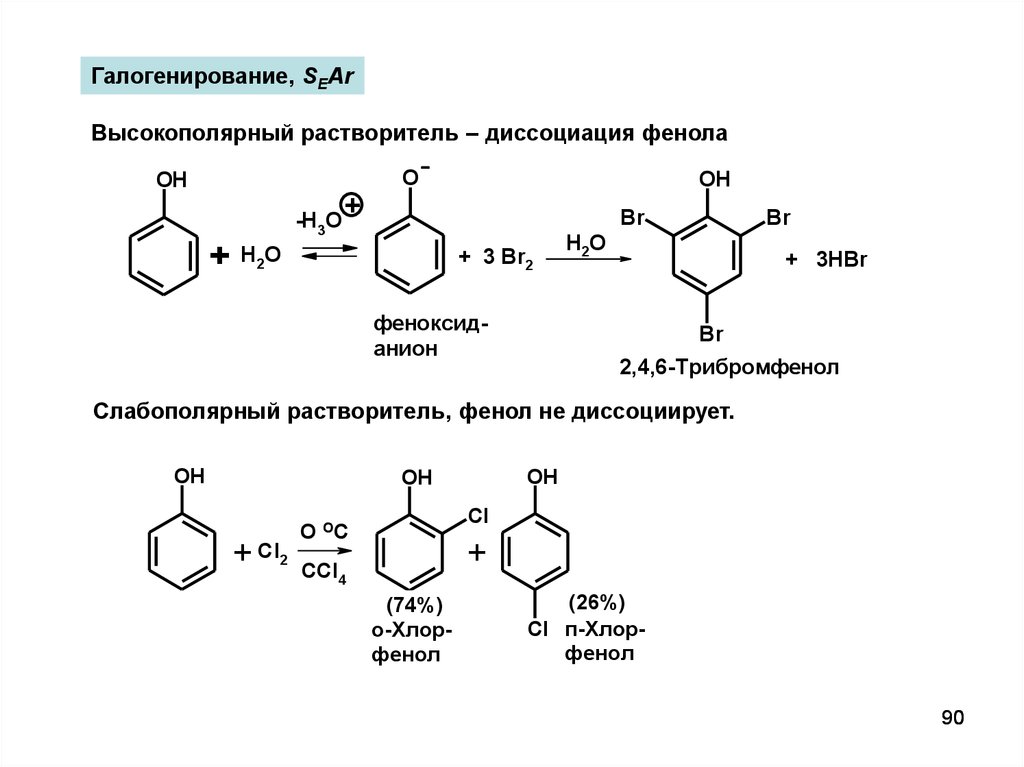
90.
Галогенирование, SEArВысокополярный растворитель – диссоциация фенола
OH
+
-H3O
+
O
OH
Br
H 2O
+ 3 Br2
феноксиданион
Br
H2O
+ 3HBr
Br
2,4,6-Трибромфенол
Слабополярный растворитель, фенол не диссоциирует.
OH
OH
OH
+ Cl2
Cl
O OC
+
CCl4
(74%)
о-Хлорфенол
(26%)
Cl п-Хлорфенол
90
91.
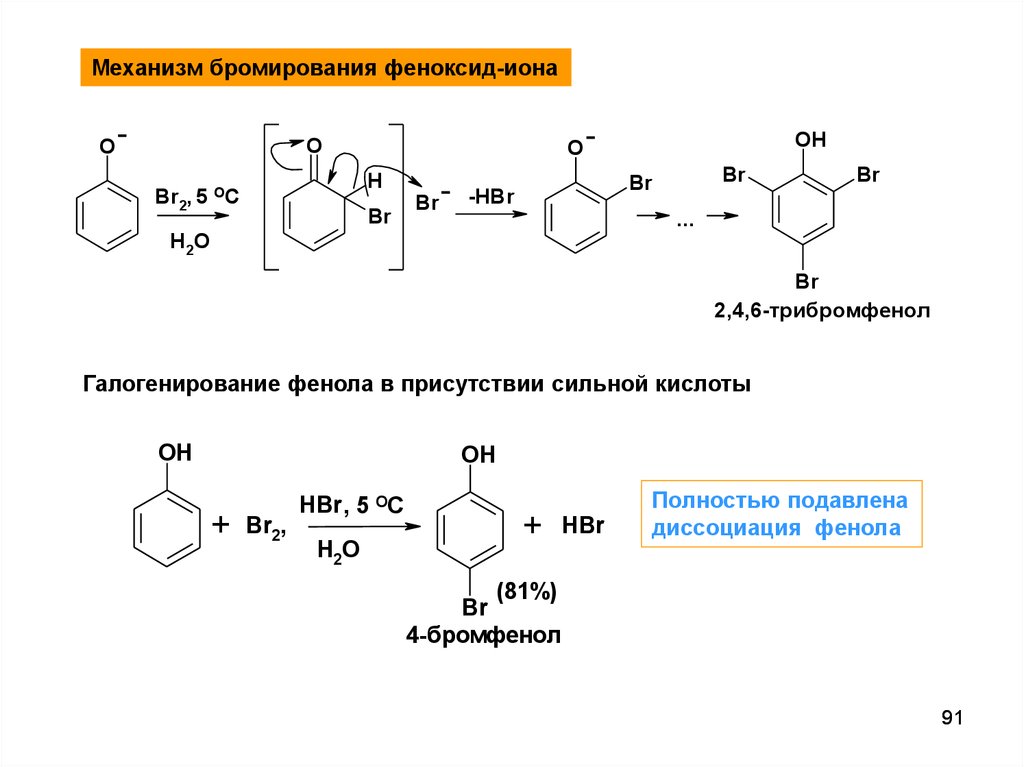
Механизм бромирования феноксид-ионаO
O
H
Br2, 5 OC
OH
O
Br
Br
Br
Br
-HBr
Br
...
H 2O
Br
2,4,6-трибромфенол
Галогенирование фенола в присутствии сильной кислоты
OH
OH
+
Br2,
HBr , 5 OC
H 2O
+
HBr
Полностью подавлена
диссоциация фенола
(81%)
Br
4-бромфенол
91
92.
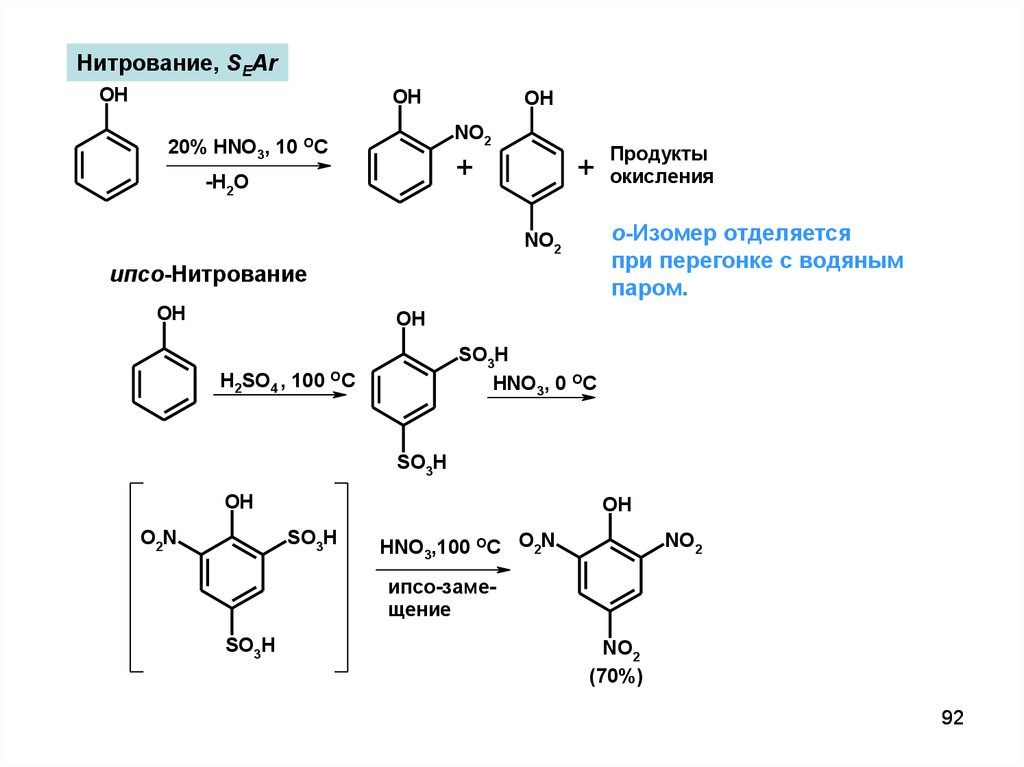
Нитрование, SEArOH
OH
OH
NO2
20% HNO3, 10 OC
+
-H2O
+
о-Изомер отделяется
при перегонке с водяным
паром.
NO2
ипсо-Нитрование
OH
Продукты
окисления
OH
SO3H
HNO3, 0 OC
H2SO4 , 100 OC
SO3H
OH
O2N
OH
SO3H
HNO3,100 OC O2N
NO2
ипсо-замещение
SO3H
NO2
(70%)
92
93.
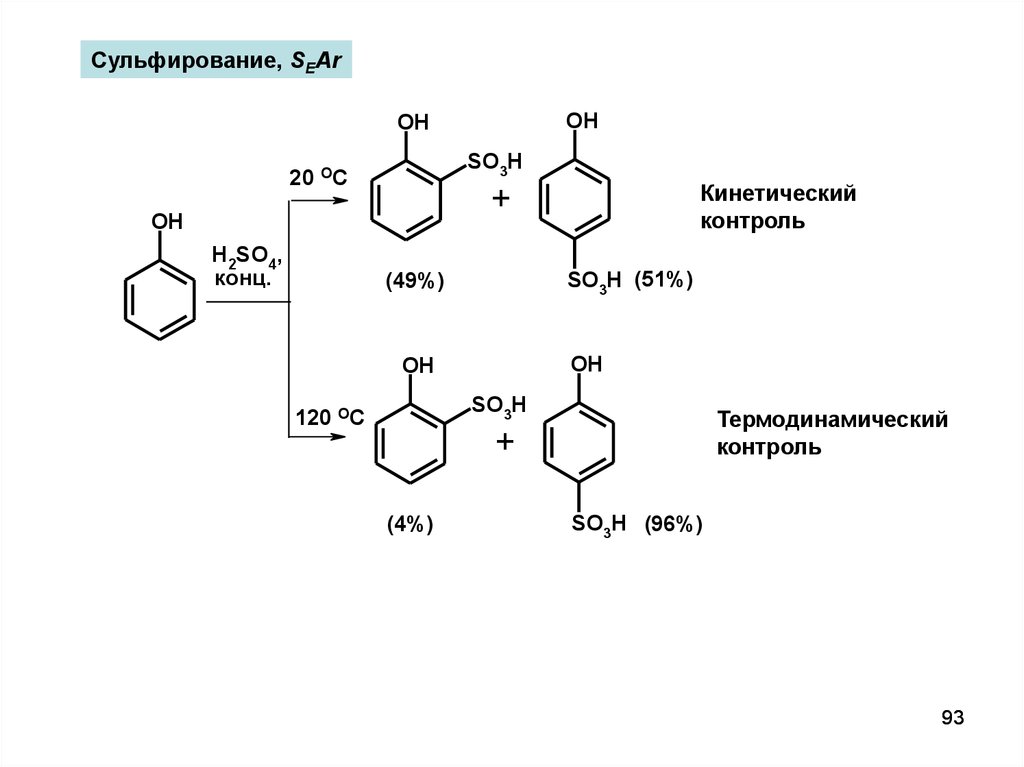
Сульфирование, SEArOH
OH
SO3H
20 OC
+
OH
H2SO4,
конц.
Кинетический
контроль
SO3H (51%)
(49%)
OH
OH
SO3H
120 OC
Термодинамический
контроль
+
(4%)
SO3H (96%)
93
94.
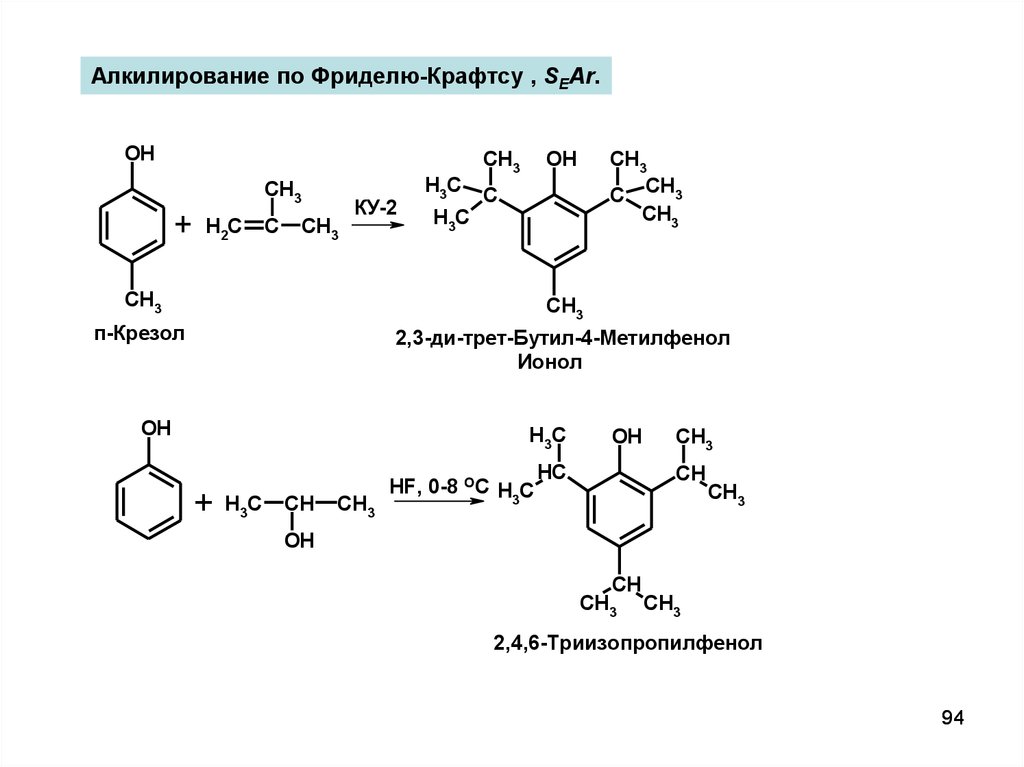
Алкилирование по Фриделю-Крафтсу , SEAr.OH
+
CH3
H2C
C
CH3
КУ-2
H3C
H3C
CH3
CH3
C CH3
CH3
OH
C
CH3
CH3
п-Крезол
2,3-ди-трет-Бутил-4-Метилфенол
Ионол
OH
H3C
+
H3C
CH
CH3
HF, 0-8 OC H C
3
OH
HC
CH3
CH
CH3
OH
CH
CH3
CH3
2,4,6-Триизопропилфенол
94
95.
Ацилирование по Фриделю-Крафтсу, SEArOH
O
+
H3C
C
O
AlCl3; 140 OC
O
AlCl3
CH3 Перегруппировка Фриса
Cl
CH3
O
O
+ HO
HO
CH3
1-(2-Гидроксифенил)этанон
1-(4-Гидроксифенил)этанон
OH
+
CH3COOH BF3
20
OC
O
C
HO
CH3
(95%)
95
96.
Конденсация фенола с фталевым ангидридом, SEArРазновидность реакции ацилирования по Фриделю-Крафтсу (А.Байер).
OH
HO
O
OH
C
2
+
O
H2SO4, 120 OC
C
O
C
C
O
O
Фенолфталеин
Фталевый
ангидрид
Азосочетание, SEAr
+
N2 Cl
Солянокислый
фенилдиазоний
(электрофил)
+
O Na
+
N
N
OH
4-Фенилазофенол
96
97.
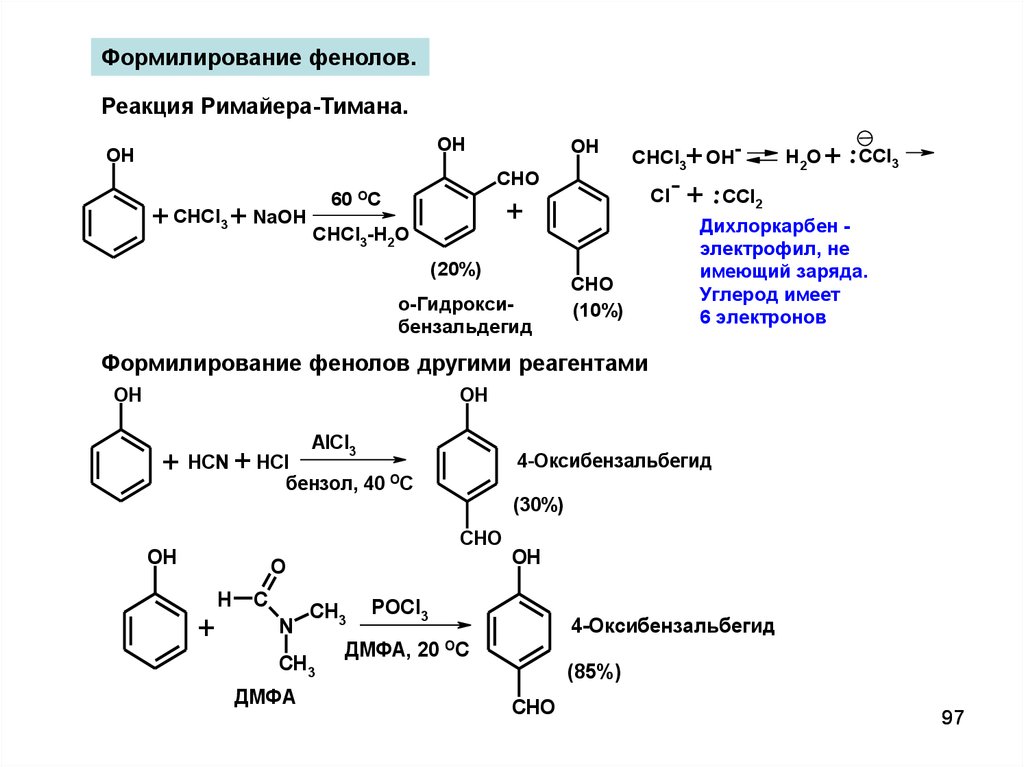
Формилирование фенолов.Реакция Римайера-Тимана.
OH
OH
60
OH
CHO
OC
Cl
+
+ CHCl3 + NaOH CHCl -H O
3
CHCl3 OH-
2
(20%)
о-Гидроксибензальдегид
CHO
(10%)
+
+ .CCl2
H 2O
+ .CCl3
Дихлоркарбен электрофил, не
имеющий заряда.
Углерод имеет
6 электронов
Формилирование фенолов другими реагентами
OH
OH
+ HCN + HCl
AlCl3
4-Оксибензальбегид
бензол, 40
ОС
(30%)
CHO
OH
O
+
H
C
N
CH3
CH3
ДМФА
OH
POCl3
ДМФА, 20
4-Оксибензальбегид
ОС
(85%)
CHO
97
98.
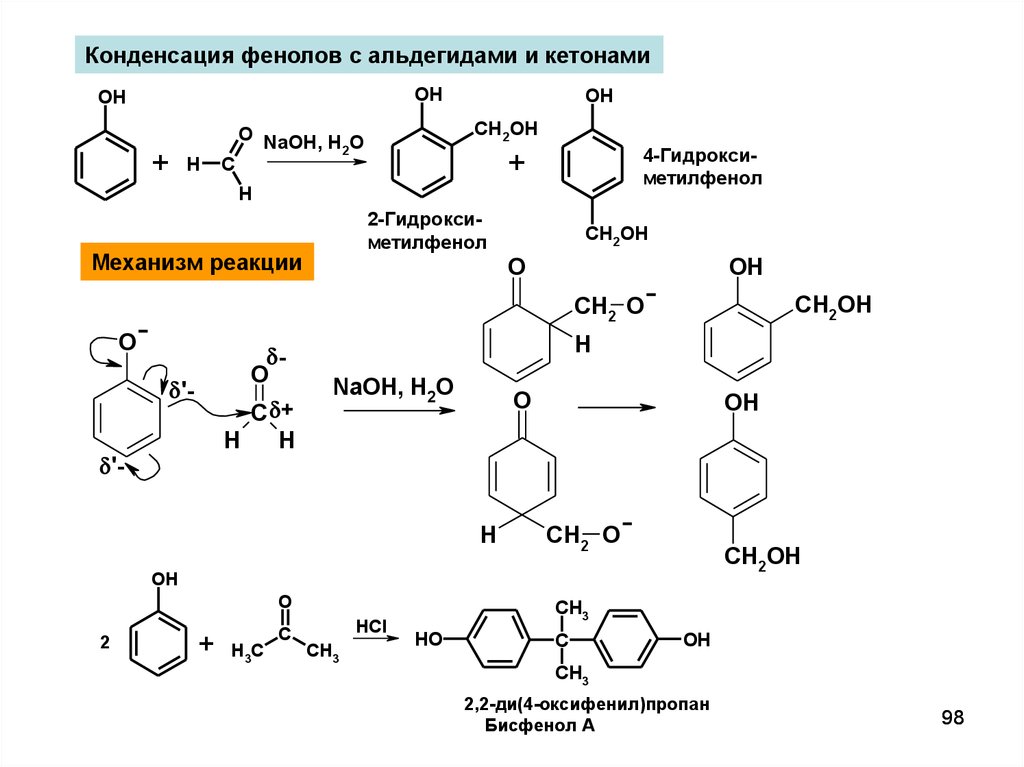
Конденсация фенолов с альдегидами и кетонамиOH
OH
+
H
C
OH
CH2OH
O NaOH, H O
2
4-Гидроксиметилфенол
+
H
2-Гидроксиметилфенол
Механизм реакции
CH2OH
OH
O
CH2OH
CH2 O
O
O
'-
C +
H
H
'-
H
NaOH, H2O
O
H
OH
CH2 O
CH2OH
OH
O
2
+
H3C
C
HCl
CH3
CH3
HO
C
OH
CH3
2,2-ди(4-оксифенил)пропан
Бисфенол А
98
99.
Фенол-формальдегидная смола (Л.Бакелунд, 1909 г.).Первое синтетическое высокомолекулярное вещество.
OH
n
+
n HCOH
OH
20-150 OC
NaOH, H2O
OH
OH
Бакелит
OH
n
HO
HO
OH
99
100.
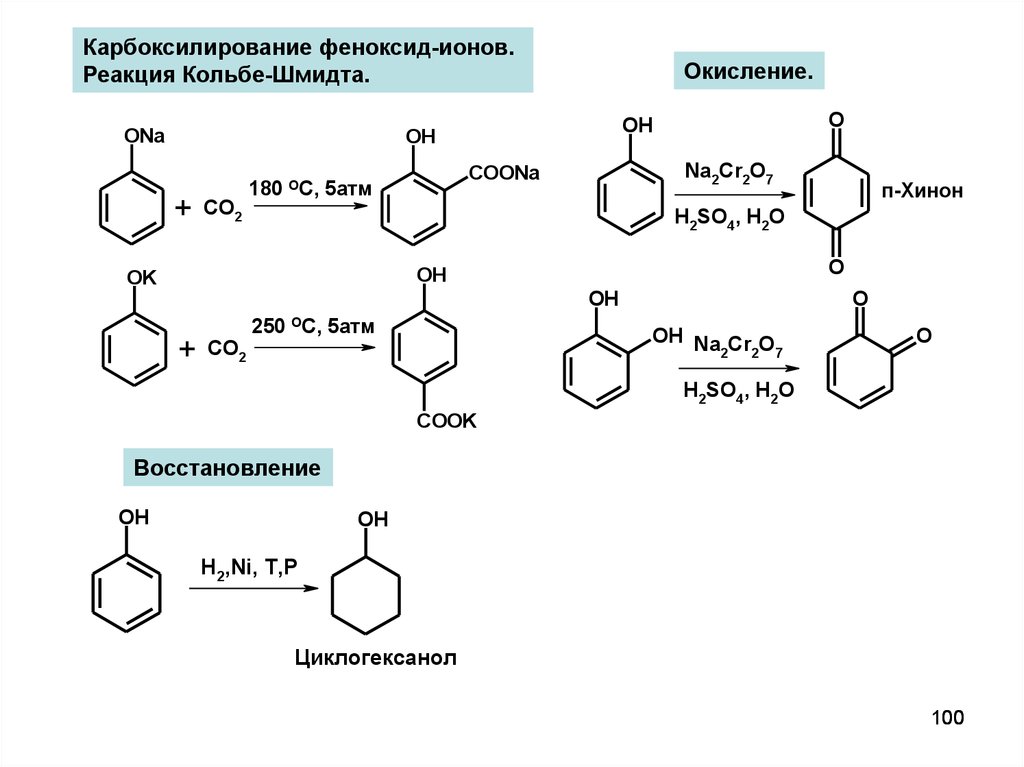
Карбоксилирование феноксид-ионов.Реакция Кольбе-Шмидта.
ONa
Окисление.
+
CO2
Na2Cr2O7
COONa
180 OC, 5атм
O
OH
OH
H2SO4, H2O
O
OH
OK
O
OH
+
CO2
п-Хинон
250 OC, 5атм
OH Na Cr O
2
2 7
O
H2SO4, H2O
COOK
Восстановление
OH
OH
H2,Ni, T,P
Циклогексанол
100
101.
Эпоксидная смолаn
O
O
+
n Cl
CH2
O
эпихлоргидрин
CH3
H2C
CH CH2 O
O
C
CH3
C
O CH2 CH CH2 O
CH3
OH
O
CH3
n
CH2CH CH2
O
Элластичный материал
O
O
H2C
CH2CH CH2
CH CH2
H2N CH2 CH2 NH CH2 CH2 NH2
CH2CH CH2
O
Сшивки цепей полимера, образование твердого материала
101
































 Химия
Химия








