Похожие презентации:
Фенолы. Простые эфиры
1. ОРГАНИЧЕСКАЯ ХИМИЯ
*1.
Фенолы
2.
Простые эфиры
2.
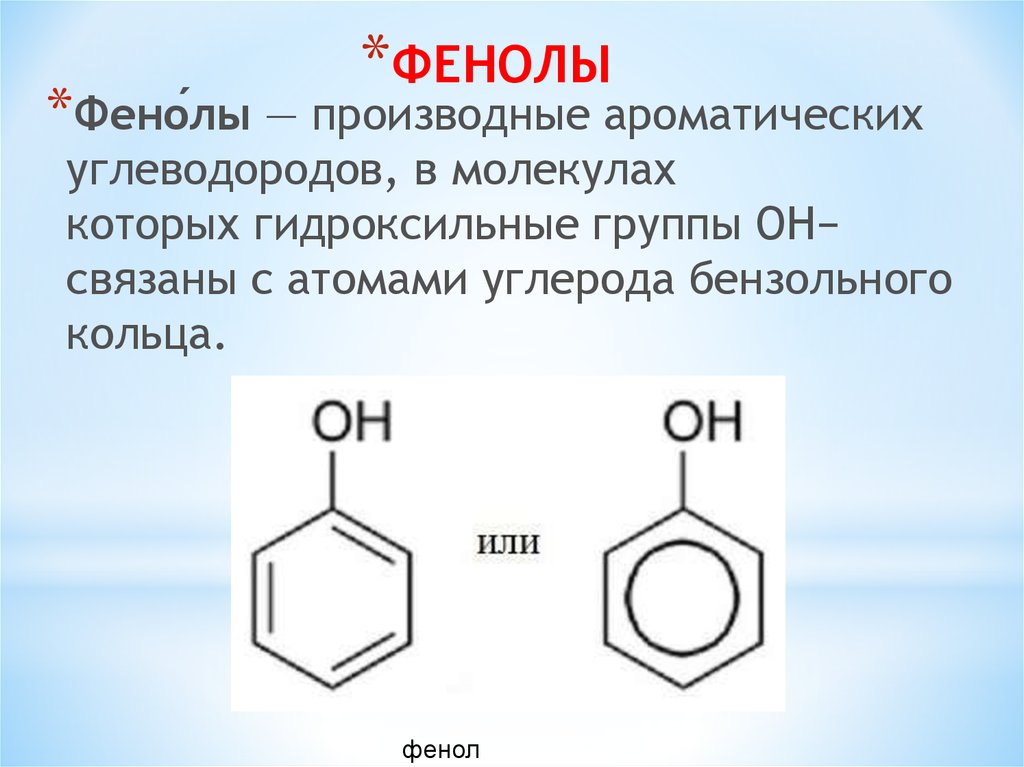
*ФЕНОЛЫ*Фено́лы — производные ароматических
углеводородов, в молекулах
которых гидроксильные группы OH−
связаны с атомами углерода бензольного
кольца.
фенол
3.
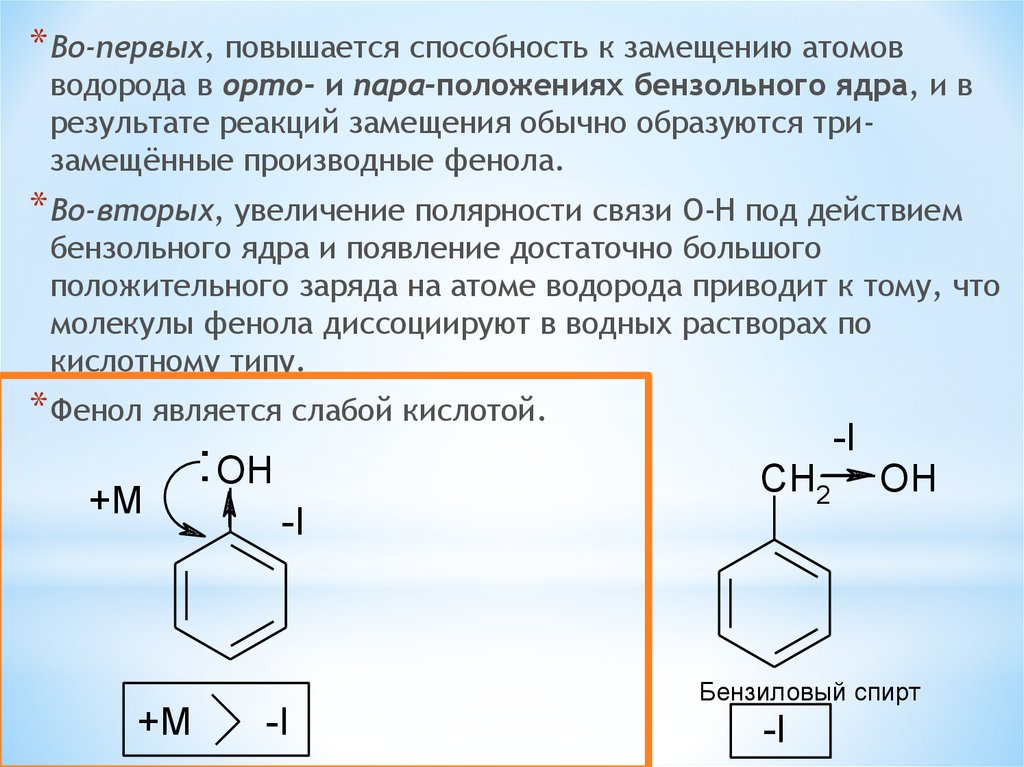
* Во-первых, повышается способность к замещению атомовводорода в орто- и пара-положениях бензольного ядра, и в
результате реакций замещения обычно образуются тризамещённые производные фенола.
* Во-вторых, увеличение полярности связи O-H под действием
бензольного ядра и появление достаточно большого
положительного заряда на атоме водорода приводит к тому, что
молекулы фенола диссоциируют в водных растворах по
кислотному типу.
* Фенол является слабой кислотой.
+M
: OH
-I
-I
CH2
OH
Бензиловый спирт
+M
-I
-I
4.
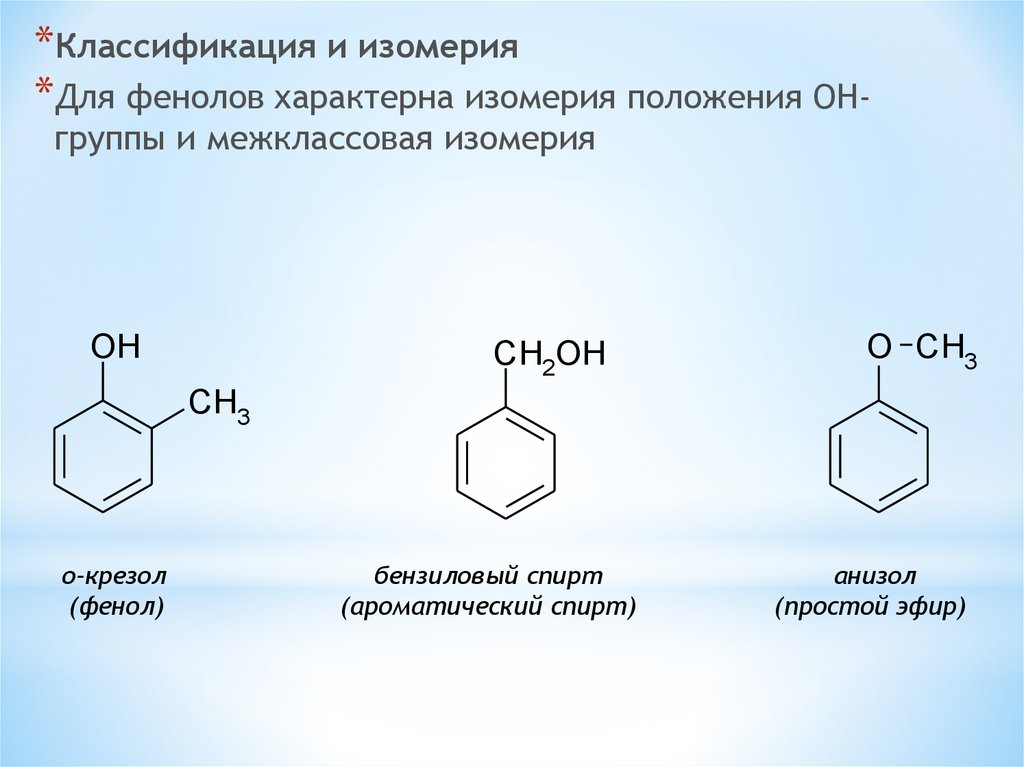
*Классификация и изомерия*Для фенолов характерна изомерия положения OHгруппы и межклассовая изомерия
OH
CH2OH
O CH3
CH3
о-крезол
(фенол)
бензиловый спирт
(ароматический спирт)
анизол
(простой эфир)
5.
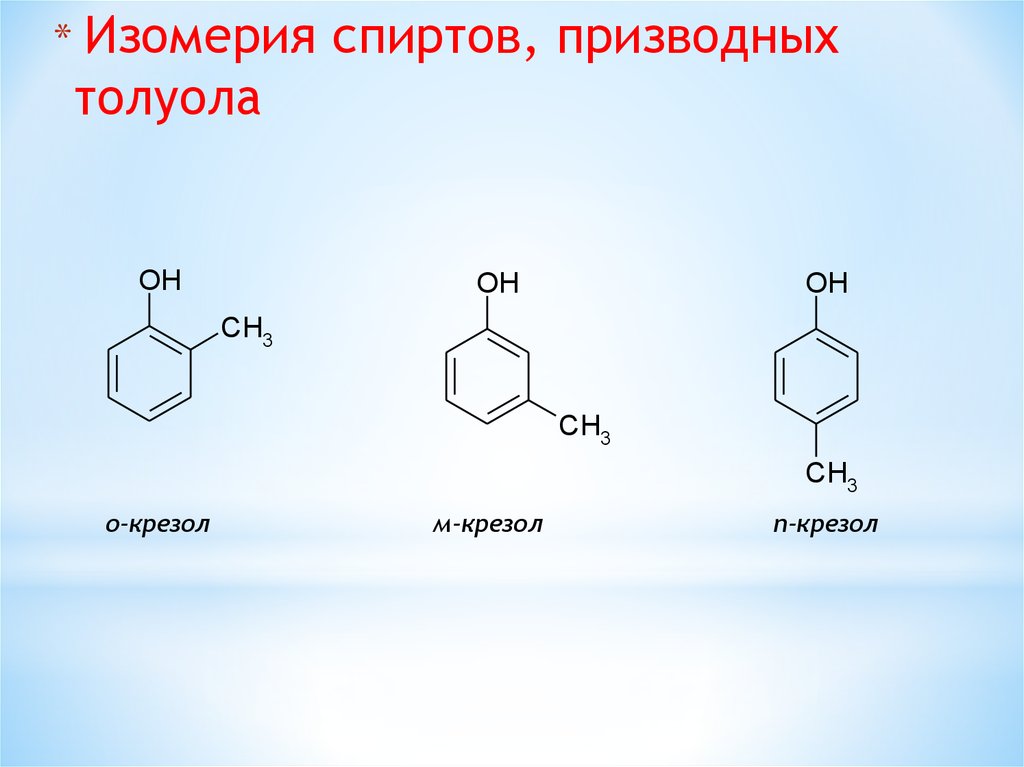
* Изомерияспиртов, призводных
толуола
OH
OH
OH
CH3
CH3
CH3
о-крезол
м-крезол
п-крезол
6.
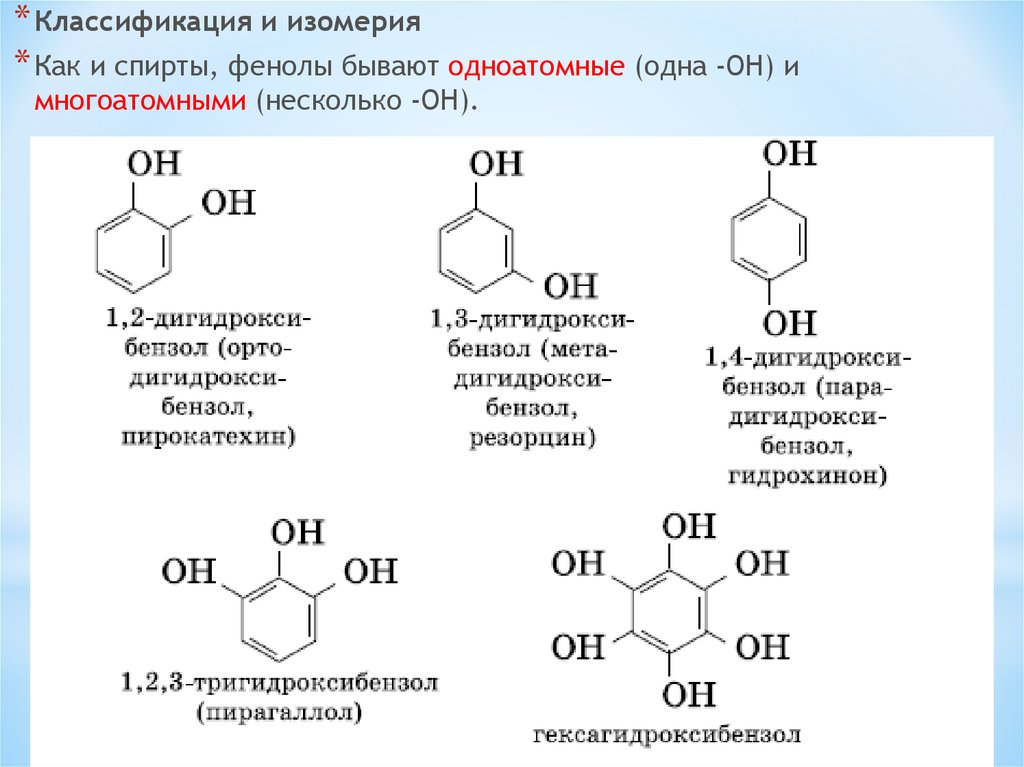
* Классификация и изомерия* Как и спирты, фенолы бывают одноатомные (одна -OH) и
многоатомными (несколько -OH).
10.9.11
7.
* Физические и биологические свойстваВодородные связи
8.
*Фенол очень токсичен, при попадании на кожу вызываетожоги. Фенол обладает хорошими дезинфицирующими
свойствами; это было первое вещество, которое
использовалось для дезинфекции (Дж. Листер, 1867)
*Фенолы входят в состав креозота – жидкости, получаемой из
каменноугольной смолы и используемой для пропитки шпал
для предотвращения их гниения. Очищенный креозот
используется как антисептик в медицине.
*Пентахлорфенол применяется для пропитки древесины как
антисептик, инсектицид и фунгицид. Пентахлорфенолятом
натрия обработаны брёвна Кижских церквей.
9.
10.
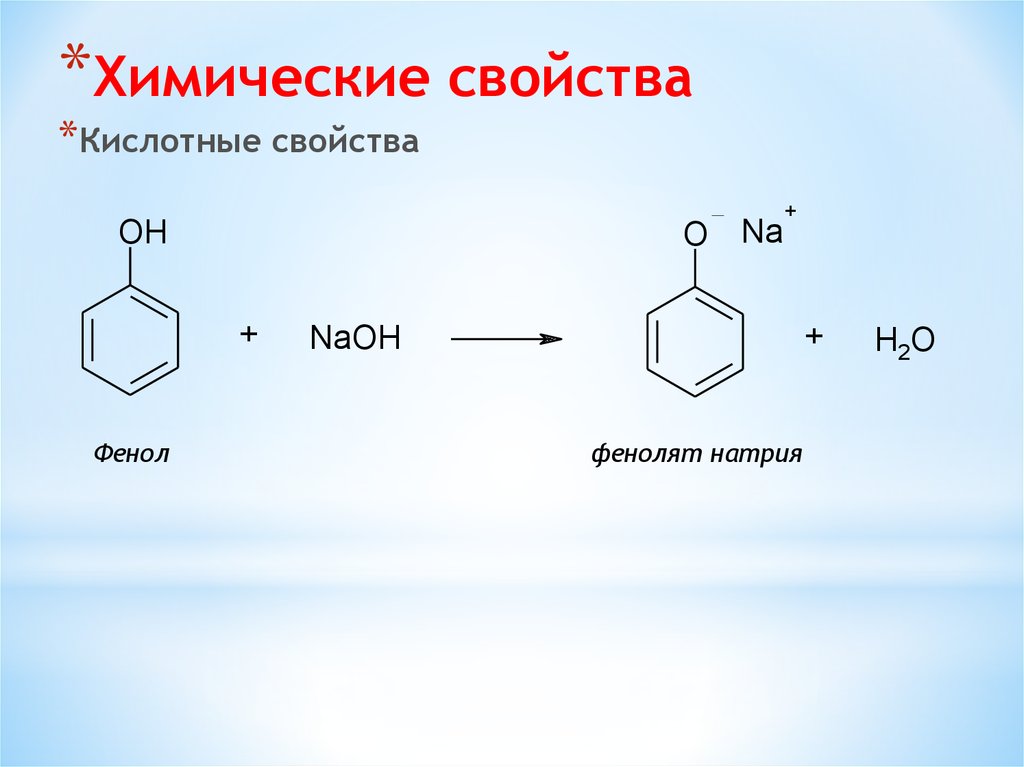
*Химические свойства*Кислотные свойства
O Na
OH
+
Фенол
+
+
NaOH
фенолят натрия
H2O
11.
* Нуклеофильные свойства фенолятовO Na
+
O CH3
+
фенолят натрия
+
CH3 I
анизол
NaI
12.
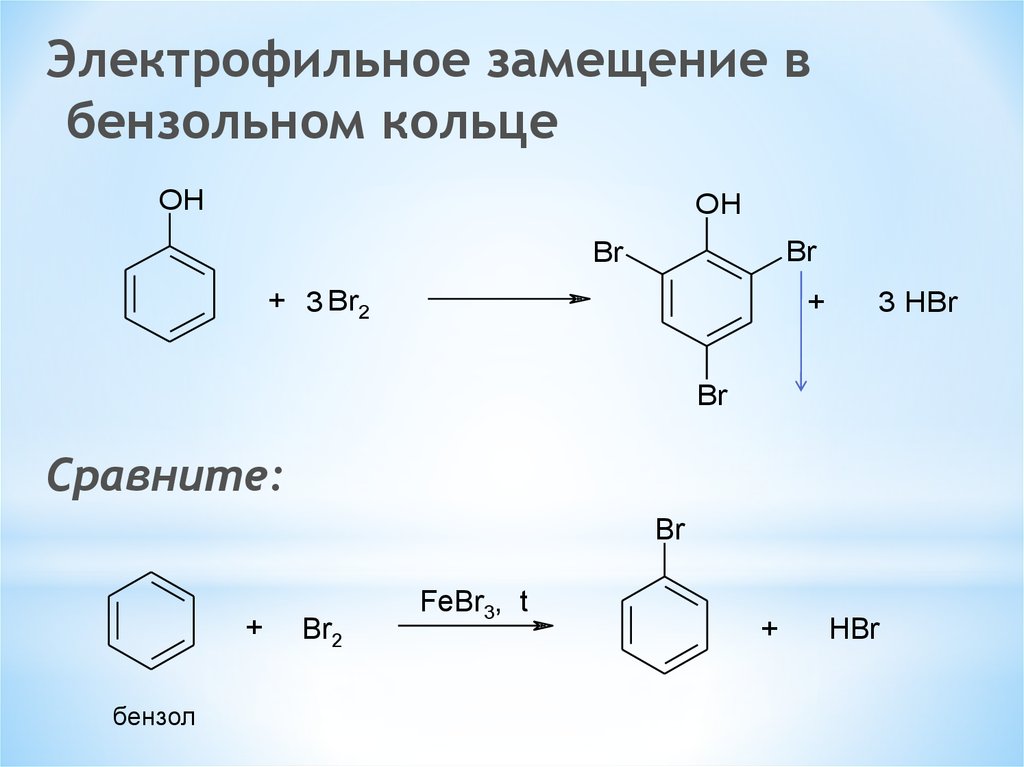
Электрофильное замещение вбензольном кольце
OH
OH
Br
Br
+ 3 Br2
+
3 HBr
Br
Сравните:
Br
+
бензол
Br2
FeBr3, t
+
HBr
13.
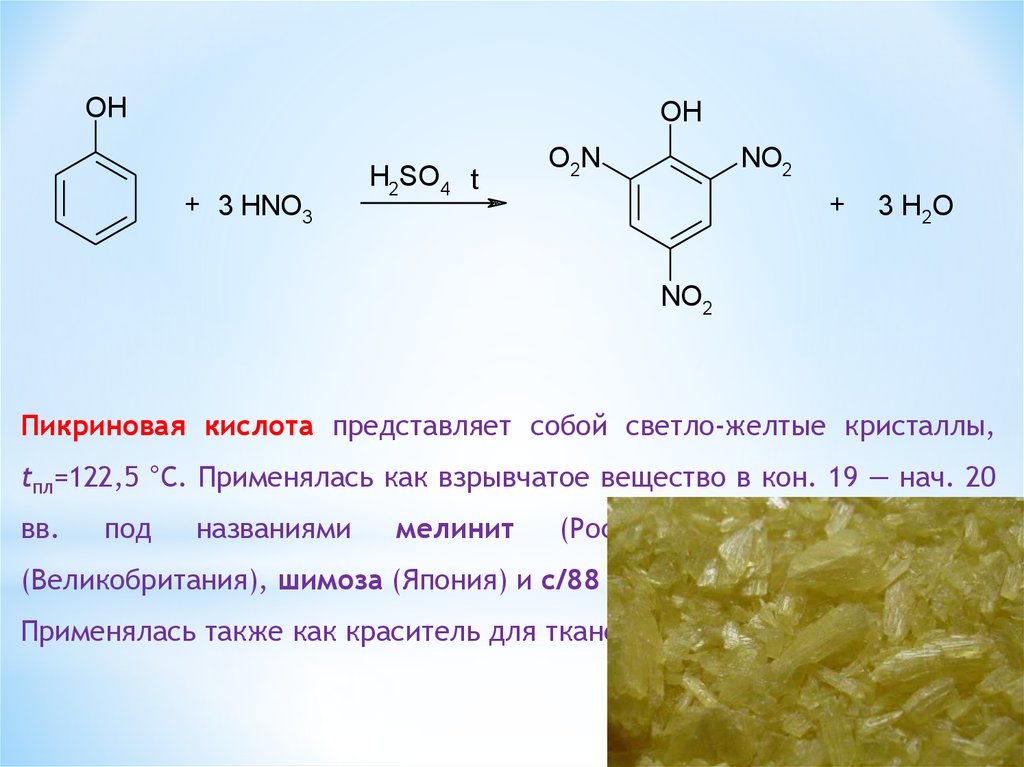
OHOH
+ 3 HNO3
H2SO4 t
NO2
O2N
+
3 H2O
NO2
Пикриновая кислота представляет собой светло-желтые кристаллы,
tпл=122,5 °С. Применялась как взрывчатое вещество в кон. 19 — нач. 20
вв.
под
названиями
мелинит
(Россия,
Франция),
(Великобритания), шимоза (Япония) и с/88 (Германия).
Применялась также как краситель для тканей.
лиддит
14.
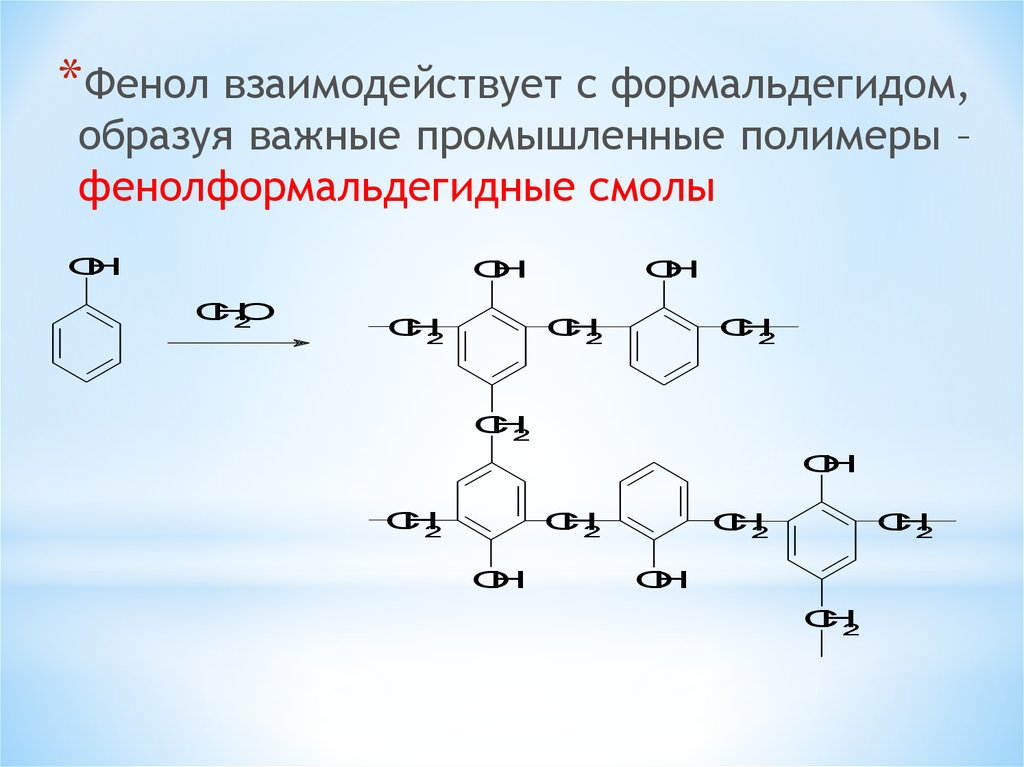
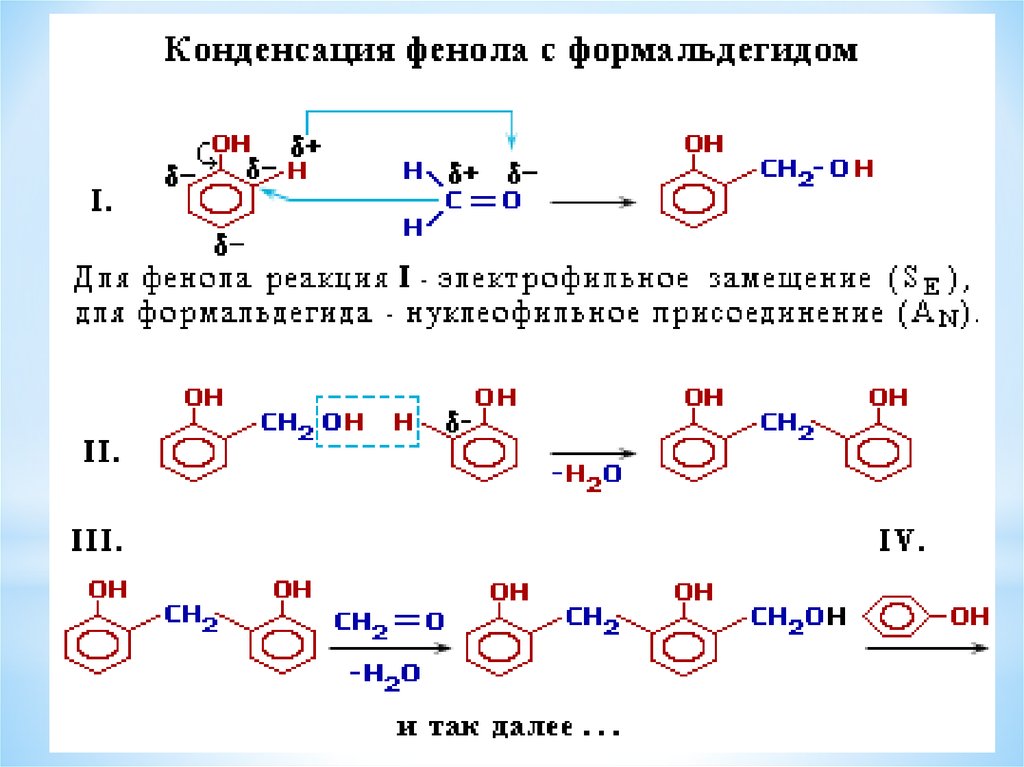
*Фенол взаимодействует с формальдегидом,образуя важные промышленные полимеры –
фенолформальдегидные смолы
H
O
H
O
H
O
O
H
C
2
H
C
2
H
C
2
H
C
2
H
C
2
H
O
H
C
2
H
C
2
H
O
H
C
2
H
C
2
H
O
H
C
2
15.
Нижник Я.П.http://norgchem.professorjournal.ru
10.9.11
16.
* Фенолформальдегидные смолы являются вязкими жидкостями илитвердыми веществами. Отвержденные фенолоформальдегидные
смолы обладают электроизоляционными и механическими
свойствами. Применяются в производстве фенопластов, клеев,
лаков, герметиков, фанеры, фенолформальдегидного волокна
(кайнол).
* https://www.youtube.com/watch?v=KI5GLTmn4J0
https://www.youtube.com/watch?v=RqOFrBi6zeQ
*
Фенолформальдегидные
смолы
являлись
первыми
промышленными синтетическими смолами; их производство под
названием “бакелит” было начато в 1909 году.
* Также,
в
промышленности
используются
крезолоформальдегидные смолы, резорцино-формальдегидные смолы,
феноло-анилино-формальдегидные
смолы,
феноло-
17.
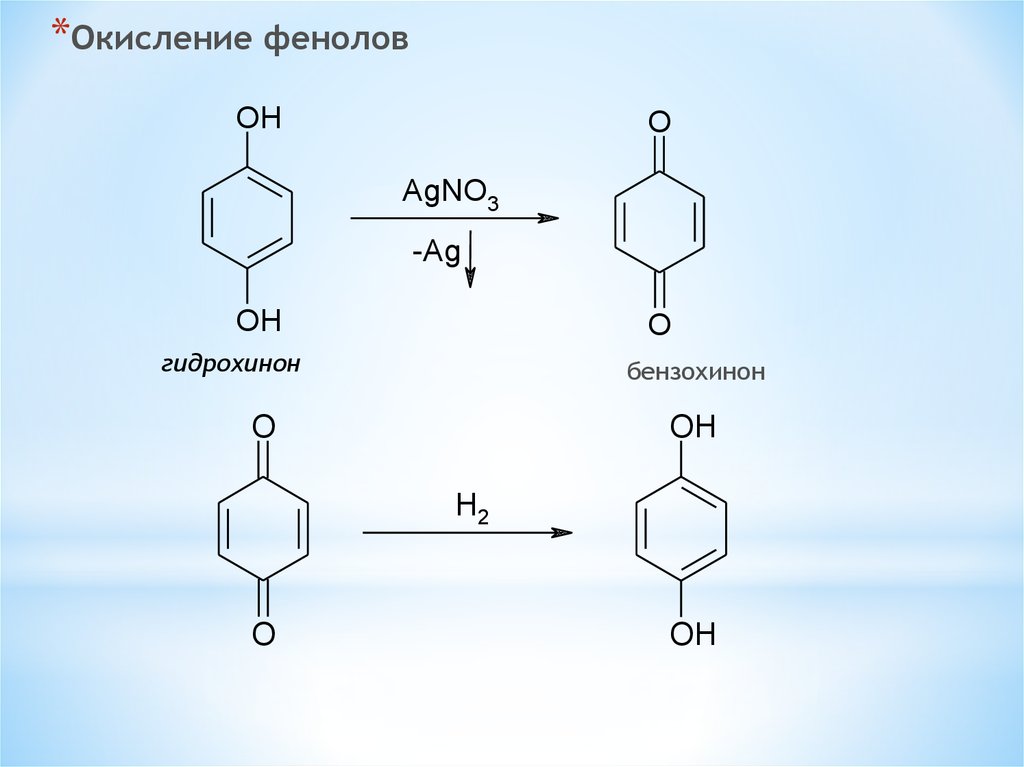
*Окисление феноловOH
O
AgNO3
-Ag
OH
O
гидрохинон
бензохинон
O
OH
H2
O
OH
18.
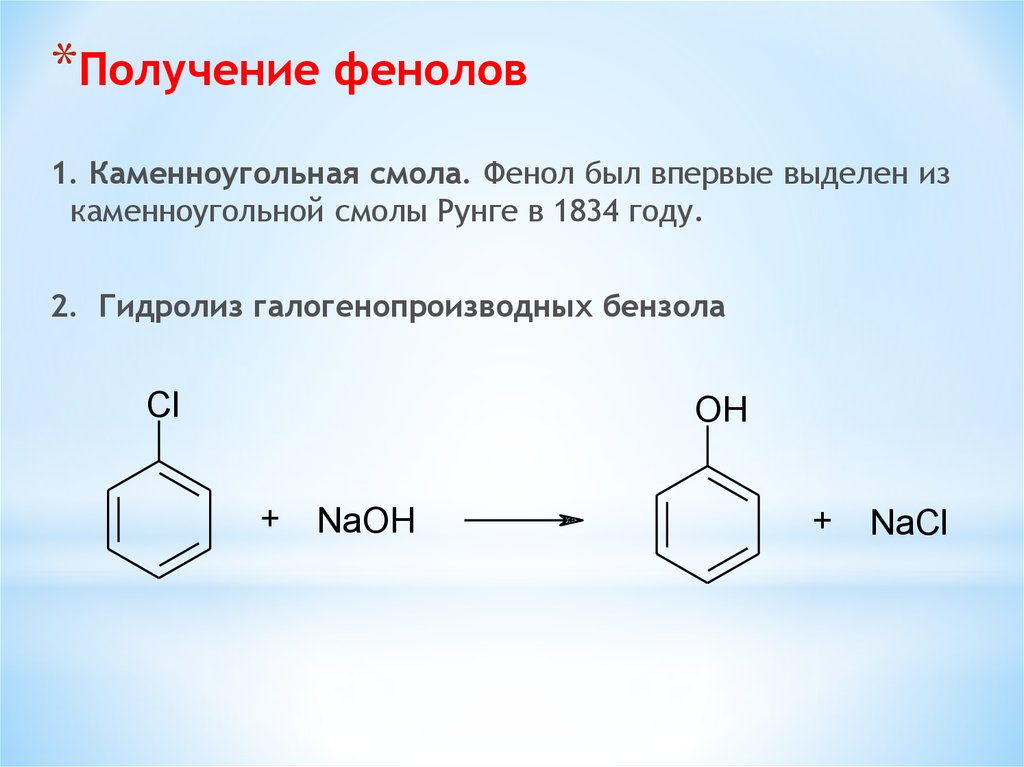
*Получение фенолов1. Каменноугольная смола. Фенол был впервые выделен из
каменноугольной смолы Рунге в 1834 году.
2. Гидролиз галогенопроизводных бензола
Cl
OH
+
NaOH
+
NaCl
19. Виде по теме: https://www.youtube.com/watch?v=GHuLtv59G44
*10.9.11
20.
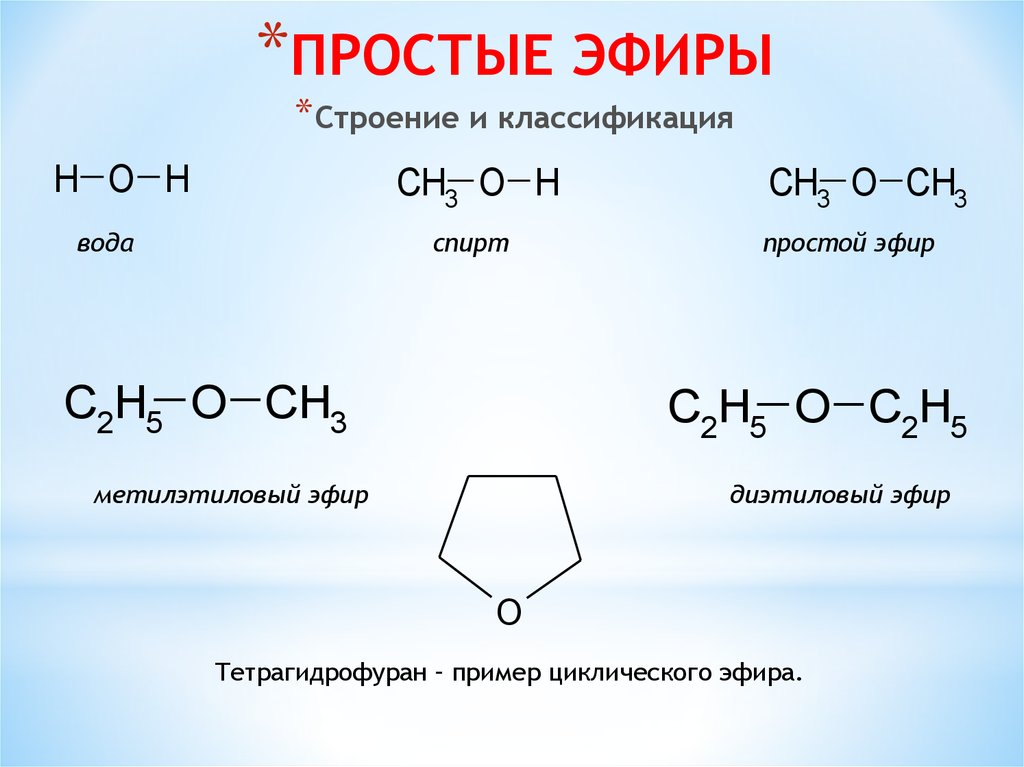
*ПРОСТЫЕ ЭФИРЫ*Строение и классификация
H O H
CH3 O H
вода
спирт
C2H5 O CH3
CH3 O CH3
простой эфир
C2H5 O C2H5
метилэтиловый эфир
диэтиловый эфир
O
Тетрагидрофуран – пример циклического эфира.
21.
* Номенклатура*Обычно простые эфиры называют по радикально-
функциональной номенклатуре, перечисляя радикалы
в виде прилагательного и добавляя слово эфир.
*По номенклатуре ИЮПАК эфиры называются как
алкоксильные производные углеводородов, используя
приставки алкокси-, алкенилокси-, арилокси- и т.д.
диметиловый эфир
CH3 O CH3
метоксиметан
22.
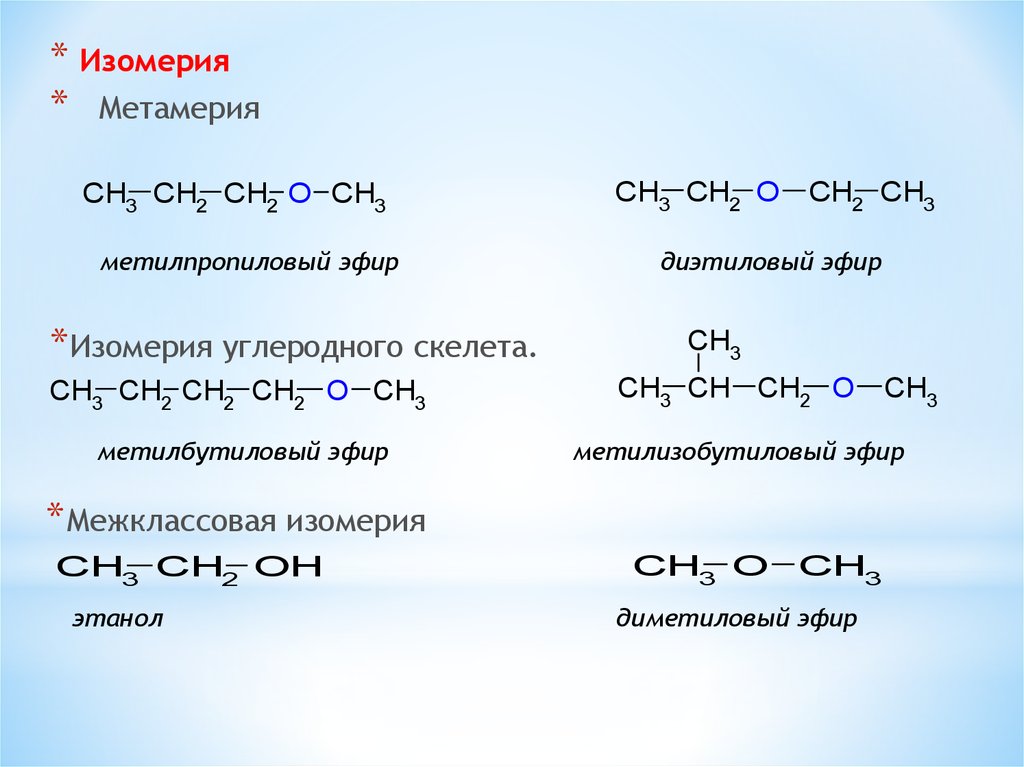
* Изомерия* Метамерия
CH3 CH2 CH2 O CH3
метилпропиловый эфир
*Изомерия углеродного скелета.
CH3 CH2 O CH2 CH3
диэтиловый эфир
CH3
CH3 CH2 CH2 CH2 O CH3
CH3 CH CH2 O
метилбутиловый эфир
метилизобутиловый эфир
*Межклассовая изомерия
CH3 CH2 OH
этанол
CH3 O CH3
диметиловый эфир
CH3
23.
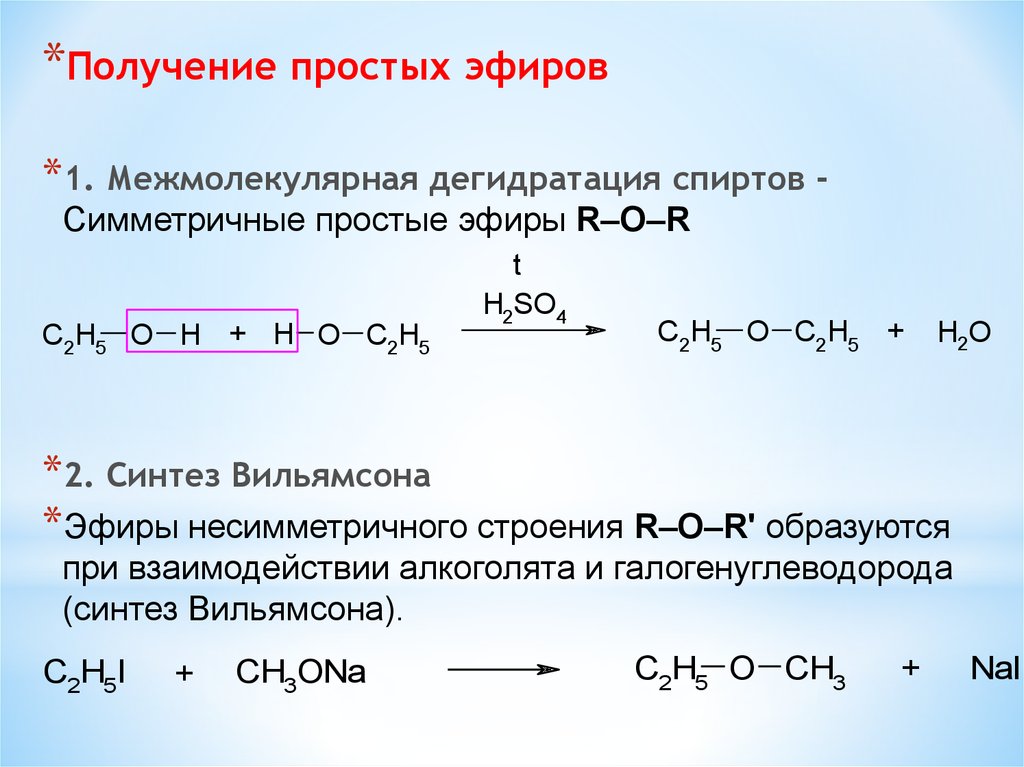
*Получение простых эфиров*1. Межмолекулярная дегидратация спиртов Симметричные простые эфиры R–O–R
C2H5 O H + H O C2H5
t
H2SO4
C2H5 O C2H5 +
H2O
*2. Синтез Вильямсона
*Эфиры несимметричного строения R–O–R' образуются
при взаимодействии алкоголята и галогенуглеводорода
(синтез Вильямсона).
C2H5I
+
CH3ONa
C2H5 O CH3
+
NaI
24.
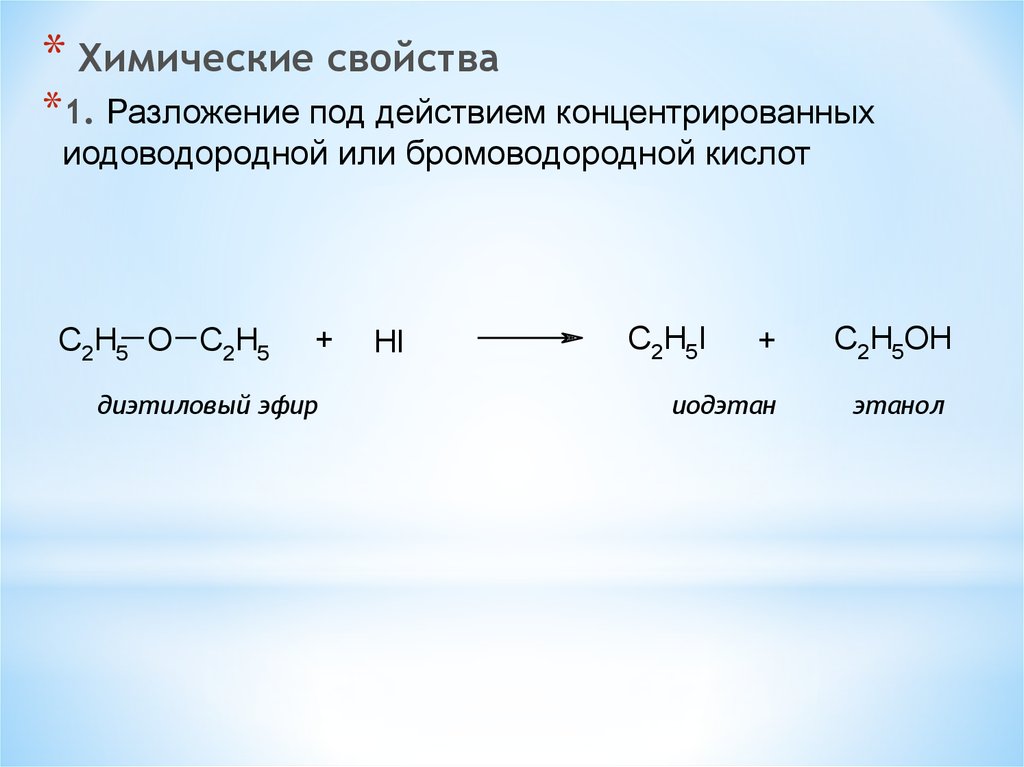
* Химические свойства*1. Разложение под действием концентрированных
иодоводородной или бромоводородной кислот
C2H5 O C2H5
+
диэтиловый эфир
HI
C2H5I
+
иодэтан
C2H5OH
этанол
25.
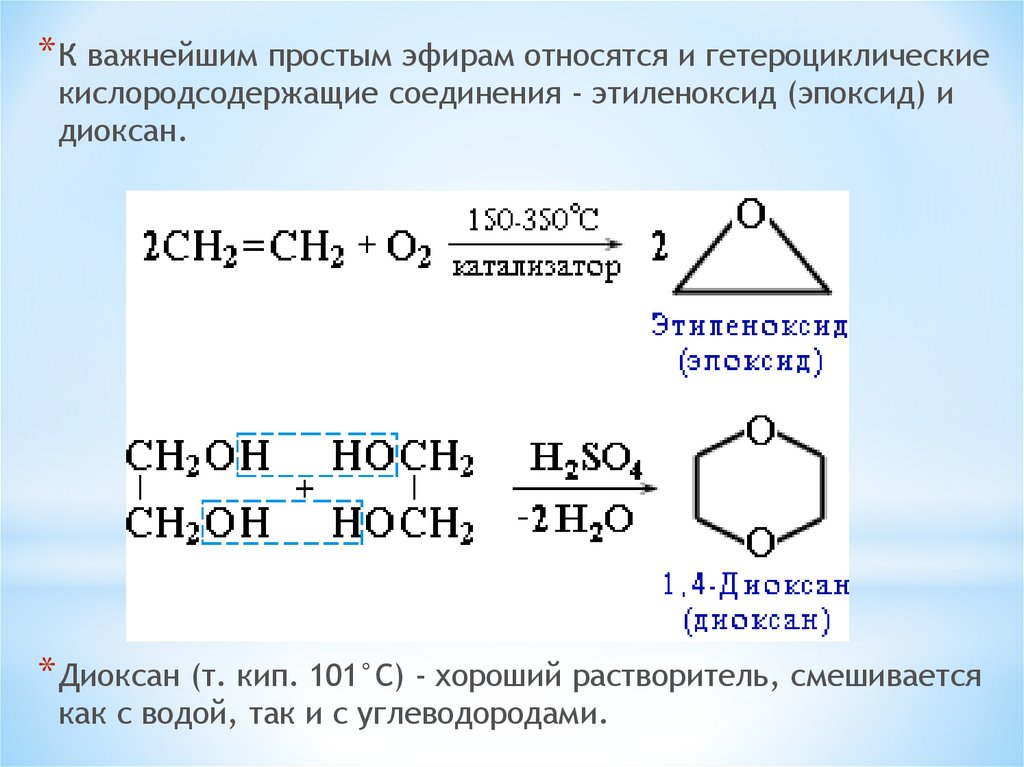
* К важнейшим простым эфирам относятся и гетероциклическиекислородсодержащие соединения - этиленоксид (эпоксид) и
диоксан.
* Диоксан (т. кип. 101°С) - хороший растворитель, смешивается
как с водой, так и с углеводородами.
26.
* Эпоксиды образуются в организме человека в результатебиотрансформации чужеродных соединений — ксенобиотиков.
* В процессе биотрансформации некоторых ксенобиотиков под
действием ферментной системы происходит образование
эпоксидного цикла, сама реакция носит название
эпоксидирование. Образовавшиеся продукты легко
алкилируют нуклеофильные центры нуклеиновых
кислот (ДНК), что влечёт к повышению количества мутаций.
* противоэпилептический
* карбамазепин.
Рис. Обезвреживание бензантрацена. Е1 - фермент микросомальной системы;
Е2 - эпоксидгидратаза.
27.
* Эпоксидныематериалы
используются для
устройства полов на
промышленных и
декоративных
объектах.
Нижник Я.П.
http://norgchem.professorjournal.ru
10.9.11









 Химия
Химия








