Похожие презентации:
Органическая химия. Классификация кислот
1.
3. Органическая химия3.3. Кислородсодержащие органические соединения
3.3.3.Карбоновые кислоты и сложные эфиры
2.
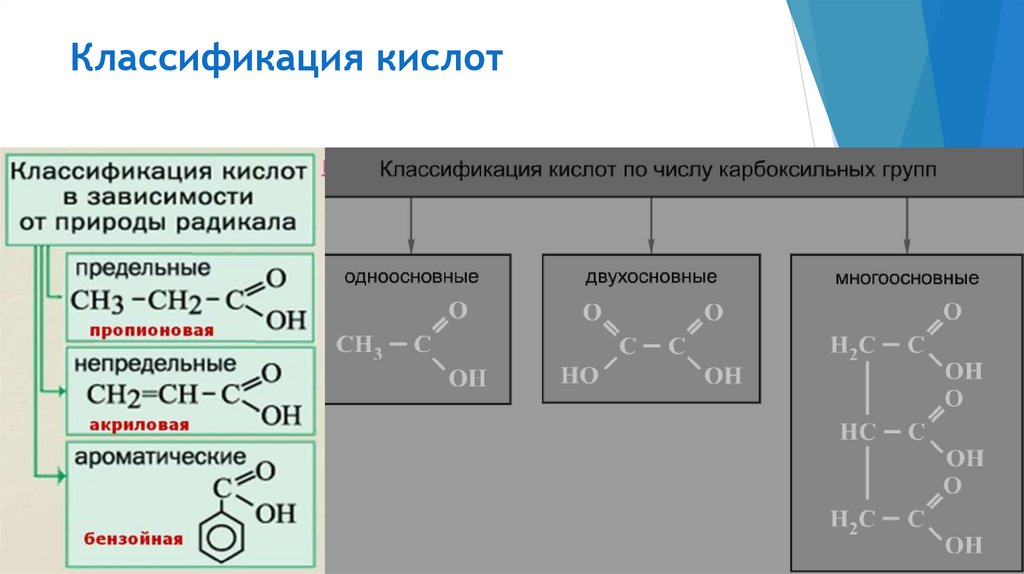
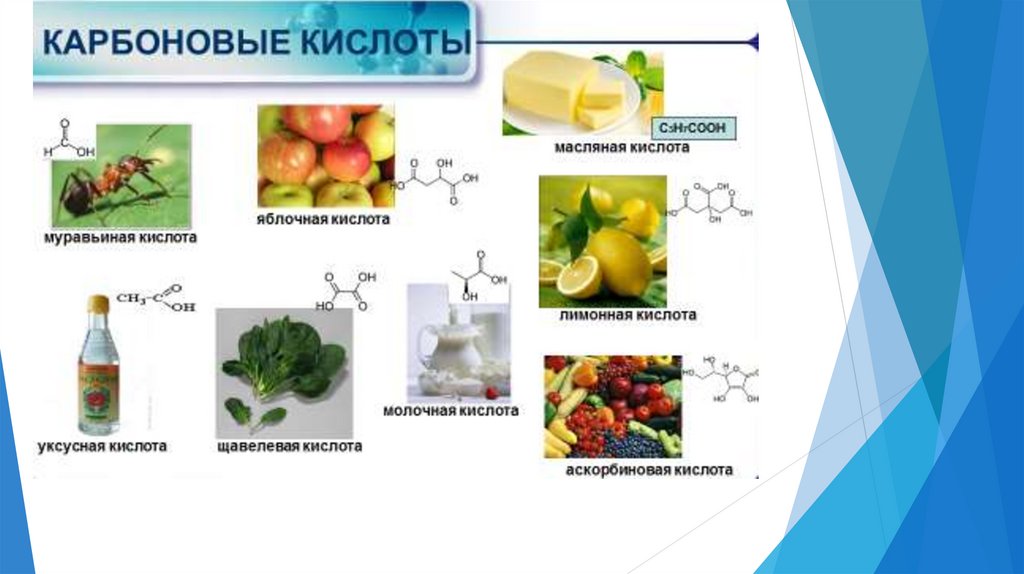
Классификация кислот3.
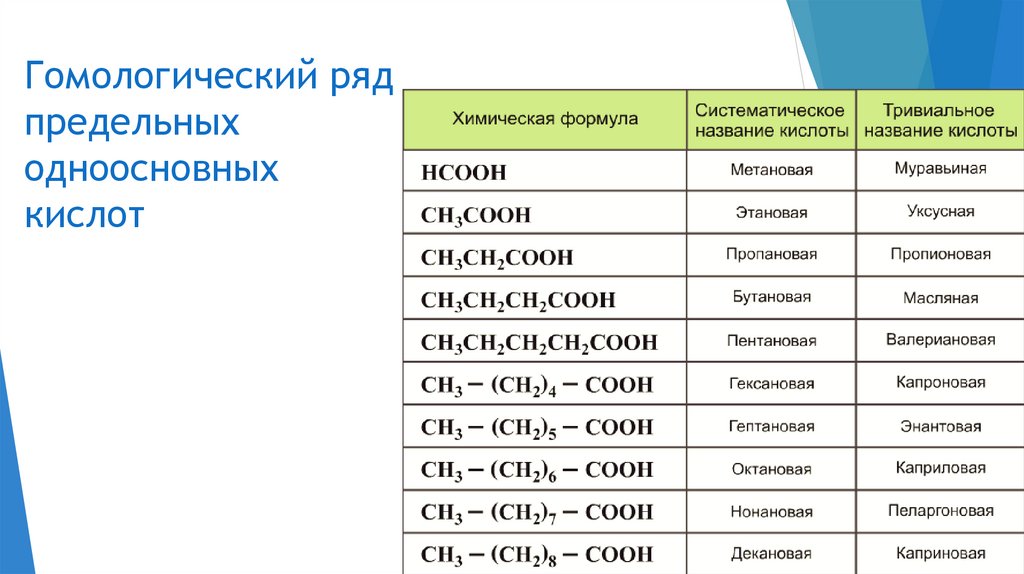
Гомологический рядпредельных
одноосновных
кислот
4.
5.
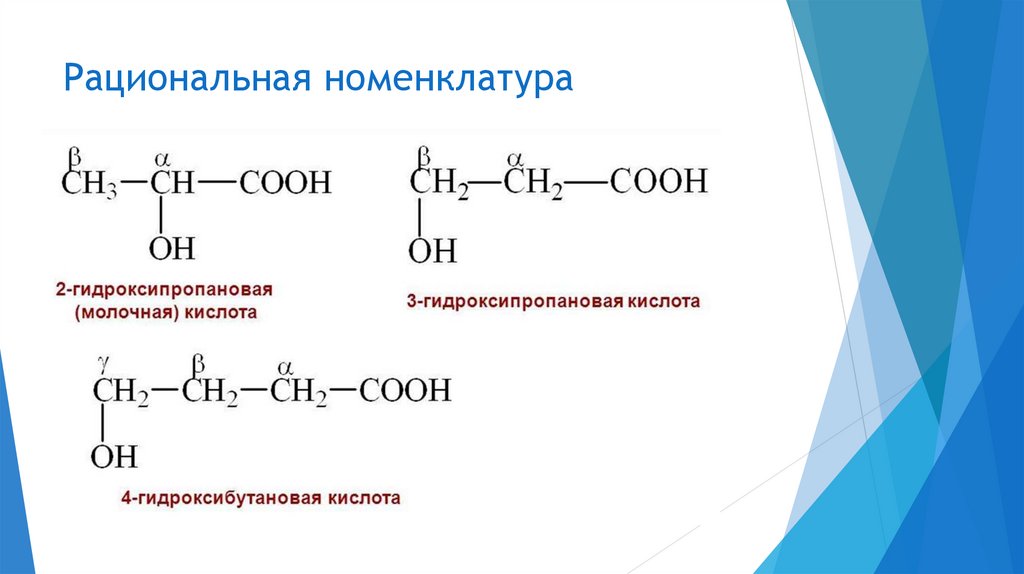
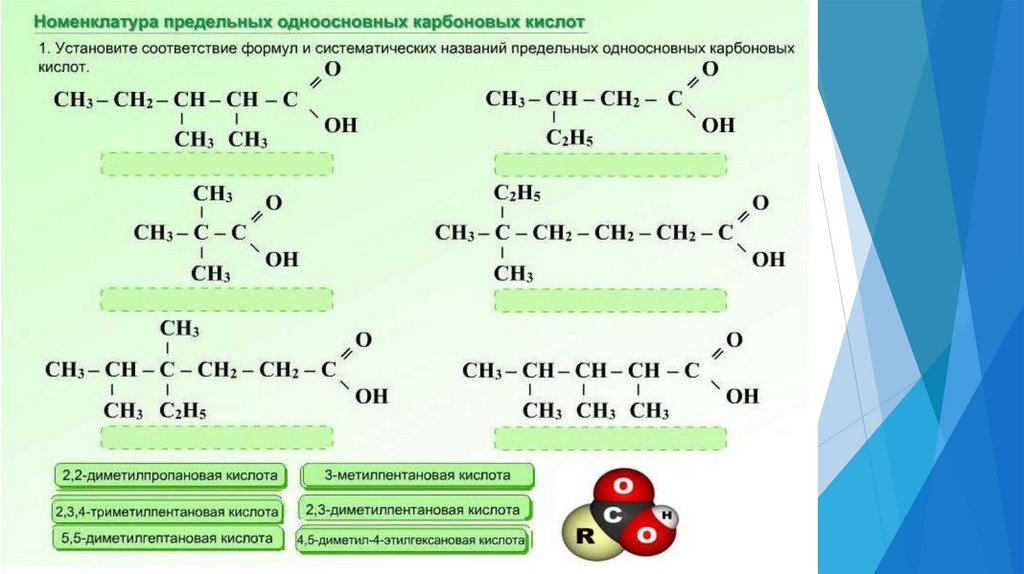
Рациональная номенклатура6.
7.
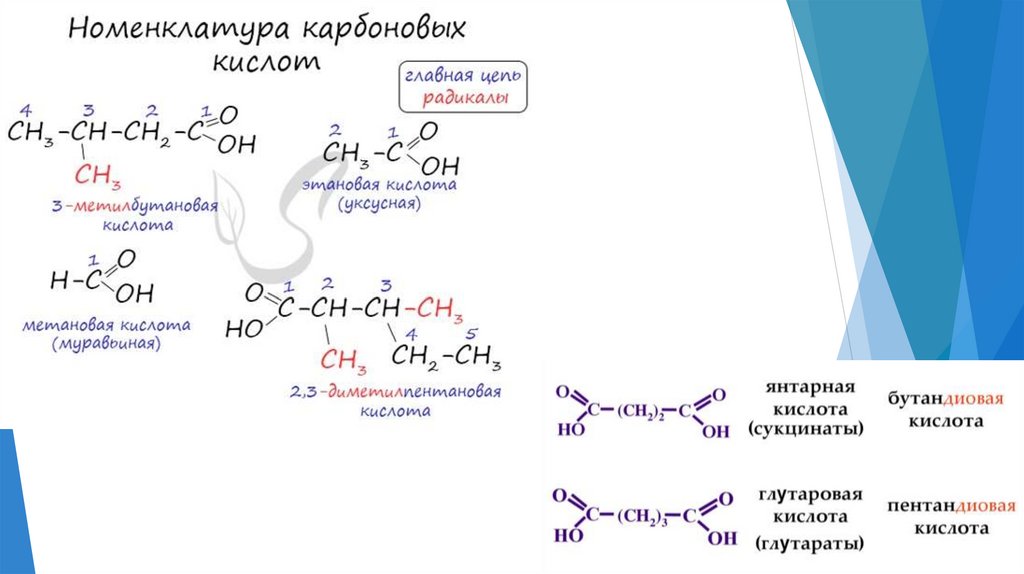
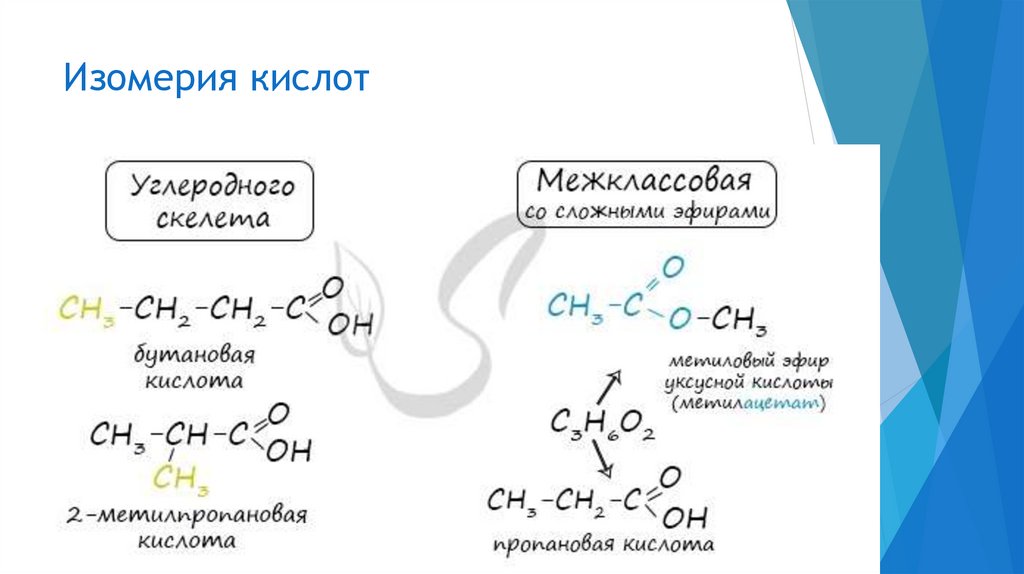
Изомерия кислот8.
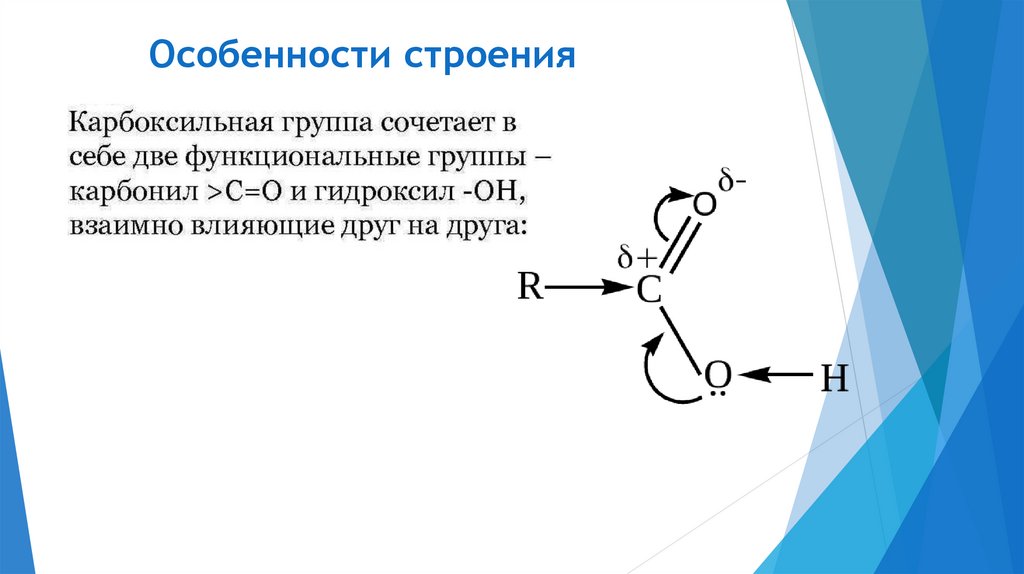
Особенности строения9.
10.
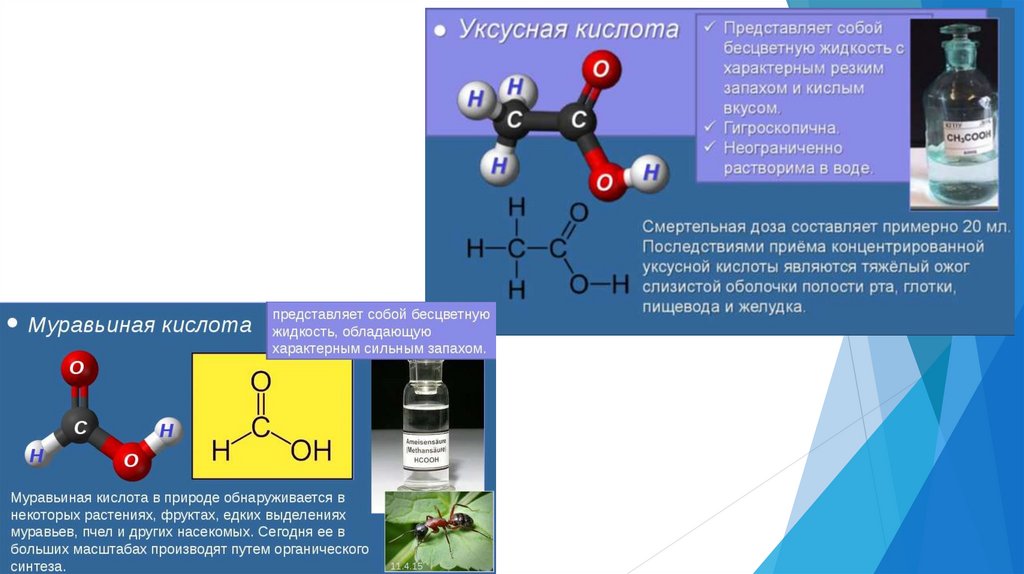
Физические свойстваМежду молекулами кислоты, благодаря группам ОН,
образуются многочисленные водородные связи,
поэтому:
аномально высокие температуры кипения ,
например, у муравьиной кислоты- 100
хорошая растворимость в воде, например, низшие
кислоты- растворяются не ограничено.
11.
12.
Химические свойства: реакции окисленияВ атмосфере кислорода, или под действием другого
окислителя, карбоновые кислоты окисляются до
углекислого газа и воды.
CH3COOH + О2 → СО2+ H2O
Легче всего окисляется муравьиная кислота. Это
связано с особенностями ее строения.
13.
Химические свойства: реакцияэлектрофильного замещения
Для растворов карбоновых кислот будут возможны все
реакции характерные для кислот
CH3COOH + NaOH CH3COONa + H2O
CH3COOH + Mg (CH3COO)2Mg + H2
CH3COOH + NaНСO3 CH3COONa + СО2 + H2O
CH3COOH + Fe3O3 → (CH3COO)3Fe + H2O
14.
Химические свойства: реакциянуклеофильного замещения
Наиболее важные из реакций нуклеофильного замещения –
реакции этерификации. Так называют реакции
образования сложных эфиров из кислот и спиртов.
CH3- CO-OH + C2H5O-H
Н
CH3-CO-OC2H5 + H2O
15.
Обратите внимание!Реакции присоединения по двойной связи, которые
характерны для карбонильной группы, для кислот не
характерны. Здесь проявляется влияние гидроксогруппы на
величину положительного заряда карбонильного атома
углерода. Неподеленные электронные пары кислорода из
гидроксогруппы смещаются к карбонильному углероду и
уменьшают заряд на нем. Поэтому атака нуклеофила на
карбонильный углерод становится проблематичной.
16.
Химические свойства, обусловленныеналичием радикала.
Например, предельные карбоновые кислоты могут
вступать в реакцию свободно-радикального замещения:
CH3COOH + Cl2 → CCl3COOH + HCl
Если радикал непредельный, то для него возможны
реакции присоединения по двойной связи. Например,
реакция гидрирования, обесцвечивание бромной воды.
СН2=СН-СООН + Н2 → СН3- СН2 -СООН
17.
18.
Получение кислот1) окисление альдегидов;
2) окисление спиртов (без выделения альдегидов
как промежуточного продукта);
3)
окисление
алканов
(каталитическое,
выделения промежуточных соединений);
4) гидролиз жиров.
без










 Химия
Химия








