Похожие презентации:
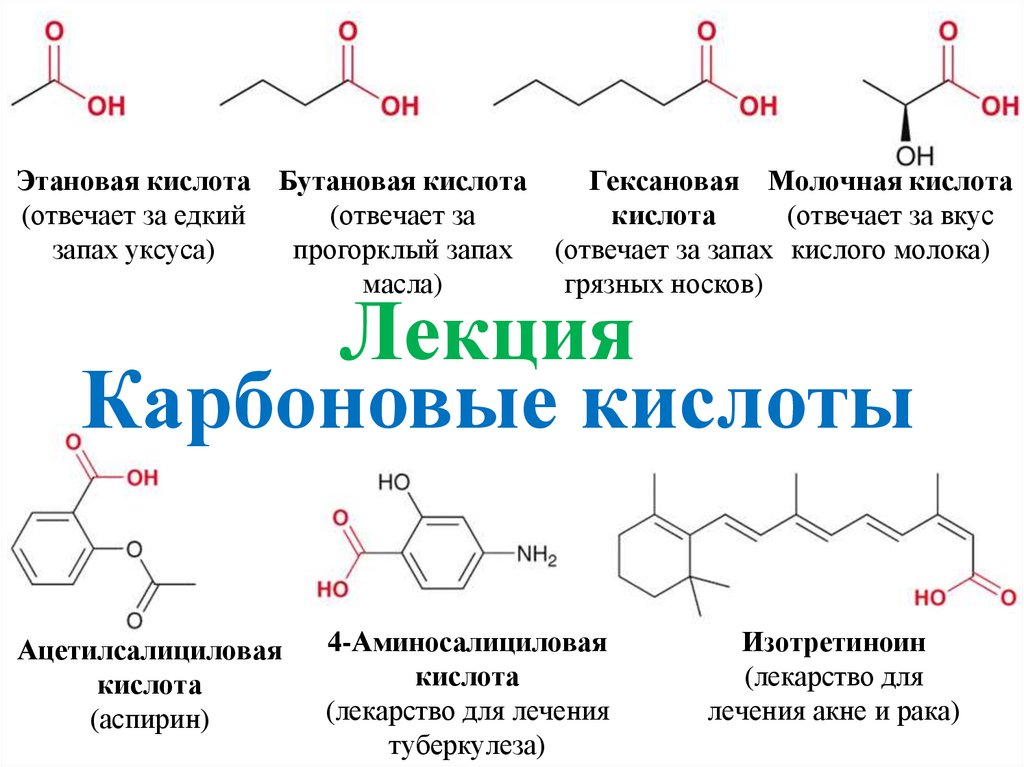
Этановая кислота Бутановая кислота
1.
Этановая кислота Бутановая кислотаГексановая Молочная кислота
(отвечает за едкий
(отвечает за
кислота
(отвечает за вкус
запах уксуса)
прогорклый запах (отвечает за запах кислого молока)
масла)
грязных носков)
Лекция
Карбоновые кислоты
Ацетилсалициловая
кислота
(аспирин)
4-Аминосалициловая
кислота
(лекарство для лечения
туберкулеза)
Изотретиноин
(лекарство для
лечения акне и рака)
2.
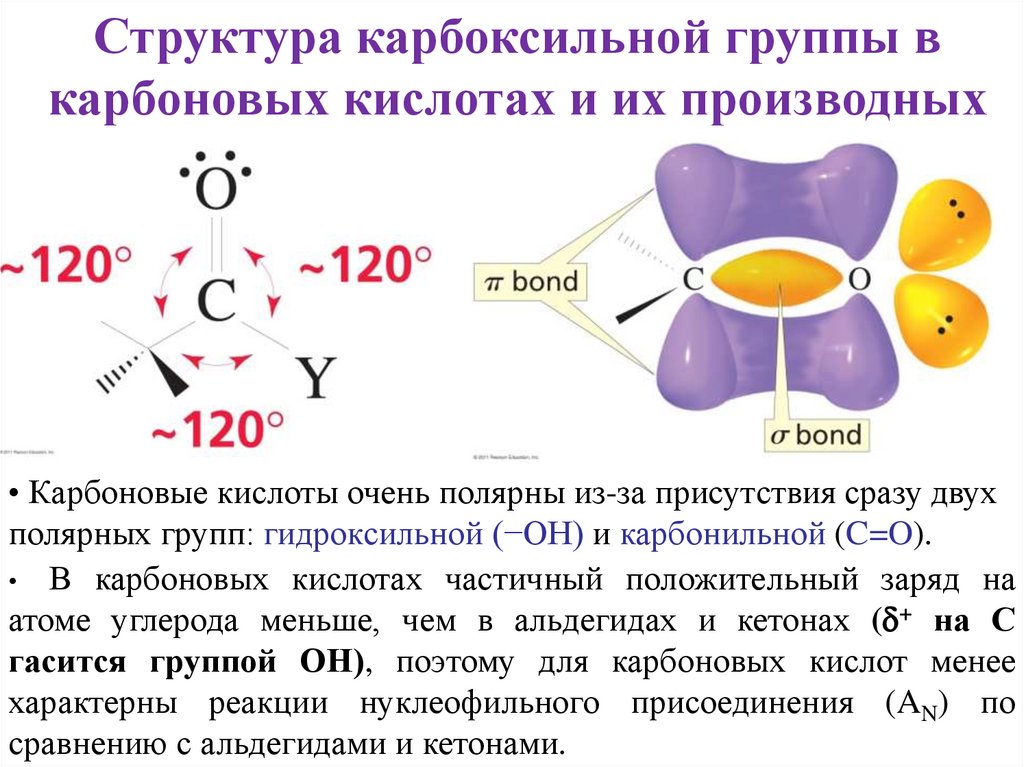
Структура карбоксильной группы вкарбоновых кислотах и их производных
• Карбоновые кислоты очень полярны из-за присутствия сразу двух
полярных групп: гидроксильной (−OH) и карбонильной (C=O).
• В карбоновых кислотах частичный положительный заряд на
атоме углерода меньше, чем в альдегидах и кетонах ( + на С
гасится группой ОН), поэтому для карбоновых кислот менее
характерны реакции нуклеофильного присоединения (AN) по
сравнению с альдегидами и кетонами.
3.
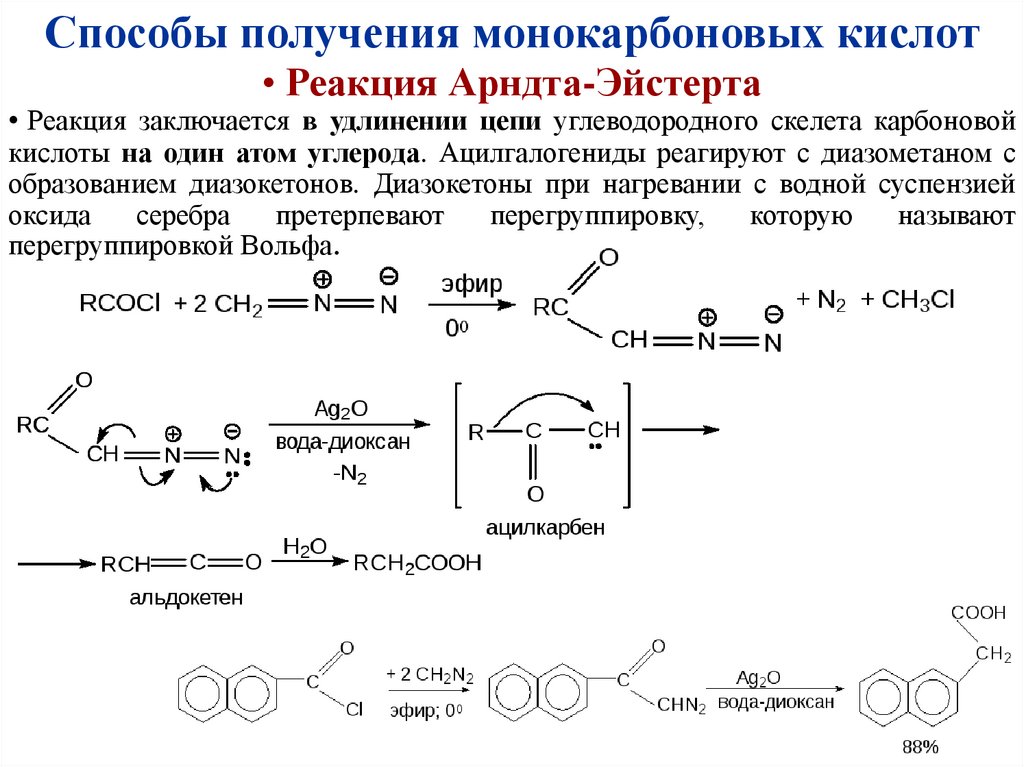
Способы получения монокарбоновых кислот• Реакция Арндта-Эйстерта
• Реакция заключается в удлинении цепи углеводородного скелета карбоновой
кислоты на один атом углерода. Ацилгалогениды реагируют с диазометаном с
образованием диазокетонов. Диазокетоны при нагревании с водной суспензией
оксида
серебра
претерпевают
перегруппировку,
которую
называют
перегруппировкой Вольфа.
4.
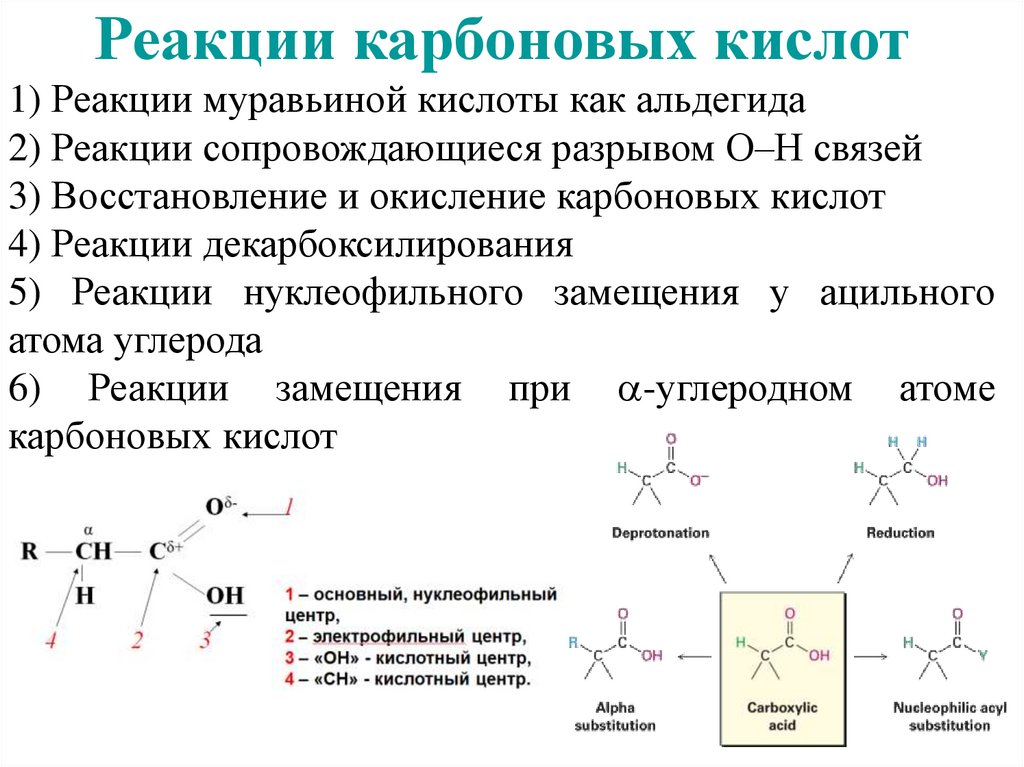
Реакции карбоновых кислот1) Реакции муравьиной кислоты как альдегида
2) Реакции сопровождающиеся разрывом О–Н связей
3) Восстановление и окисление карбоновых кислот
4) Реакции декарбоксилирования
5) Реакции нуклеофильного замещения у ацильного
атома углерода
6) Реакции замещения при -углеродном атоме
карбоновых кислот
5.
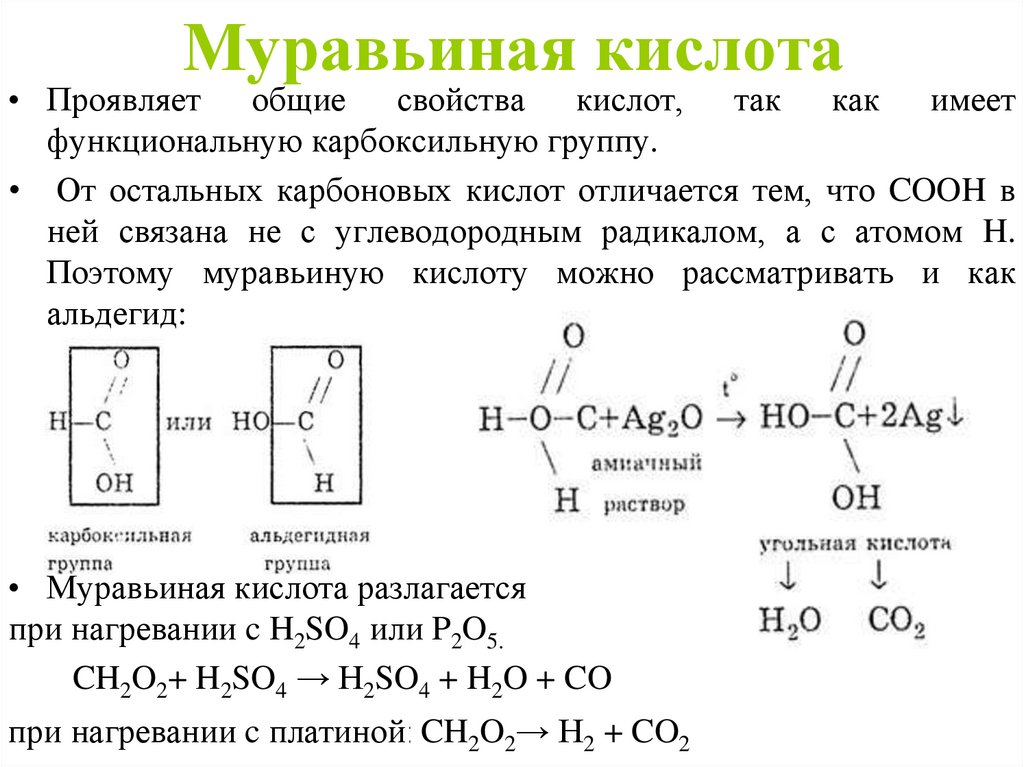
Муравьиная кислота• Проявляет общие свойства кислот, так как имеет
функциональную карбоксильную группу.
• От остальных карбоновых кислот отличается тем, что COOH в
ней связана не с углеводородным радикалом, а с атомом H.
Поэтому муравьиную кислоту можно рассматривать и как
альдегид:
• Муравьиная кислота разлагается
при нагревании c H2SO4 или P2O5.
CH2O2+ H2SO4 → H2SO4 + H2O + CO
при нагревании c платиной: CH2O2→ H2 + CO2
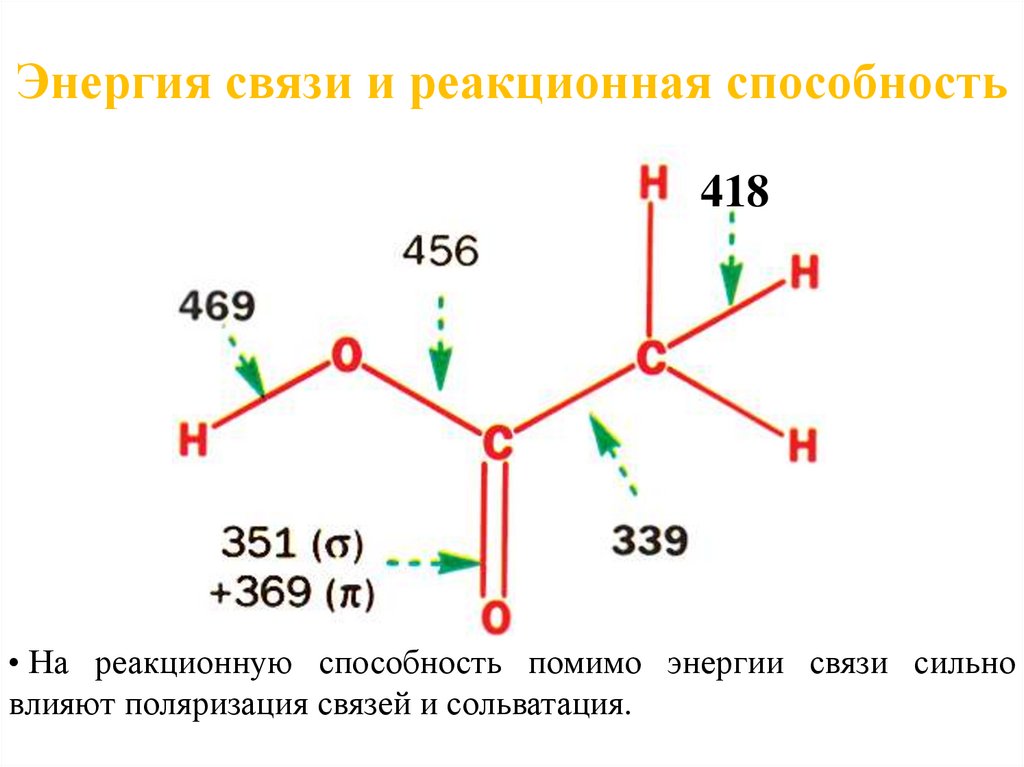
6. Муравьиная кислота
Энергия связи и реакционная способность418
• На реакционную способность помимо энергии связи сильно
влияют поляризация связей и сольватация.
7.
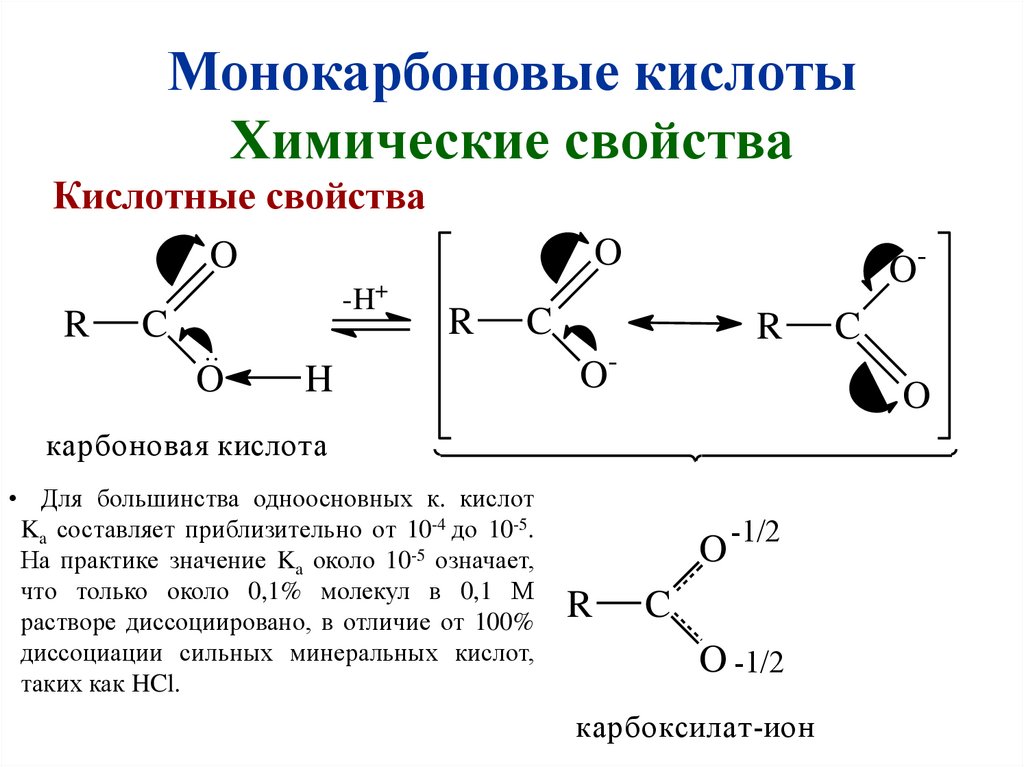
Монокарбоновые кислотыХимические свойства
Кислотные свойства
O
R
C
-H+
..
O
O
R
O-
C
H
R
O-
O
карбоновая кислота
• Для большинства одноосновных к. кислот
Ka составляет приблизительно от 10-4 до 10-5.
На практике значение Ka около 10-5 означает,
что только около 0,1% молекул в 0,1 М
растворе диссоциировано, в отличие от 100%
диссоциации сильных минеральных кислот,
таких как HCl.
O
R
C
-1/2
C
O -1/2
карбоксилат-ион
8.
Монокарбоновые кислотыХимические свойства
Кислотные свойства. Индуктивный эффект pKa
уксусная кислота
4,76
Cl
CH2COOH монохлоруксусная кислота 2,85
Cl
CHCOOH дихлоруксусная кислота
1,25
Cl
Cl
Cl
CCOOH
Cl
трихлоруксусная кислота
0,66
Увеличение кислотности
CH3COOH
9.
Монокарбоновые кислотыХимические свойства
Кислотные свойства. Индуктивный эффект
pKa
-хлормасляная кислота 2,84
Cl
CH3CHCH2COOH
-хлормасляная кислота 4,06
Cl
CH2CH2CH2COOH
-хлормасляная кислота 4,52
Cl
CH3CH2CH2COOH
масляная кислота
4,82
Уменьшение кислотности
CH3CH2CHCOOH
10.
II. Образование солей:а) С активными металлами:
2 CH3COOH + Mg → (CH3COO)2Mg + H2
б) С основными оксидами:
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
в) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
г) С солями более слабых кислот:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эта реакция с содой используется как качественная
на карбоксильную группу (по выделению пузырьков
CO2).
11.
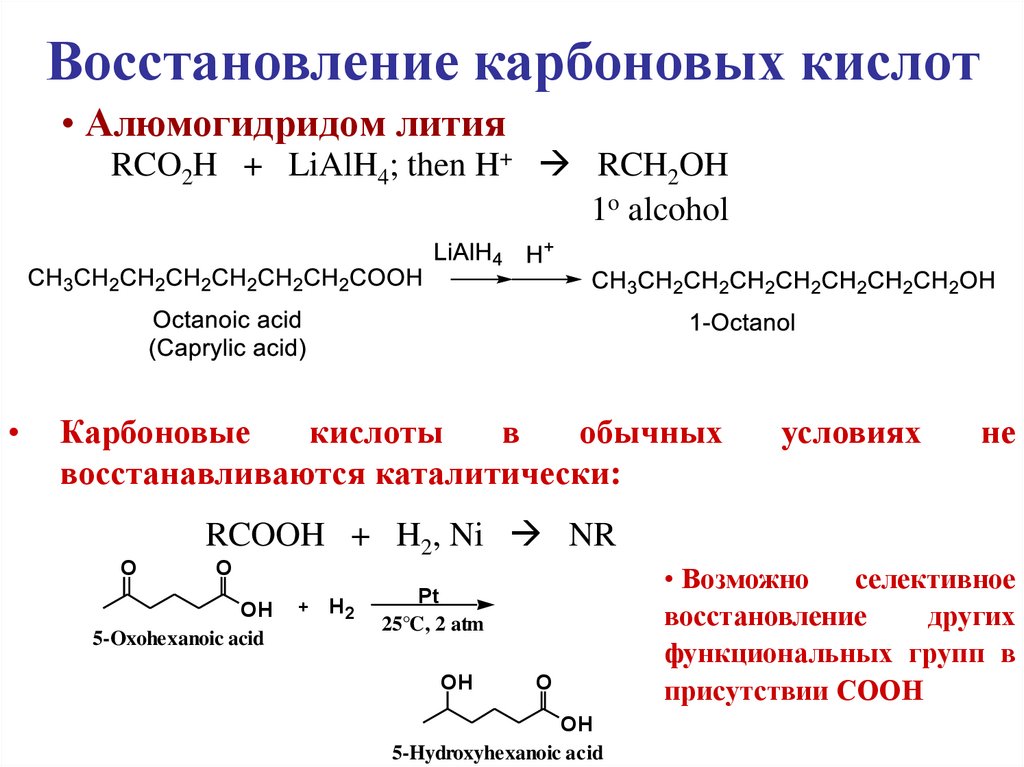
Восстановление карбоновых кислот• Алюмогидридом лития
RCO2H + LiAlH4; then H+ RCH2OH
1o alcohol
Карбоновые
кислоты
в
обычных
восстанавливаются каталитически:
условиях
не
RCOOH + H2, Ni NR
O
O
OH
5-Oxohexanoic acid
+
H2
Pt
25°C, 2 atm
OH
O
OH
5-Hydroxyhexanoic acid
• Возможно
селективное
восстановление
других
функциональных групп в
присутствии СООН
12.
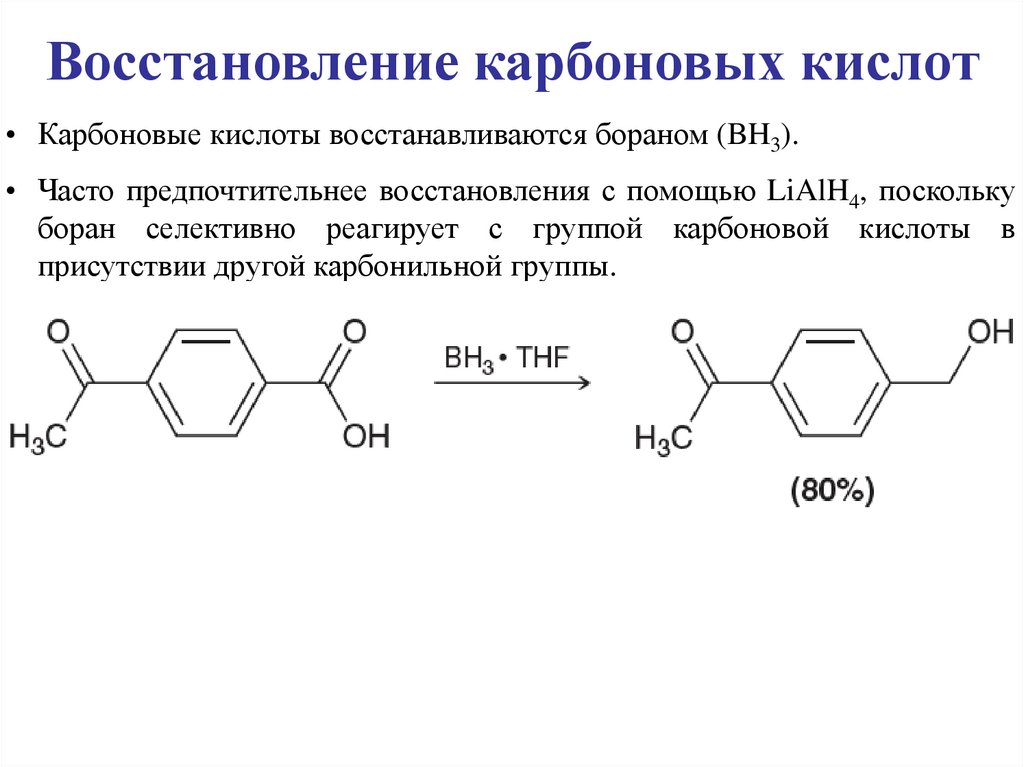
Восстановление карбоновых кислот• Карбоновые кислоты восстанавливаются бораном (BH3).
• Часто предпочтительнее восстановления с помощью LiAlH4, поскольку
боран селективно реагирует с группой карбоновой кислоты в
присутствии другой карбонильной группы.
13.
Декарбоксилирование• Реакция, в которой происходит отщепление CO2 и
образующиеся соединения содержат на один атом
углерода меньше, чем исходная кислота.
• Обычно декарбоксилируют соли кислот.
• Пример: Реакция Бородина - реакция серебряной соли
карбоновой кислоты при нагревании с раствором брома
в CCl4.
RCOOAg + Br2
CCl4
80 O
RBr + CO2 + AgBr
CCl4
CH3(CH2)10COOAg + Br2
CH3(CH2)10Br + AgBr 67%
O
80
CCl4
CH3OOC(CH2)4COOAg + Br2
CH3OOC(CH2)3CH2Br 68%
O
80
14.
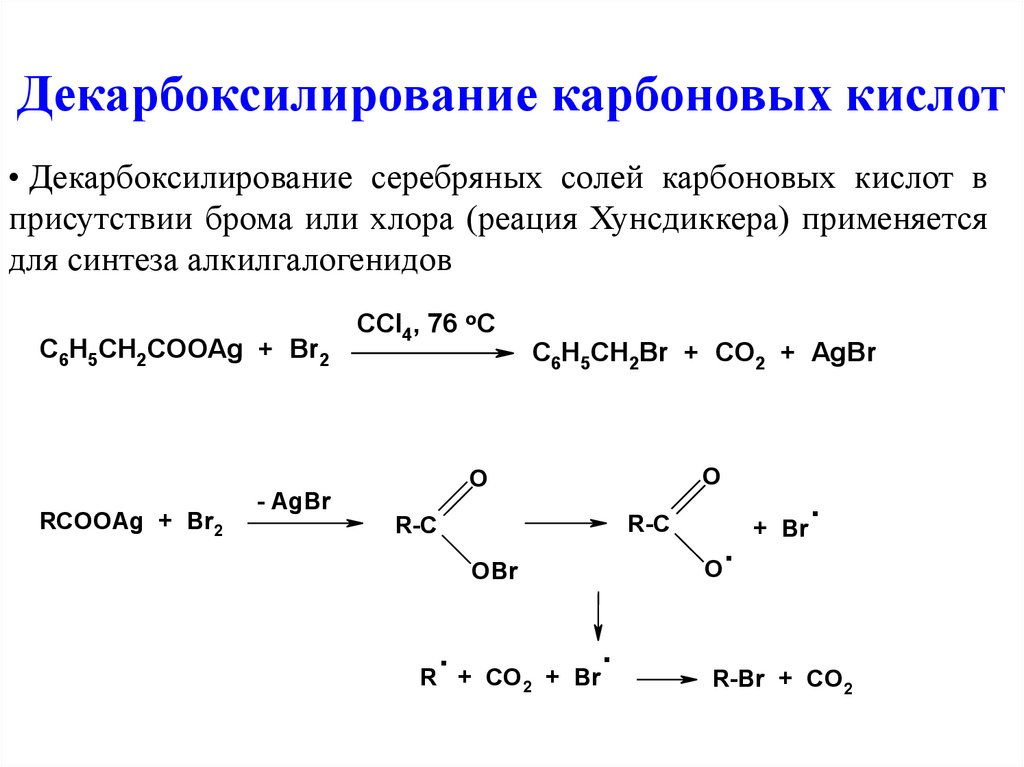
Декарбоксилирование карбоновых кислот• Декарбоксилирование серебряных солей карбоновых кислот в
присутствии брома или хлора (реация Хунсдиккера) применяется
для синтеза алкилгалогенидов
C6H5CH2COOAg + Br2
CCl4, 76 oC
C6H5CH2Br + CO2 + AgBr
O
O
RCOOAg + Br2
- AgBr
R-C
R-C
O
OBr
.
R + CO2 + Br
.
.
+ Br
.
R-Br + CO2
15. Декарбоксилирование
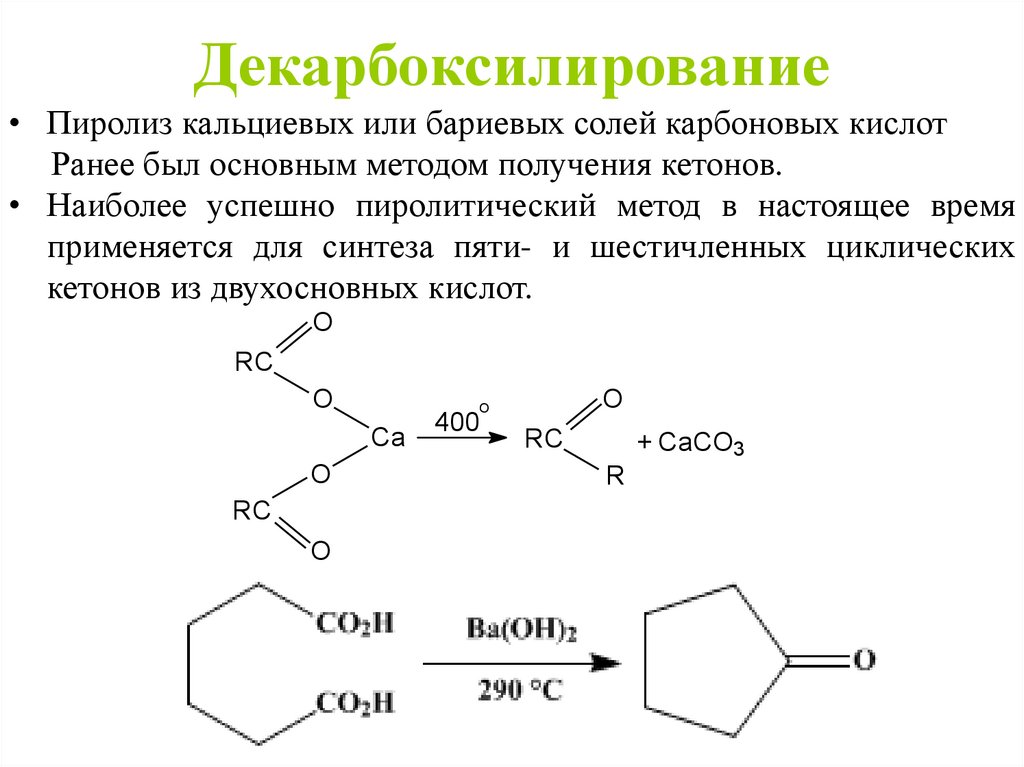
• Пиролиз кальциевых или бариевых солей карбоновых кислотРанее был основным методом получения кетонов.
• Наиболее успешно пиролитический метод в настоящее время
применяется для синтеза пяти- и шестичленных циклических
кетонов из двухосновных кислот.
O
RC
O
Ca
O
RC
O
O
O
400
RC
+ CaCO3
R
16.
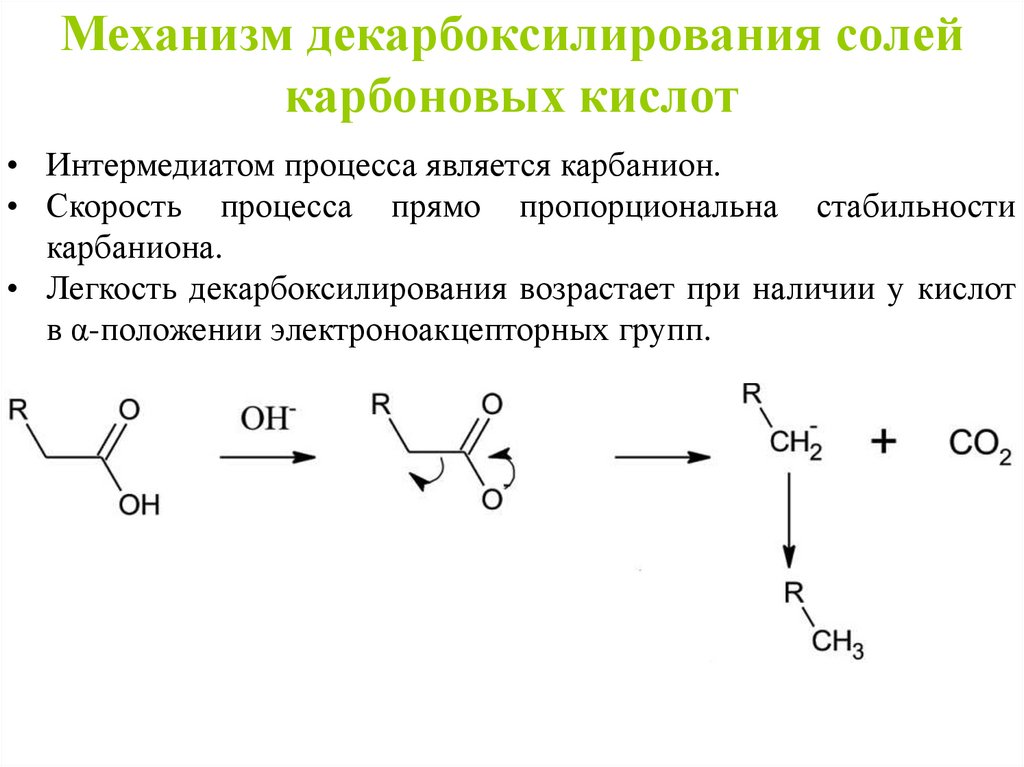
Механизм декарбоксилирования солейкарбоновых кислот
• Интермедиатом процесса является карбанион.
• Скорость процесса прямо пропорциональна стабильности
карбаниона.
• Легкость декарбоксилирования возрастает при наличии у кислот
в α-положении электроноакцепторных групп.
17.
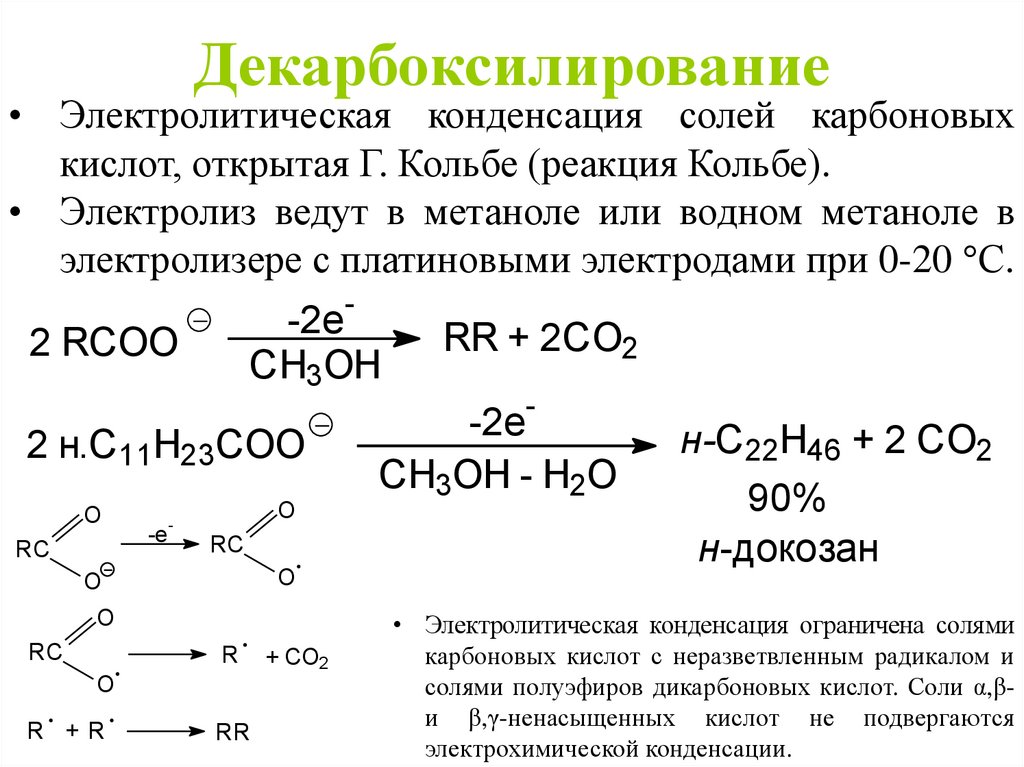
Декарбоксилирование• Электролитическая конденсация солей карбоновых
кислот, открытая Г. Кольбе (реакция Кольбе).
• Электролиз ведут в метаноле или водном метаноле в
электролизере с платиновыми электродами при 0-20 С.
-
-2e
CH3OH
2 RCOO
RR + 2CO2
-
2 н.C11H23COO
O
RC
-e
O
-
RC
O
O
O
RC
R
O
R +R
RR
+ CO2
-2e
CH3OH - H2O
н-C22H46 + 2 CO2
90%
н-докозан
• Электролитическая конденсация ограничена солями
карбоновых кислот с неразветвленным радикалом и
солями полуэфиров дикарбоновых кислот. Соли α,βи β,γ-ненасыщенных кислот не подвергаются
электрохимической конденсации.
18.
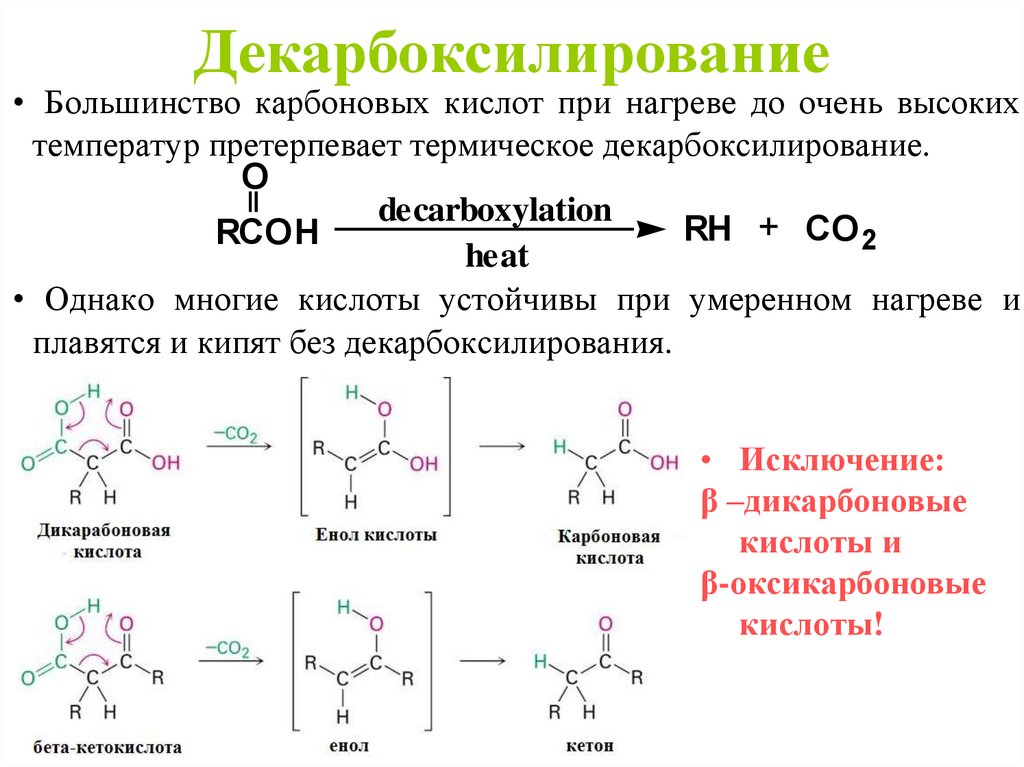
Декарбоксилирование• Большинство карбоновых кислот при нагреве до очень высоких
температур претерпевает термическое декарбоксилирование.
O
decarboxylation
RH + CO 2
RCOH
heat
• Однако многие кислоты устойчивы при умеренном нагреве и
плавятся и кипят без декарбоксилирования.
• Исключение:
β –дикарбоновые
кислоты и
β-оксикарбоновые
кислоты!
19.
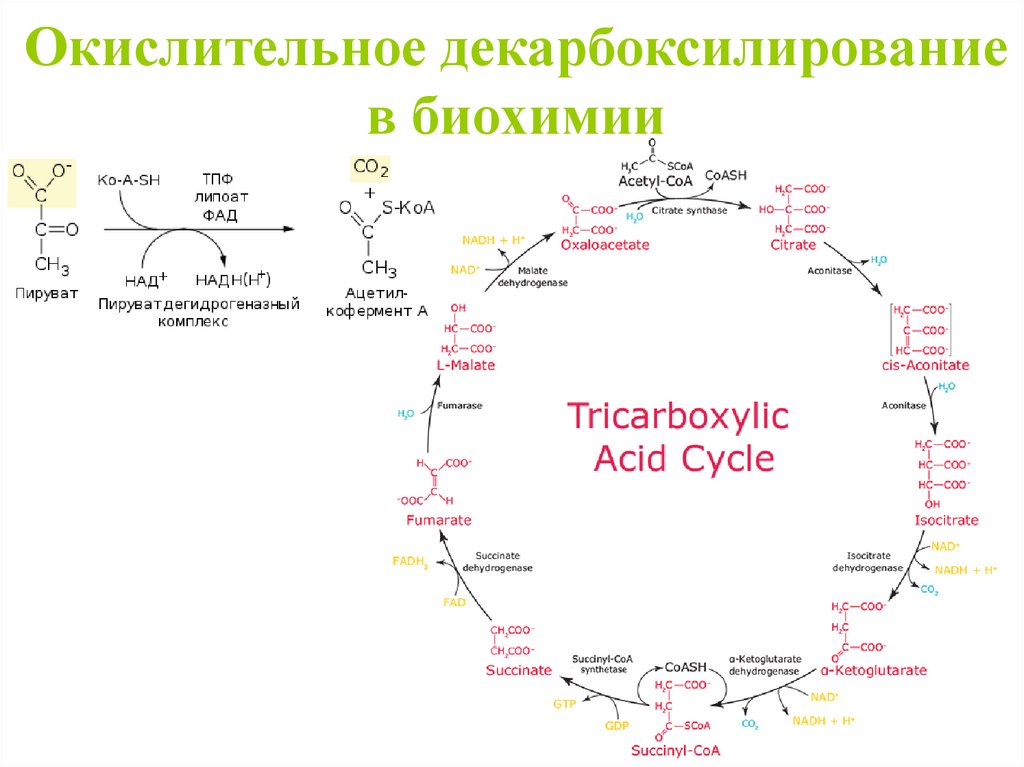
Окислительное декарбоксилированиев биохимии
20.
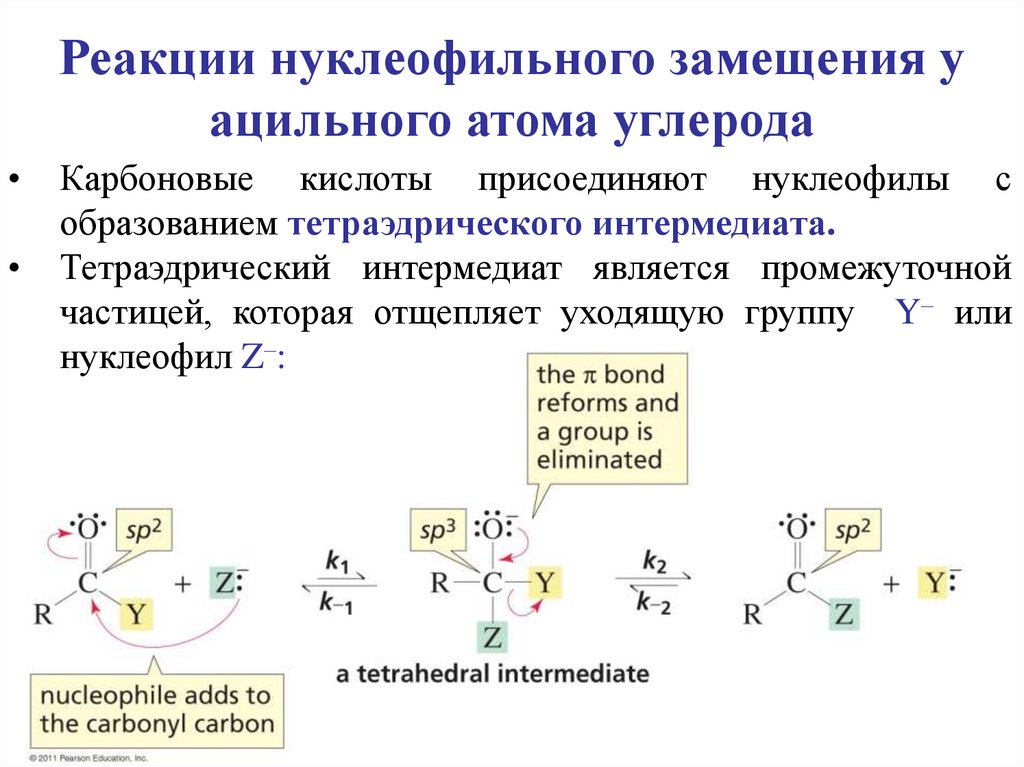
Реакции нуклеофильного замещения уацильного атома углерода
Карбоновые кислоты присоединяют нуклеофилы с
образованием тетраэдрического интермедиата.
Тетраэдрический интермедиат является промежуточной
частицей, которая отщепляет уходящую группу Y– или
нуклеофил Z–:
21.
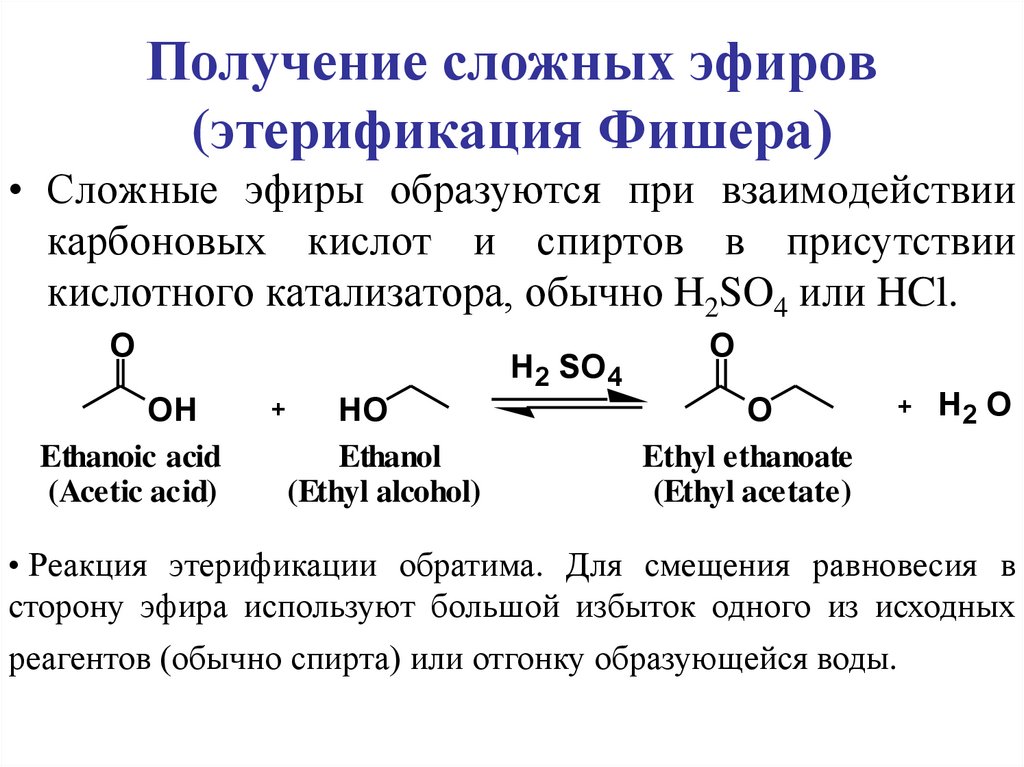
Получение сложных эфиров(этерификация Фишера)
• Сложные эфиры образуются при взаимодействии
карбоновых кислот и спиртов в присутствии
кислотного катализатора, обычно H2SO4 или HCl.
O
OH
Ethanoic acid
(Acetic acid)
H2 SO 4
+
HO
Ethanol
(Ethyl alcohol)
O
O
Ethyl ethanoate
(Ethyl acetate)
+ H2 O
• Реакция этерификации обратима. Для смещения равновесия в
сторону эфира используют большой избыток одного из исходных
реагентов (обычно спирта) или отгонку образующейся воды.
22.
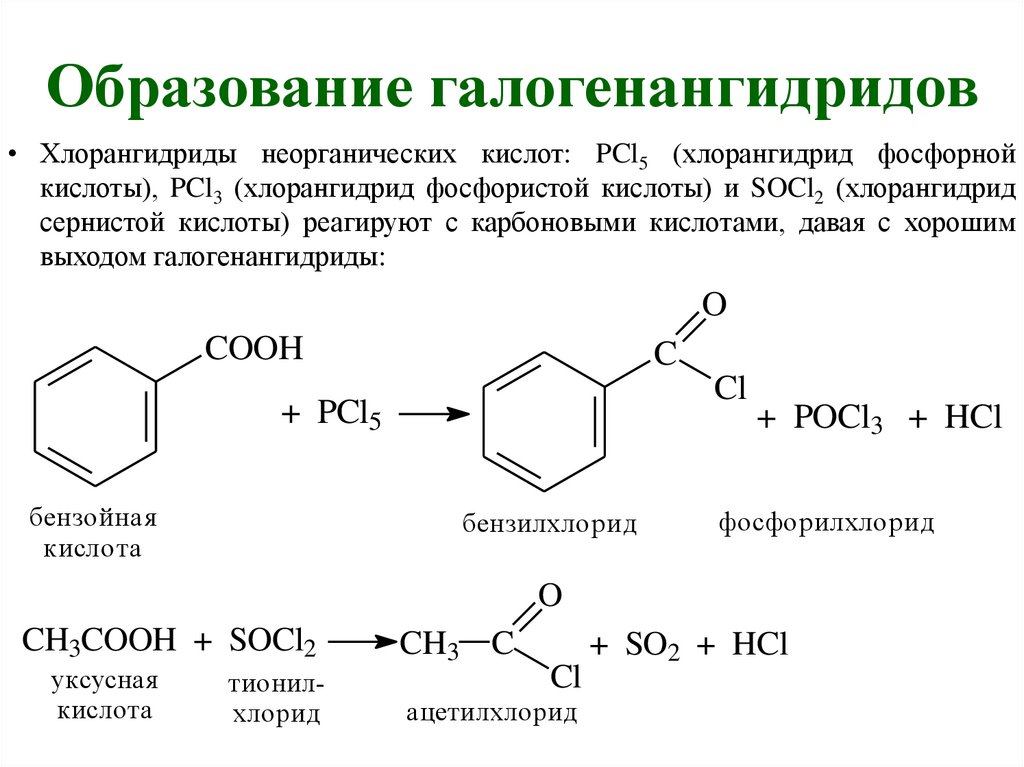
Образование галогенангидридов• Хлорангидриды неорганических кислот: PCl5 (хлорангидрид фосфорной
кислоты), PCl3 (хлорангидрид фосфористой кислоты) и SOCl2 (хлорангидрид
сернистой кислоты) реагируют с карбоновыми кислотами, давая с хорошим
выходом галогенангидриды:
O
COOH
C
Cl
+ PCl5
бензойная
кислота
бензилхлорид
+ POCl3 + HCl
фосфорилхлорид
O
CH3COOH + SOCl2
уксусная
кислота
тионилхлорид
CH3 C
Cl
ацетилхлорид
+ SO2 + HCl
23. Получение сложных эфиров (этерификация Фишера)
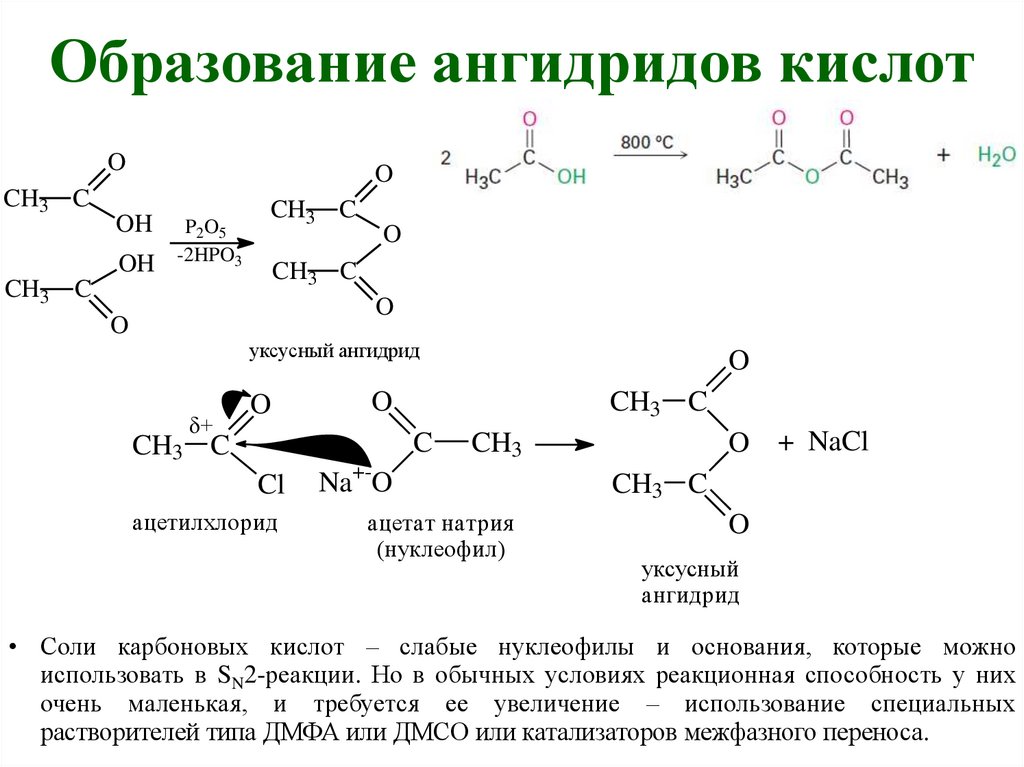
Образование ангидридов кислотO
CH3 C
O
OH
OH
P2O5
-2HPO3
CH3 C
O
CH3 C
CH3 C
O
O
уксусный ангидрид
+
O
O
CH3 C
ацетилхлорид
CH3 C
C
+
Cl
O
O + NaCl
CH3
Na+-O
ацетат натрия
(нуклеофил)
CH3 C
O
уксусный
ангидрид
• Соли карбоновых кислот – слабые нуклеофилы и основания, которые можно
использовать в SN2-реакции. Но в обычных условиях реакционная способность у них
очень маленькая, и требуется ее увеличение – использование специальных
растворителей типа ДМФА или ДМСО или катализаторов межфазного переноса.
24.
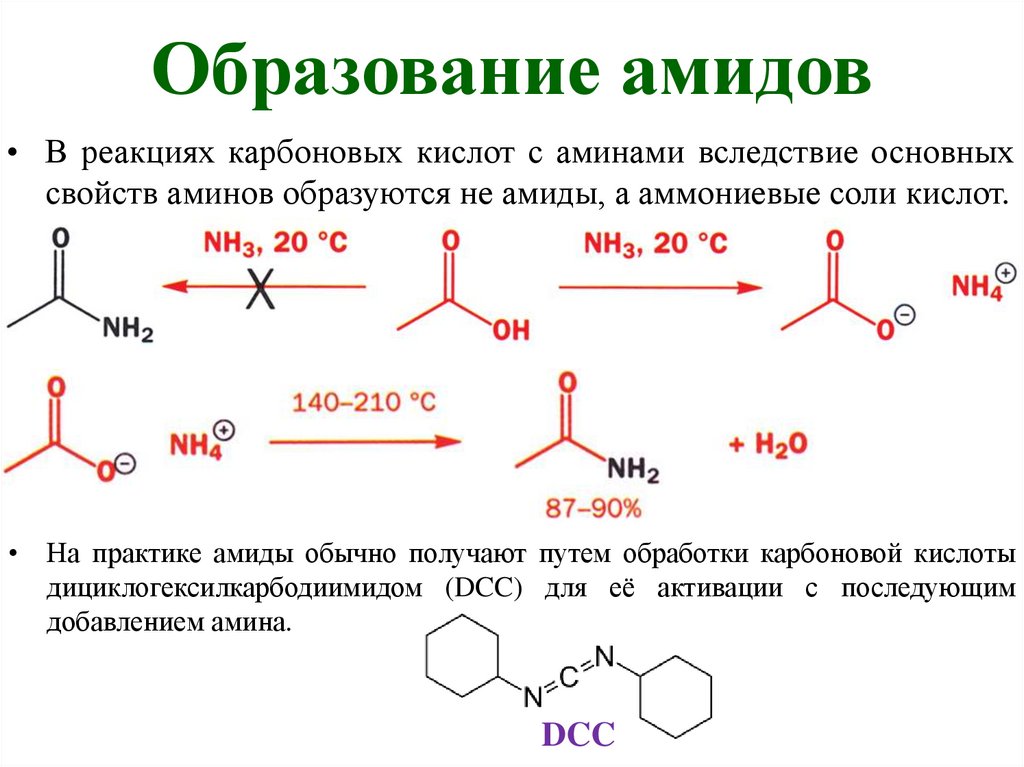
Образование амидов• В реакциях карбоновых кислот с аминами вследствие основных
свойств аминов образуются не амиды, а аммониевые соли кислот.
• На практике амиды обычно получают путем обработки карбоновой кислоты
дициклогексилкарбодиимидом (DCC) для её активации с последующим
добавлением амина.
DCC
25.
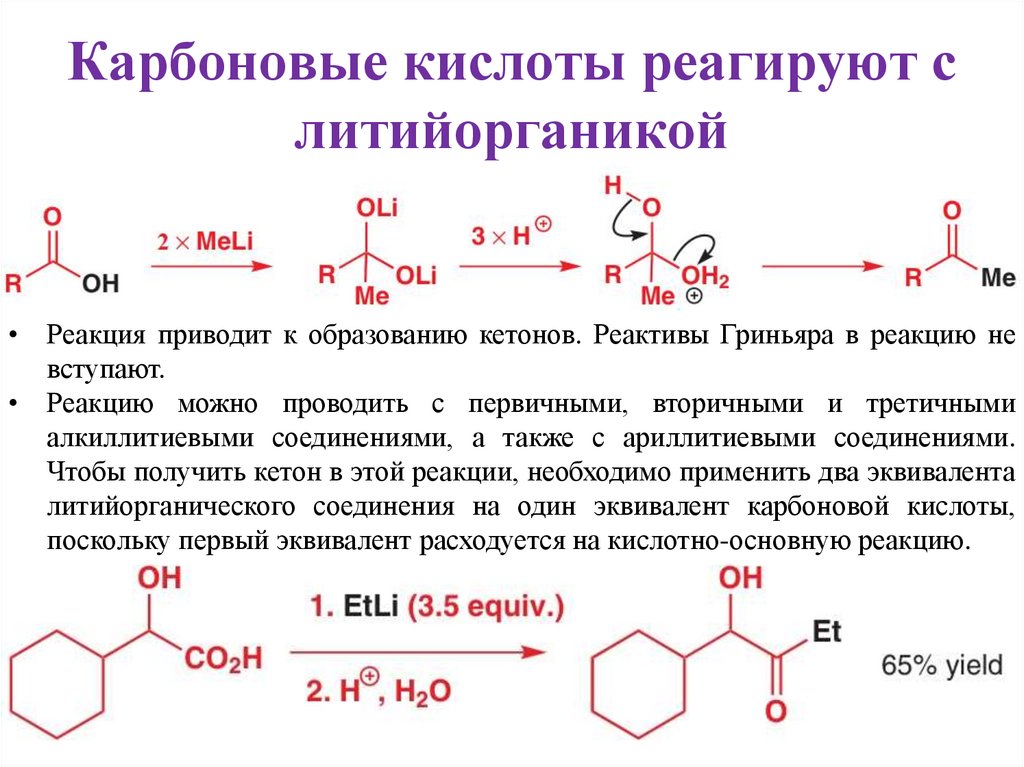
Карбоновые кислоты реагируют слитийорганикой
• Реакция приводит к образованию кетонов. Реактивы Гриньяра в реакцию не
вступают.
• Реакцию можно проводить с первичными, вторичными и третичными
алкиллитиевыми соединениями, а также с ариллитиевыми соединениями.
Чтобы получить кетон в этой реакции, необходимо применить два эквивалента
литийорганического соединения на один эквивалент карбоновой кислоты,
поскольку первый эквивалент расходуется на кислотно-основную реакцию.
26.
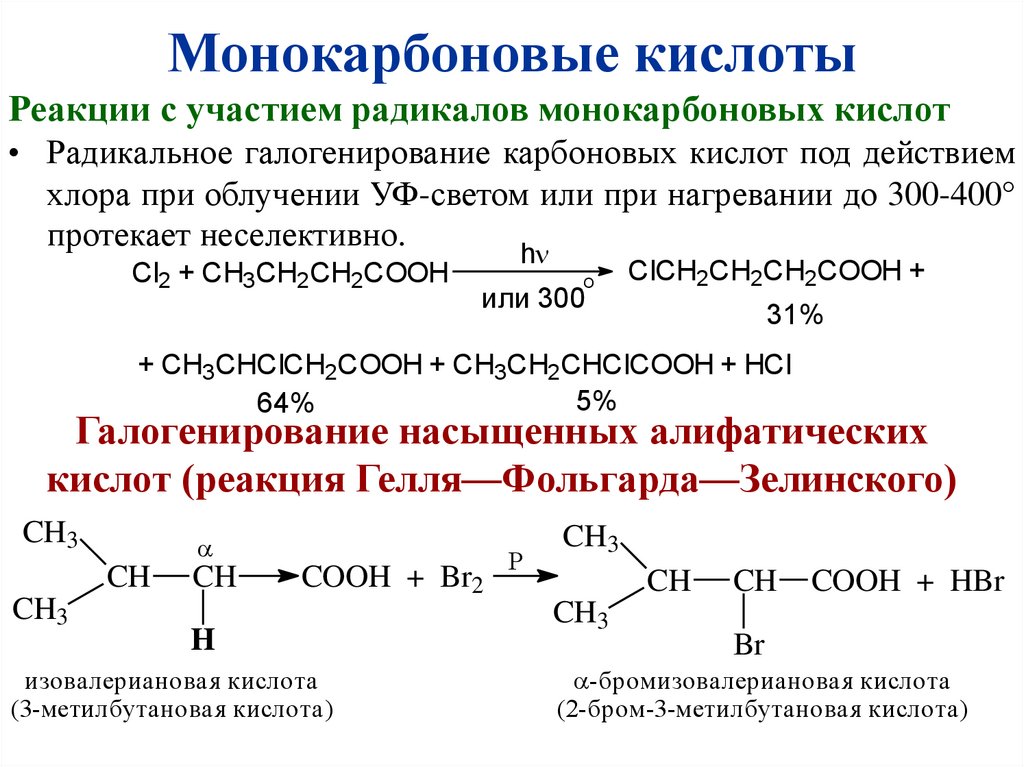
Монокарбоновые кислотыРеакции с участием радикалов монокарбоновых кислот
• Радикальное галогенирование карбоновых кислот под действием
хлора при облучении УФ-светом или при нагревании до 300-400
протекает неселективно.
Cl2 + CH3CH2CH2COOH
h
O
или 300
ClCH2CH2CH2COOH +
31%
+ CH3CHClCH2COOH + CH3CH2CHClCOOH + HCl
5%
64%
Галогенирование насыщенных алифатических
кислот (реакция Гелля—Фольгарда—Зелинского)
CH3
CH
CH3
CH
COOH + Br2
H
изовалериановая кислота
(3-метилбутановая кислота)
P
CH3
CH
CH3
CH
COOH + HBr
Br
-бромизовалериановая кислота
(2-бром-3-метилбутановая кислота)
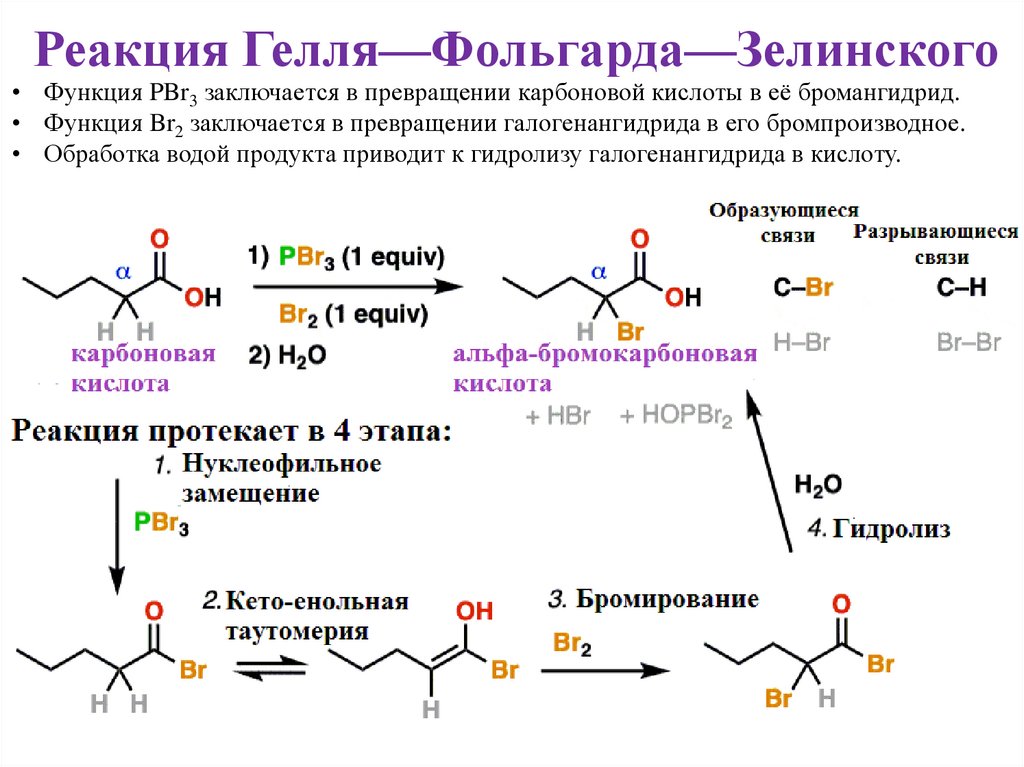
27.
Реакция Гелля—Фольгарда—Зелинского• Функция PBr3 заключается в превращении карбоновой кислоты в её бромангидрид.
• Функция Br2 заключается в превращении галогенангидрида в его бромпроизводное.
• Обработка водой продукта приводит к гидролизу галогенангидрида в кислоту.
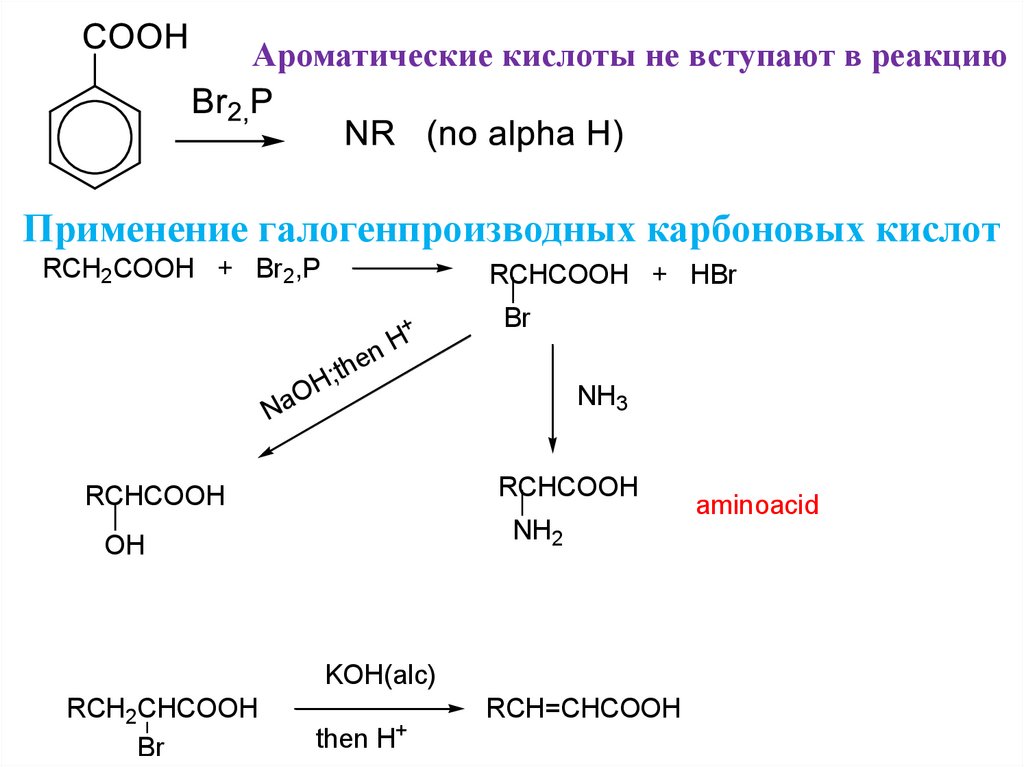
28. Карбоновые кислоты реагируют с литийорганикой
Ароматические кислоты не вступают в реакциюПрименение галогенпроизводных карбоновых кислот
RCH2COOH + Br2,P
RCHCOOH + HBr
+
H
n
he
t
;
OH
a
N
Br
NH3
RCHCOOH
RCHCOOH
NH2
OH
KOH(alc)
RCH2CHCOOH
Br
then
H+
RCH=CHCOOH
aminoacid
29.
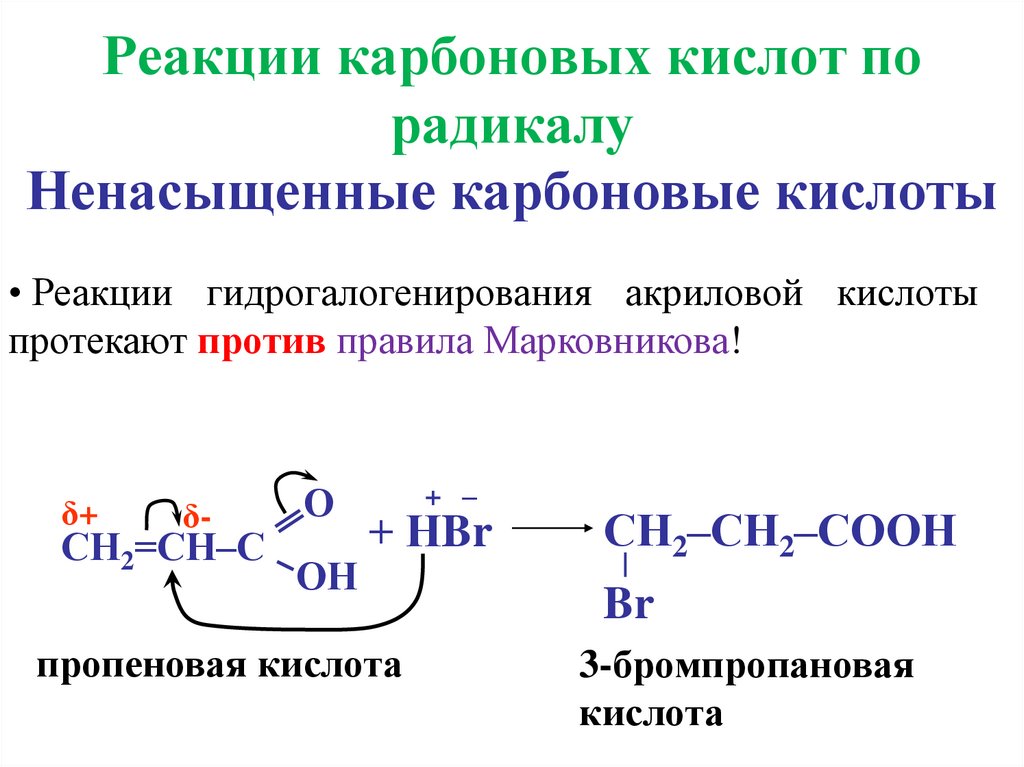
Реакции карбоновых кислот порадикалу
Ненасыщенные карбоновые кислоты
• Реакции гидрогалогенирования акриловой кислоты
протекают против правила Марковникова!
δ+
δ-
СН2=СН–С
О
ОН
+ –
+ НBr
пропеновая кислота
СН2–СН2–СООН
Br
3-бромпропановая
кислота
30.
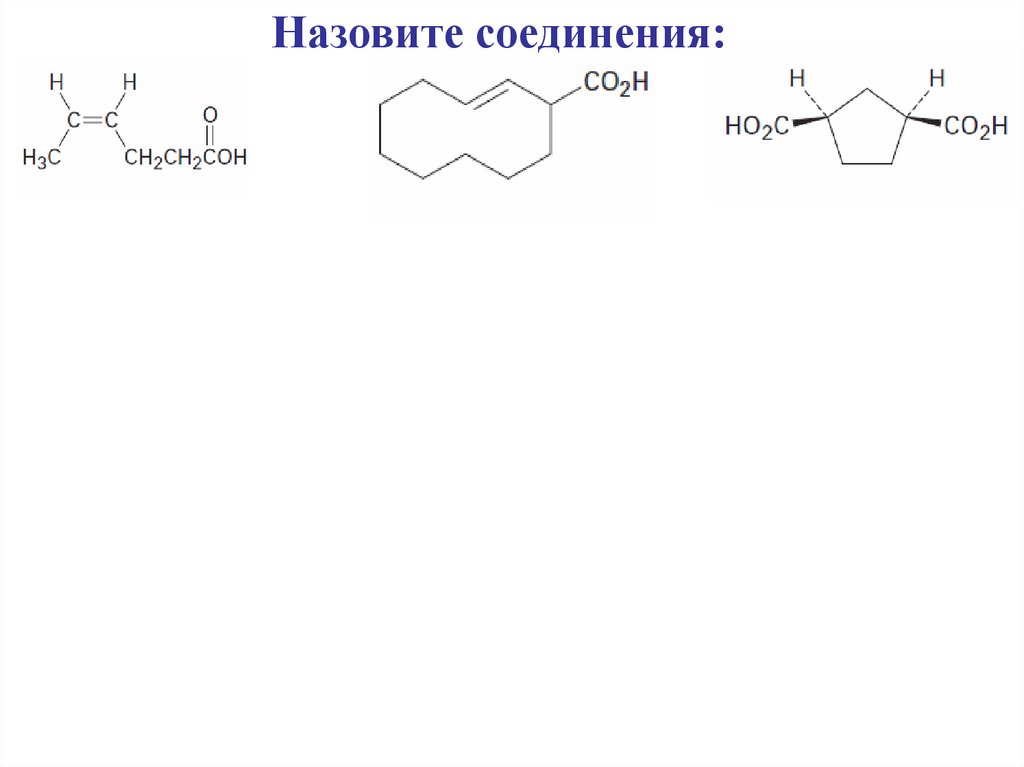
Назовите соединения:31.
Получите соединения:32. Реакции карбоновых кислот по радикалу
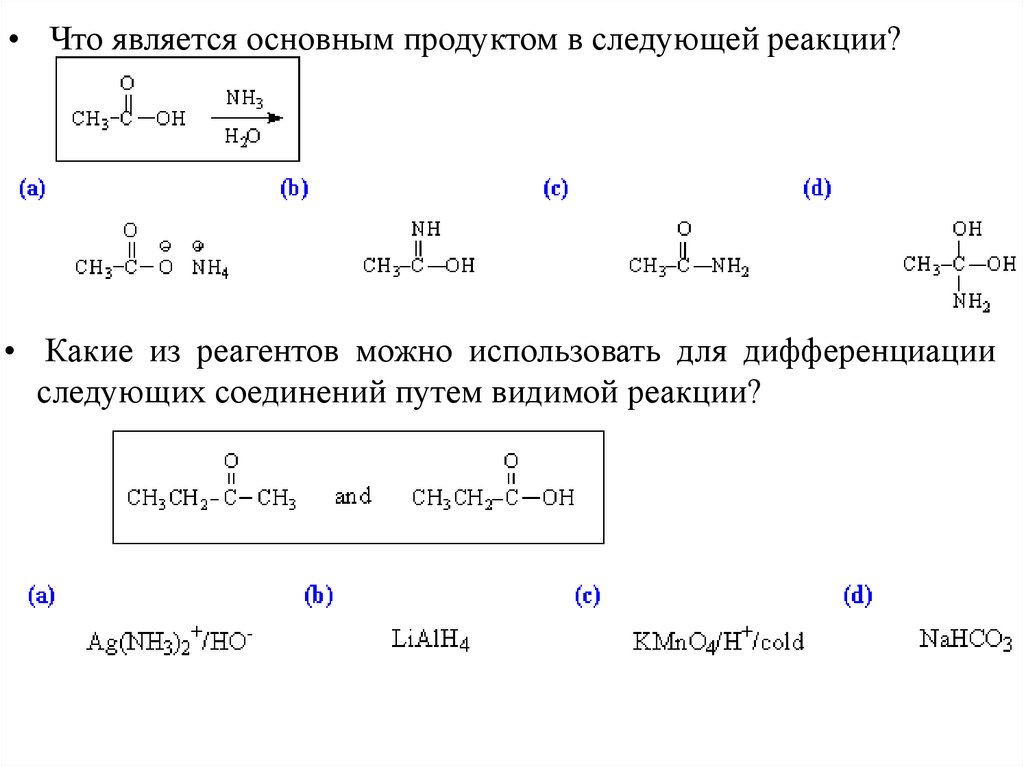
• Что является основным продуктом в следующей реакции?• Какие из реагентов можно использовать для дифференциации
следующих соединений путем видимой реакции?
33.
• п-аминобензойная кислота широко используется каккомпонент в солнцезащитных кремах. Предложите метод
синтеза вещества начиная с толуола.
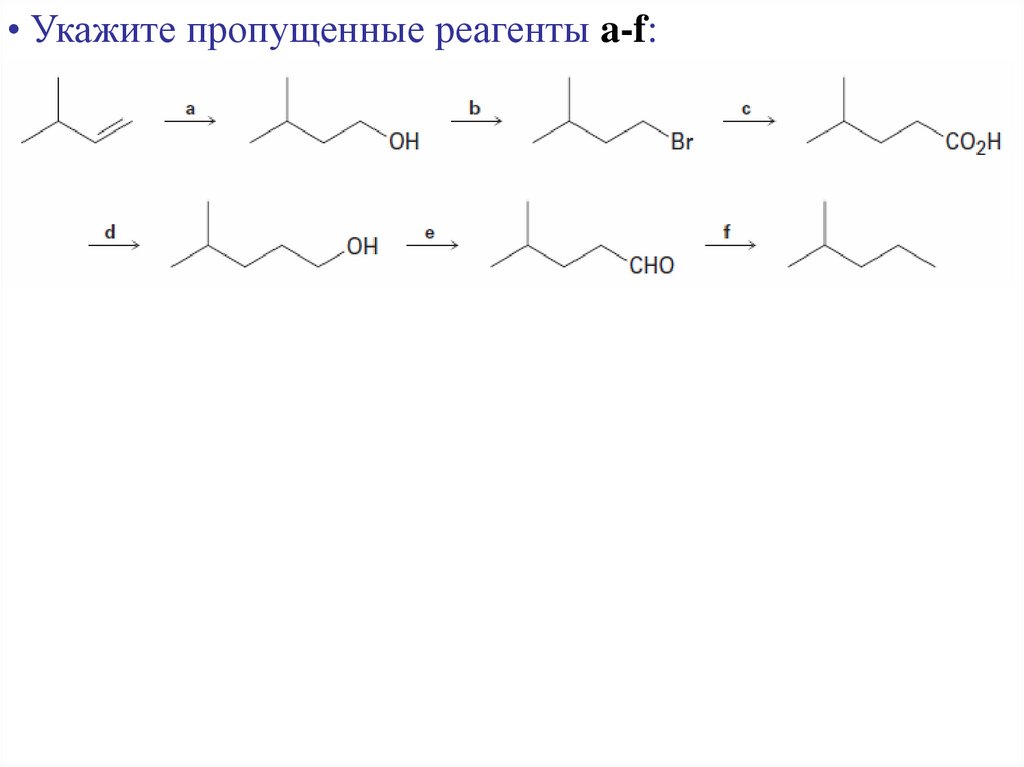
34. Жирные кислоты
• Укажите пропущенные реагенты a-f:35. Мыло
• Неизвестное вещество реагирует с натрием, гидроксидом натрия,окисляется аммиачным раствором оксида серебра и хлором. Это
вещество находит применение в фармацевтической и пищевой
промышленности. В молекуле этого вещества одинаковое
количество атомов кислорода и водорода. Что это за вещество?
36.
• Осуществите следующее превращение, используя процессэлектролиза:
37.
4. Докажите строение соединения состава C6H12O. Известно, что данноесоединение при окислении превращается в продукт состава C6H12O2,
показывающий кислую реакцию. При взаимодействии C6H12O2 с карбонатом
кальция и сухой перегонке полученного продукта с ацетатом кальция
образовалось соединение, давшее после окисления вещество C5H10O2. Это
вещество обработали карбонатом кальция и перегнали с ацетатом кальция, а
итоговый продукт окислили. При последней реакции образовалась изомасляная
кислота.
38.
• ЭДТА (соединение В) является сильным хелатирующим агентом и используется в виде трилона Б(соединения Г) для уменьшения жесткости воды, как антикоагулянт крови, пищевой антиокислитель и
консервант. Соединения Г и Д используются в производстве маргаринов, фруктово-ягодных соков (в
них лучше сохраняется витамин С), при консервации рыбы, грибов, картофеля (защищают его от
потемнения), крабов и креветок. Синтез соединения В осуществляется по следующей схеме:
этилен + Cl2 → А (C2H4Cl2)
А + NH3/100°, P → Б (C2H8N2)
Б + монохлоруксусная кислота → В (C10H16O8N2)
В + NaOH → Г (C10H14O8N2Na2)
Г + CaCO3 → Д (C10H12O8N2Na2Ca)
Изобразите структурные формулы соединений В, Г и Д и всех
промежуточных соединений
39.
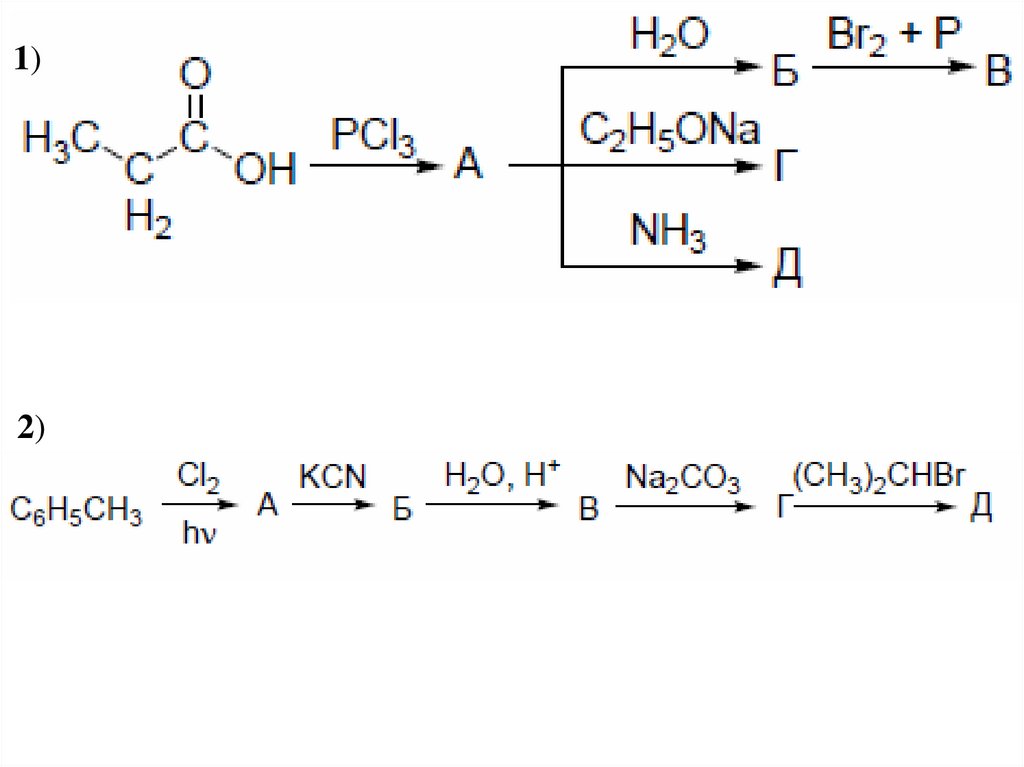
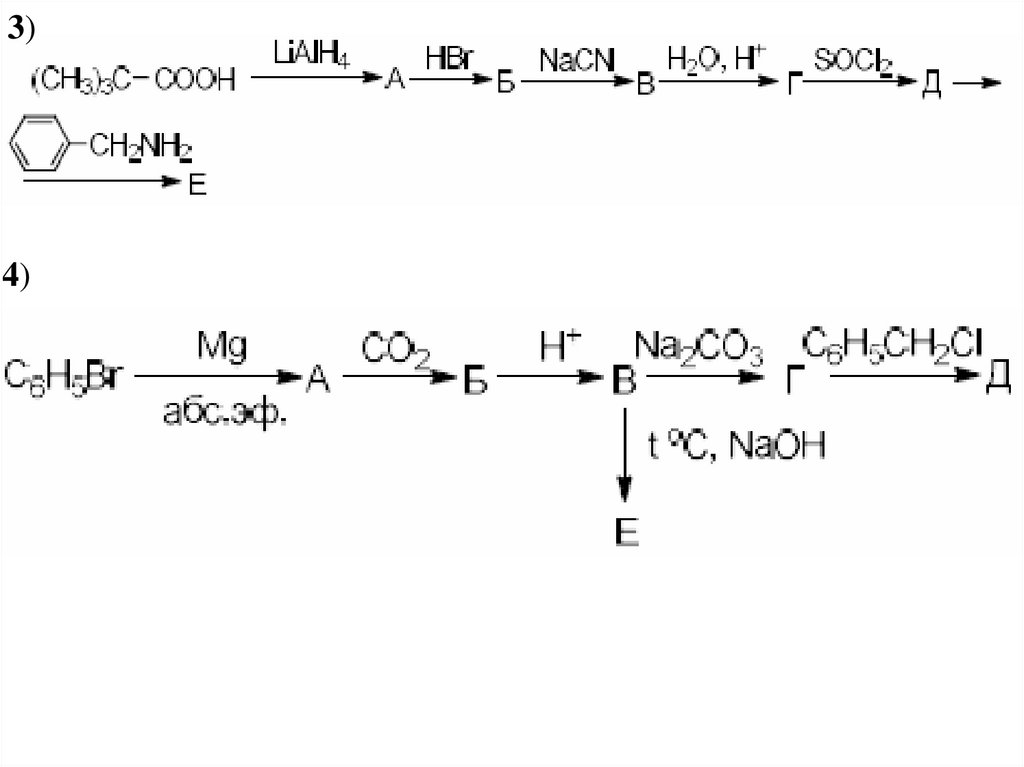
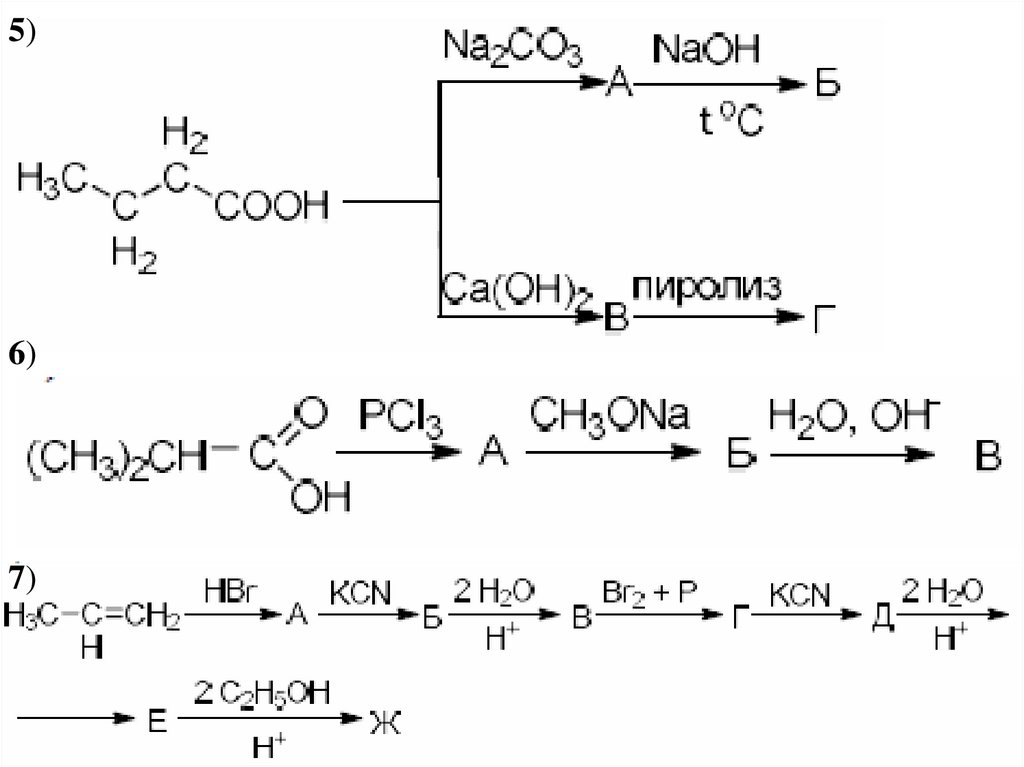
40. Дикарбоновые кислоты
1)2)
41.
3)4)
42. Образование солей дикарбоновыми кислотами:
5)6)
7)
43.
44.
• Соединение Х, состава С4Н8О3 реагирует сбромоводородом с образованием С4Н7BrО2 , c
хлоридом фосфора (V) образуется С4Н6Сl2О. При
нагревании Х получается соединение состава
С8Н12О4 . Установите строение Х.














 Химия
Химия








