Похожие презентации:
Альдегиды и кетоны
1.
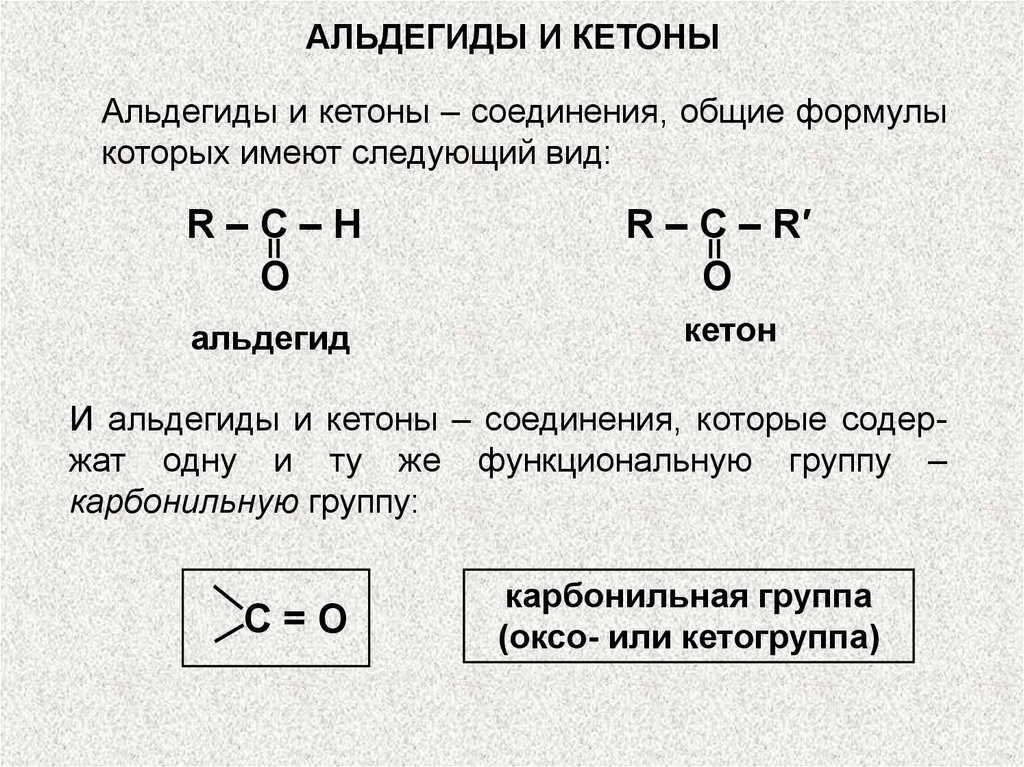
АЛЬДЕГИДЫ И КЕТОНЫАльдегиды и кетоны – соединения, общие формулы
которых имеют следующий вид:
R–C–H
O
альдегид
R – C – R′
O
кетон
И альдегиды и кетоны – соединения, которые содержат одну и ту же функциональную группу –
карбонильную группу:
С=О
карбонильная группа
(оксо- или кетогруппа)
2.
АЛЬДЕГИДЫ И КЕТОНЫОтсюда их название: карбонильные соединения.
У кетонов обе валентности карбонильного углерода
затрачиваются на связь с углеводородными радикалами.
У альдегидов одна валентность затрачивается на
связь с радикалом, вторая – на связь с водородом.
Альдегиды и кетоны изомерны:
CnH2nO
общая формула насыщенных
альдегидов и кетонов
3.
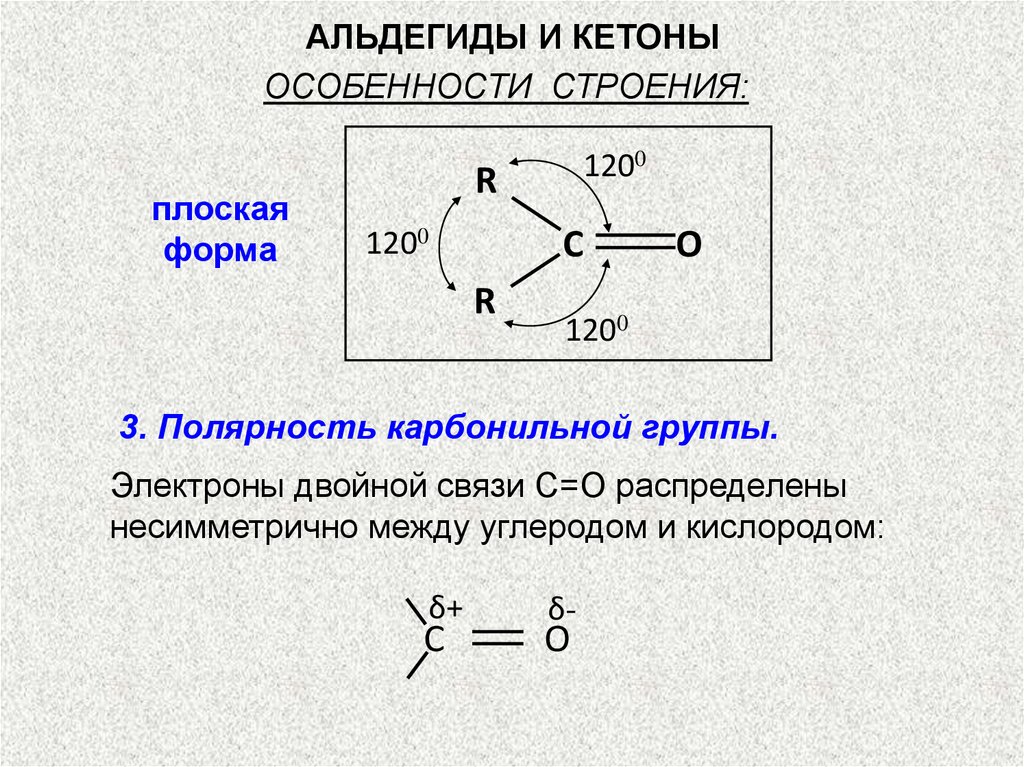
АЛЬДЕГИДЫ И КЕТОНЫОСОБЕННОСТИ СТРОЕНИЯ:
1.sp2-гибридизация карбонильного атома углерода:
2s
2p
С*
s+p+p
sp2
2. Плоское строение: часть молекулы, непосредственно окружающая углерод карбонильной группы, плоская:
4.
АЛЬДЕГИДЫ И КЕТОНЫОСОБЕННОСТИ СТРОЕНИЯ:
плоская
форма
1200
R
C
1200
R
O
1200
3. Полярность карбонильной группы.
Электроны двойной связи C=O распределены
несимметрично между углеродом и кислородом:
δ+
С
δ-
О
5.
АЛЬДЕГИДЫ И КЕТОНЫИЗОМЕРИЯ
Изомерия альдегидов обусловлена строением
углеводородного радикала.
CH3–CH2–CH2–C
O
H
CH3
CH3–CH–C
O
H
Изомерия кетонов обусловлена двумя причинами:
1. строением радикалов
2. положением кетогруппы внутри углеродной цепи
CH3–C–CH2–CH2–CH3
O
пентанон-2
CH3–CH2–C–CH2–CH3
O
пентанон-3
6.
АЛЬДЕГИДЫ И КЕТОНЫНОМЕНКЛАТУРА
1. Заместительная номенклатура альдегидов:
название
альдегида
CH3– C
=
O
H
этаналь
название
углеводорода
+
аль
O
CH3–CH–CН2–С
CH3
H
3-метилбутаналь
7.
АЛЬДЕГИДЫ И КЕТОНЫ2. Рациональная номенклатура альдегидов:
название
альдегида
O
CH3–C
H
уксусный
альдегид
=
названия
заместителей
O
CH3–CH–C
H
CH3
+
уксусный
альдегид
CI
O
CI– C –C
H
CI
диметилуксусный трихлоруксусный
альдегид
альдегид
8.
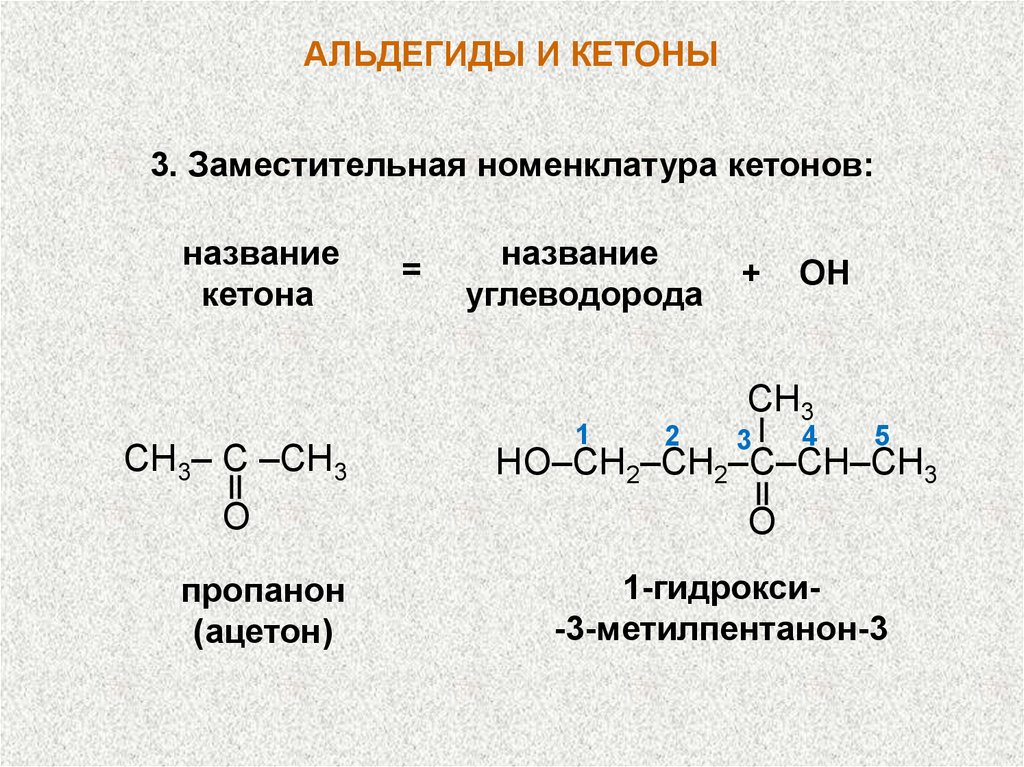
АЛЬДЕГИДЫ И КЕТОНЫ3. Заместительная номенклатура кетонов:
название
кетона
CH3– C –CH3
O
пропанон
(ацетон)
=
название
углеводорода
1
2
+
ОН
CH3
3
4
5
HO–CH2–CH2–C–CН–СH3
O
1-гидрокси-3-метилпентанон-3
9.
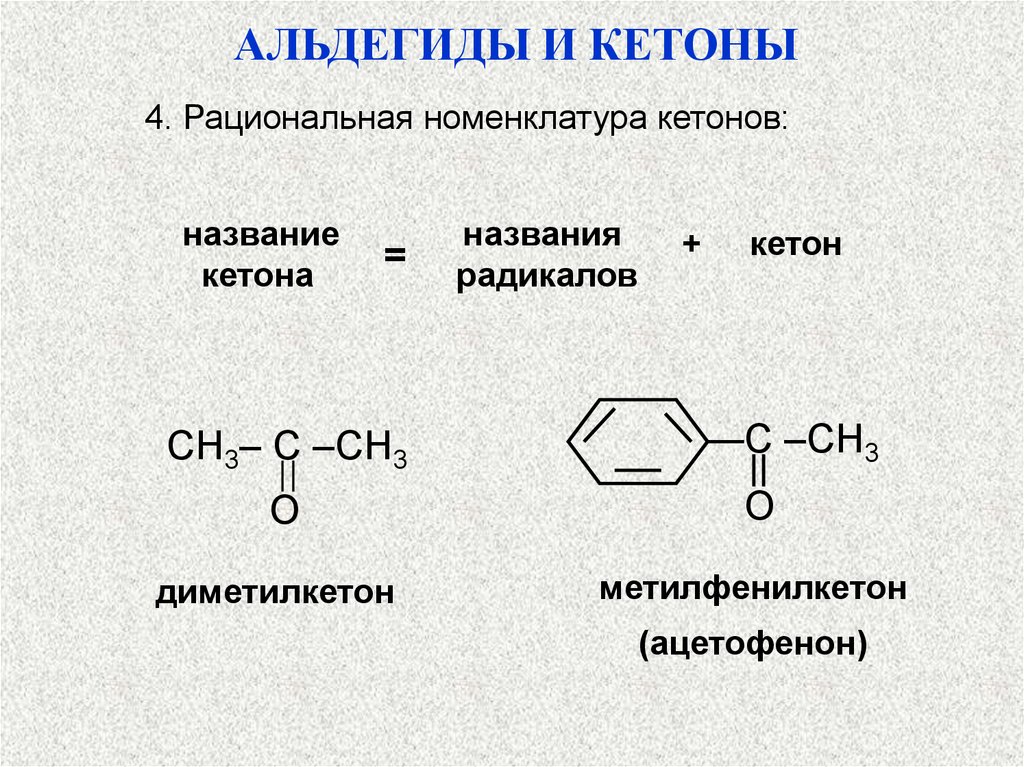
АЛЬДЕГИДЫ И КЕТОНЫ4. Рациональная номенклатура кетонов:
название
кетона
=
CH3– C –CH3
названия
радикалов
+
кетон
C –CH3
O
O
диметилкетон
метилфенилкетон
(ацетофенон)
10.
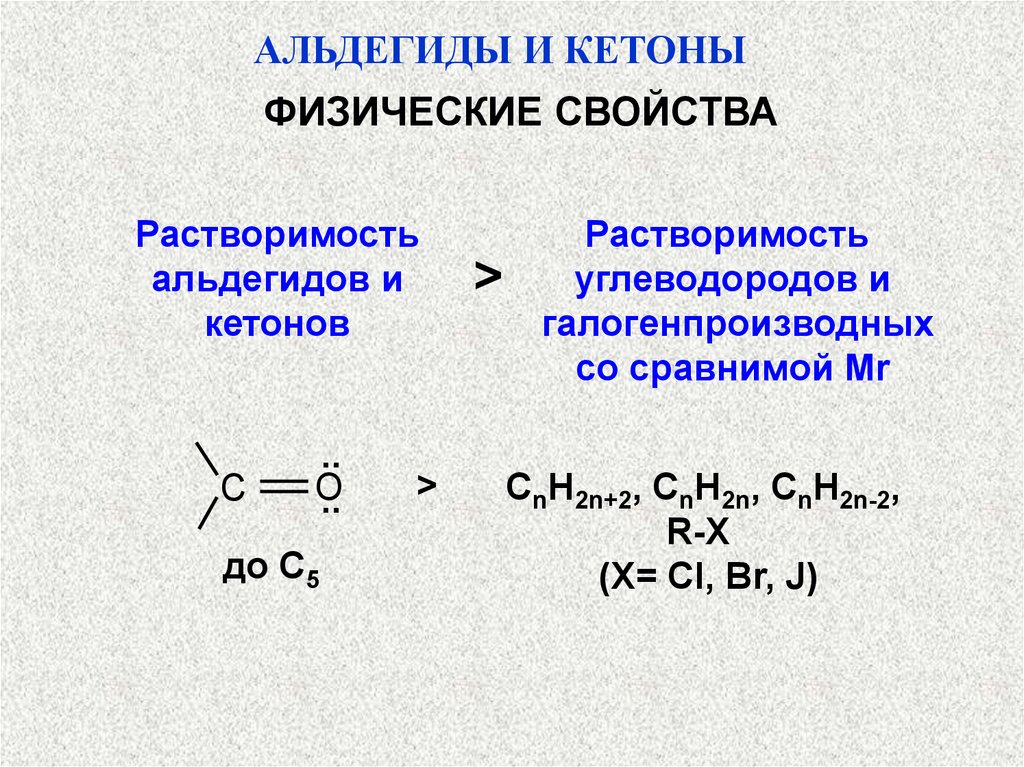
АЛЬДЕГИДЫ И КЕТОНЫФИЗИЧЕСКИЕ СВОЙСТВА
Так как альдегиды и кетоны полярные
соединения, они имеют более высокие температуры
кипения, чем неполярные соединения сравнимого
молекулярного веса, но ниже, чем у спиртов, что
указывает на отсутствие у оксосоединений
существенной молекулярной ассоциации.
Низшие оксосоединения заметно растворимы в
воде, вероятно, вследствие образования водородных связей; обладают резким запахом.
С увеличением размера молекул (начиная с С5)
растворимость резко уменьшается; высшие
альдегиды и кетоны обладают приятным запахом
11.
АЛЬДЕГИДЫ И КЕТОНЫФИЗИЧЕСКИЕ СВОЙСТВА
Ткип альдегидов > Ткип соединений со сравнимой молекулярной массой
и кетонов
δ-
δ+
С
О
Ткип
С
Ткип
..
О
..
<
δ-
δ+
R–O–H
12.
АЛЬДЕГИДЫ И КЕТОНЫФИЗИЧЕСКИЕ СВОЙСТВА
Растворимость
альдегидов и
кетонов
С
..
О
..
до С5
>
>
Растворимость
углеводородов и
галогенпроизводных
со сравнимой Мr
СnH2n+2, CnH2n, CnH2n-2,
R-X
(X= CI, Br, J)
13.
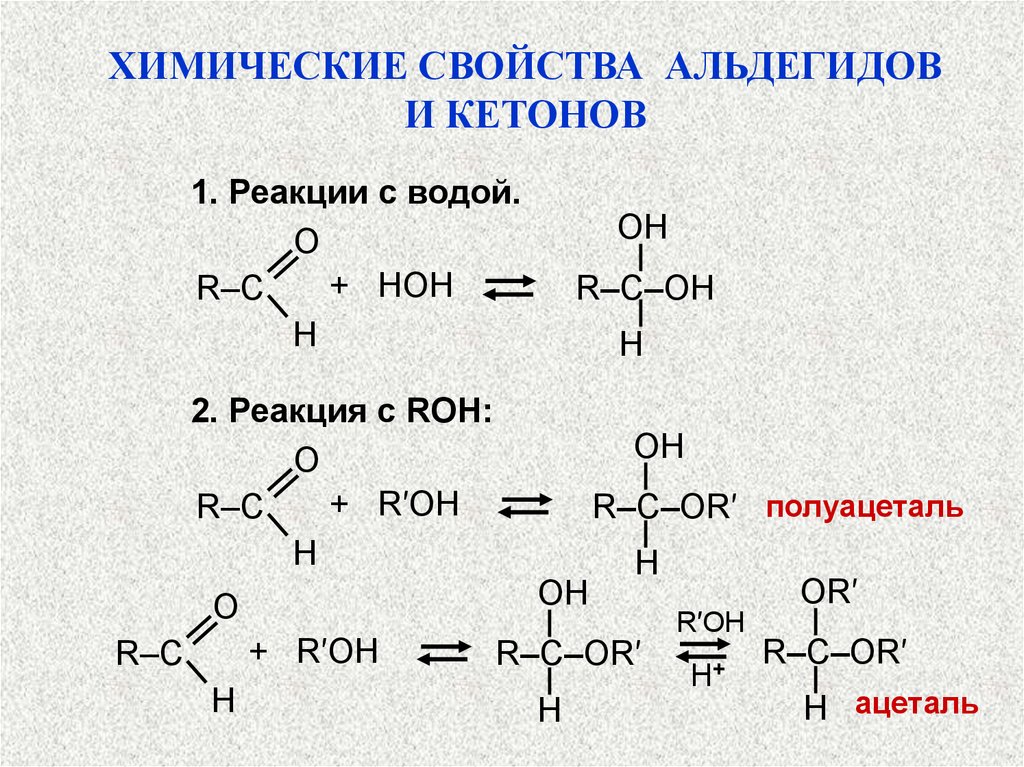
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВИ КЕТОНОВ
1. Реакции с водой.
O
+ НOH
R–C
H
OH
R–C–OН
H
2. Реакция c ROH:
O
+ R′OH
R–C
H
+ R′OH
H
R–C–OR′ полуацеталь
OH
O
R–C
OH
H
R–C–OR′
H
OR′
R′OH
H+
R–C–OR′
H ацеталь
14.
АЛЬДЕГИДЫ И КЕТОНЫ3. Реакции с NH3 и его производными:
RNH2, R2NH, NH2 – NH2, NH2OH,
C6H5–NH–NH2, NH2–NH–CO–NH2
4. Реакции с металлоорганическими соединениями:
RC ≡ C–M+, RMgX
5. Реакции с NaHSO3.
6. Реакции с HCN/CN–.
7. Окисление.
8. Восстановление.
9. Конденсация и галогенирование –
реакции обусловленные подвижностью α – Н.
15.
АЛЬДЕГИДЫ И КЕТОНЫПОЛУЧЕНИЕ:
1. Окисление спиртов:
Альдегиды получают из первичных спиртов:
R–CH2–OH
Cu, t0
K2Cr2O7
O
R–C
H
Кетоны получают из вторичных спиртов:
R– CН –R′
OH
Cu, t0 или
KMnO4 или K2Cr2O7
R– C –R′
O
16.
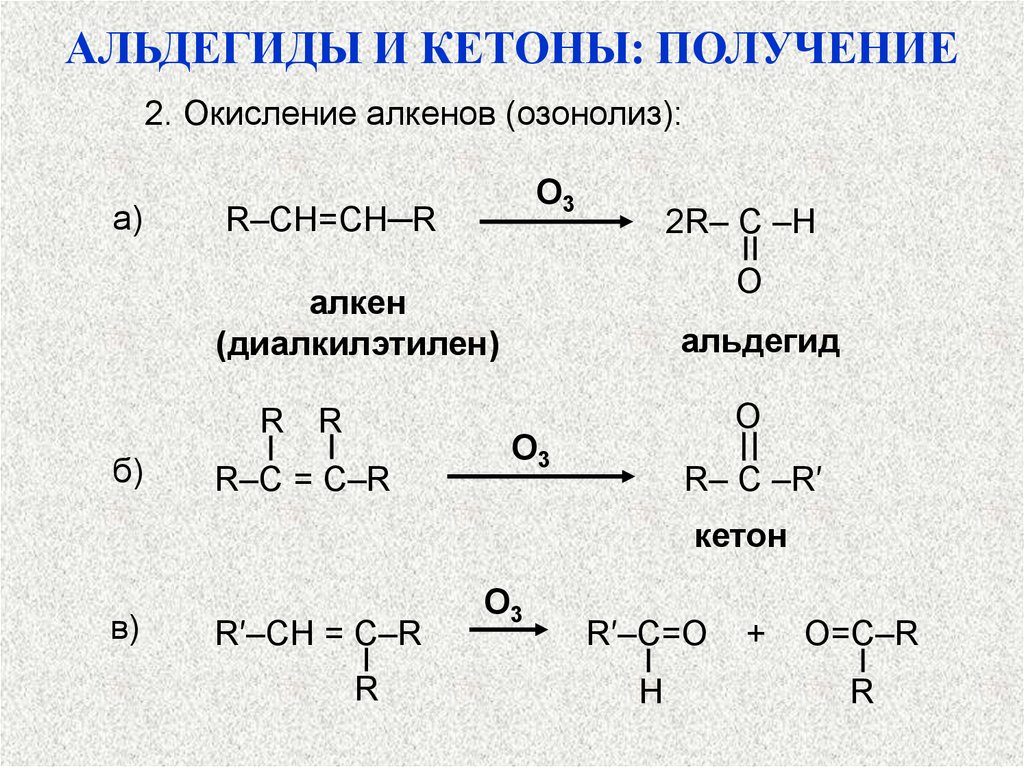
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ2. Окисление алкенов (озонолиз):
а)
О3
R–CH=CH─R
2R– C –H
O
алкен
(диалкилэтилен)
R R
б)
R–C = C–R
альдегид
O
O3
R– C –R′
кетон
в)
R′–CH = C–R
R
O3
R′–C=O
H
+
O=C–R
R
17.
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕПо
строению
продуктов
озонолиза
можно
определить строение исходного алкена. Для этого
мысленно удаляют из них кислород и соединяют
осколки двойной связью:
CH3–CН2–С=O
+
O=C–CH2–CH3
H
CH3
–О2
CH3–CН2–С=CH–CH2–CH3
CH3
18.
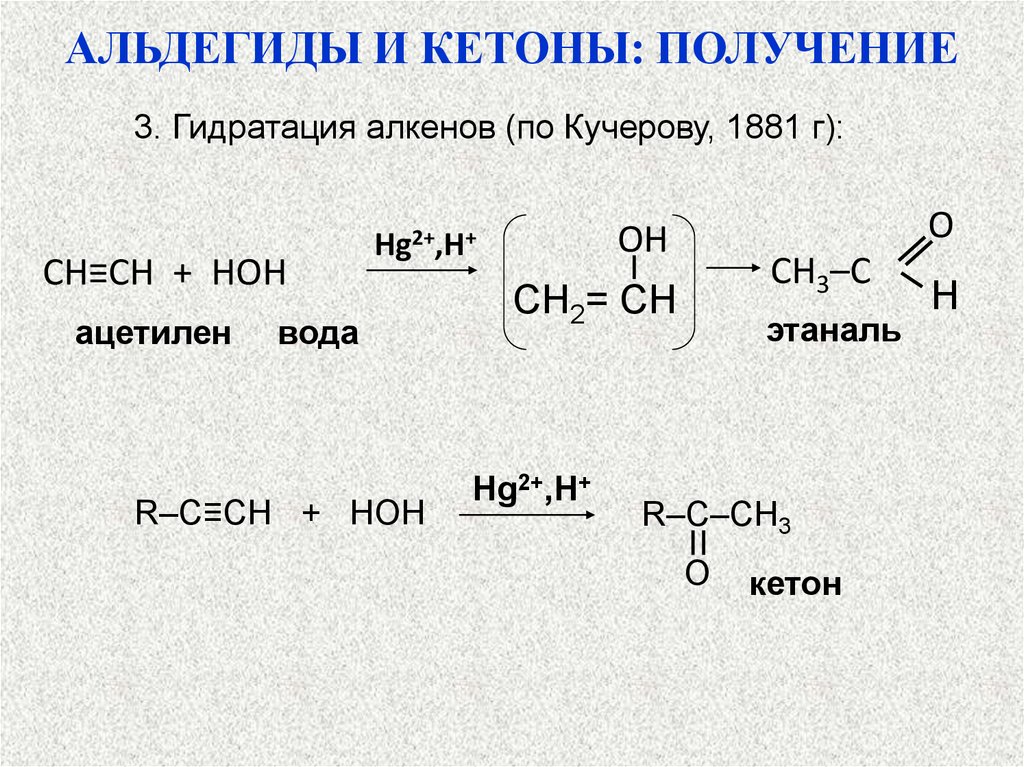
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ3. Гидратация алкенов (по Кучерову, 1881 г):
CH≡CH + HOH
ацетилен
вода
R–C≡CH + HOH
O
OH
Hg2+,H+
CH3–C
CH2= CH
Hg2+,H+
этаналь
R–C–CH3
O
кетон
H
19.
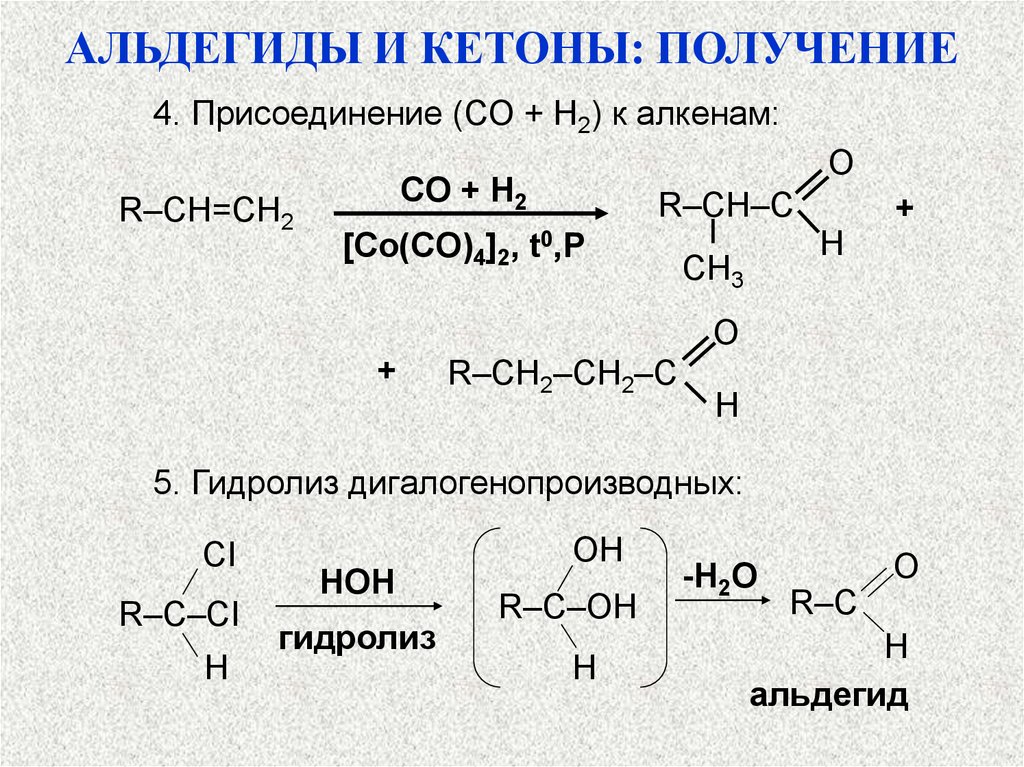
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ4. Присоединение (СО + Н2) к алкенам:
R–CH=CH2
O
CO + H2
R–CH–C
[Co(CO)4]2, t0,P
+
H
CH3
O
+
R–CH2–CH2–C
H
5. Гидролиз дигалогенопроизводных:
CI
R–C–CI
Н
OH
HOH
гидролиз
R–C–OH
H
-H2O
O
R–C
H
альдегид
20.
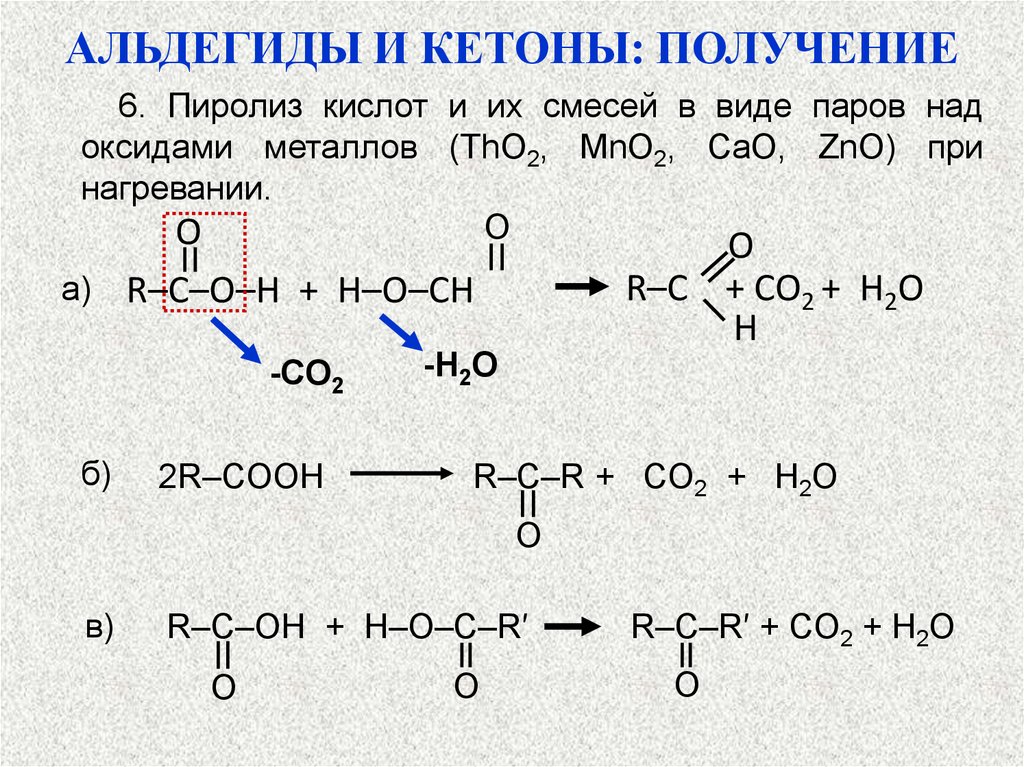
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ6. Пиролиз кислот и их смесей в виде паров над
оксидами металлов (ThO2, MnO2, CaO, ZnO) при
нагревании.
O
O
а)
R–C–O–H + H–O–CH
-CO2
б)
O
R–C + CO2 + H2O
H
2R–COOH
-H2O
R–C–R + CO2 + H2O
O
в)
R–C–OH + H–O–C–R′
O
O
R–C–R′ + CO2 + H2O
O
21.
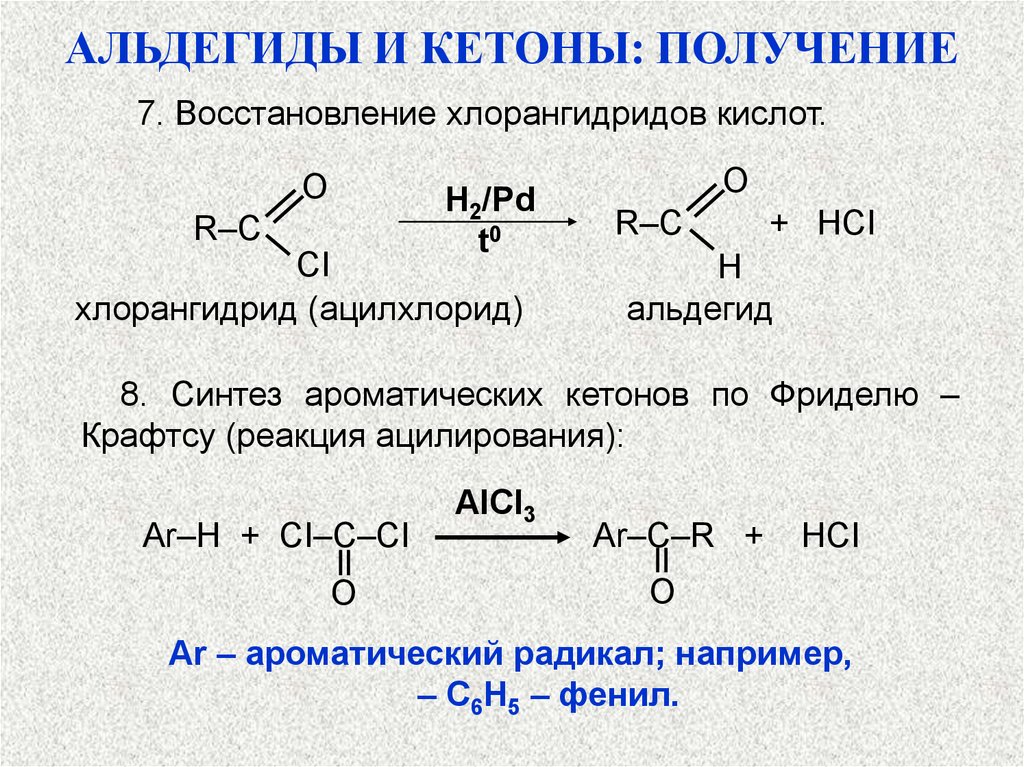
АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ7. Восстановление хлорангидридов кислот.
O
H2/Pd
t0
R–C
CI
хлорангидрид (ацилхлорид)
O
R–C
+ HCI
H
альдегид
8. Синтез ароматических кетонов по Фриделю –
Крафтсу (реакция ацилирования):
Ar–H + CI–C–CI
O
AICI3
Ar–C–R +
HCI
O
Ar – ароматический радикал; например,
– C6H5 – фенил.
22.
АЛЬДЕГИДЫ И КЕТОНЫХИМИЧЕСКИЕ СВОЙСТВА
Химия оксосоединений определяется наличием
карбонильной группы.
ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ:
1. Плоское строение оксогруппы, отсюда доступность
группы для атаки сверху и снизу.
2. Карбонильная группа содержит двойную углерод
кислородную связь, которая сильно поляризована:
δ+
С
δ-
О
23.
РЕАКЦИОННАЯ СПОСОБНОСТЬ КАРБОНИЛЬНОЙГРУППЫ
δ+
С
δО
δ+
чем больше заряд
на углероде, тем выше
реакционная способность
оксосоединений
электронодефицитный центр:
место нуклеофильной (Nu) атаки
(реакция присоединения)
24.
ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ:3. Способность кислорода приобретать и
нести отрицательный заряд:
.. ‒
:
–С– О
..
в этом состоянии кислород
не проявляет большой
реакционной способности
Вывод: типичными реакциями альдегидов и кетонов будут реакции нуклеофильного присоединения.
25.
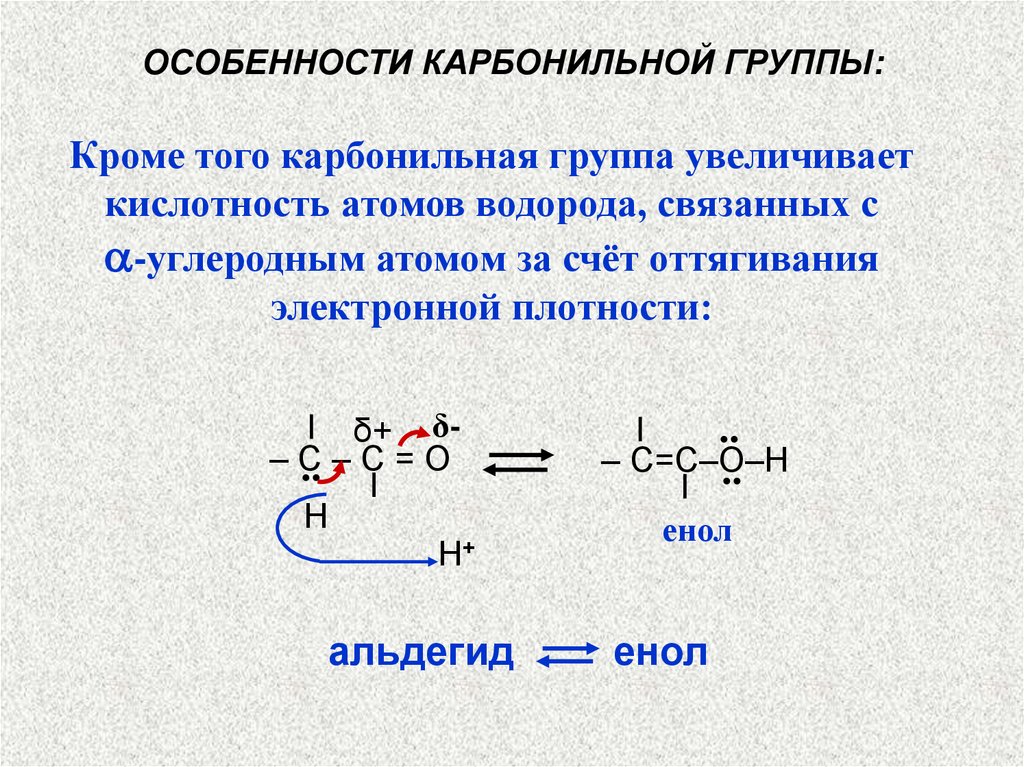
ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ:Кроме того карбонильная группа увеличивает
кислотность атомов водорода, связанных с
-углеродным атомом за счёт оттягивания
электронной плотности:
δ+ δ–С
.. – С = О
Н
Н+
альдегид
..
– С=С‒О‒Н
..
енол
енол
26.
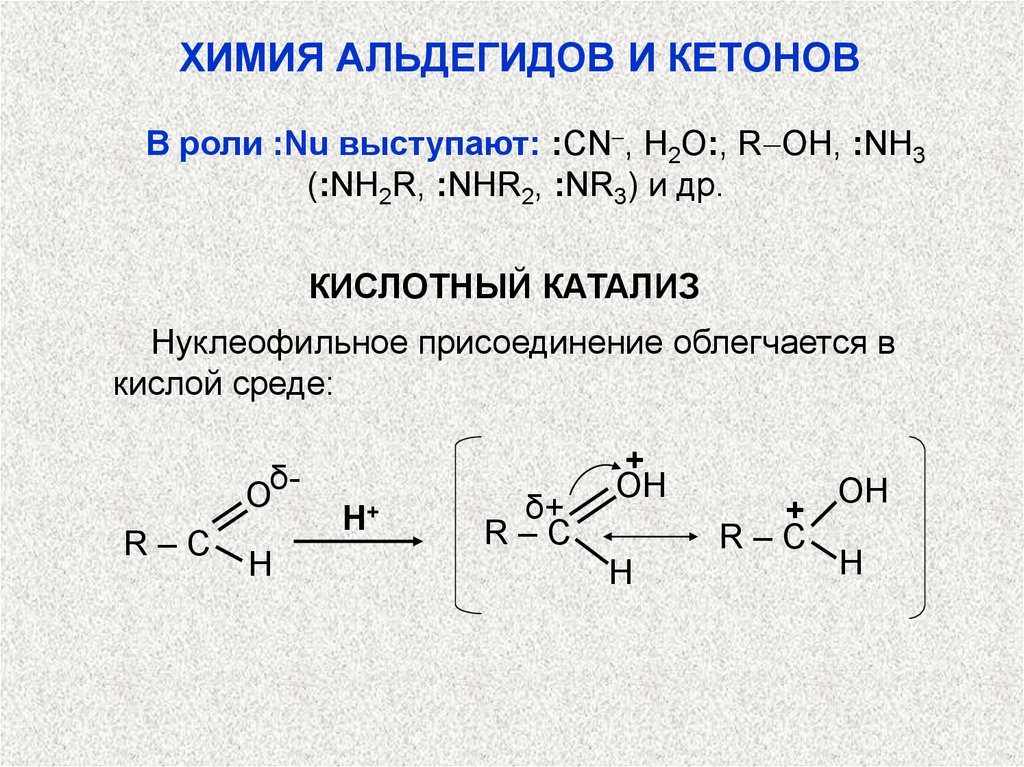
ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВНУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ
Процесс протекает ступенчато и начинается с
медленной атаки нуклеофила (:Nu ) по карбонильному углероду; образовавшийся анион быстро
присоединяет электрофил Е+ (например Н+):
:Nu─
δ+ δC = O медленно
альдегид или
кетон
.. ‒
H+
Nu– C –O.. :
быстро
промежуточный
продукт
Nu– C –OH
продукт
27.
ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВВ роли :Nu выступают: :CN , H2O:, R OH, :NH3
(:NH2R, :NHR2, :NR3) и др.
КИСЛОТНЫЙ КАТАЛИЗ
Нуклеофильное присоединение облегчается в
кислой среде:
δO
R–C
H
H+
δ+
R–C
+
OH
H
+
R–C
OH
H
28.
ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВВлияние заместителей на реакционную
способность карбонильной группы:
1. Электроноакцепторные заместители увеличивают
положительный заряд ( +) карбонильного углерода,
вследствии чего присоединение :Nu облегчается,
скорость реакции увеличивается:
2. Электронодонорные заместители снижают + на
карбонильном углероде и поэтому затрудняют
присоединение
:Nu,
скорость
присоединения
снижается.
δCI
δH
δ+ O
δ+ O
<
H–C–C
CI C C
H
H
H
менее реакционноCI
более реакционноспособен
способен
29.
ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВОксосоединения по убывающей активности их в
реакции нуклеофильного присоединения можно
расположить в следующий ряд:
O
H–C
H
O
>
CH3–C
H
CH3–C– CH3 >
>
O
CH3–C– C6H5
O
>
C6H5–C– C6H5
O
Примечание: кроме электронных факторов надо
учитывать и пространственные.
30.
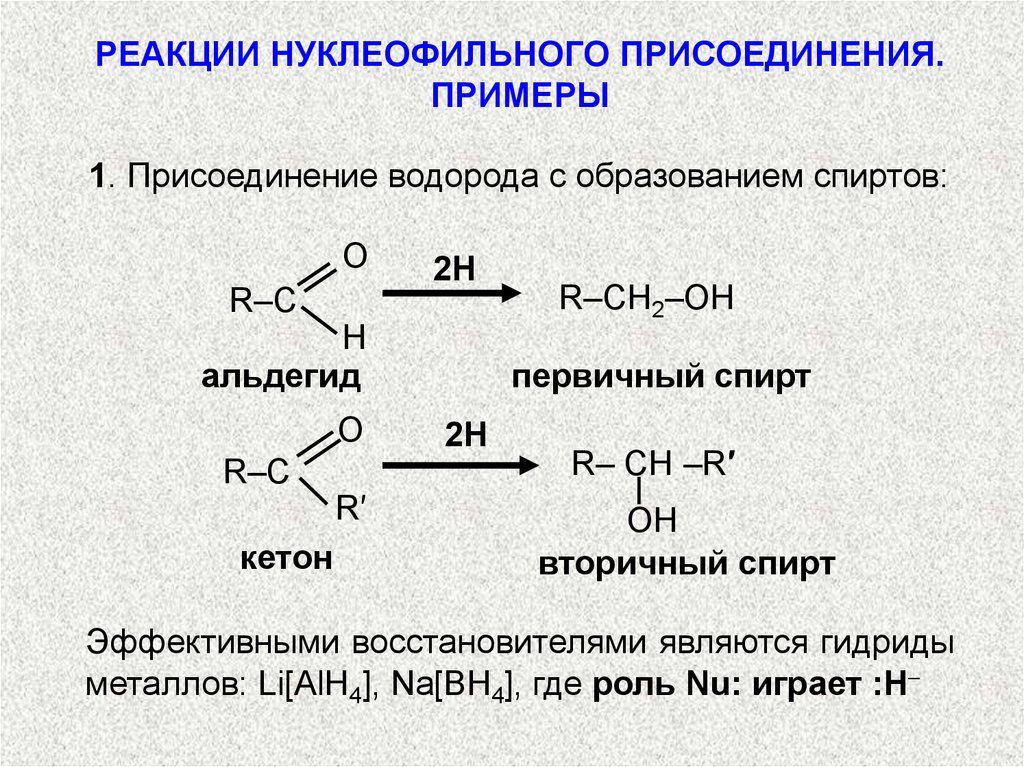
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
1. Присоединение водорода с образованием спиртов:
O
2Н
R–C
H
альдегид
O
R–C
кетон
R′
R–CH2–OH
первичный спирт
2Н
R– CH –R′
OH
вторичный спирт
Эффективными восстановителями являются гидриды
металлов: Li[AlH4], Na[BH4], где роль Nu: играет :H
31.
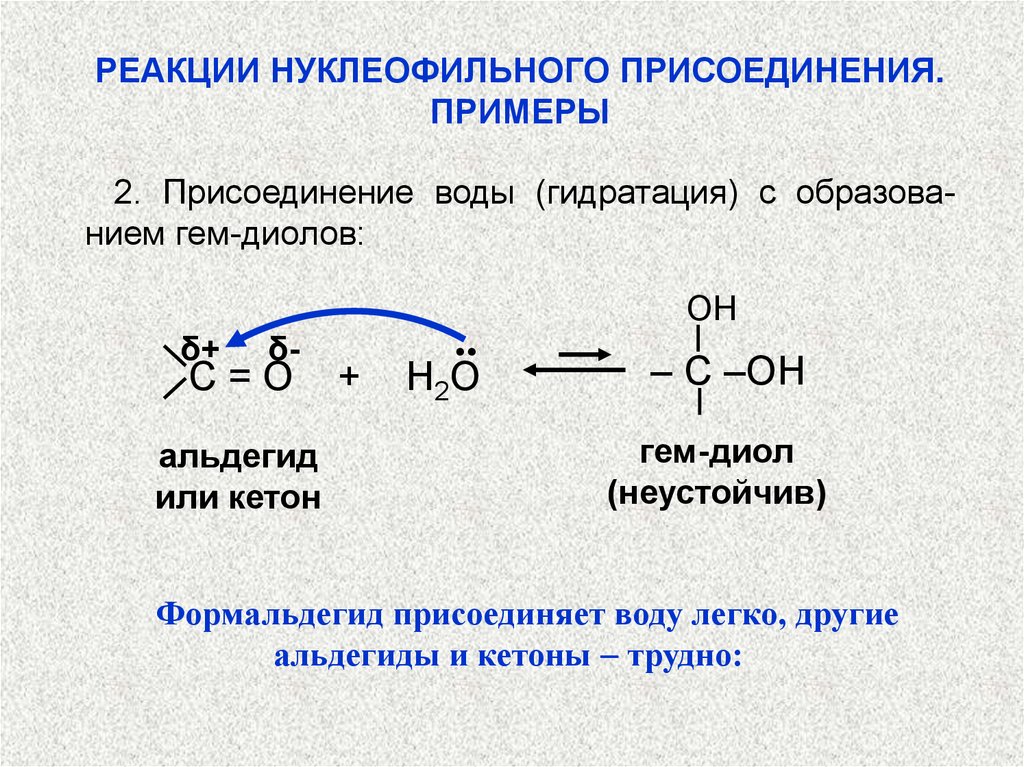
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
2. Присоединение воды (гидратация) с образованием гем-диолов:
δ+
δ-
C=O
альдегид
или кетон
+
..
Н2О
OH
– C –OH
гем-диол
(неустойчив)
Формальдегид присоединяет воду легко, другие
альдегиды и кетоны трудно:
32.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ ВОДЫOH
O
..
H– C –H + HOH
H– C –H
раствор
формалина
OH
Смещению равновесия вправо благоприятствуют
электроноакцепторные заместители, связанные с
карбонильным углеродом:
CI3C
δδ+ O
C
+ H2O
H
хлораль
OH
CI3C – C –H
OH
хлоральгидрат
33.
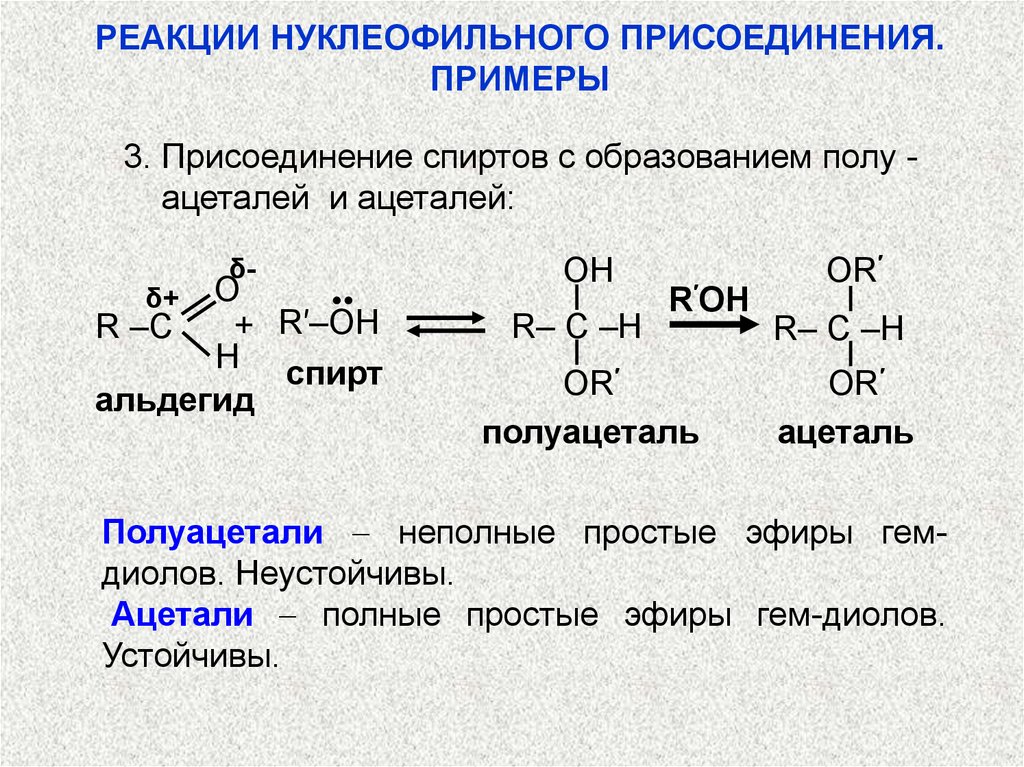
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
3. Присоединение спиртов с образованием полу ацеталей и ацеталей:
δ-
O
..
+ R′–OH
R –C
H спирт
альдегид
δ+
OH
R– C –H
R′OH
OR′
полуацеталь
OR′
R– C –H
OR′
ацеталь
Полуацетали неполные простые эфиры гемдиолов. Неустойчивы.
Ацетали полные простые эфиры гем-диолов.
Устойчивы.
34.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
4. Присоединение цианид-иона :CN
H+ + :CN
HCN
δ+ δC=O
альдегид
или кетон
:CN–
O–
– C –CN
H+
OH
– C –CN
гидроксинитрил
35.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
5. Присоединение бисульфита натрия с образо ванием бисульфитных соединений:
CH3
δ+
R–C
+
Oδ-
CH3 O
O
:S –O–Na+
OH
R– C – S–O–Na+
OH O
легко гидролизуются
с образованием исходных
оксосоединений (в Н+, ОН- )
36.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
6. Присоединение магнийорганических соединений
R – MgX (это важный синтетический метод получения
спиртов!!!)
δ+
δ-
C=O +
-δ δ+
R–MgX
H2O
R–C–OMgX
R–C–OH + Mg(OH)X
а) формальдегид даёт первичные спирты;
б) остальные альдегиды – вторичные;
в) кетоны дают третичные спирты.
H2O
37.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
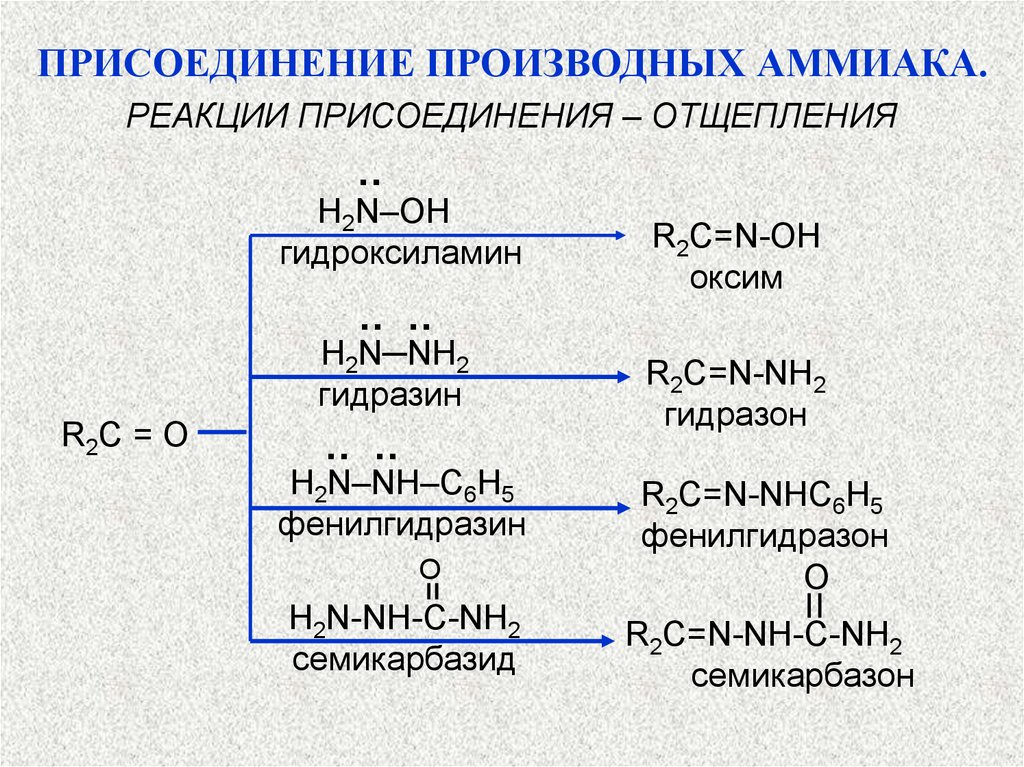
7. Присоединение производных аммиака
процесс идёт по механизму присоединения –
отщепления
Общая схема:
δ+
δ-
··
С = O + H2N–G
H+
С = N–G + H2O
Механизм: реакция идёт в две стадии
первая стадия – присоединение аммиака (или его
производного) по карбонильной группе с образованием нестойкого аддукта.
вторая стадия – отщепление аддуктом воды.
38.
ПРИСОЕДИНЕНИЕ ПРОИЗВОДНЫХ АММИАКА.МЕХАНИЗМ:
Н
δ+ δ-
OH H
С = О + :N–G
─C – N–G
‒H2O
–C=N–G
Н
Основание Шиффа
(если G = R,H)
G = H, R, OH, NH2 и др.
39.
ПРИСОЕДИНЕНИЕ ПРОИЗВОДНЫХ АММИАКА.РЕАКЦИИ ПРИСОЕДИНЕНИЯ – ОТЩЕПЛЕНИЯ
··
H2N‒OH
гидроксиламин
··
··
H2N─NH2
гидразин
R2C = O
·· ··
H2N‒NH‒C6H5
фенилгидразин
O
H2N-NH-C-NH2
семикарбазид
R2C=N-OH
оксим
R2C=N-NH2
гидразон
R2C=N-NHC6H5
фенилгидразон
О
R2C=N-NH-C-NH2
семикарбазон
40.
ПРОДУКТЫ ПРИСОЕДИНЕНИЯ АММИАКА ИЕГО ПРОИЗВОДНЫХ:
Оксимы, гидразоны, фенилгидразоны –
твёрдые, кристаллические вещества с
характерными температурами плавления.
Это
свойство
используется
идентификации альдегидов и кетонов.
.
для
41.
Синтез мочевино-формальдегидных ианилино-формальдегидных смол.
По
механизму
присоединения
–
отщепления происходит поликонденсация
мочевины или анилина (а также фенола) с
формальдегидом
42.
АЛЬДЕГИДЫ И КЕТОНЫКонденсация мочевины с формальдегидом
(кислая среда)
1.
··
HN-CH2OH
H–N–H
δ-
δ+
C=O + O = CH2
C=O
NH
.. 2
NH
.. 2
CH2=O
HN-CH2OH
CO
формальдегид
мочевина
монометилолмочевина
HN-CH2OH
43.
АЛЬДЕГИДЫ И КЕТОНЫHN-CH2OH
2.
N=CH2
Н+
CO
NH2
NH2
– N – CH2
N=CH2
3. CO
NH2
CO + H2O
t0
полимеризация
CO
HN2
n
44.
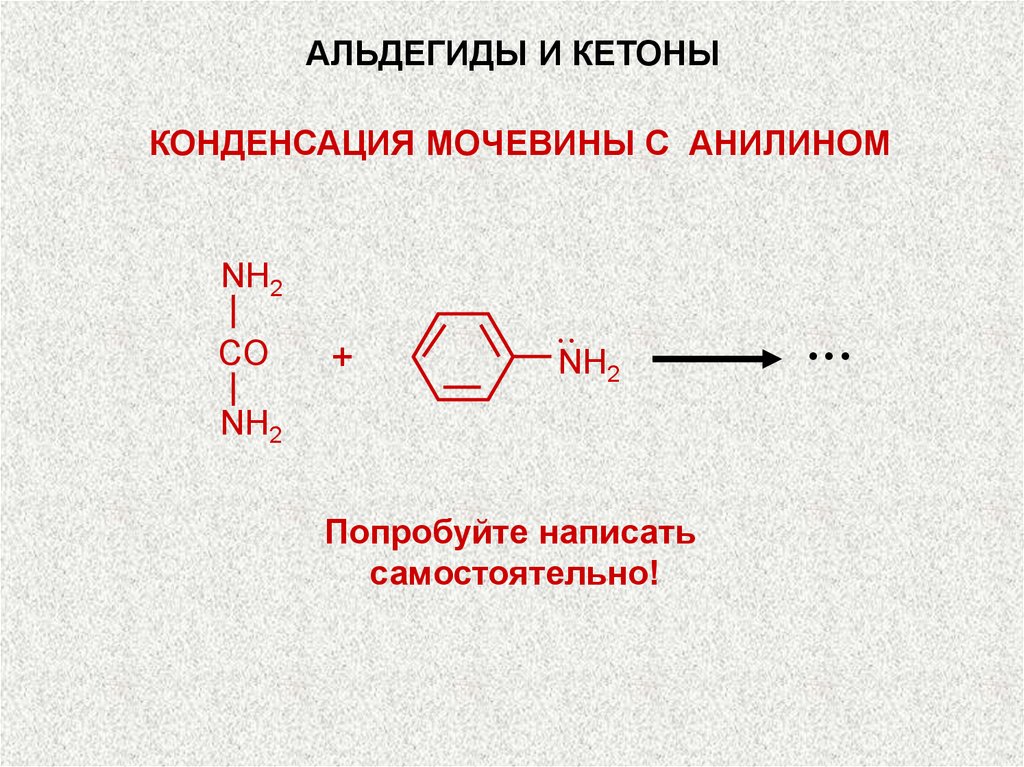
АЛЬДЕГИДЫ И КЕТОНЫКОНДЕНСАЦИЯ МОЧЕВИНЫ С АНИЛИНОМ
NH2
CO
+
··NH
2
NH2
Попробуйте написать
самостоятельно!
••
45.
АЛЬДЕГИДЫ И КЕТОНЫАЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ
Альдегиды
способны
вступать
в
реакции
конденсации между собой в присутствии оснований.
Кетоны реагируют труднее:
δ+ δ−
С=О +
карбонильный
компонент
α
–С
.. – С
H
О :OH–
Н
метиленовый
компонент
ОН
О
α
β
– С – С– С
Н
альдегидоспирт
46.
АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯВ этой реакции одна молекула альдегида участвует
своей карбонильной группой (карбонильный
компонент), другая – α-водородом (метиленовый
компонент).
МЕХАНИЗМ КОНДЕНСАЦИИ
(на примере уксусного альдегида)
Реакция относится к типичным реакциям нуклеофильного присоединения:
Роль :Nu играет карбанион, образующийся при
отщеплении α-водорода от молекулы альдегида:
47.
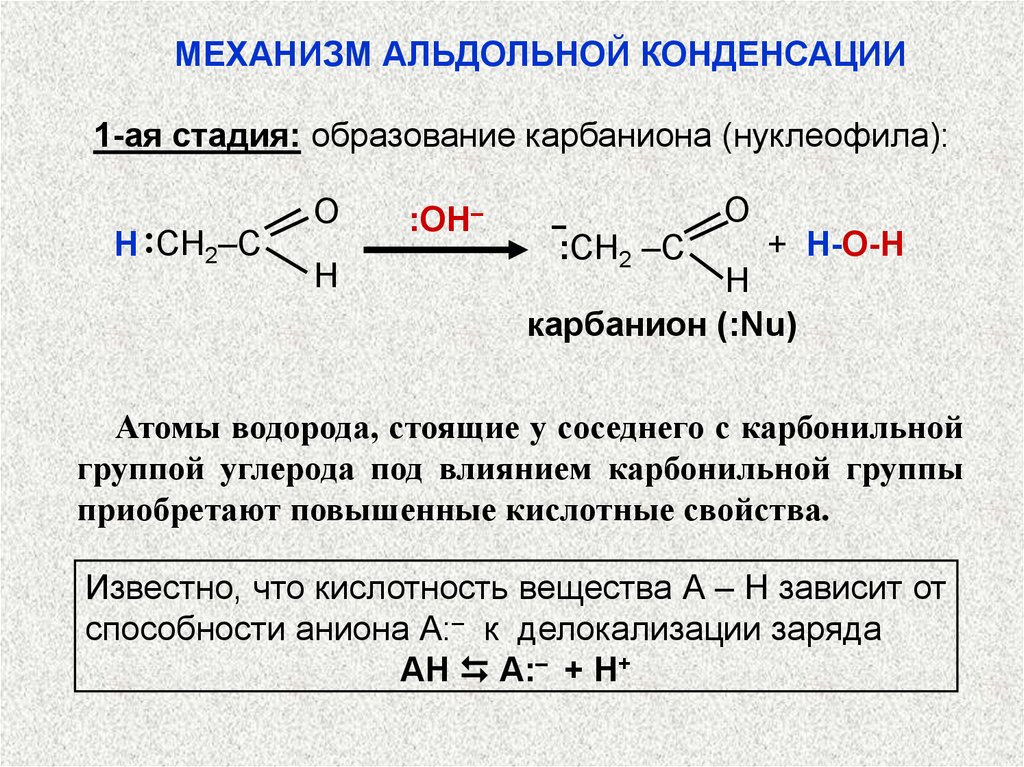
МЕХАНИЗМ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ1-ая стадия: образование карбаниона (нуклеофила):
··
Н CH2‒C
О
Н
:OH–
‒
:CH2 –C
О
+ H-O-Н
Н
карбанион (:Nu)
Атомы водорода, стоящие у соседнего с карбонильной
группой углерода под влиянием карбонильной группы
приобретают повышенные кислотные свойства.
Известно, что кислотность вещества А – Н зависит от
способности аниона А:– к делокализации заряда
АН А:– + Н+
48.
АЛЬДЕГИДЫ И КЕТОНЫМЕХАНИЗМ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ
Карбанион, образующийся после отщепления
α-водорода (но не j- или δ-водорода) способен к
делокализации заряда (резонансный эффект):
··
СН2 = С–О
··
или
СН2
··
·· –С = ··
СН
О
2
··
H
H
С–Н
О
резонансный гибрид
49.
АЛЬДЕГИДЫ И КЕТОНЫМЕХАНИЗМ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ
2-ая стадия: нуклеофильное присоединение:
δО
+δ
CH3 –C
Н
:CH2 –C
карбонильный
компонент
О
CH3–CН–СН2–С
Н
O–
метиленовый
компонент
O
+ 2Cu(OH)2
R–C
H
голубой
цвет
R–C
О
Н
анион
O
+ Cu2O + H2O
ОH красный
осадок
50.
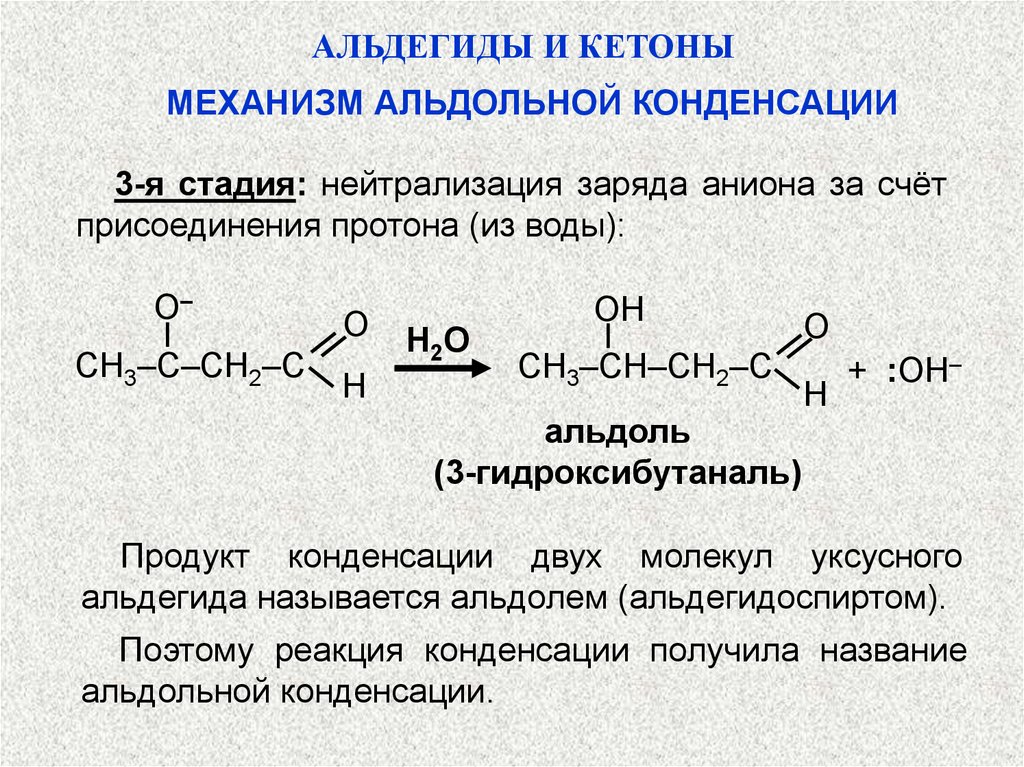
АЛЬДЕГИДЫ И КЕТОНЫМЕХАНИЗМ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ
3-я стадия: нейтрализация заряда аниона за счёт
присоединения протона (из воды):
O–
CH3–C–CH2–C
O
H
H2O
OH
CH3–CH–CH2–C
альдоль
(3-гидроксибутаналь)
O
H
+ :OH–
Продукт конденсации двух молекул уксусного
альдегида называется альдолем (альдегидоспиртом).
Поэтому реакция конденсации получила название
альдольной конденсации.
51.
АЛЬДЕГИДЫ И КЕТОНЫРЕАКЦИЯ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ
Альдегиды не содержащие α-водорода к альдольной конденсации не способны:
CH3
O
CH3– C –C
CH3
H
O
C
H
52.
ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВАльдегиды окисляются легко слабыми окислителями:
[Ag(NH3)2]OH
и
Cu(OH)2
РЕАКЦИЯ СЕРЕБРЯНОГО ЗЕРКАЛА
O
+
R–C
+ 2[Ag(NH3)2]
H
альдегид
O
R–C
+ 2Ag↓+ 4NH3+ H2O
OH
кислота
53.
ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВКетоны этих реакций не дают. Они устойчивы к
слабым окислителям и к кислороду воздуха. Сильные
окислители (KMnO4, K2Cr2O7) в жёстких условиях
окисляют кетоны с разрывом углеродных связей с
образованием смеси (кислот и кетонов).
ПОЛИМЕРИЗАЦИЯ АЛЬДЕГИДОВ
Простые альдегиды (но не кетоны) полимеризуются,
образуя как циклические, так и линейные полимеры:
nCH2 = O +
формальдегид
H2O
H(– C – OCH2 –)nOH
параформальдегид
54.
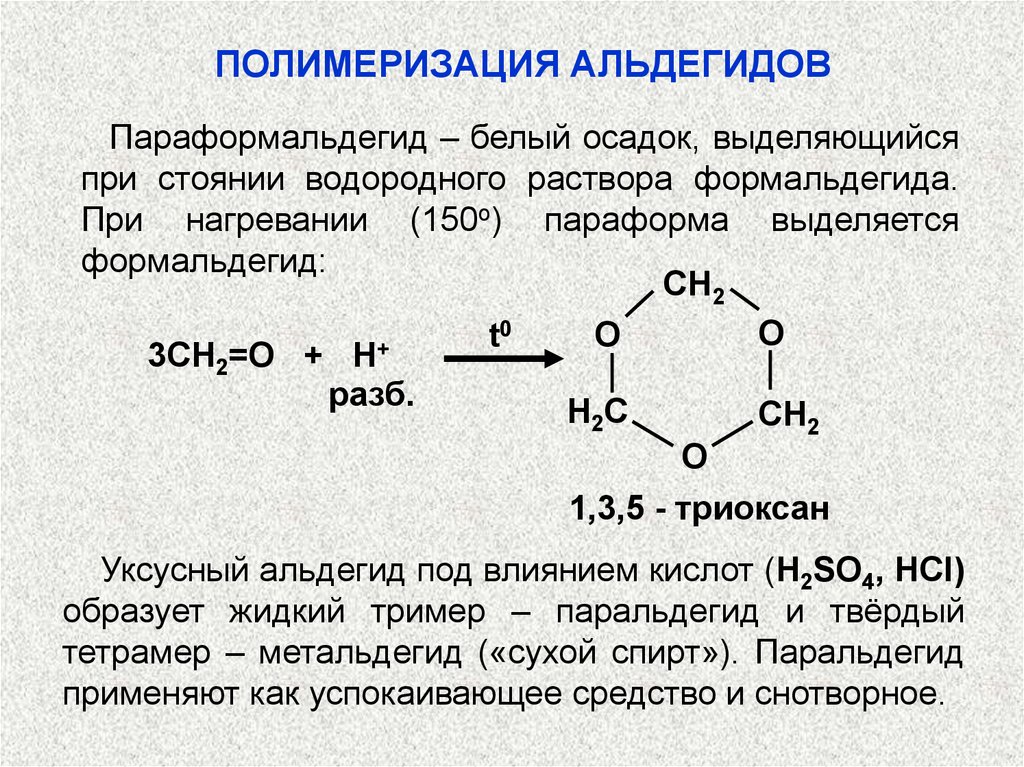
ПОЛИМЕРИЗАЦИЯ АЛЬДЕГИДОВПараформальдегид – белый осадок, выделяющийся
при стоянии водородного раствора формальдегида.
При нагревании (150о) параформа выделяется
формальдегид:
CH2
O
O
t0
+
3CH2=O + H
разб.
H2C
CH2
O
1,3,5 - триоксан
Уксусный альдегид под влиянием кислот (H2SO4, HCl)
образует жидкий тример – паральдегид и твёрдый
тетрамер – метальдегид («сухой спирт»). Паральдегид
применяют как успокаивающее средство и снотворное.

































 Химия
Химия








