Похожие презентации:
Кислоты
1.
Тема презентацииКИСЛОТЫ
2.
Цель урока: познакомиться склассификациями и общими
химическими свойствами кислот.
3. План урока
1. Классификации кислот2. Физические свойства кислот
3. Химические свойства кислот
4.
Na2CO3AlCl3
H2SiO3
Cu(OH)2
H2SO4
CO2
FeO
MgBr2
NiO
HCl
NaOH
Ca(OH)2
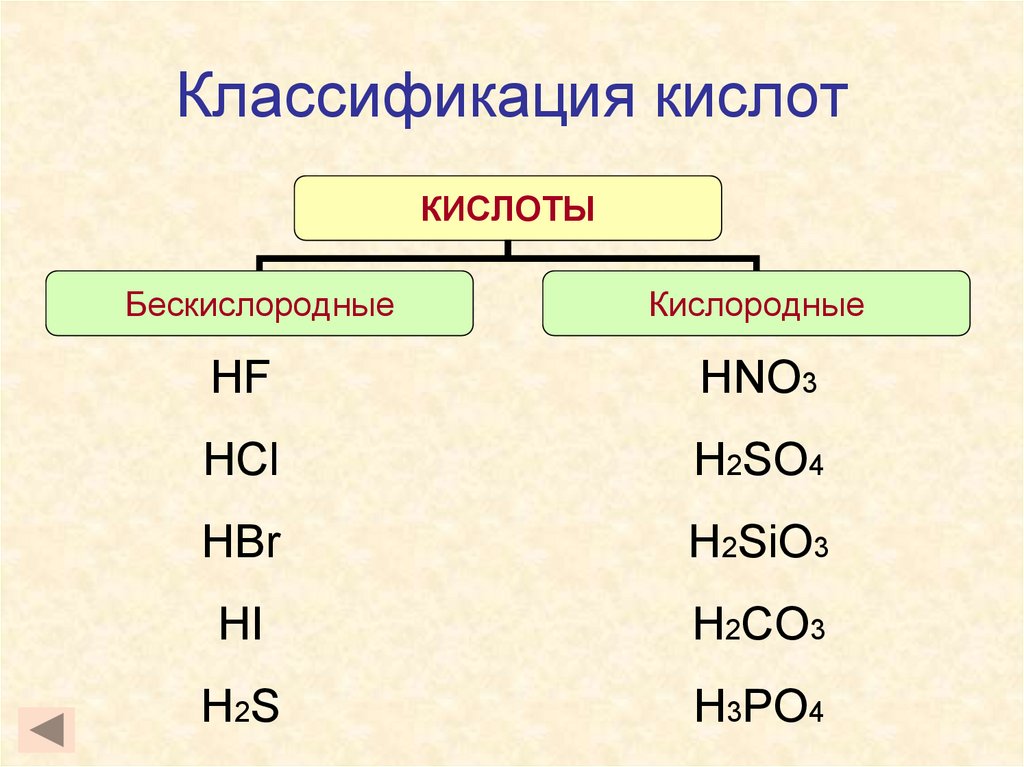
5. Классификация кислот
КИСЛОТЫБескислородные
Кислородные
HF
HNO3
HCl
H2SO4
HBr
H2SiO3
HI
H2CO3
H 2S
H3PO4
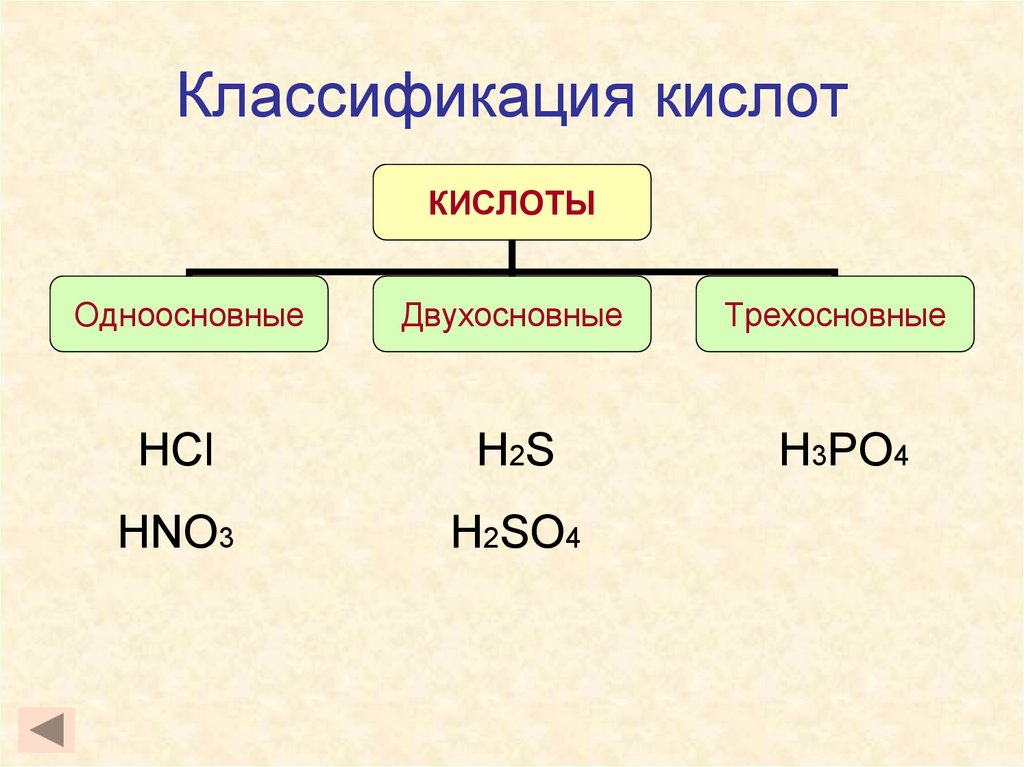
6. Классификация кислот
КИСЛОТЫОдноосновные
Двухосновные
Трехосновные
HCl
H 2S
H3PO4
HNO3
H2SO4
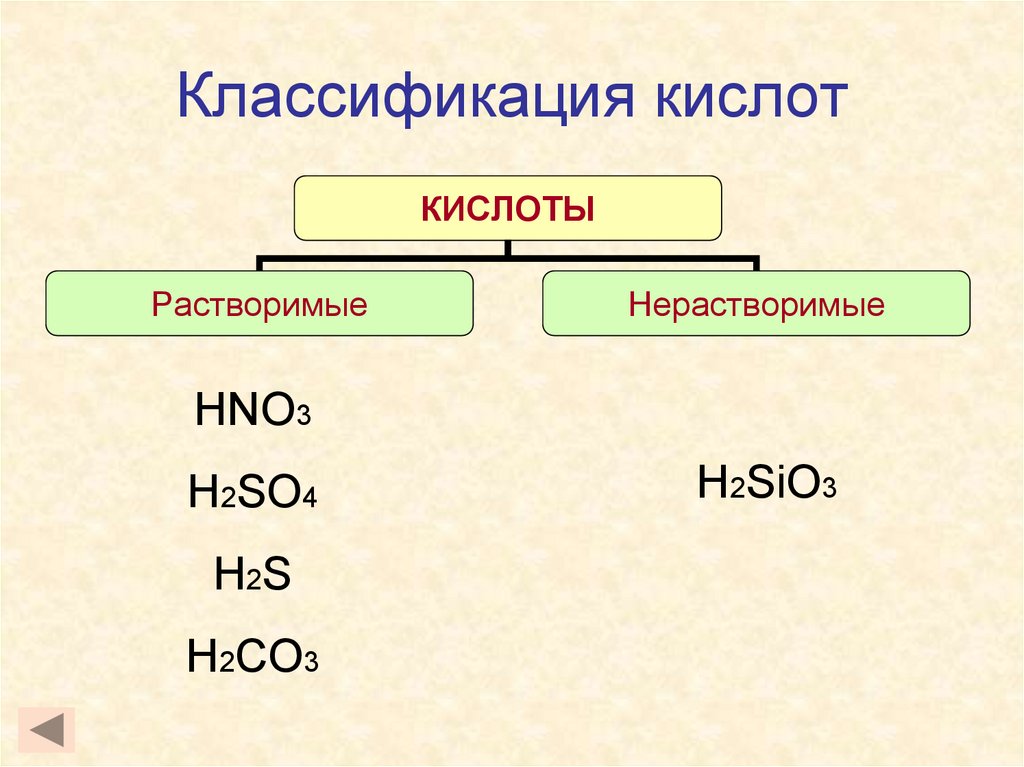
7. Классификация кислот
КИСЛОТЫРастворимые
Нерастворимые
HNO3
H2SO4
H 2S
H2CO3
H2SiO3
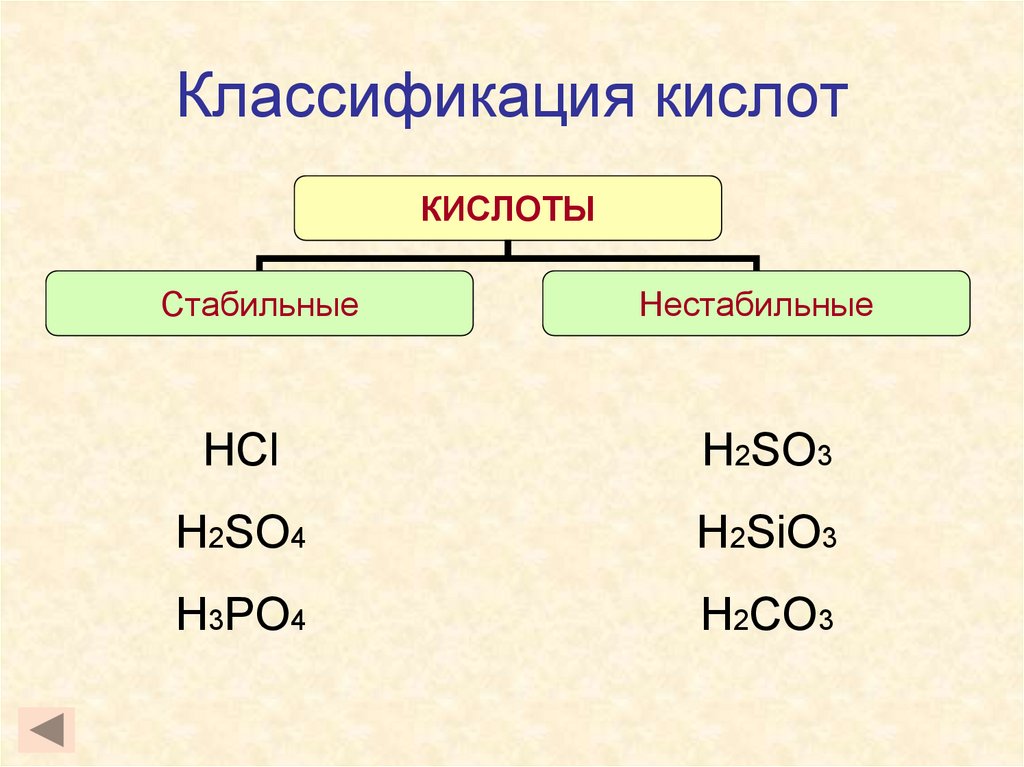
8. Классификация кислот
КИСЛОТЫСтабильные
Нестабильные
HCl
H2SO3
H2SO4
H2SiO3
H3PO4
H2CO3
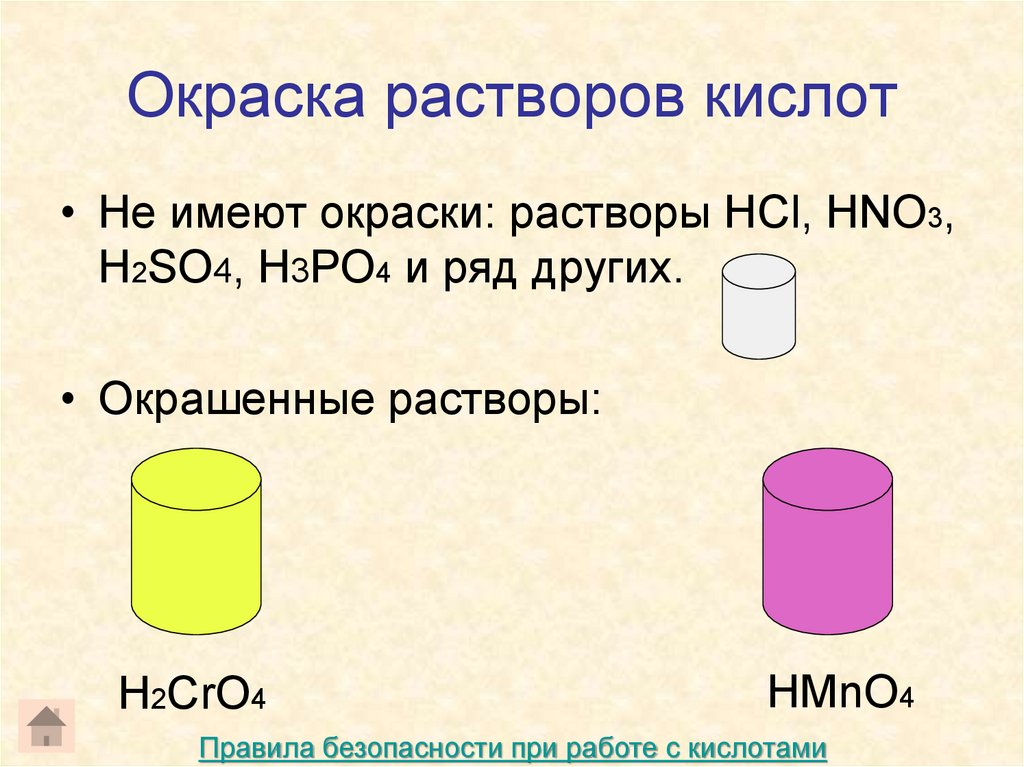
9. Окраска растворов кислот
• Не имеют окраски: растворы HCl, HNO3,H2SO4, H3PO4 и ряд других.
• Окрашенные растворы:
H2CrO4
HMnO4
Правила безопасности при работе с кислотами
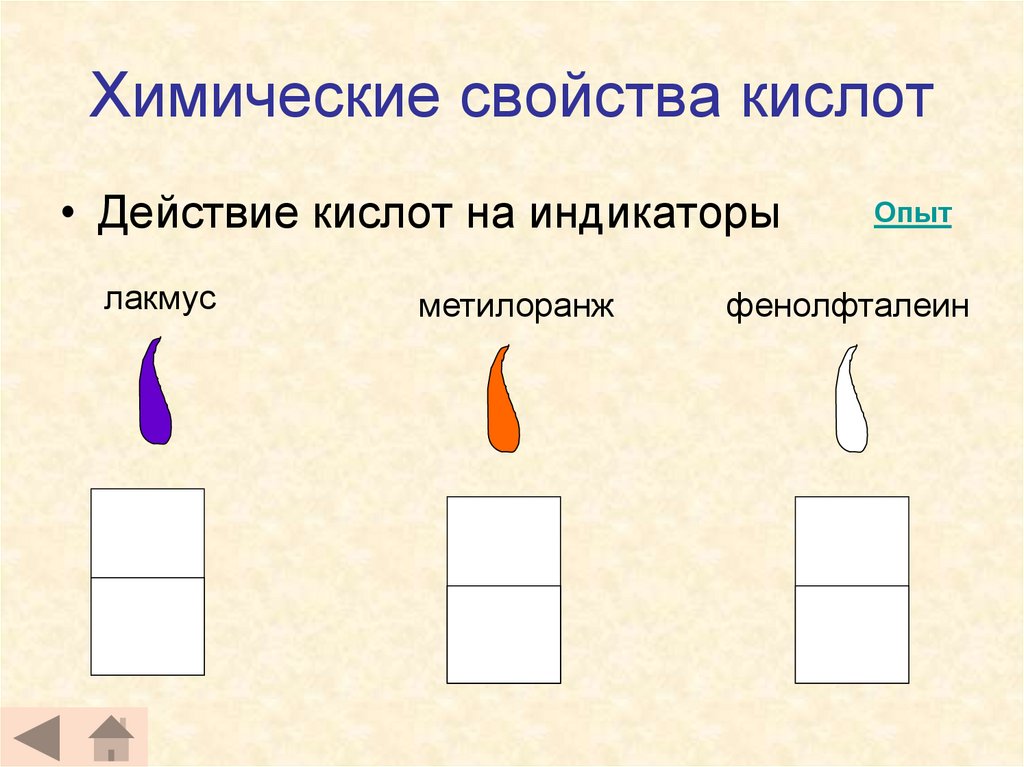
10. Химические свойства кислот
• Действие кислот на индикаторылакмус
метилоранж
Опыт
фенолфталеин
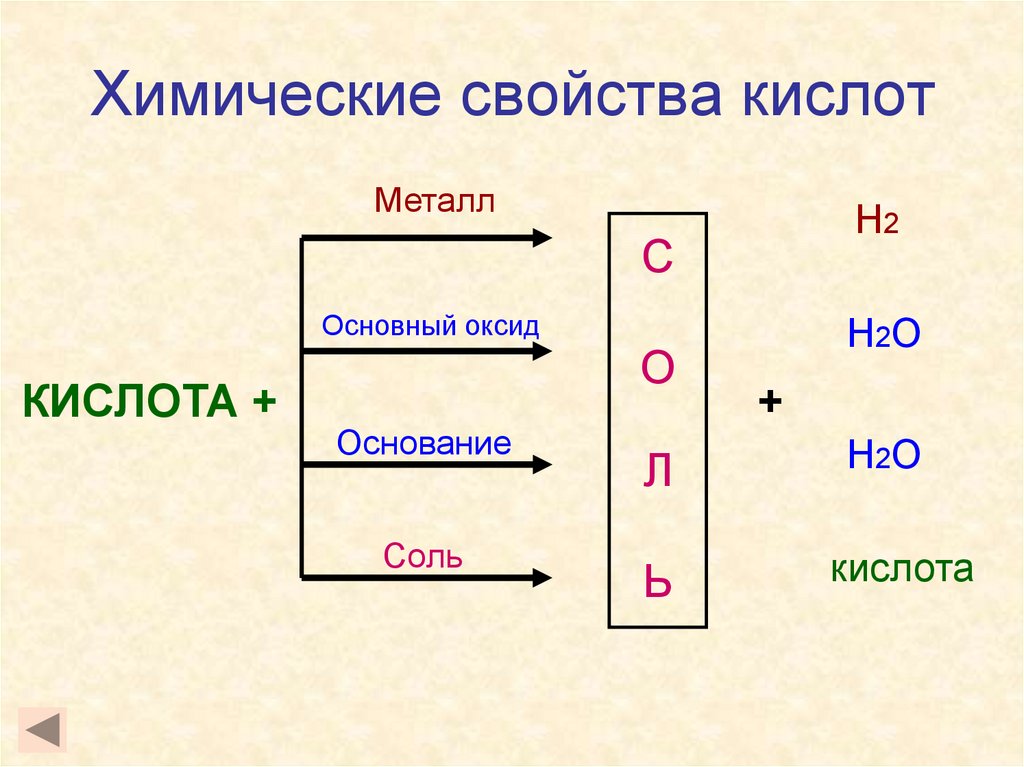
11. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Л
Ь
Н2О
+
Н2О
кислота
12. Химические свойства кислот
• Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие металлов с кислотами
13.
Химические свойства кислот• Кислота + основный оксид = соль + вода
Опыт. Взаимодействие оксида меди (II) с
серной кислотой
СuO + H2SO4 = CuSO4 + H2O
14.
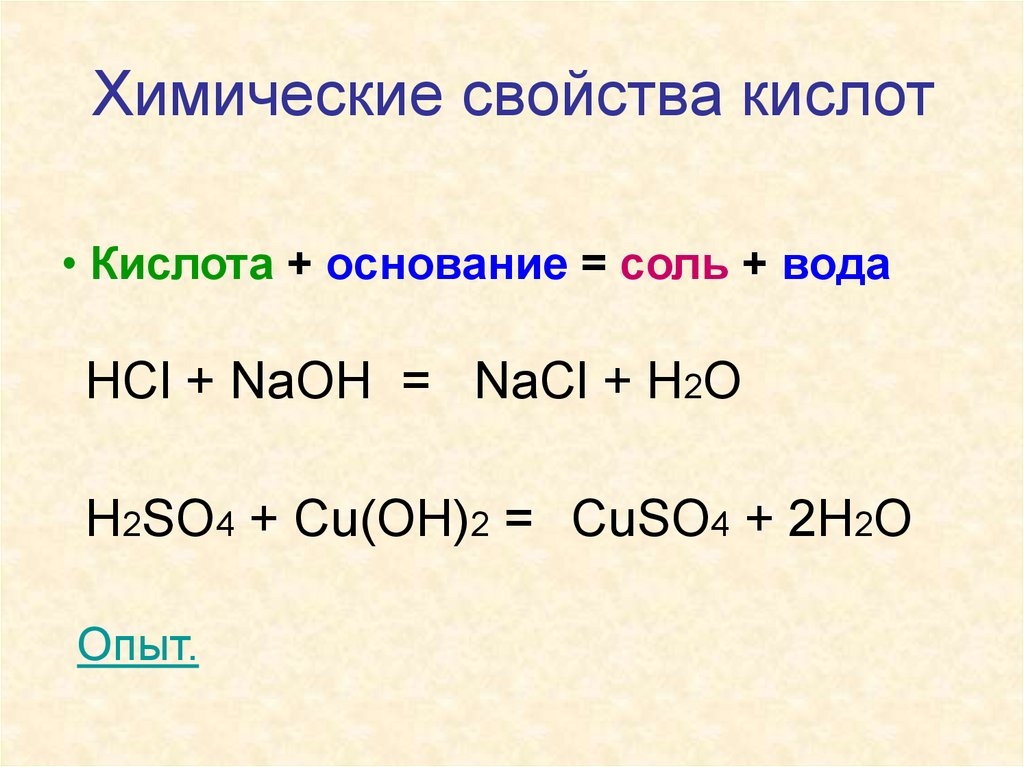
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
Опыт.
15.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
16. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
1) SiО22) LiОН
3) Ва (NО3)2
4) НСI
5) К2О
6) К2 SiО3
7) Н NО3
8) Fе(ОН)3
17. Спасибо за внимание!
18. Информационные источники:
1.3CD-ROM «Химия.8 класс» (Электронный ресурс) – М.
«Просвещение»,2004.
2.
Габриелян О.С. Настольная книга учителя. Химия. 8 класс. М.: Дрофа,
2003
3.
Маркина И.В. Современный урок химии. Ярославль. Академия развития.
2008
4.
Правила техники безопасности при работе с кислотами. Анимация.
http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de0800200c9a66/ch08_20_05.swf
5. http://www.logosib.ru/him/HCl.jpg
6. http://forexaw.com/TERMs/Metal121313/img73211_41_Himicheskie_svoystva_zolota-rastvoryi.jpg









 Химия
Химия








