Похожие презентации:
Кислоты. Общая характеристика, химические свойства
1.
КИСЛОТЫ.Общая
характеристика,
химические свойства.
2.
Цель урока: познакомиться склассификациями и общими
химическими свойствами кислот.
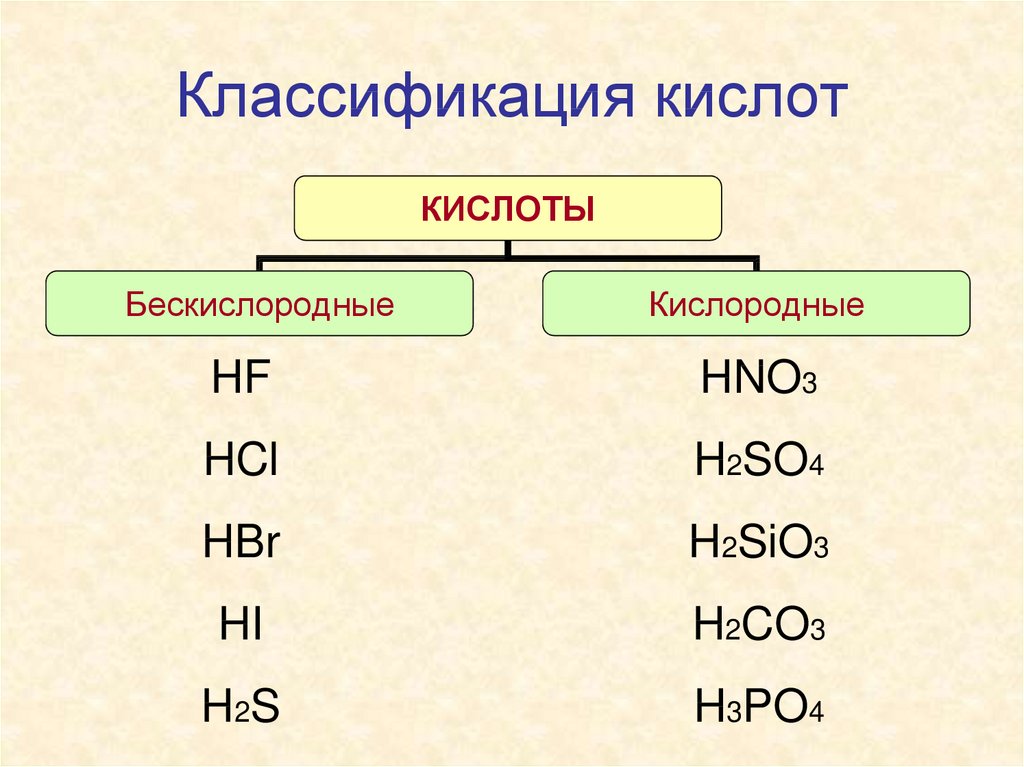
3. Классификация кислот
КИСЛОТЫБескислородные
Кислородные
HF
HNO3
HCl
H2SO4
HBr
H2SiO3
HI
H2CO3
H 2S
H3PO4
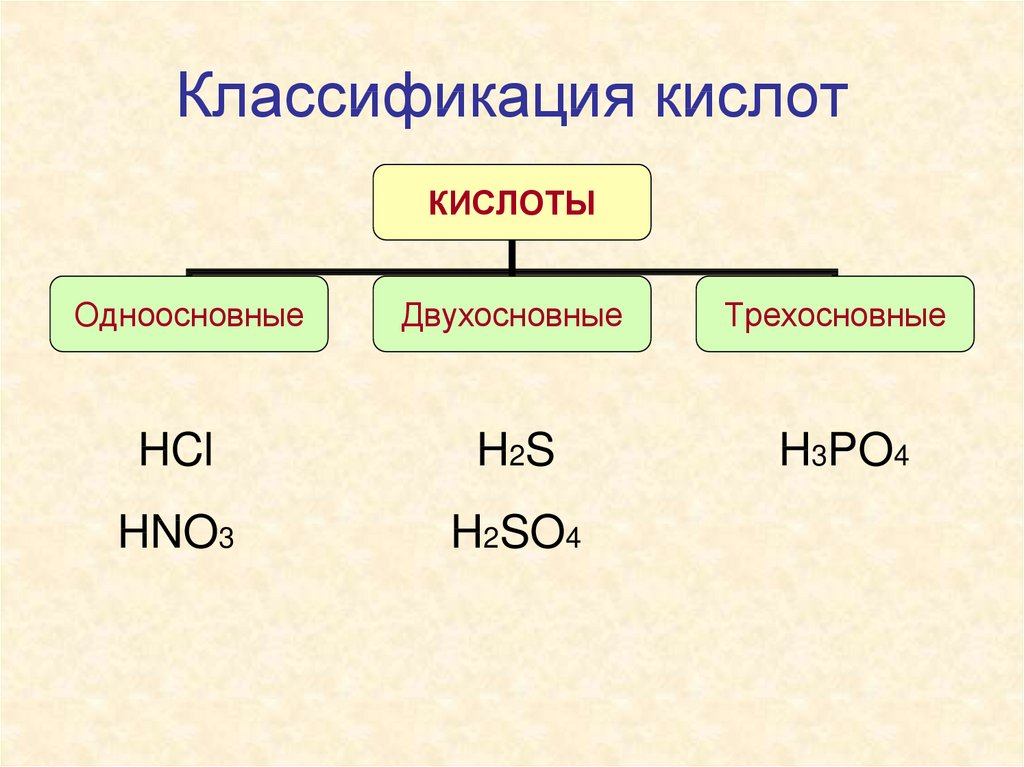
4. Классификация кислот
КИСЛОТЫОдноосновные
Двухосновные
Трехосновные
HCl
H 2S
H3PO4
HNO3
H2SO4
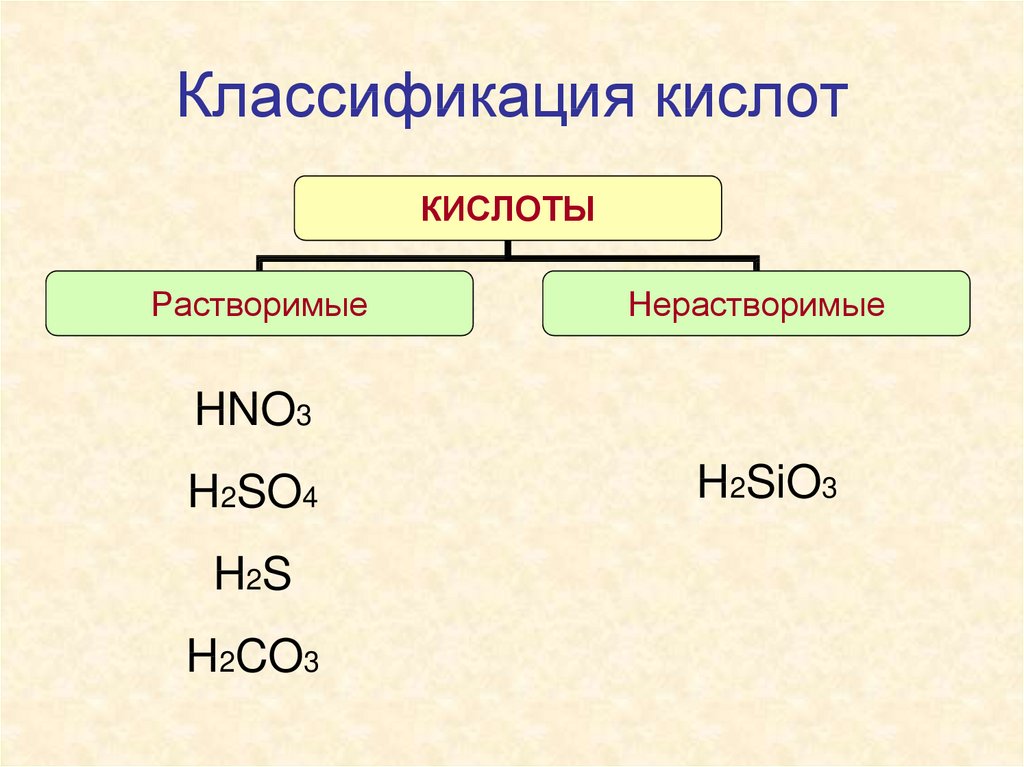
5. Классификация кислот
КИСЛОТЫРастворимые
Нерастворимые
HNO3
H2SO4
H 2S
H2CO3
H2SiO3
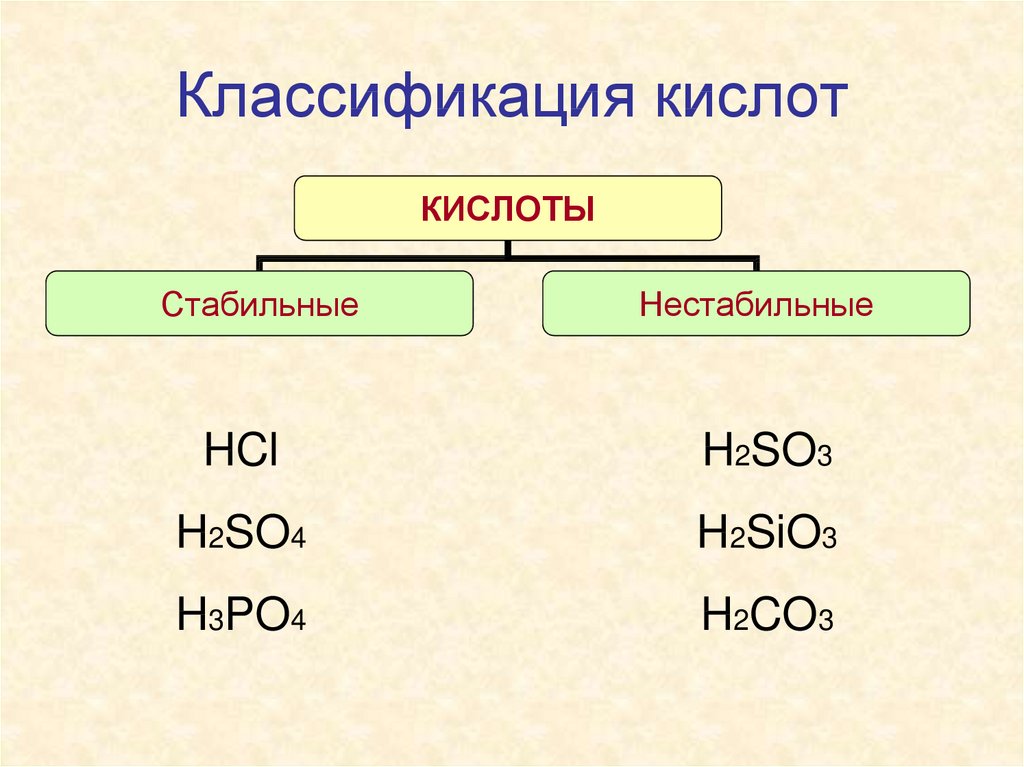
6. Классификация кислот
КИСЛОТЫСтабильные
Нестабильные
HCl
H2SO3
H2SO4
H2SiO3
H3PO4
H2CO3
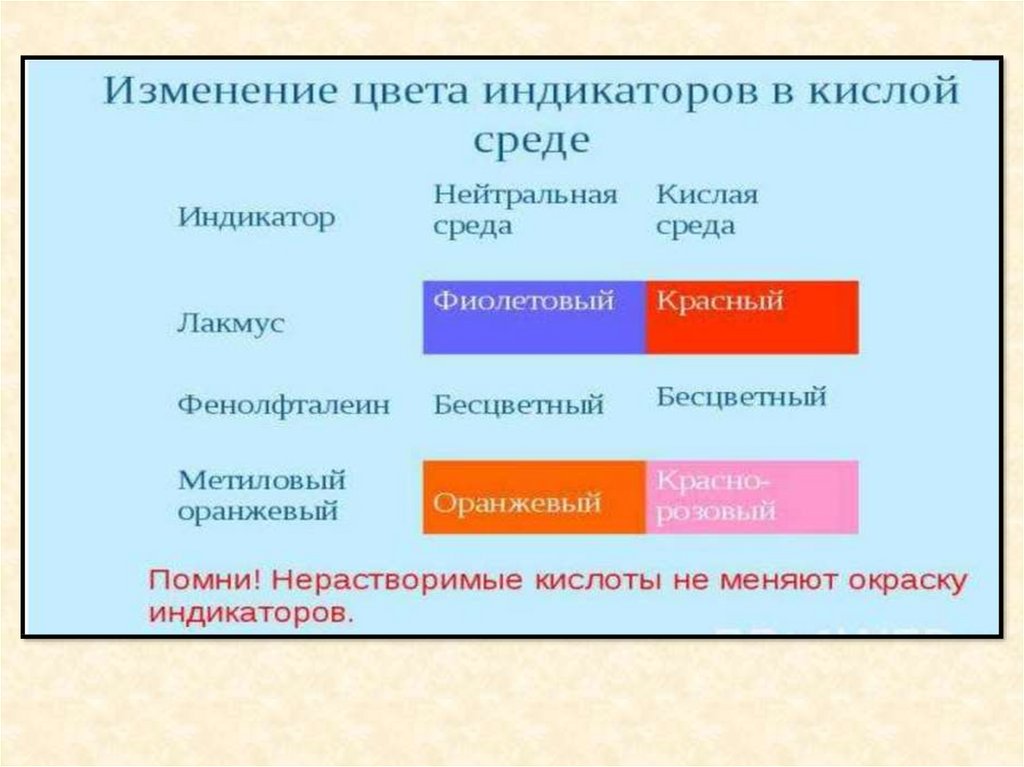
7.
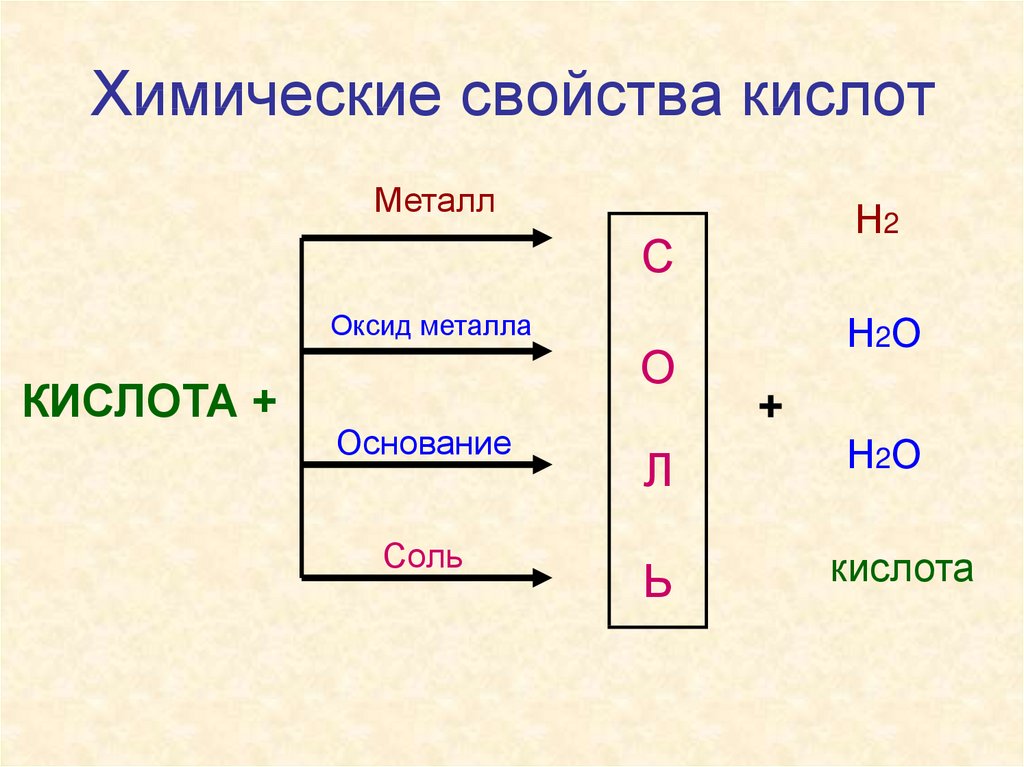
8. Химические свойства кислот
МеталлН2
С
Оксид металла
КИСЛОТА +
О
Основание
Соль
Л
Ь
Н2О
+
Н2О
кислота
9. Химические свойства кислот
• Кислота + металл = соль + водород(металл в ряду активности должен находиться левее водорода, а
получившаяся соль должна быть растворимой!)
Ряд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
10.
Химические свойства кислот• Кислота + оксид металла = соль + вода
СuO + H2SO4 = CuSO4 + H2O
11.
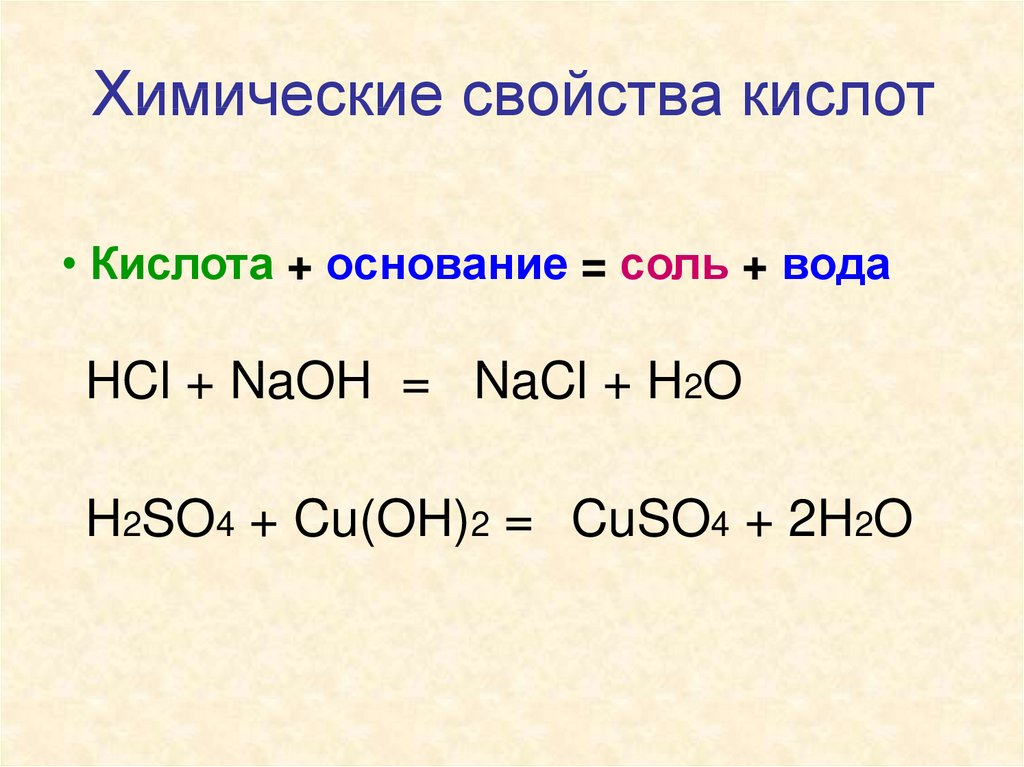
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
12.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
↓
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
13. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Если реакция невозможна,
объясните причину.1) SiО2
2) LiОН
3) Ва (NО3)2
4) НСI
5) К2О
6) К2 SiО3
7) Н NО3
8) Fе(ОН)3






 Химия
Химия








