Похожие презентации:
Классификация кислот, химические свойства кислот
1.
2.
Тема урокаКлассификация
кислот, химические
свойства кислот
3. План изучения нового материала: 1.Состав и классификация кислот 2. Физические свойства кислот 3.Химические свойства кислот 4.
Цели:Образовательные:
изучить состав, классификацию кислот;
изучить физические и химические свойства кислот.
Развивающие:
развивать практические навыки;
развивать логическое мышление путем сравнения, обобщения,
систематизации, анализа;
учить выделять причинно-следственные связи.
Воспитательные
развивать взаимосвязь между предметами;
развивать знания о применении химии в быту;
План изучения нового материала:
1.Состав и классификация кислот
2. Физические свойства кислот
3.Химические свойства кислот
4. Применение кислот
4.
К0Приложение.
К5
5
Применение
4
Химические свойства
3
1
2
1
1
Физические свойства
К1
Классификации
Состав
КИСЛОТЫ
К2
К4
К3
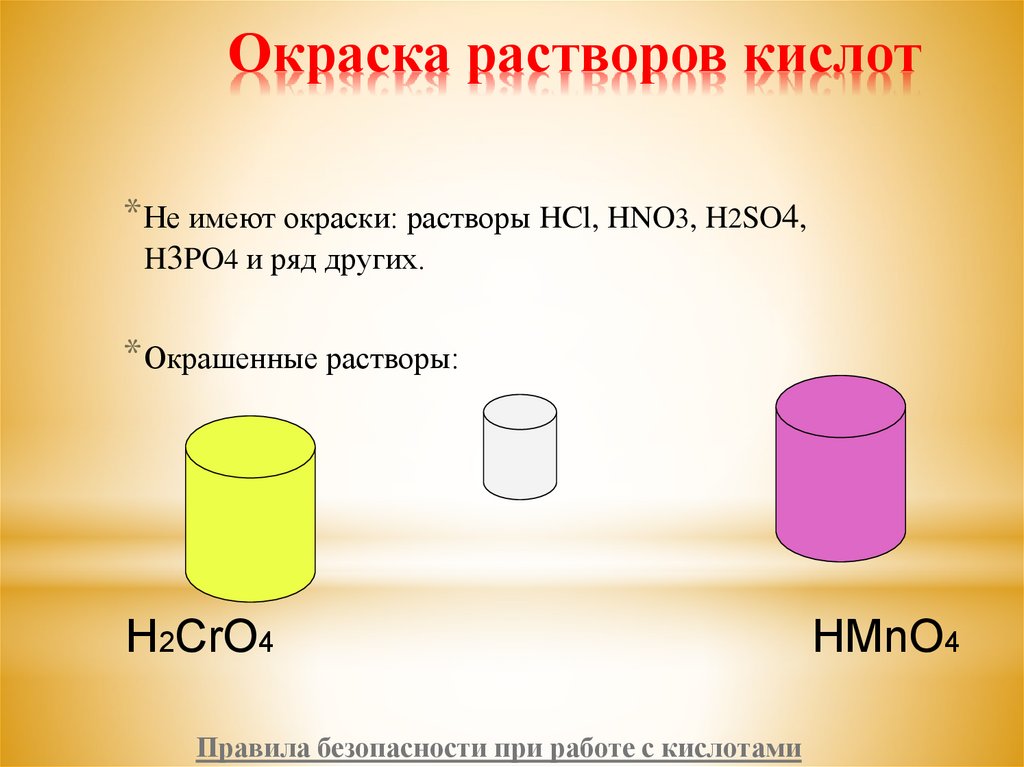
5. Окраска растворов кислот
* Не имеют окраски: растворы HCl, HNO3, H2SO4,H3PO4 и ряд других.
* Окрашенные растворы:
H2CrO4
Правила безопасности при работе с кислотами
HMnO4
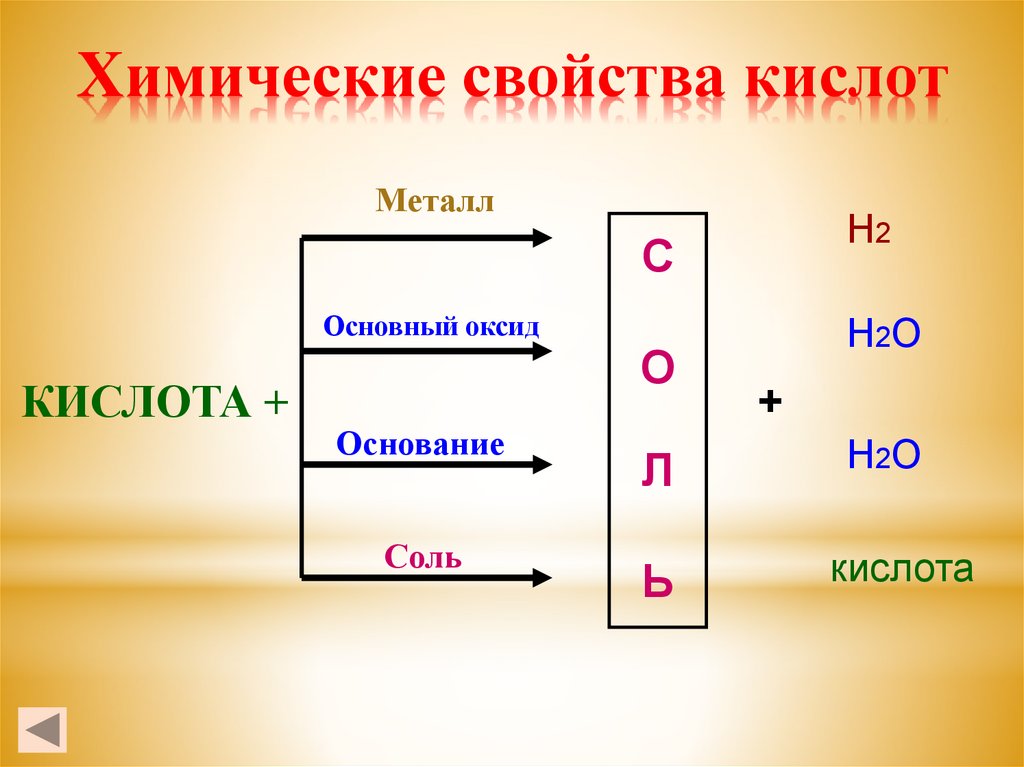
6. Химические свойства кислот
* Действие кислот на индикаторылакмус
метилоранж
Опыт
фенолфталеин
7. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Л
Ь
Н2О
+
Н2О
кислота
8. Химические свойства кислот
* Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
Опыт 1. Взаимодействие цинка с соляной кислотой
Опыт 2. Взаимодействие металлов с кислотами
9.
Химические свойства кислотКислота + основный оксид = соль + вода
Опыт. Взаимодействие оксида меди (II) с
серной кислотой
СuO + H2SO4 = CuSO4 + H2O
10.
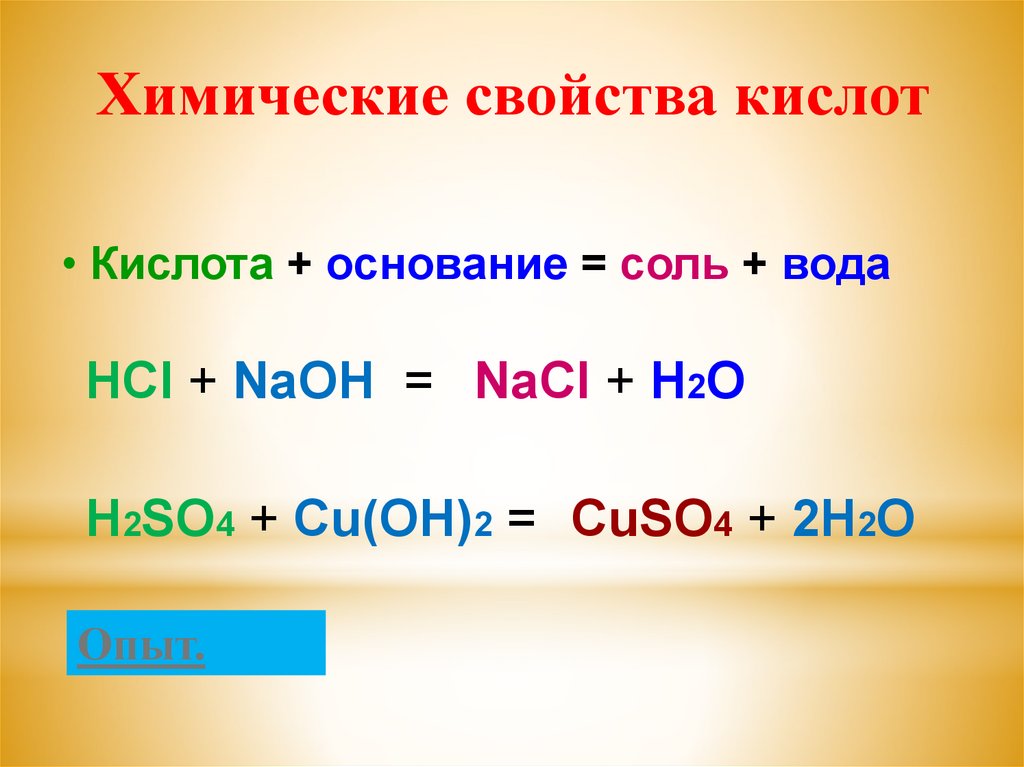
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
Опыт.
11.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2
12.
Приложение 1.К0
К5
К1
5
Применение
В металлургии
4
Химические свойства
В народном хозяйстве
3
1
2
1
1
Физические свойства
В сельском хозяйстве
В пищевой промышленности
Классификации
О (?)
Э
Состав
Н
В медицине
КИСЛОТЫ
Действие на
индикаторы
С металлами
С оксидами металлов
С основаниями
С солями
• Кислородосодержащие
• Бескислородные
• Одноосновные
• Двухосновные
Агрегатное
• Трехосновные
состояние
• Растворимые
• Нерастворимые
Цвет
• Сильные
Запах
• Слабые
Вкус
К4
К3
К2
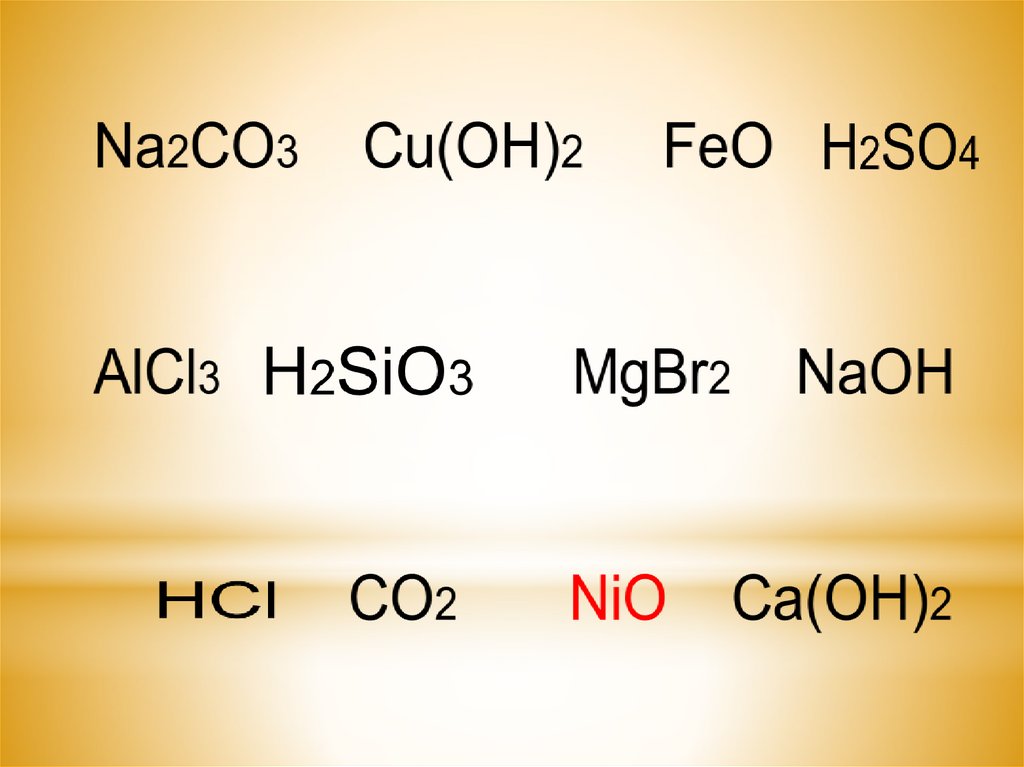
13. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
1) SiО22) LiОН
3) Ва (NО3)2
4) НСI
5) К2О
6) К2 SiО3
7) Н NО3
8) Fе(ОН)3
А
К
А
С
Л
И
О
Й
14. Информационные источники
1. Габриелян О.С. Настольная книга учителя. Химия. 8класс. М.: Дрофа, 2003
2.Правила техники безопасности при работе с кислотами.
Анимация. http://files.schoolcollection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de0800200c9a66/ch08_20_05.swf
3.Воскобойникова Н. П., Галыгина Л. В., Галыгина И. В.
К вопросу о педагогических технологиях и системах
обучения // Химия в школе. — 2002. — № 2.










 Химия
Химия








