Похожие презентации:
Кислоты
1.
Тема презентацииКИСЛОТЫ
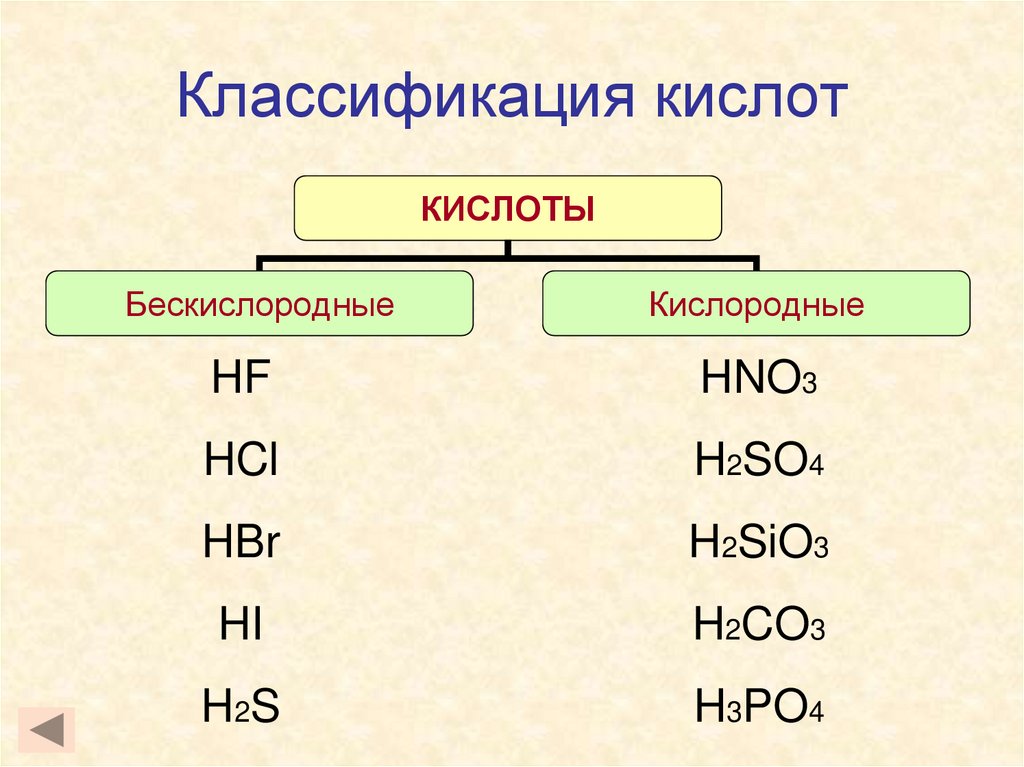
2. Классификация кислот
КИСЛОТЫБескислородные
Кислородные
HF
HNO3
HCl
H2SO4
HBr
H2SiO3
HI
H2CO3
H 2S
H3PO4
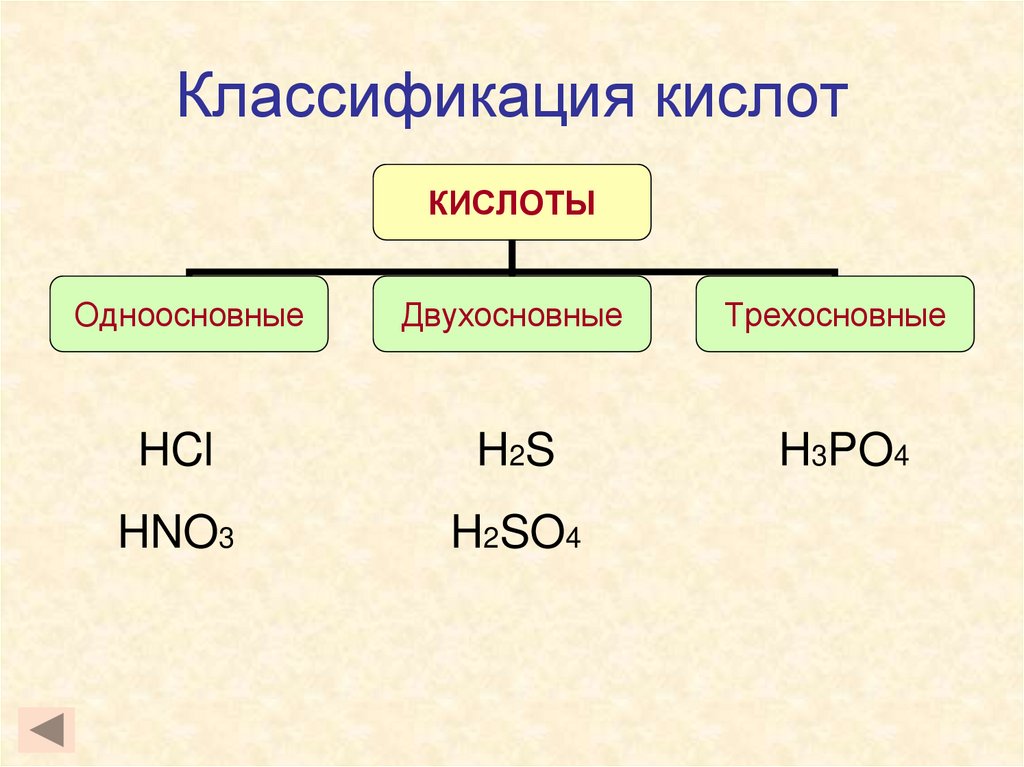
3. Классификация кислот
КИСЛОТЫОдноосновные
Двухосновные
Трехосновные
HCl
H 2S
H3PO4
HNO3
H2SO4
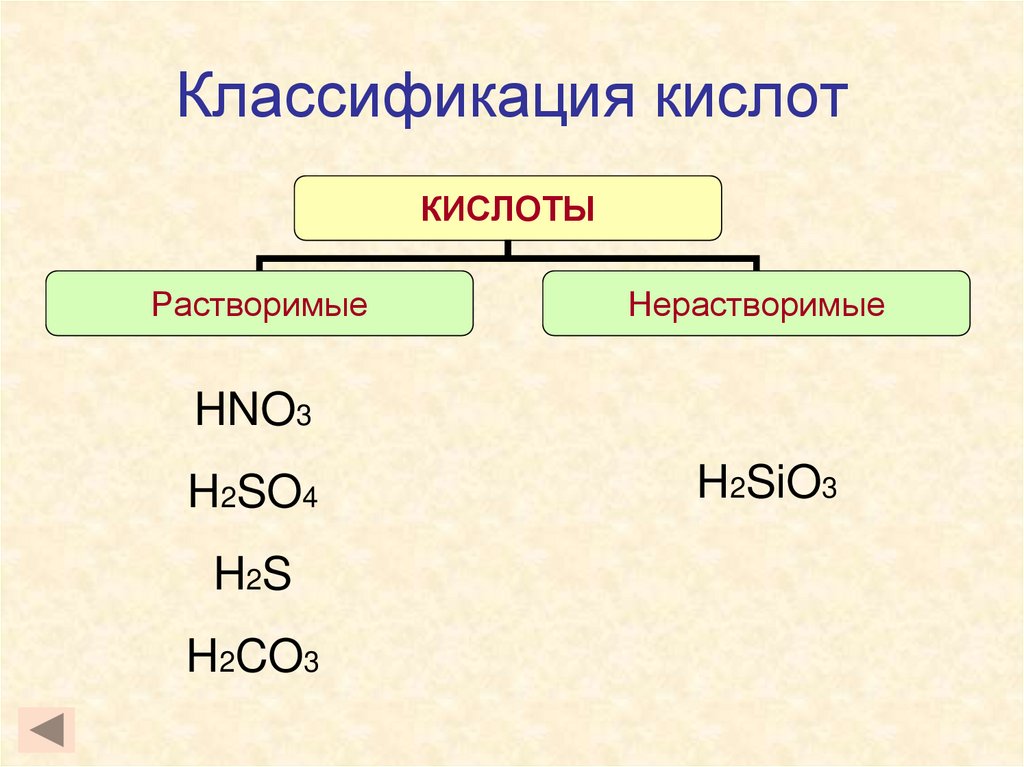
4. Классификация кислот
КИСЛОТЫРастворимые
Нерастворимые
HNO3
H2SO4
H 2S
H2CO3
H2SiO3
5. Классификация кислот
КИСЛОТЫСтабильные
Нестабильные
HCl
H2SO3
H2SO4
H2SiO3
H3PO4
H2CO3
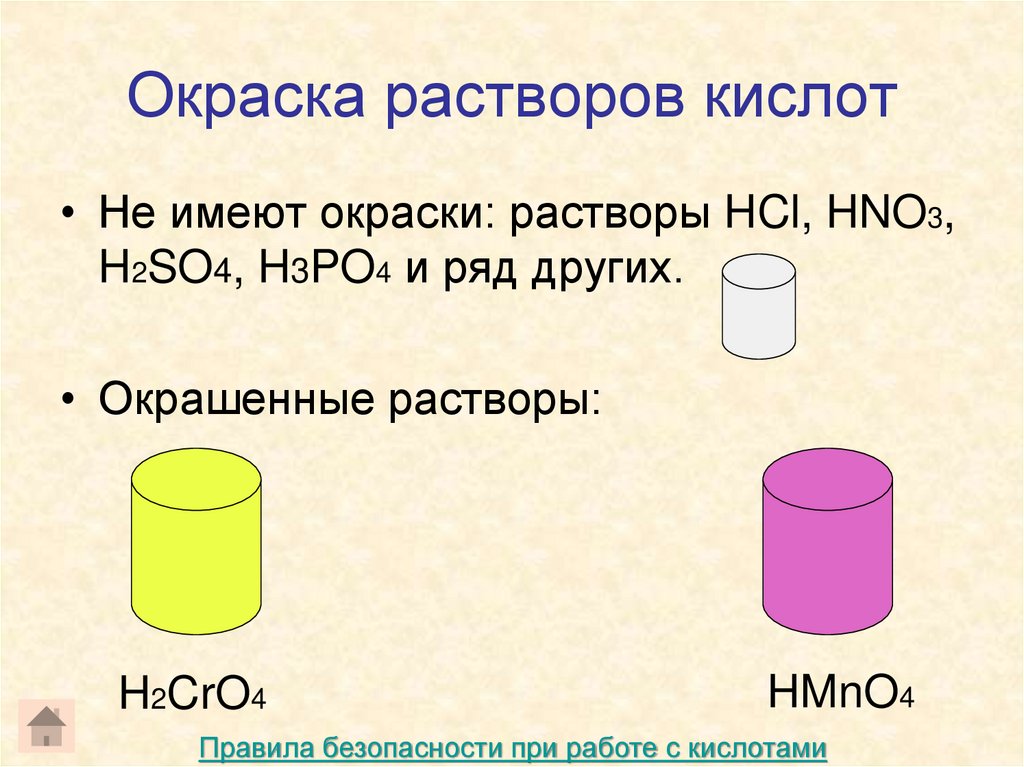
6. Окраска растворов кислот
• Не имеют окраски: растворы HCl, HNO3,H2SO4, H3PO4 и ряд других.
• Окрашенные растворы:
H2CrO4
HMnO4
Правила безопасности при работе с кислотами
7. Химические свойства кислот
• Действие кислот на индикаторылакмус
метилоранж
Опыт
фенолфталеин
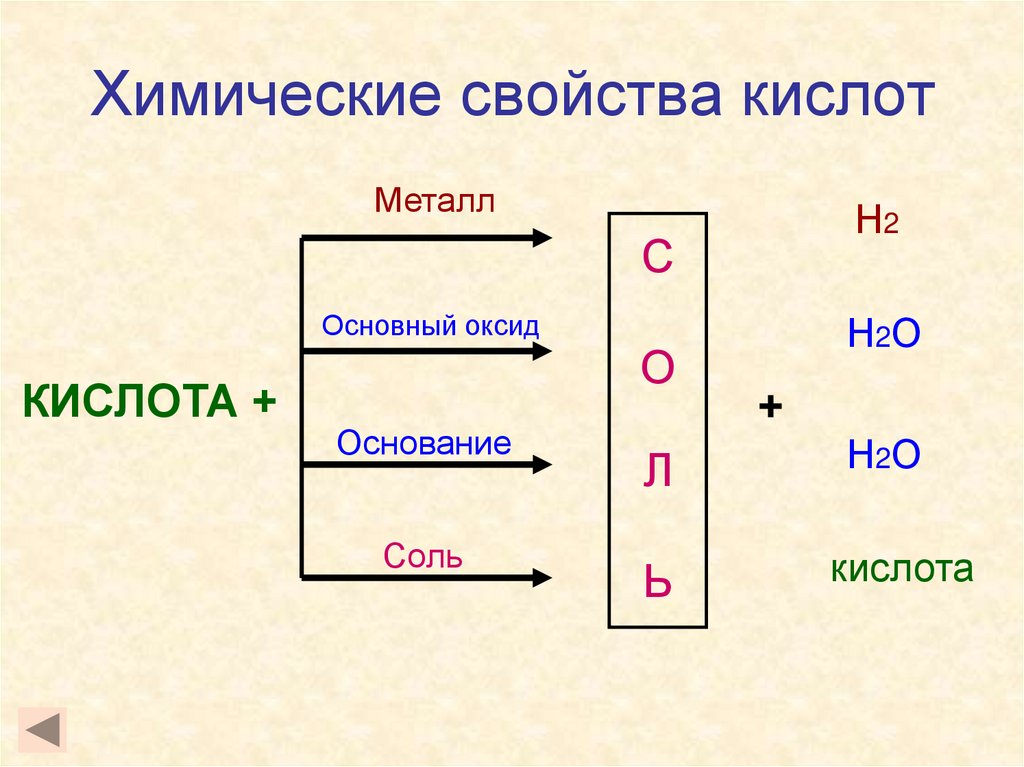
8. Химические свойства кислот
МеталлН2
С
Основный оксид
КИСЛОТА +
О
Основание
Соль
Н2О
+
Л
Н2О
Ь
кислота
9. Химические свойства кислот
• Кислота + металл = соль + водородРяд активности металлов:
Li K Ba Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
Активность металлов уменьшается
10.
Химические свойства кислот• Кислота + основный оксид = соль + вода
СuO + H2SO4 = CuSO4 + H2O
11.
Химические свойства кислот• Кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
12.
Химические свойства кислот• Кислота 1 + соль 1 = соль 2 + Кислота 2
Условия реакции:
1. Если образуется осадок ↓:
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2. Если выделяется газ:
2 HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2








 Химия
Химия








