Похожие презентации:
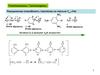
Амины
1.
..NH2
Амины
Алифатические
амины ..
..
С2Н5NH2
Этанамин
(первичный амин )
Н3C
С2Н5NHCH3
Н3C
..
N
..
NH2
CH(CH3)2
N-Метилэтанамин
N,N-диметилпропан-2-амин Циклопентанамин
(первичный амин )
(вторичный амин )
(третичный амин )
Ароматические амины
..
NH2
..
NH
CH3
Анилин
Фенил(п-толил)амин
(первичный амин )
(вторичный амин )
Алкилароматические амины
..
NHСН3
..
..
H2N
NH2
п-Фенилендиамин
(двупервичный диамин)
..
NH2
-Нафтиламин
(первичный амин )
..
N(СН3)2
N,N-Диметил- -нафтиламин
N-Метиланилин
(третичный амин )
(вторичный амин )
Моноамины, диамины, …, полиамины.
1
2.
Способы полученияВосстановление азотсодержащих соединений
СН3
СН3
H2, Ni
NO2
Нитробензол
NH2
п-Нитротолуол
1) Sn, HCl
2) NaOH
;
NO2
NH2
Анилин
п-Толуидин
O
H3C
N
C
H3C
CH3
N
CH2
NOH
1) LiAlH4, эфир H
2) H3O+
CH3
LiAlH4
N-Метил-N-фе- эфир
нилацетамид
СH3CH2CH2CN
Бутанонитрил
N-МетилN-этиланилин
LiAlH4
Оксим циклогексанона
NH2
Циклогексиламин
СH3CH2CH2СН2NH2
Бутиламин
2
3.
Алкилирование аммиака и аминовСH3CH2Br
+
_
+
[CH3CH2NH3] Br
NH3
NH3(изб)
СH3CH2Br + CH3CH2NH2
_
+
[CH3CH2NH2CH2CH3] Br
СH3CH2Br + (C2H5)2NH
+
[(C2H5)2NHCH2CH3] Br
CH3CH2NH2
Этиламин
NaOH
+
NH4Br
(CH3CH2)2NH + NaBr + H2O
Диэтиламин
NaOH
(CH3CH2)3N + NaBr + H2O
Триэтиламин
Реакция переалкилирования
СH3CH2Br
+
(C2H5)3N
+
[(C2H5)3NCH2CH3] Br
Тетраэтиламмоний
бромид
Аминолиз (алкилирование аммиака и аминов спиртами)
NH3
ROH
Al2O3, T
RNH2
ROH
Al2O3, T
R2NH
ROH
Al2O3, T
R3N
Процесс неселективный
3
4.
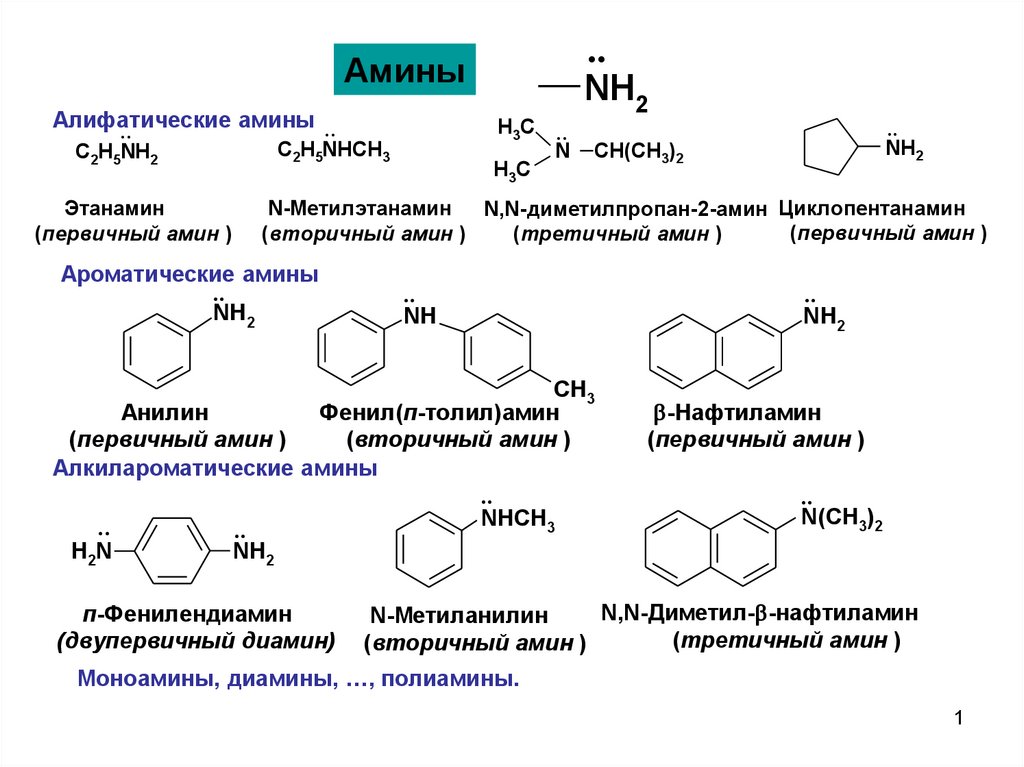
Синтез первичных аминов по ГабриэлюO
O
O
NK + X R
..
NH2NH2.H2O
N R
C2H5OH
ДМФА
O
NH
+
CH
CH2 2
ДМФА
OH
C2H5OH
HO
NH
O
1,2,3,4-тетрагидро1,4-фталазиндион
O
NH
+
OH
дофамин-нейромедиатор, гормон
(вызывает чувство удовольствия)
OH
OH
O
NH2
CH2
CH
N CH2 2
80-100 ОС
OH
4-(2-бромэтил)бенз1,2-диол
CH2
NH2NH2.H2O
NH
+
O
Br
фталимид К
R NH2
R
O
O
O
NH2
NH
O
N-алкилфталимид
NK
O
NH
1,2,3,4-тетрагидро1,4-фталазиндион
O
4
5.
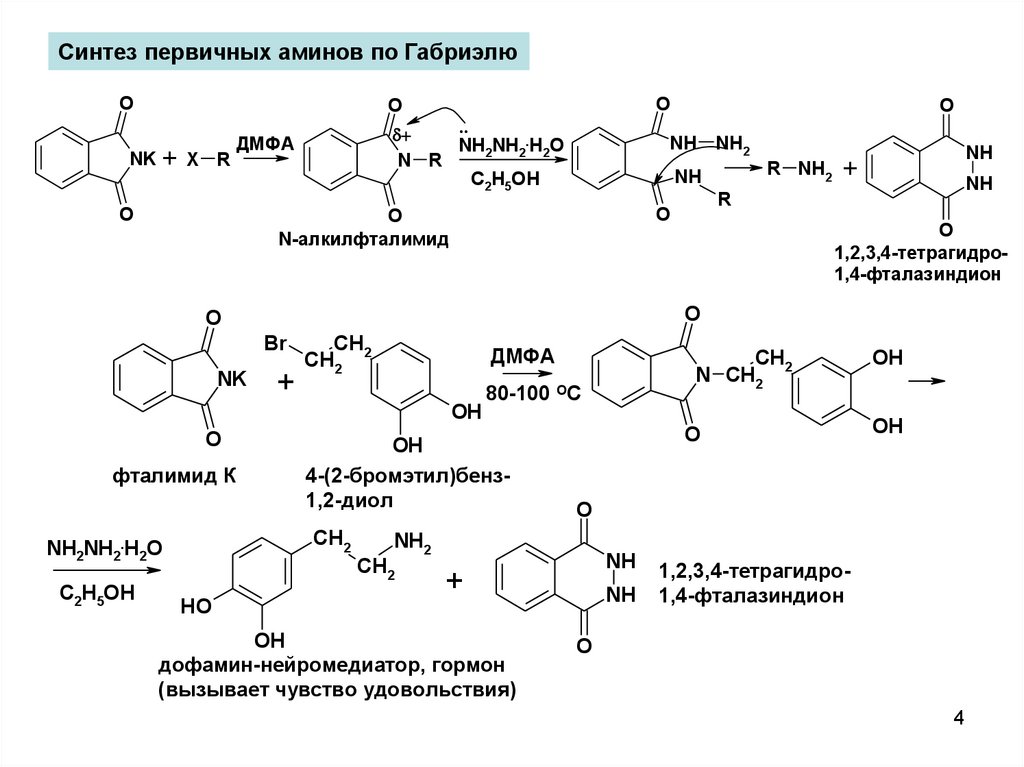
Восстановительное аминирование карбонилсодержащих соединенийNi
C6H5 CH2 CH CH3 1-фенилпропан-2-амин
(фенамин, амфетамин)
NH2
стимулятор центральной нервной системы
C6H5 CH2 C CH3 + NH3 + H2
O
Механизм
R'
R
+
- H2O
NH3
O
R'
R
NH
H
H2 / Ni
H2N
R
R'
имин
Перегруппировка Гофмана
NaOH,Cl2,H2O
CH3
O
0-20 C
C6H5 CH2 C NH2 (фентерамин - препарат для
C6H5 CH2 C C NH2
уменьшения веса)
CH3
CH3
2,2-диметил-32-метил-1-фенилфенилпропанамид
пропан-2-амин
H3C O
5
6.
R ..N
H
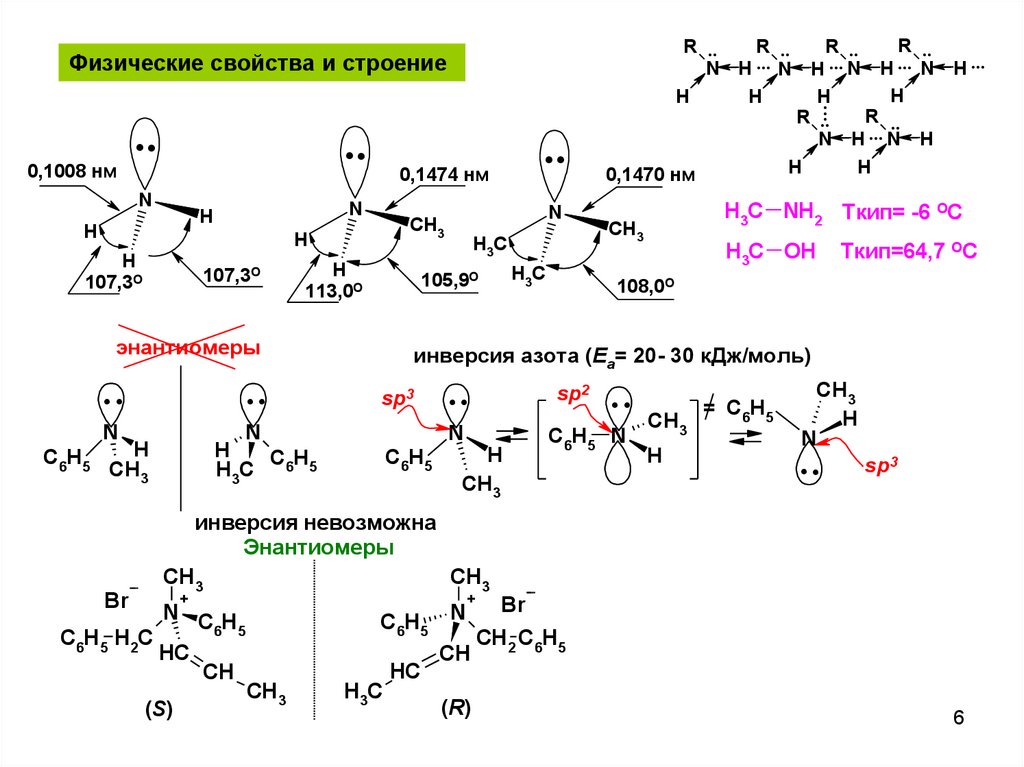
Физические свойства и строение
..
..
0,1008 нм
N
H
0,1474 нм
N
H
107,3О
H
113,0О
C6H5
..
N
N
H
CH3
Br
H3C
sp3
..
N
C6H5
+
(S)
H ...
H3C NH2 Ткип= -6 ОС
CH3
H3C OH
Ткип=64,7 ОС
108,0О
sp2
H
CH3
инверсия невозможна
Энантиомеры
CH3
CH3
C6H5
CH3
H.
R ....
N
H
0,1470 нм
R ..
...
H N
H
R ..
H ... N H
H
R ..
H ... N
инверсия азота (Еа= 20- 30 кДж/моль)
H
CH
H3C 6 5
N CH
6 5
C6H5 H2C
HC
CH
H3C
105,9О
энантиомеры
..
N
CH3
H
H
107,3О
..
R ..
H ... N
H
H3C
HC
N
+
CH
(R)
..
C6H5 N
CH3
H
= C6H5
CH3
H
N
..
sp3
Br
CH2 C6H5
6
7.
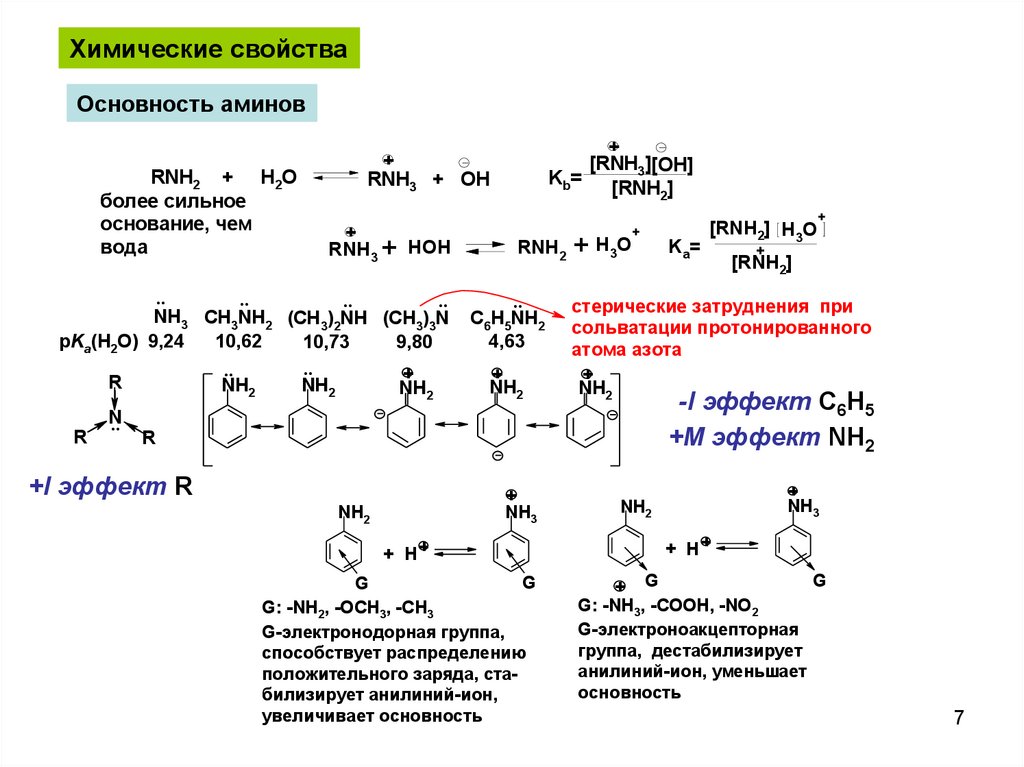
Химические свойстваОсновность аминов
RNH2 + H2O
более сильное
основание, чем
вода
R
+
+
RNH3 + HOH
..
..
..
..
NH3 CH3NH2 (CH3)2NH (CH3)3N
pKa(H2O) 9,24
10,62
10,73
9,80
..
..
+
R
NH2
NH2
NH2
N
..
+
[RNH3][OH]
Kb=
[RNH2]
+
RNH3 + OH
RNH2
..
C6H5NH2
4,63
+
NH2
+
+ H 3O
+
NH3
NH2
+ H+
G
G
G: -NH2, -OCH3, -CH3
G-электронодорная группа,
способствует распределению
положительного заряда, стабилизирует анилиний-ион,
увеличивает основность
+
[RNH2]
стерические затруднения при
сольватации протонированного
атома азота
+
NH2
-I эффект C6H5
+M эффект NH2
R
+I эффект R
Ka=
[RNH2] H3O
+
NH3
NH2
+ H+
G
+ G
G: -NH3, -COOH, -NO2
G-электроноакцепторная
группа, деcтабилизирует
анилиний-ион, уменьшает
основность
7
8.
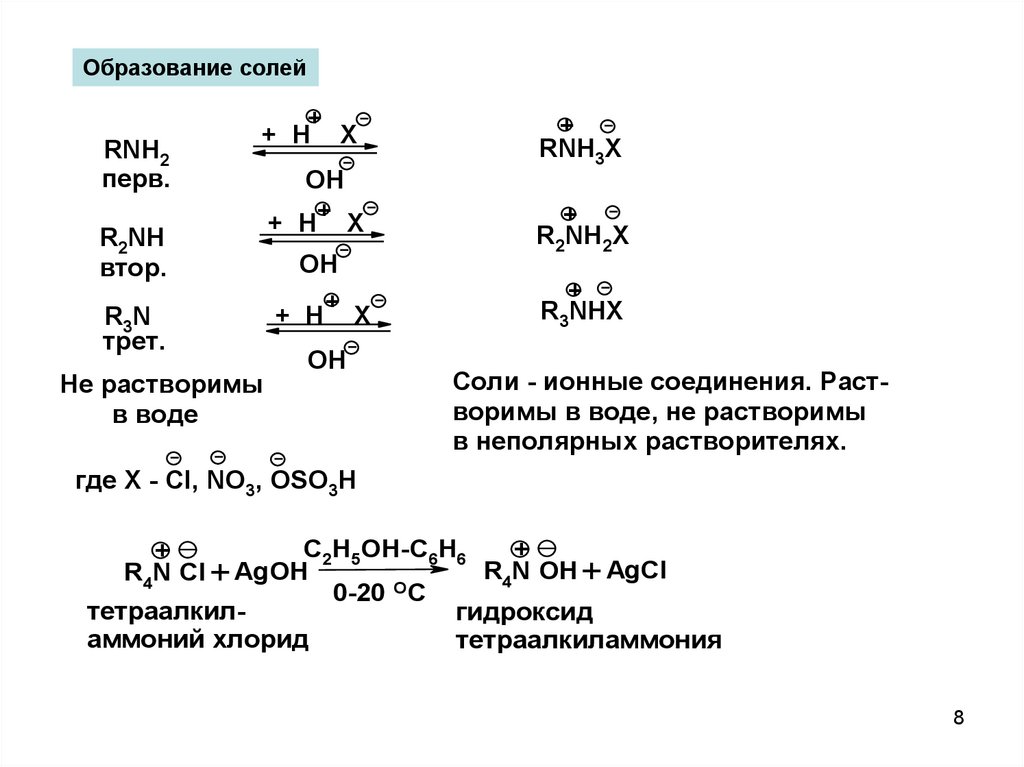
Образование солейRNH2
перв.
+
+ H X
R2NH
втор.
R3N
трет.
Не растворимы
в воде
OH
+ H+ X
OH
+
+ H X
OH
+
RNH3X
+
R2NH2X
+
R3NHX
Соли - ионные соединения. Растворимы в воде, не растворимы
в неполярных растворителях.
где X - Cl, NO3, OSO3H
C2H5OH-C6H6
+
+
R
N
OH + AgCl
AgOH
R4N Cl +
4
O
0-20 C
тетраалкилгидроксид
аммоний хлорид
тетраалкиламмония
8
9.
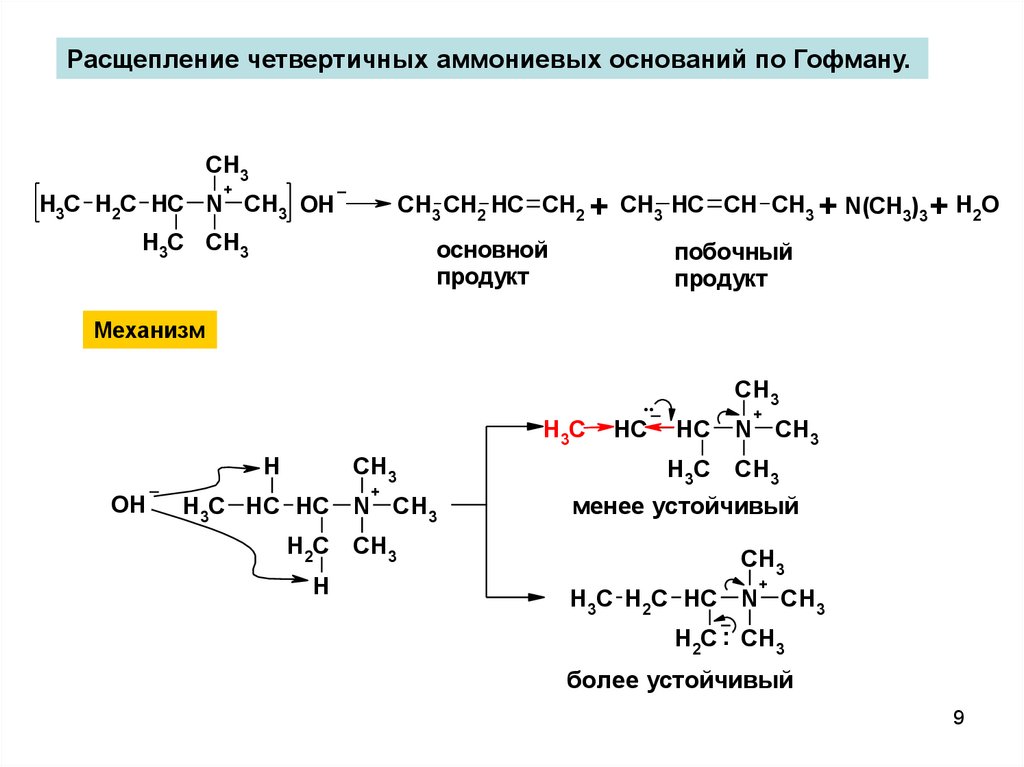
Расщепление четвертичных аммониевых оснований по Гофману.CH3
+
CH3 CH2 HC CH2 + CH3 HC CH CH3 + N(CH3)3 + H2O
H3C H2C HC N CH3 OH
H3C CH3
основной
продукт
побочный
продукт
Механизм
H3C
H
OH
CH3
+
H3C HC HC N CH3
H2C CH3
H
CH3
..
+
HC HC N CH3
H3C CH3
менее устойчивый
CH3
+
H3C H2C HC N CH3
H2C : CH3
более устойчивый
9
10.
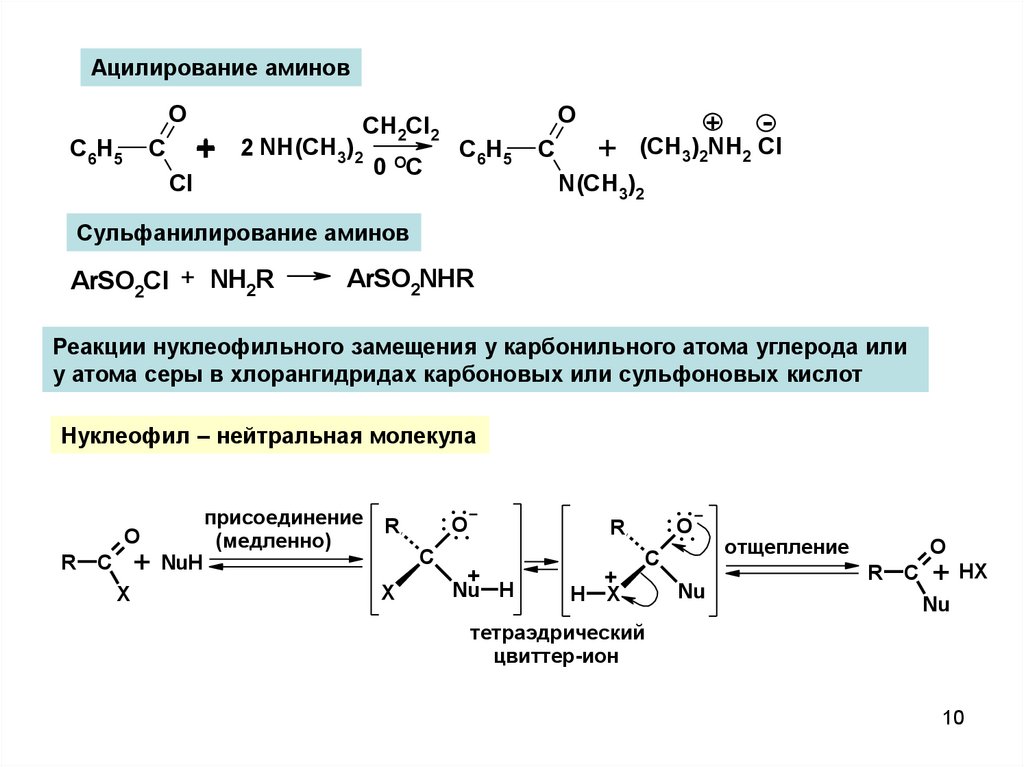
Ацилирование аминовO
C6H5
+
C
CH2Cl2
2 NH(CH3)2
Cl
0 OC
O
C6H5
+
C
+
(CH3)2NH2 Cl
N(CH3)2
Сульфанилирование аминов
ArSO2Cl + NH2R
ArSO2NHR
Реакции нуклеофильного замещения у карбонильного атома углерода или
у атома серы в хлорангидридах карбоновых или сульфоновых кислот
Нуклеофил – нейтральная молекула
O
R
+ NuH
C
X
присоединение
(медленно)
R
C
X
....O..
+
Nu H
R
H
+
C
X
....O..
Nu
O
отщепление
R
C
+ HX
Nu
тетраэдрический
цвиттер-ион
10
11.
Взаимодействие первичных и вторичных аминов с карбонилсодержащимисоединениями
C6H13C(O)H + C6H5NH2
O +
N
CH3COOH
C2H5OH
C6H13CH NC6H5 + H2O
имин
гептилиденфениламин
п-CH3C6H4SO3H
C2H5OH
+ H2O
N
енамин
4-(циклогекс-1-ен-1-ил)пирролидин
Механизм
Нуклеофильное присоединение - отщепление.
Первичные амины превращаются в имины (основания Шиффа).
k, л/моль с
O
..
R H2C C + H2N
R1
G
R H2C C NH+ G
2
R1
+
OH
R H2C C NH
O
H
R1 G
полуаминаль
3
OH2
+
R H2C C
R1
..
H
-H2O
NH
G
R H2C C
N
R1
катион иминия
+
G
R H2C C
имин
..
N
+H
+
..
H2N
G +H
pH
5
+
H2N
H
R1 G
11
+
G
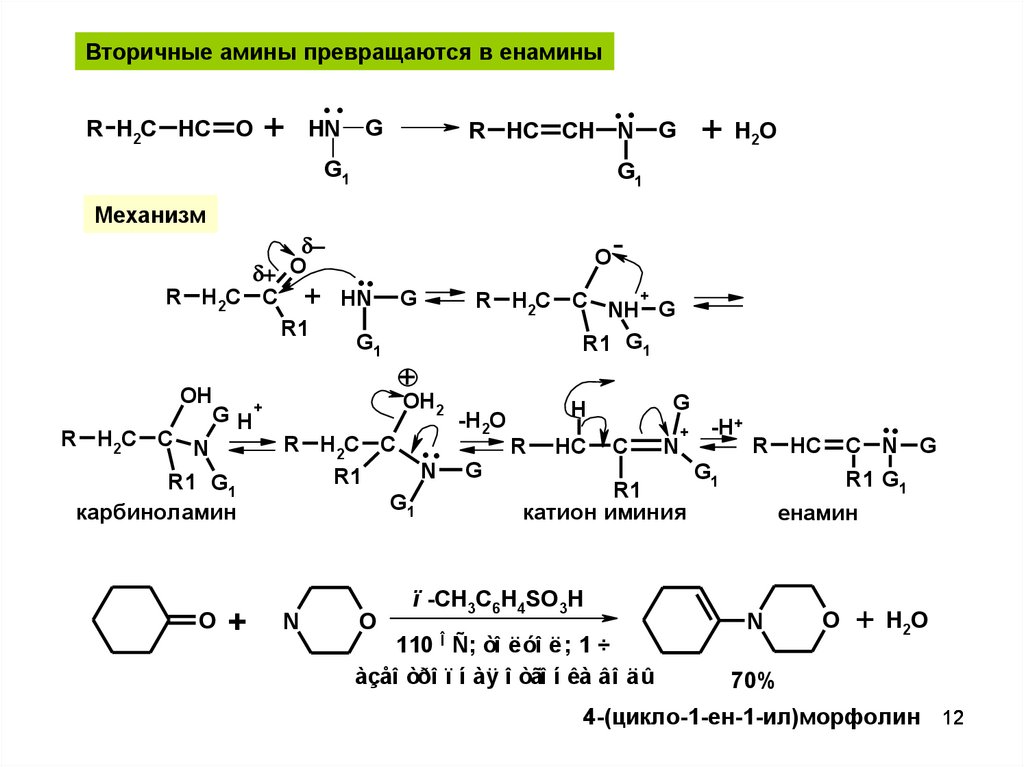
12.
Вторичные амины превращаются в енаминыR H2C HC
O
+
..
HN
G
R HC
..
CH N
G1
G
+
H2O
G1
Механизм
O
..
R H2C C + HN G
R1
G1
O
R H2C C NH+ G
R1 G1
+
OH
OH2
G
H
G H+
-H2O
+
..
+ -H
R H2C C N
R H2C C . .
R HC C N G
R HC C
N
N G
G1
R1
R1 G1
R1 G1
R1
G1
катион иминия
карбиноламин
енамин
O
+
N
O
ï -CH3C6H4SO3H
N
Î
110 Ñ; òî ëóî ë; 1 ÷
àçåî òðî ï í àÿ î òãî í êà âî äû
O
+
H2O
70%
4-(цикло-1-ен-1-ил)морфолин 12
13.
Реакции с азотистой кислотойВторичные амины с азотистой кислотой образуют N-нитрозоамины
H2O, 0-5 OC
(CH3)2NH + NaNO2 + HCl
(CH3)2N N O + NaCl + H2O
N-нитрозодиметиламин (88%)
H2O, 0-5 OC
C6H5NHCH3 + NaNO2 + HCl
C6H5N N O
+ NaCl + H2O
CH3 (90%)
Первичные ароматические амины с азотистой кислотой образуют соли диазония
ArNH2 + NaNO2 + HX
H2O, 0-5 OC
+
Ar N N X + NaX + 2 H2O
соль арендиазония
Окисление аминов
Первичные амины окисляются до нитрозосоединений
H3C
CH3C(O)OOH
NH2
H 2O
H3C
N O
1-метил-4-нитрозобензол
(73%)
13
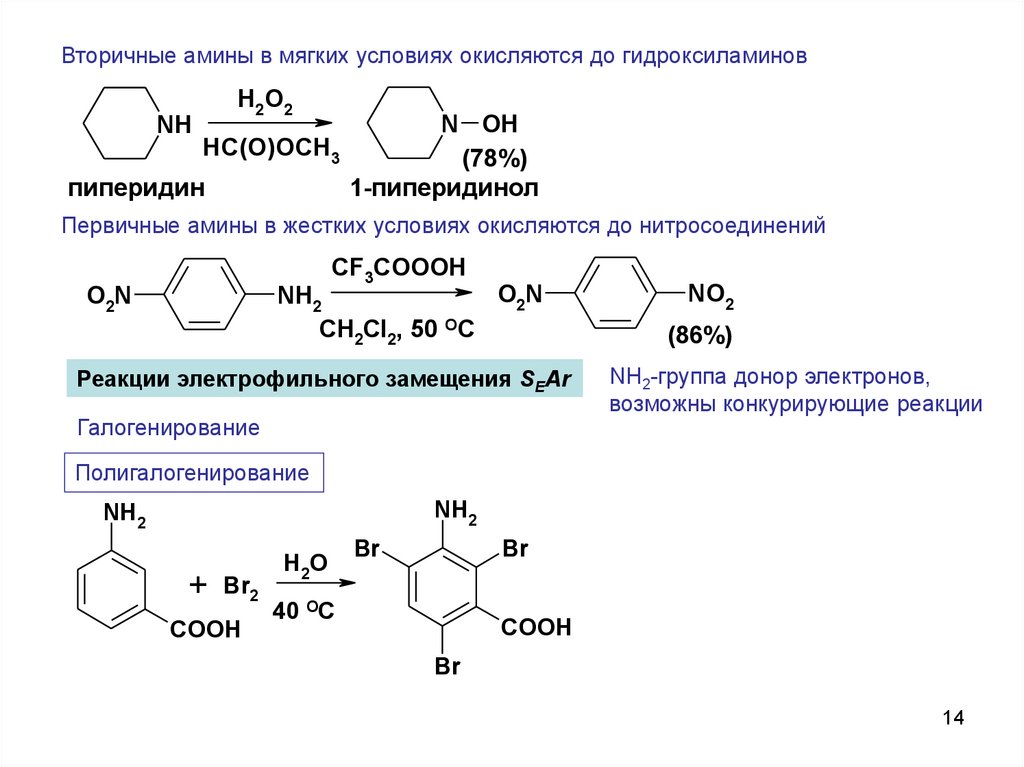
14.
Вторичные амины в мягких условиях окисляются до гидроксиламиновH2O2
N OH
HC(O)OCH3
(78%)
пиперидин
1-пиперидинол
NH
Первичные амины в жестких условиях окисляются до нитросоединений
CF3COOOH
O2N
NH2
CH2Cl2, 50 OC
O2N
Реакции электрофильного замещения SEAr
Галогенирование
NO2
(86%)
NH2-группа донор электронов,
возможны конкурирующие реакции
Полигалогенирование
NH2
NH2
+
Br2
COOH
H 2O
Br
Br
40 OC
COOH
Br
14
15.
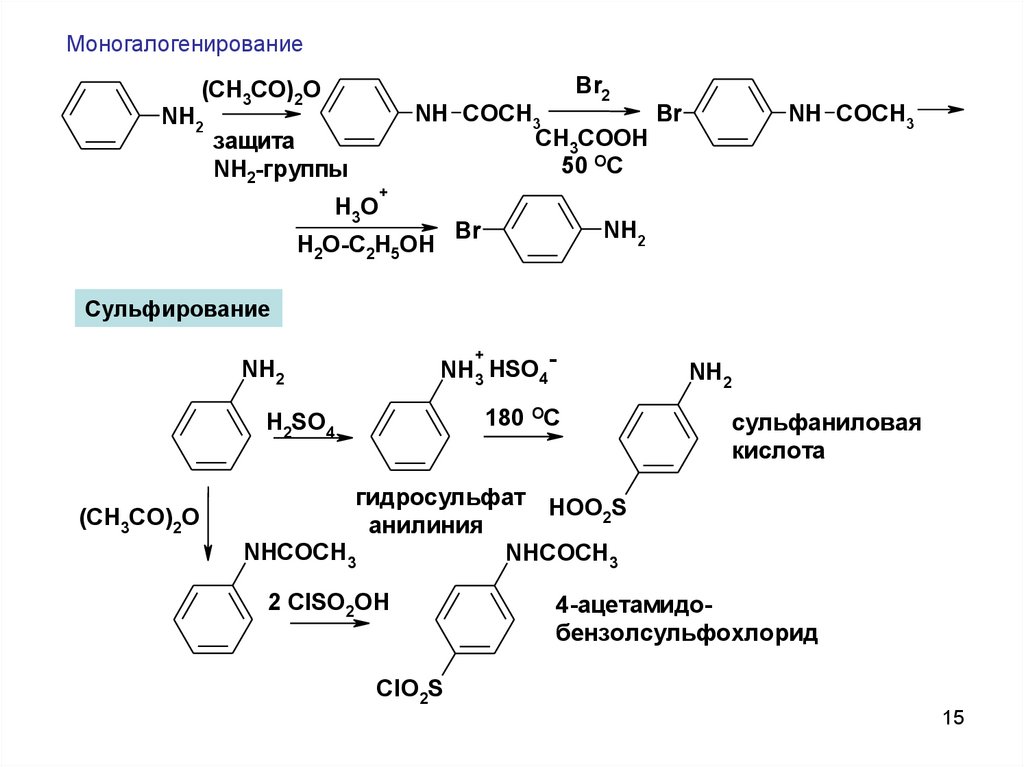
МоногалогенированиеBr2
(CH3CO)2O
NH2
NH COCH3
Br
CH3COOH
50 OC
защита
NH2-группы
H 3O
NH COCH3
+
NH2
Br
H2O-C2H5OH
Сульфирование
+
NH3 HSO4-
NH2
180 OC
H2SO4
(CH3CO)2O
NH2
сульфаниловая
кислота
гидросульфат HOO S
2
анилиния
NHCOCH3
NHCOCH3
2 ClSO2OH
4-ацетамидобензолсульфохлорид
ClO2S
15
16.
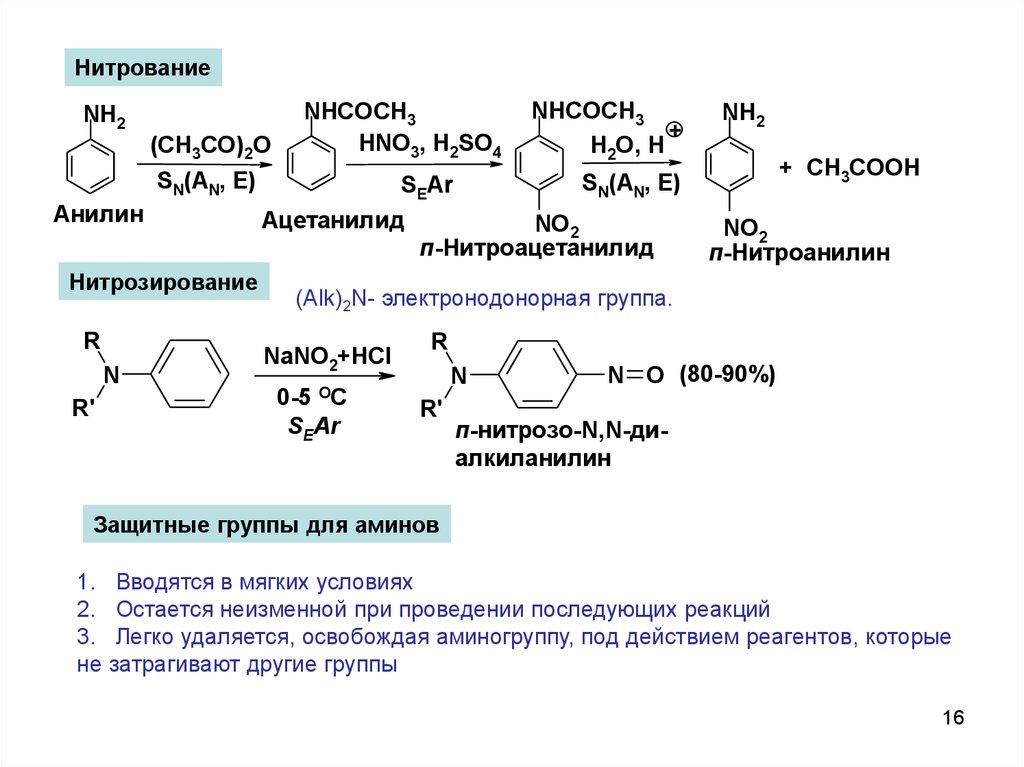
НитрованиеNH2
(CH3CO)2O
NHCOCH3
HNO3, H2SO4
SN(AN, E)
Анилин
Нитрозирование
R
N
R'
NH2
+ CH3COOН
SN(AN, E)
SEAr
Ацетанилид
NHCOCH3
+
H2O, H
NO2
п-Нитроацетанилид
NO2
п-Нитроанилин
(Alk)2N- электронодонорная группа.
NaNO2+HCl
OC
0-5
SEAr
R
N
R'
N O (80-90%)
п-нитрозо-N,N-диалкиланилин
Защитные группы для аминов
1. Вводятся в мягких условиях
2. Остается неизменной при проведении последующих реакций
3. Легко удаляется, освобождая аминогруппу, под действием реагентов, которые
не затрагивают другие группы
16
17.
OCH2 C6H5
C
O
Cl
безилхлоркарбонат (Cbz)
H2O-ТГФ, N(C2H5)3, 0-10
R NH2
O
O
O
OC
O
R
NH
C
CH2 C6H5
O
R NH Cbz
H2/Pd,
20 OC
R NH2
CH3COOH
NH
0-20 OC
O
O
O
C(CH3)3
C
R NH2
ди-трет-бутилдикарбонат (BOC) R
O
N(C2H5)3
R NH boc
(CH3)3C
C
Диамины
C
C(CH3)3
Диамины обладают всеми свойствами монаминов.
Поликонденсация
n H2N (CH2)6 NH2 + n HOOC (CH2)4 COOH
1,6-гександиамин 1,2-гександиовая к-та- n H2O
H NH (CH2)6 NH CO (CH2)4 CO OH
n
найлон-6,6 (полиамид)
17
18.
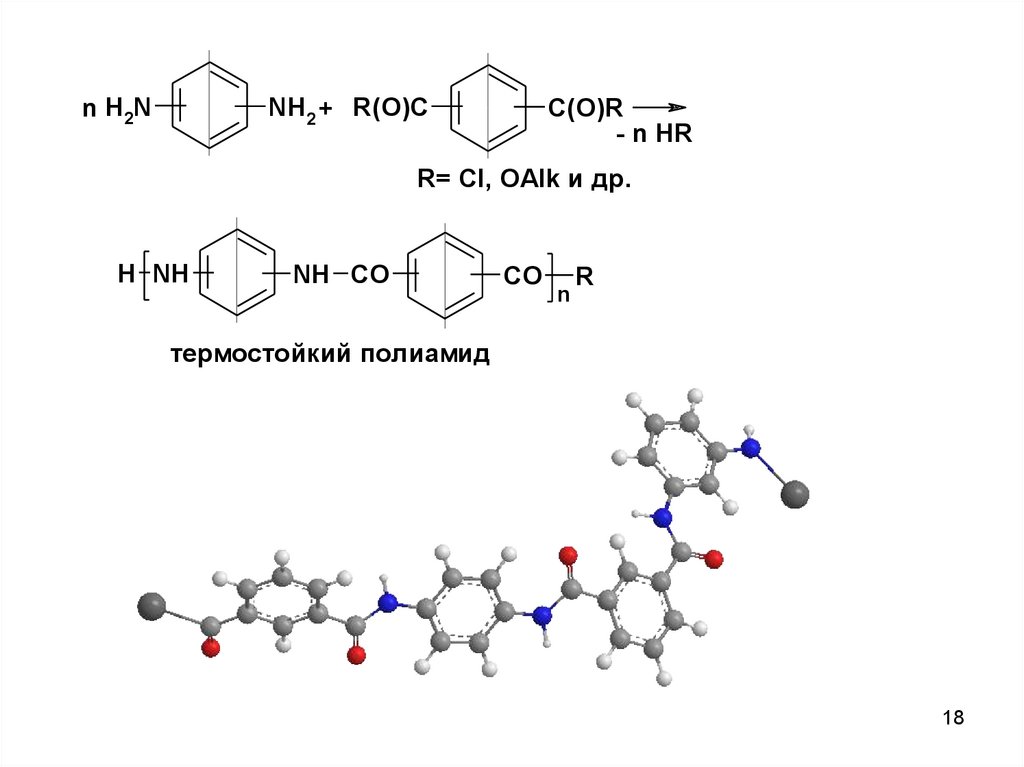
n H2NNH2 + R(O)C
C(O)R
- n HR
R= Cl, OAlk и др.
H NH
NH CO
CO
n
R
термостойкий полиамид
18
19.
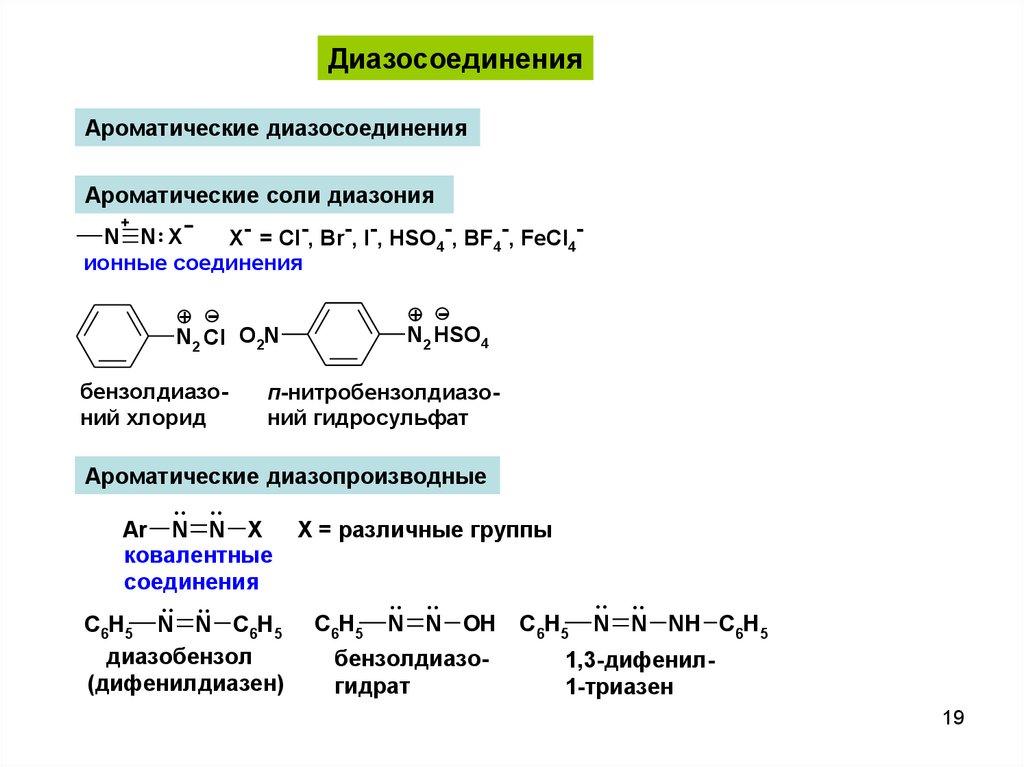
ДиазосоединенияАроматические диазосоединения
Ароматические соли диазония
+
N N: X
X- = Cl-, Br-, I-, HSO4-, BF4-, FeCl4ионные соединения
+ N2 HSO4
+ N2 Cl O2N
бензолдиазоний хлорид
п-нитробензолдиазоний гидросульфат
Ароматические диазопроизводные
.. ..
Ar N N X
ковалентные
соединения
.. ..
C6H5 N N C6H5
диазобензол
(дифенилдиазен)
X = различные группы
C6H5
.. ..
N N OH
бензолдиазогидрат
C6H5
.. ..
N N NH C6H5
1,3-дифенил1-триазен
19
20.
Способы полученияРеакция диазотирования (П.Грисс, 1858 г.)
+
Ar N2 Cl + NaCl + 2 H2O
Ar NH2 + NaNO2 + 2 HCl
0-5 OC
Побочные реакции
+
+ H 2O
..
N X + H2N
N X-
Ar
N
Ar
N
Ar
N N X-
+
+
+
t OC
Ar
OH + N2 + HX
Ar
Ar
NH2
N N NH
Ar
Ar + HX
N N
1,3-дарил-1-триазен
NH2 + HX аминодиазоарил
Механизм
Генерирование электрофила
NaNO2 + HCl
NaCl + H O N O азотистая к-та
+
H O N O + H 3O
+
H2NO2 + NO2
+
H2NO2 + Cl
+
H O N O протонированная HNO2
(нитрозацидий-катион)
H
O N O N O азотистый ангидрид
O N Cl + H2O хлористый нитрозил
20
21.
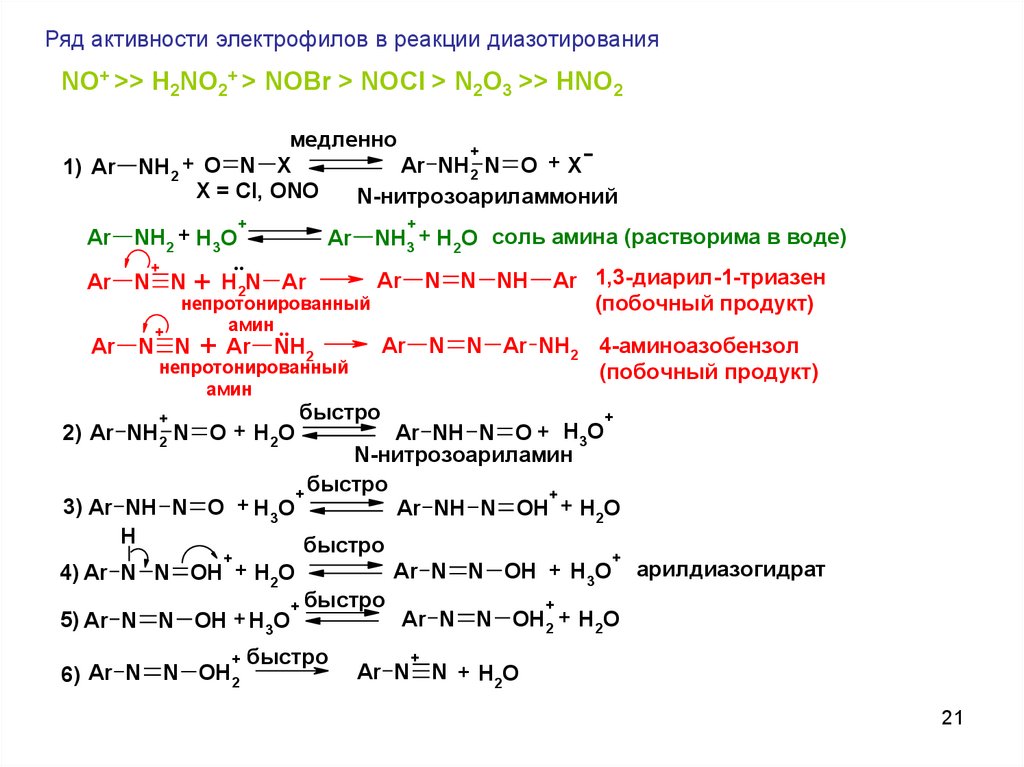
Ряд активности электрофилов в реакции диазотированияNO+ >> H2NO2+ > NOBr > NOCl > N2O3 >> HNO2
1) Ar
медленно
+
Ar NH2 N O + X
NH2 + O N X
X = Cl, ONO
N-нитрозоариламмоний
+
Ar
NH2 + H3O
Ar
..
+
N N + H2N Ar
Ar
N N
Ar
+
+
NH3 + H2O соль амина (растворима в воде)
N N NH
Ar
N N Ar NH2 4-аминоазобензол
(побочный продукт)
непротонированный
амин ..
+ Ar
NH2
непротонированный
амин
+
2) Ar NH2 N O + H2O
Ar 1,3-диарил-1-триазен
(побочный продукт)
Ar
быстро
+
Ar NH N O + H3O
N-нитрозоариламин
быстро
+
+
3) Ar NH N O + H3O
Ar NH N OH + H2O
H
быстро
+
+
4) Ar N N OH + H2O
+
5) Ar N N OH + H3O
+
6) Ar N N OH2
быстро
быстро
Ar N N OH + H3O
арилдиазогидрат
+
Ar N N OH2 + H2O
+
Ar N N + H2O
21
22.
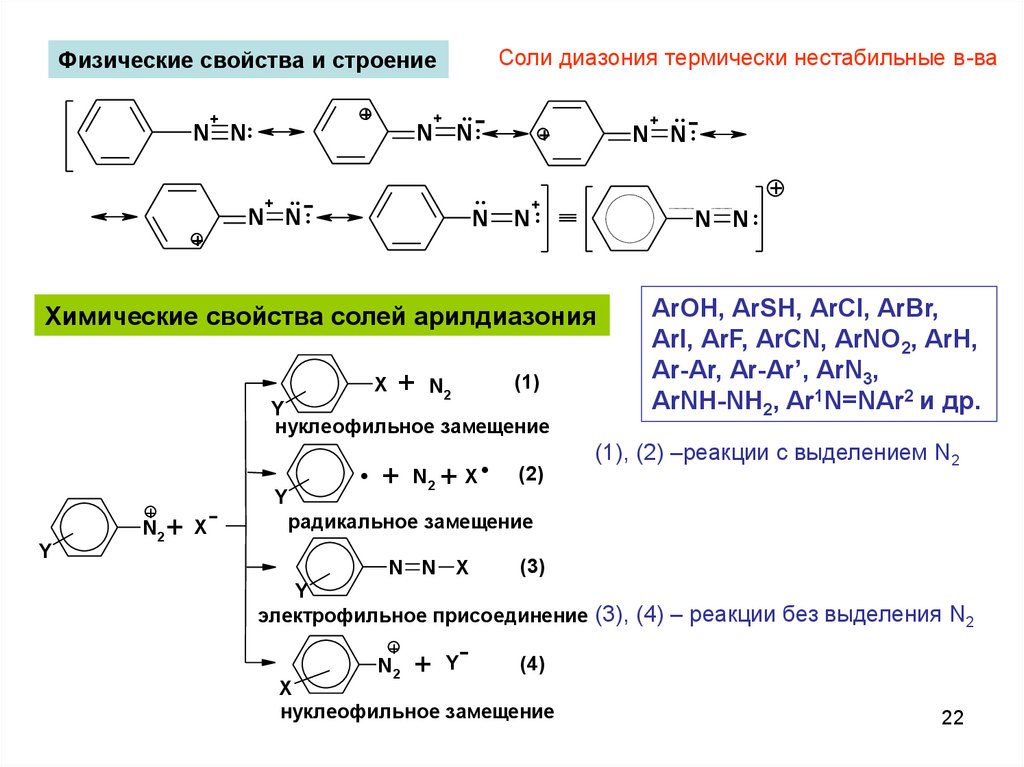
Соли диазония термически нестабильные в-ваФизические свойства и строение
+
+
N N:
N
..
N:
+
..
N
..
N N:
+
+
..
N N:
+
+
+
+
N:
N N:
Химические свойства солей арилдиазония
X
+
N2
(1)
Y
нуклеофильное замещение
Y
+
N2 + X
Y
.+
N2
+ X.
(2)
ArOH, ArSH, ArCl, ArBr,
ArI, ArF, ArCN, ArNO2, ArH,
Ar-Ar, Ar-Ar’, ArN3,
ArNH-NH2, Ar1N=NAr2 и др.
(1), (2) –реакции с выделением N2
радикальное замещение
N N X
(3)
Y
электрофильное присоединение (3), (4) – реакции без выделения N2
+
N2
+
Y
(4)
X
нуклеофильное замещение
22
23.
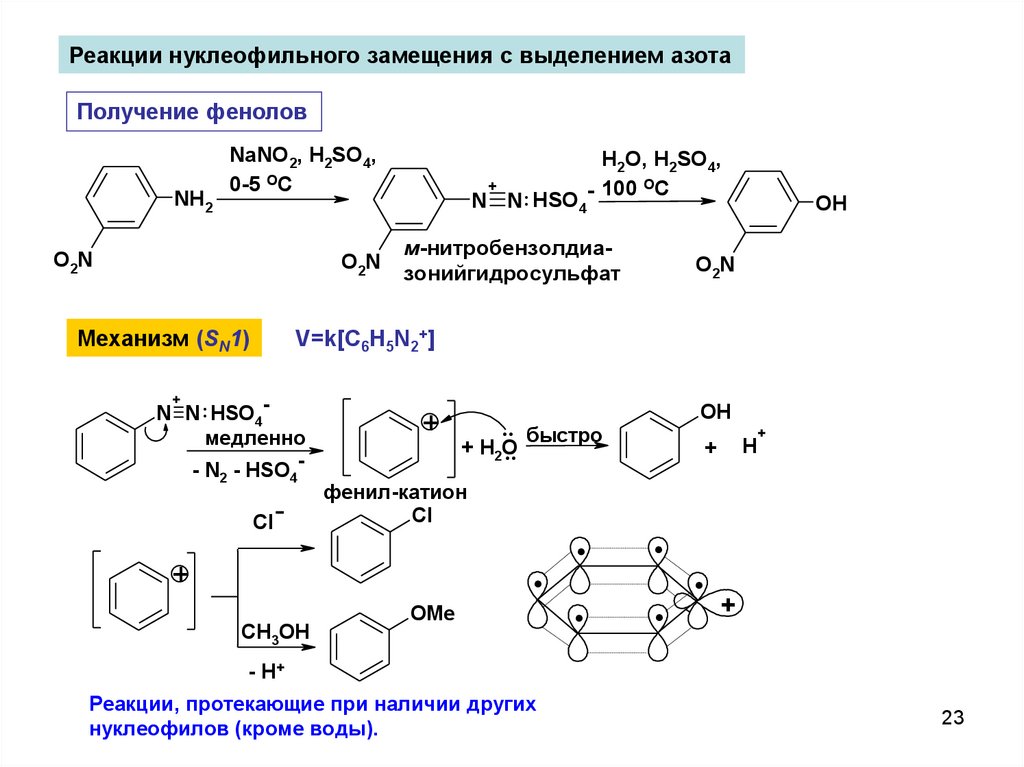
Реакции нуклеофильного замещения с выделением азотаПолучение фенолов
NaNO2, H2SO4,
0-5 OC
NH2
O2N
O2N
Механизм (SN1)
H2O, H2SO4,
+
100 OC
N N : HSO4м-нитробензолдиазонийгидросульфат
OH
O2N
V=k[C6H5N2+]
+
N N : HSO4медленно
- N - HSO -
2
4
Cl
+
фенил-катион
Cl
.
+
CH3OH
OH
.. быстро
+ H2O
..
OMe
H
+
.
.
.
.
.
+
+
- H+
Реакции, протекающие при наличии других
нуклеофилов (кроме воды).
23
24.
Получение иод- и тиоцианатареновI-, SCN- более сильные нуклеофилы, чем Cl-
KI
C6H5
+
N2 Cl
H2O, 25
KSCN
H2O, 25
C6H5 I (75%)
OC
OC
+ N2 + KCl
C6H5 S C N (54%)
Механизм SRN1
+
ArN2 + I
.
ArN2
SET
.
ArN2 + I
.
Инициирование цепи
.
Ar + N2
.
.
ArI
Ar + I
.
.
+
ArI + ArN2
ArI + ArN2
Развитие цепи
24
25.
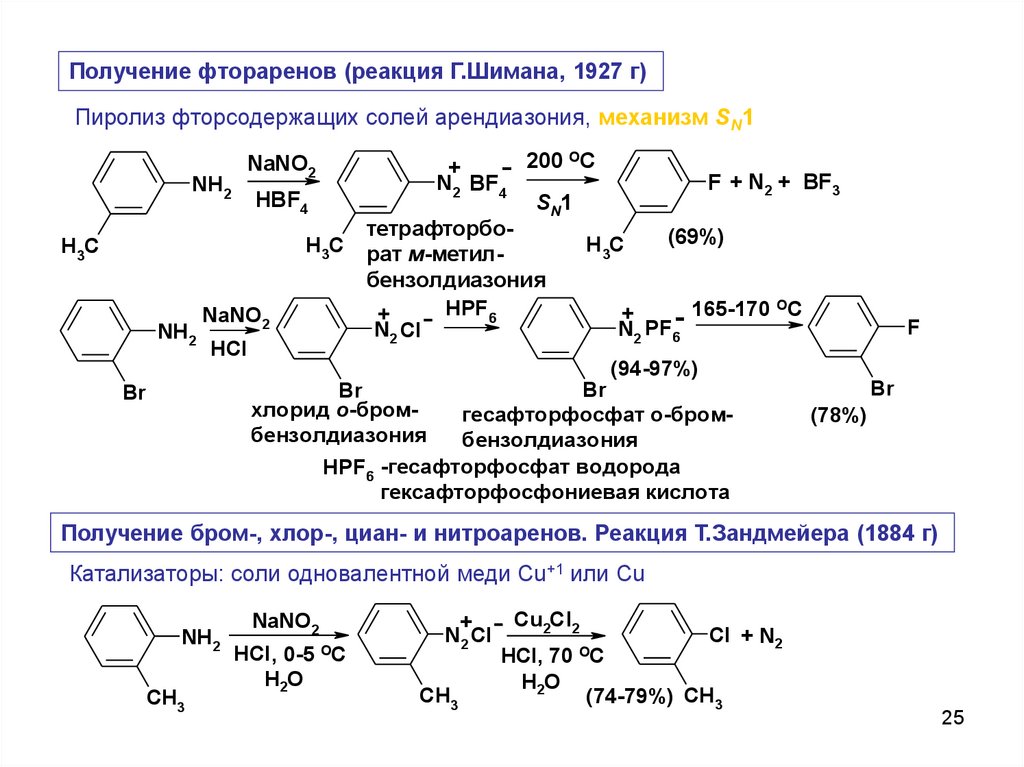
Получение фтораренов (реакция Г.Шимана, 1927 г)Пиролиз фторсодержащих солей арендиазония, механизм SN1
NH2
NaNO2
HBF4
H3C
H3C
NH2
NaNO2
HCl
200 OC
+
F + N2 + BF3
N2 BF4
SN1
тетрафторбо(69%)
H3C
рат м-метилбензолдиазония
HPF6
165-170 OC
+
+
N2 PF6
N2 Cl
(94-97%)
Br
гесафторфосфат о-бромбензолдиазония
HPF6 -гесафторфосфат водорода
гексафторфосфониевая кислота
Br
хлорид о-бромбензолдиазония
Br
F
Br
(78%)
Получение бром-, хлор-, циан- и нитроаренов. Реакция Т.Зандмейера (1884 г)
Катализаторы: соли одновалентной меди Cu+1 или Cu
NH2
CH3
NaNO2
HCl , 0-5
H2O
OC
+
N2 Cl
CH3
Cu2Cl2
HCl, 70
H2O
OC
Cl + N2
(74-79%) CH3
25
26.
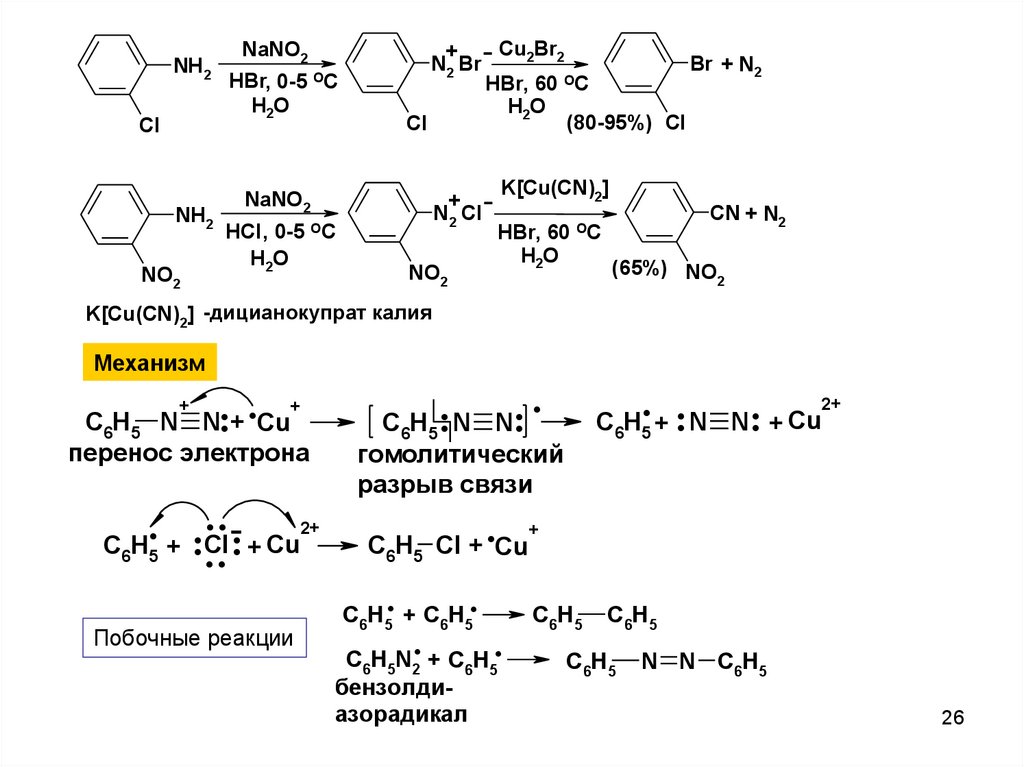
NH2Cl
NH2
NO2
Cu2Br2
+
N2 Br
Br + N2
O
HBr, 60 C
H2O
(80-95%) Cl
Cl
NaNO2
HBr, 0-5 OC
H2O
NaNO2
HCl , 0-5
H2O
+
N2 Cl
OC
NO2
K[Cu(CN)2]
HBr, 60
H2O
CN + N2
OC
(65%) NO
2
K[Cu(CN)2] -дицианокупрат калия
Механизм
C6H5 N N:+ .Cu
перенос электрона
+
+
..
2+
.
C6H5 + :Cl : + Cu
..
.
2+
C6H5 Cl + .Cu
+
.
Побочные реакции
.
C6H5 + : N N: + Cu
C6H5: N N:
гомолитический
разрыв связи
C6H5 + C6H5.
.
C6H5N2 + C6H5.
бензолдиазорадикал
C6H5
C6H5
C6H5
N N C6H5
26
27.
Л. Гаттерман (1890г)+
N2 BF4
O2N
-
NaNO2, Cu
H2O
O2N
NO2 (67-82%)
Получение азидов и тиолов
NH2
Ar
N N + NaN3
- NaCl
Cl
N3
NaN3
хлорид 3-аминобифенилдиазония
Механизм
+
+
N2 Cl
NaNO2, HCl
H2O
Ar
N
N N O
t C
N
N
арилпентазен
+
Ar N N N + N2
арилазид
27
28.
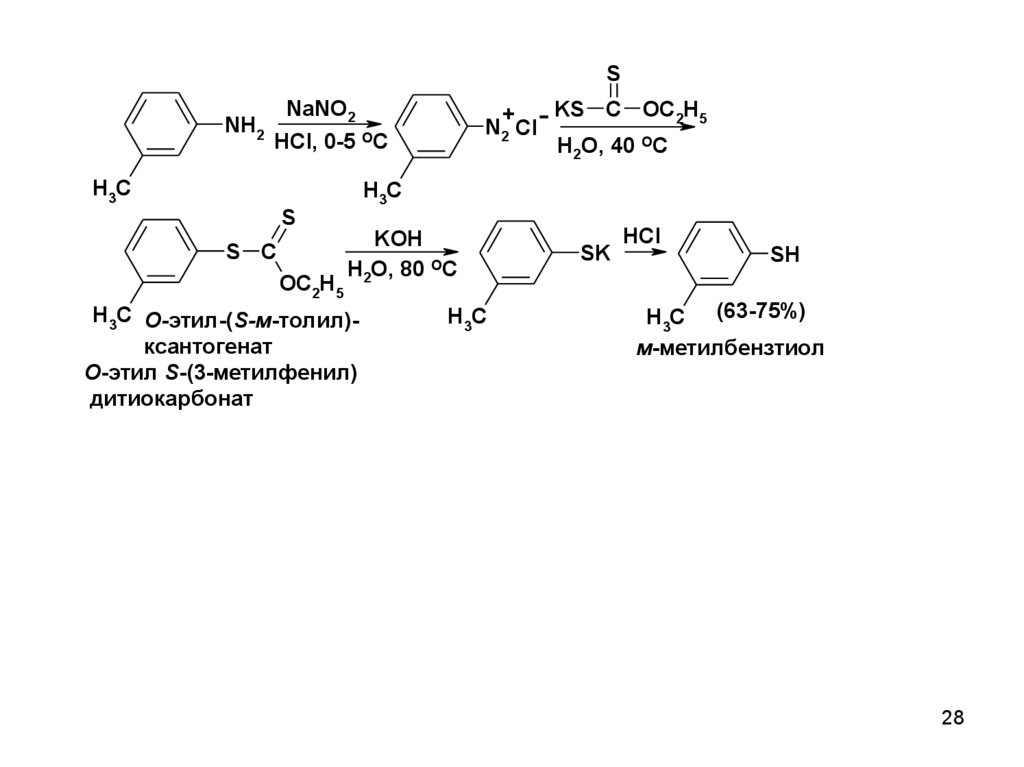
SNH2
NaNO2
KS C OC2H5
+
N2 Cl
H2O, 40 OC
HCl, 0-5 OC
H3C
S
S C
OC2H5
H3C
KOH
H2O, 80 OC
H3C О-этил-(S-м-толил)ксантогенат
О-этил S-(3-метилфенил)
дитиокарбонат
H3C
SK
HCl
SH
H3C (63-75%)
м-метилбензтиол
28
29.
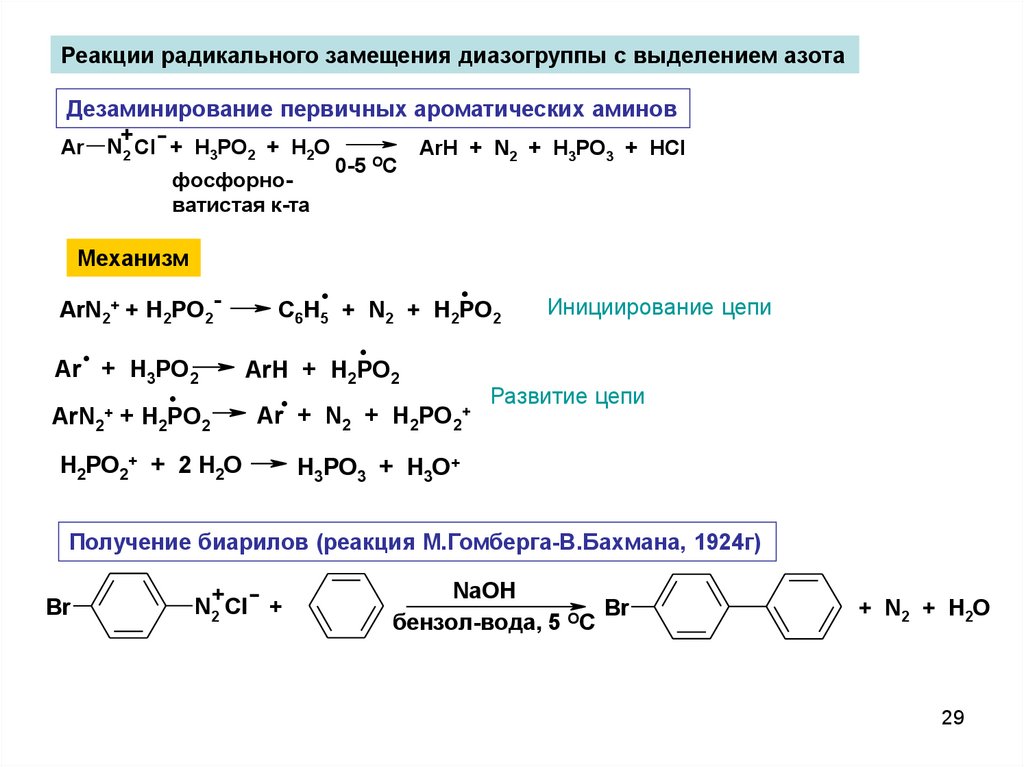
Реакции радикального замещения диазогруппы с выделением азотаДезаминирование первичных ароматических аминов
Ar
+
N2 Cl + H3PO2 + H2O
фосфорноватистая к-та
Механизм
ArN2+ + H2PO2-
.
Ar +
H3PO2
ArN2+
+ H2PO2
.
0-5 OC
ArH + N2 + H3PO3 + HCl
.
.
C6H5 + N2 + H2PO2
Инициирование цепи
.
ArH + H2PO2
.
Ar + N2 + H2PO2+
H2PO2+ + 2 H2O
Развитие цепи
H3PO3 + H3O+
Получение биарилов (реакция М.Гомберга-В.Бахмана, 1924г)
Br
+
N2 Cl +
NaOH
Br
бензол-вода, 5 ОС
+ N2 + H2O
29
30.
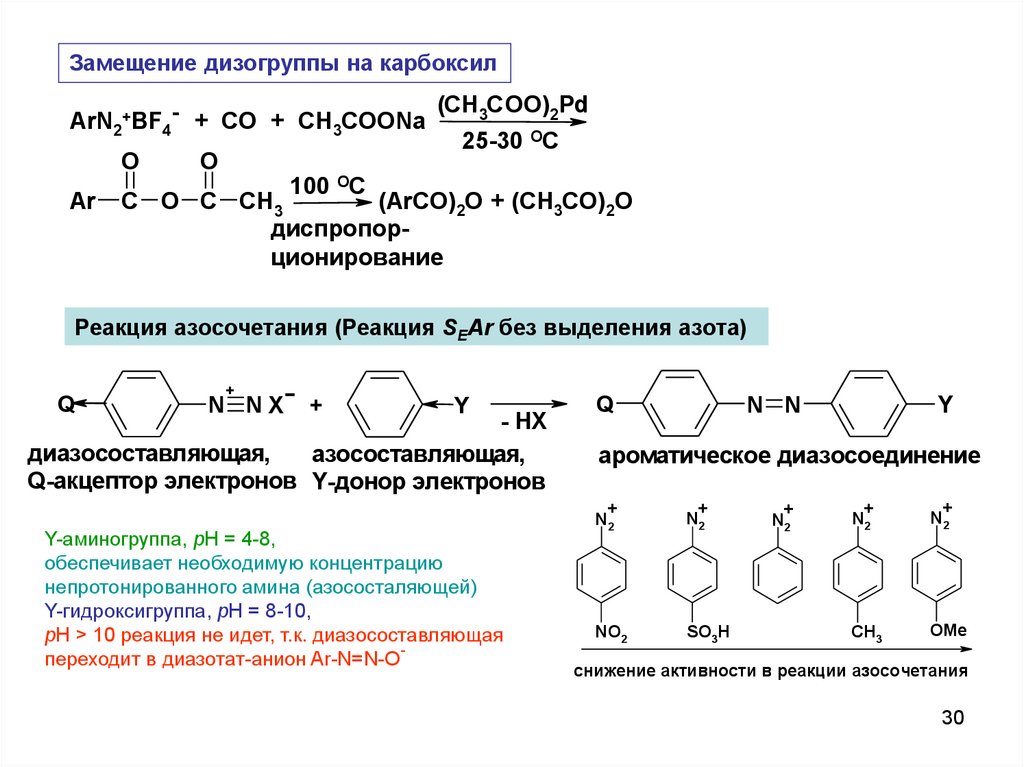
Замещение дизогруппы на карбоксилArN2+BF4- + CO + CH3COONa
O
Ar
O
(CH3COO)2Pd
25-30 OC
100 OC
C O C CH3
(ArCO)2O + (CH3CO)2O
диспропорционирование
Реакция азосочетания (Реакция SEAr без выделения азота)
Q
+
N NX
+
Y
- HX
диазосоставляющая,
азосоставляющая,
Q-акцептор электронов Y-донор электронов
Y-аминогруппа, pH = 4-8,
обеспечивает необходимую концентрацию
непротонированного амина (азососталяющей)
Y-гидроксигруппа, pH = 8-10,
pH > 10 реакция не идет, т.к. диазосоставляющая
переходит в диазотат-анион Ar-N=N-O
Q
N N
Y
ароматическое диазосоединение
+
N2
+
N2
NO2
SO3H
+
N2
+
N2
+
N2
CH3
OMe
снижение активности в реакции азосочетания
30
31.
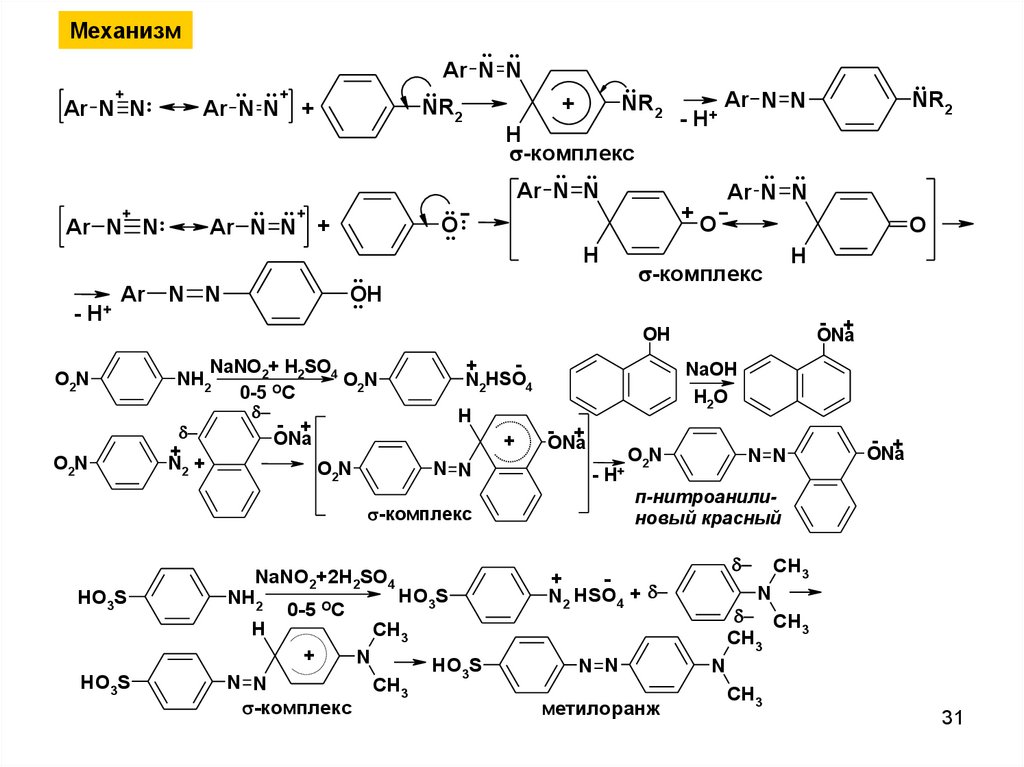
Механизм+
Ar N N:
+
Ar N N:
- H+
Ar
O2N
O2N
.. ..
Ar N N
.. .. +
Ar N N +
..
NR2
..
O
.. :
.. .. +
Ar N N +
H
-комплекс
.. ..
Ar N N
H
..
OH
..
N N
..
NR2
+
HO3S
+
.. ..
Ar N N
O
O
H
-комплекс
- +
ONa
OH
NaNO2+ H2SO4
NH2
O2N
0-5 OC
- +
ONa
+
N2 +
ON
2
+
N2HSO4
H
+
N N
NaOH
H2O
- +
ONa
- H+
NaNO2+2H2SO4
HO3S
NH2
0-5 OC
H
CH3
+
N
HO3S
N N
CH3
-комплекс
O2N
N N
- +
ONa
п-нитроанилиновый красный
-комплекс
HO3S
- H+
..
NR2
Ar N N
+
N2 HSO4 +
N N
метилоранж
CH3
N
CH
3
CH3
N
CH3
31
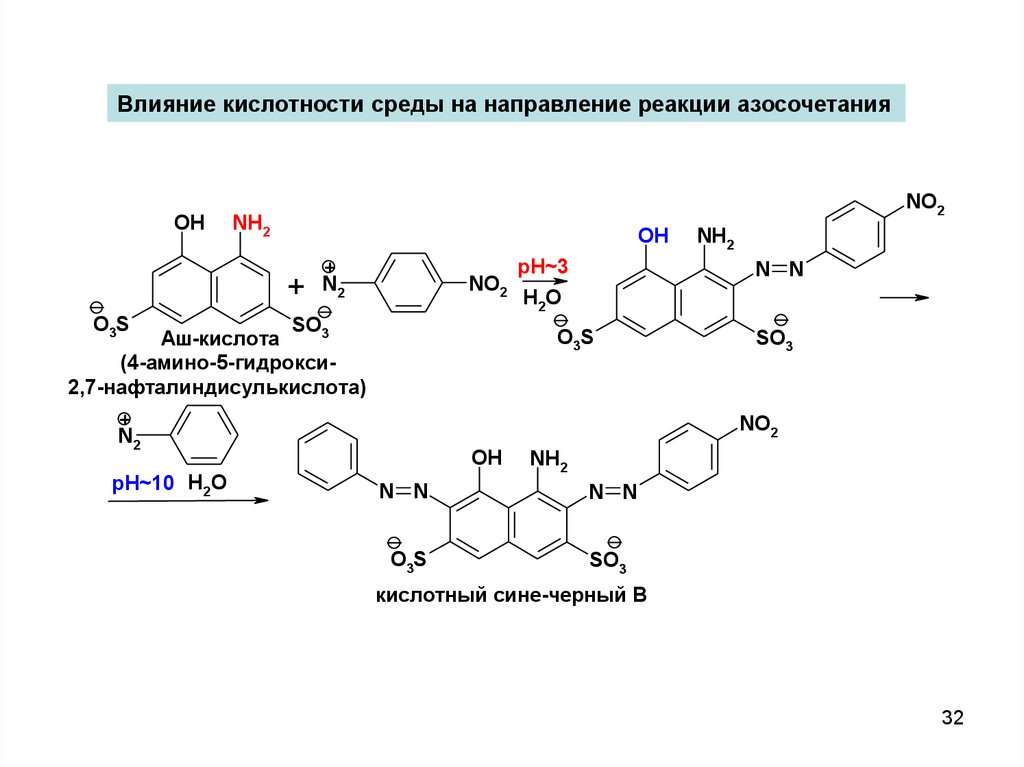
32.
Влияние кислотности среды на направление реакции азосочетанияOH
NO2
NH2
OH
+
+
NO2
N2
O3S
SO3
Аш-кислота
(4-амино-5-гидрокси2,7-нафталиндисулькислота)
pH~3
H 2O
N N
O3S
+
SO3
NO2
N2
pH~10 H2O
NH2
OH
NH2
N N
N N
O3S
SO3
кислотный сине-черный В
32
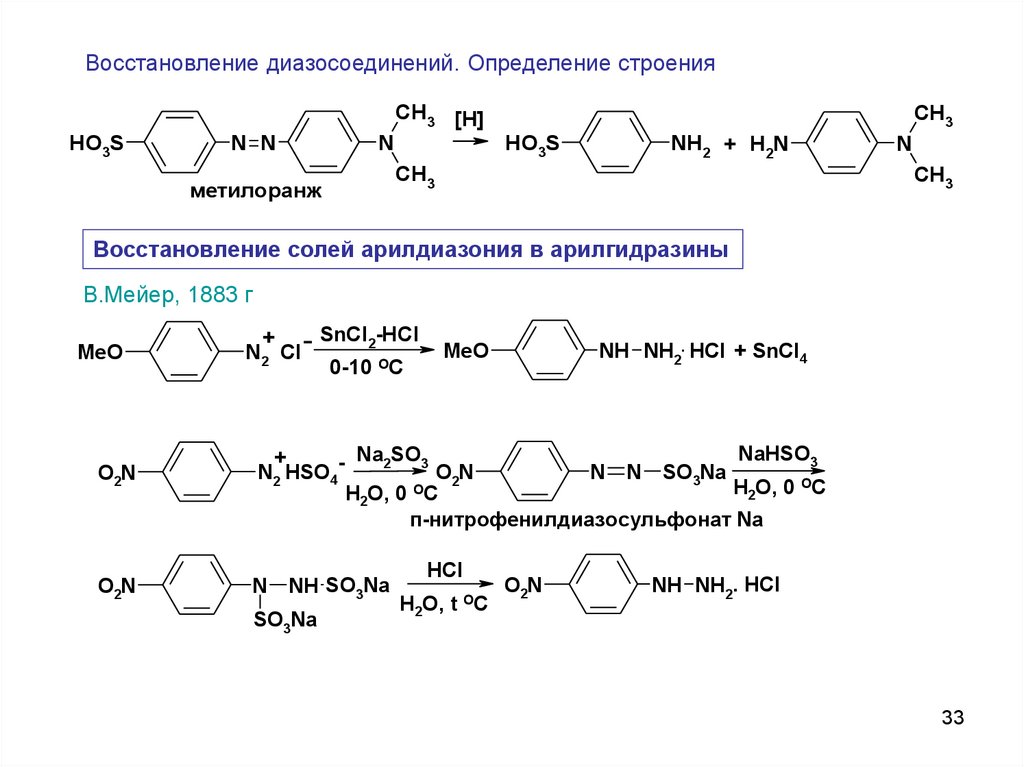
33.
Восстановление диазосоединений. Определение строенияCH3 [H]
HO3S
N N
N
метилоранж
CH3
HO3S
NH2 + H2N
CH3
N
CH3
Восстановление солей арилдиазония в арилгидразины
В.Мейер, 1883 г
MeO
O2N
O2N
SnCl2-HCl
+
N2 Cl
0-10 OC
NH NH2. HCl + SnCl4
MeO
NaHSO3
Na2SO3
+
O2N
N N SO3Na
N2 HSO4
H2O, 0 OC
H2O, 0 OC
п-нитрофенилдиазосульфонат Na
N
NH SO3Na
SO3Na
HCl
H2O, t
OC
O2N
NH NH2. HCl
33
34.
3435.
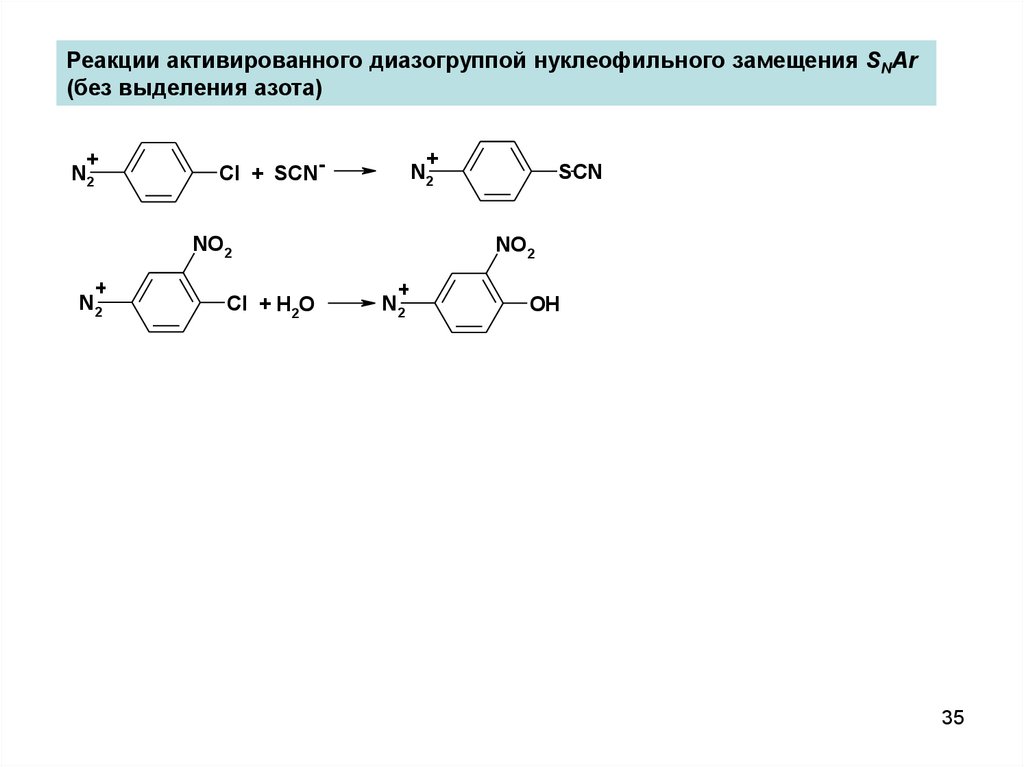
Реакции активированного диазогруппой нуклеофильного замещения SNAr(без выделения азота)
+
N2
Cl + SCN-
+
N2
NO2
+
N2
Cl + H2O
SCN
NO2
+
N2
OH
35








 Химия
Химия