Похожие презентации:
Амины
1. Амины
128.03.2019
2.
I. Классификация1. В зависимости от строения углеводородного скелета:
1) алифатические (насыщенные и ненасыщенные);
2) циклические;
3) ароматические;
4) гетероциклические;
2
28.03.2019
3.
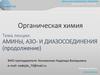
2. В зависимости от количества замещённых атомовводорода в молекуле аммиака:
1) первичные
CH3 – NH2
2) вторичные
CH3 – NH – CH3
3) третичные
CH3 – N – CH3
|
CH3
4) четвертичные
CH3
+
|
CH3 – N – CH3 Cl
|
CH3
CH3
+
|
CH3– N – CH3 OH–
|
CH3
3
28.03.2019
4.
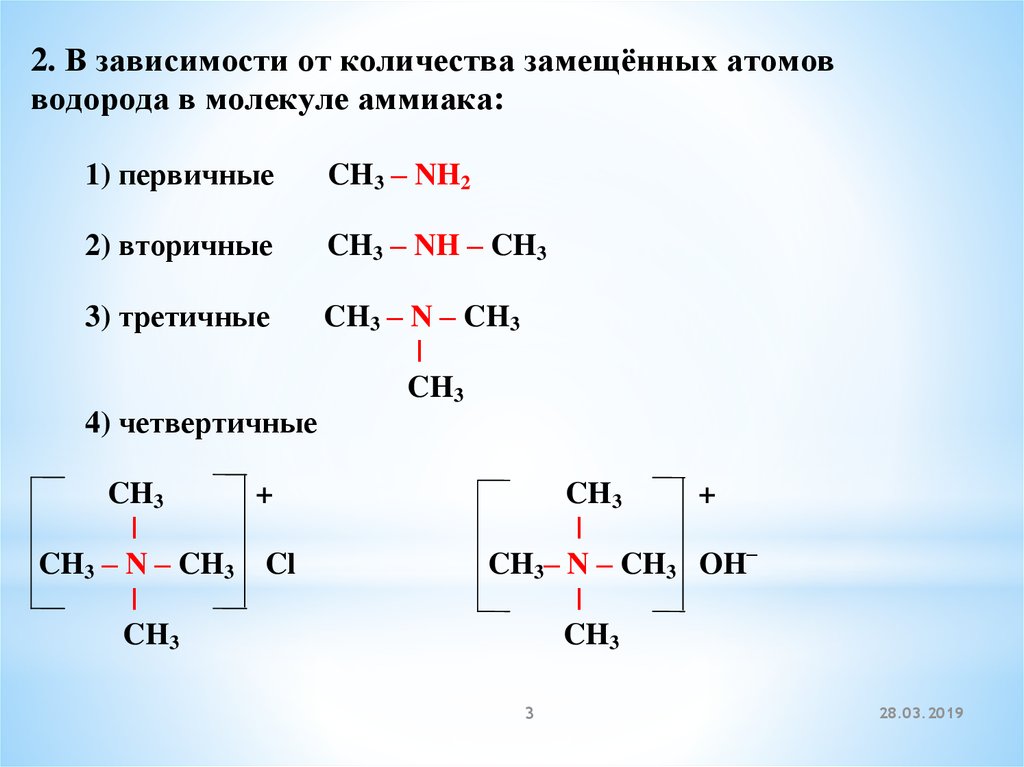
2. В зависимости от количества замещённых атомовводорода в молекуле аммиака:
1) первичные
CH3 – NH2
метиламин
2) вторичные
CH3 – NH – CH3
диметиламин
3) третичные
CH3 – N – CH3
|
CH3
4) четвертичные
CH3
+
|
CH3 – N – CH3 Cl
|
CH3
тетраметиламмоний
хлорид
триметиламин
CH3
+
|
CH3– N – CH3 OH–
|
CH3
тетраметиламмоний
гидроксид
28.03.2019
5.
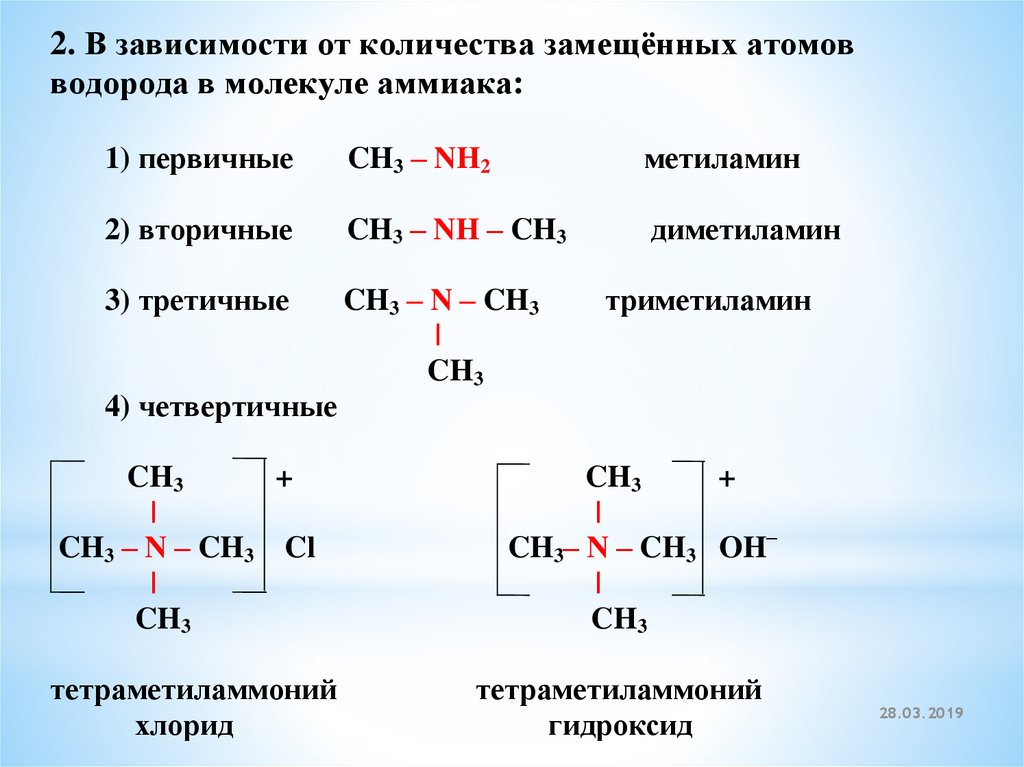
II Номенклатура и изомерия1. Тривиальная (эмпирическая):
NH2
анилин
2. Рациональная:
CH3 – CH – NH – CH2 – CH – CH3
|
|
CH3
CH3
изопропилизобутиламин
5
28.03.2019
6.
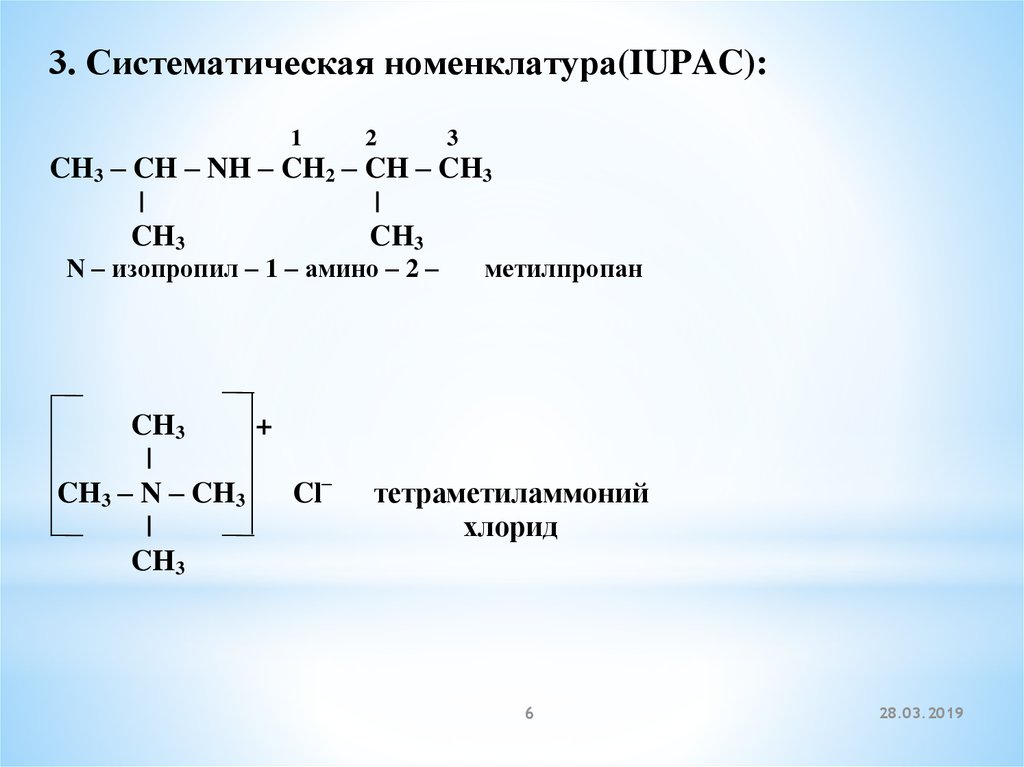
3. Систематическая номенклатура(IUPAC):1
2
3
CH3 – CH – NH – CH2 – CH – CH3
|
|
CH3
CH3
N – изопропил – 1 – амино – 2 –
CH3
+
|
CH3 – N – CH3
Cl–
|
CH3
метилпропан
тетраметиламмоний
хлорид
6
28.03.2019
7.
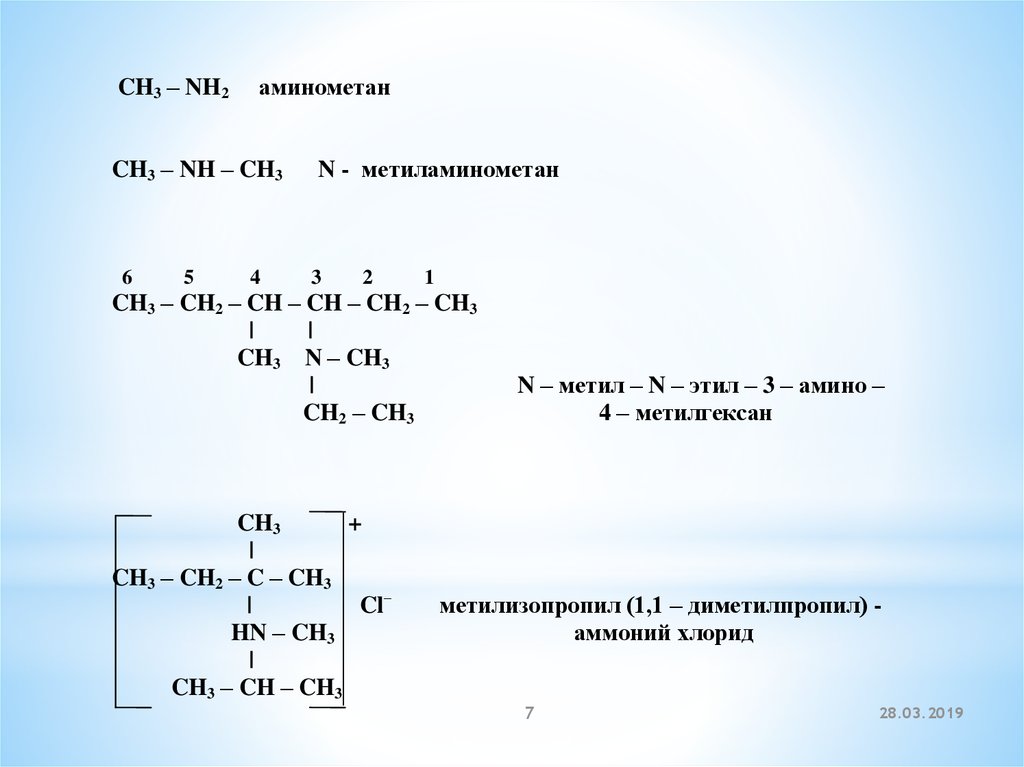
CH3 – NH2аминометан
CH3 – NH – CH3
6
5
4
N - метиламинометан
3
2
1
CH3 – CH2 – CH – CH – CH2 – CH3
|
|
CH3 N – CH3
|
CH2 – CH3
CH3
+
|
CH3 – CH2 – C – CH3
|
Cl–
HN – CH3
|
CH3 – CH – CH3
N – метил – N – этил – 3 – амино –
4 – метилгексан
метилизопропил (1,1 – диметилпропил) аммоний хлорид
7
28.03.2019
8.
III. Способы получения1.Восстановление нитросоединений (реакция Зинина):
Fe + HCl
NO2
NH2
Н.Н. Зинин
13.08.1812 - 06.02.1880
Альма-матер:
Казанский университет
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3 + 3S + 2H2O
1842г.
8
28.03.2019
9.
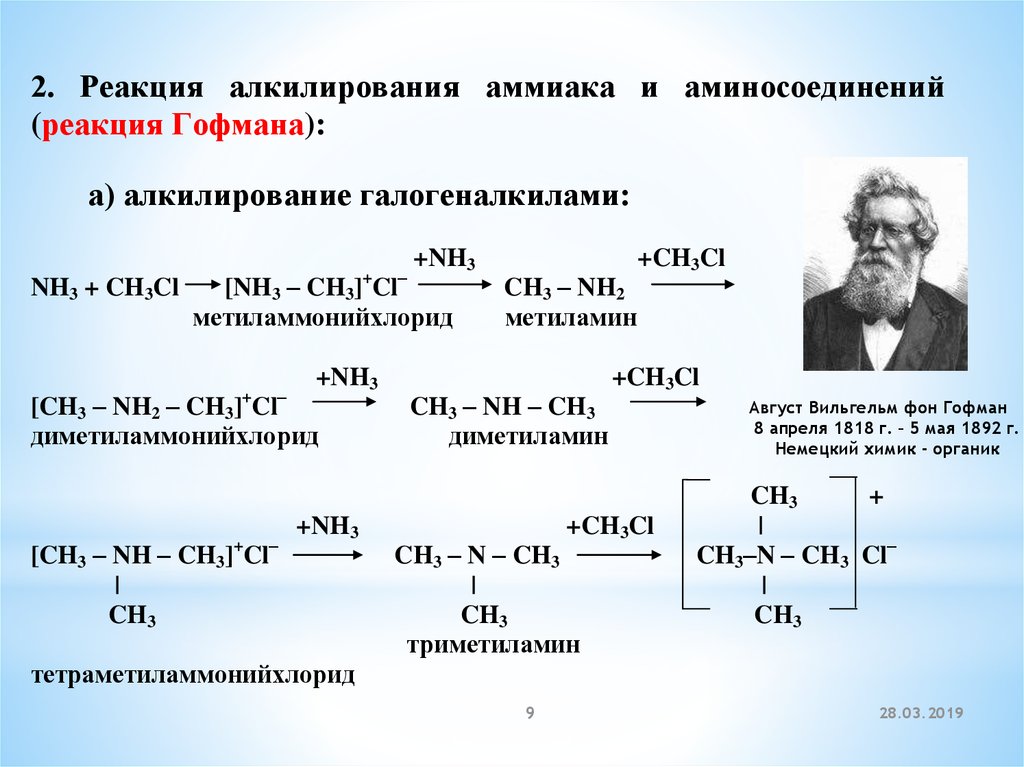
2. Реакция алкилирования аммиака и аминосоединений(реакция Гофмана):
а) алкилирование галогеналкилами:
NH3 + CH3Cl
+
–
+NH3
[NH3 – CH3] Cl
метиламмонийхлорид
–
+
+NH3
[CH3 – NH2 – CH3] Cl
диметиламмонийхлорид
+
[CH3 – NH – CH3] Cl
|
CH3
–
+NH3
CH3 – NH2
метиламин
CH3 – NH – CH3
диметиламин
+CH3Cl
+CH3Cl
+CH3Cl
CH3 – N – CH3
|
CH3
триметиламин
Август Вильгельм фон Гофман
8 апреля 1818 г. – 5 мая 1892 г.
Немецкий химик - органик
CH3
+
|
CH3–N – CH3 Cl–
|
CH3
тетраметиламмонийхлорид
9
28.03.2019
10.
б) алкилирование аммиака спиртами:300OC
CH3OH
+
NH3
CH3 – NH2 + Н2О
Аl2O3
300OC
2CH3OH
+
NH3
Аl2O3
CH3 – NH – CH3 + 2Н2О
300OC
3CH3OH
+
CH3 – N – CH3
|
CH3
NH3
Аl2O3
10
+ 3Н2О
28.03.2019
11.
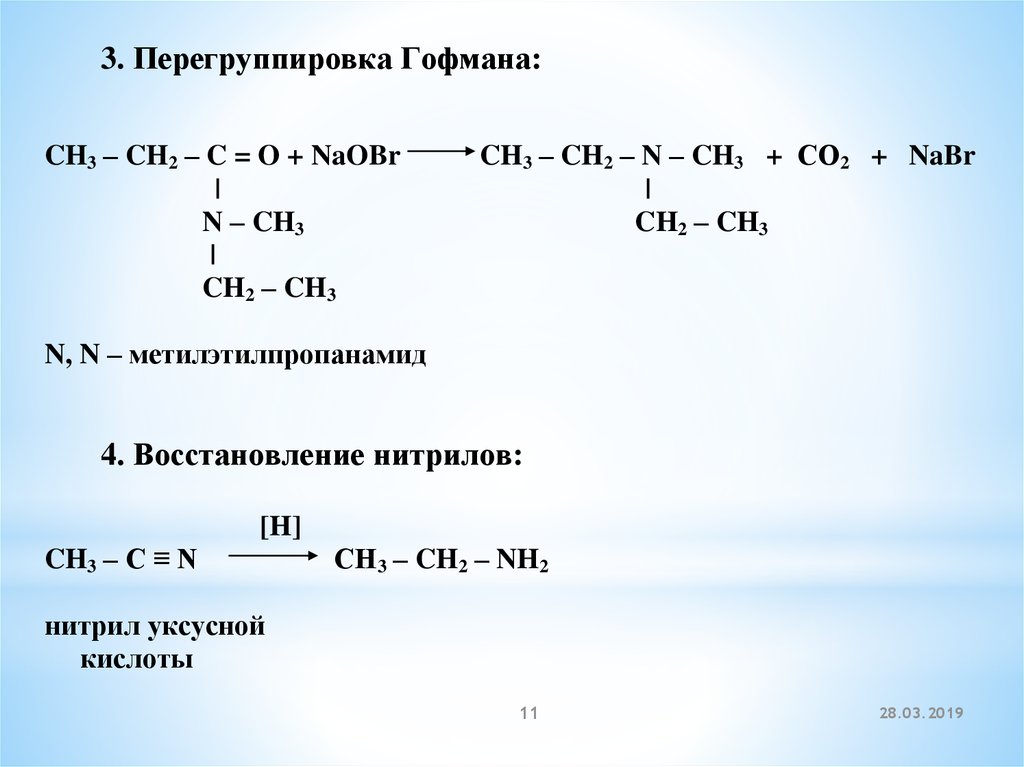
3. Перегруппировка Гофмана:CH3 – CH2 – C = O + NaOBr
|
N – CH3
|
CH2 – CH3
CH3 – CH2 – N – CH3 + СО2 + NaBr
|
CH2 – CH3
N, N – метилэтилпропанамид
4. Восстановление нитрилов:
[H]
CH3 – C ≡ N
CH3 – CH2 – NH2
нитрил уксусной
кислоты
11
28.03.2019
12.
IV. Физические свойства12
28.03.2019
13.
14.
*Первые два члена ряда первичных аминовявляются газами, средние члены жидкостями, высшие амины – твёрдые
вещества. Растворимость в воде убывает
по
мере
возрастания
длины
углеводородного радикала; у первых
членов гомологических рядов аминов она
значительна.
*Анилин – простейший ароматический
амин- представляет собой жидкость.
Нафтиламины
являются
твёрдыми
веществами.
14
28.03.2019
15.
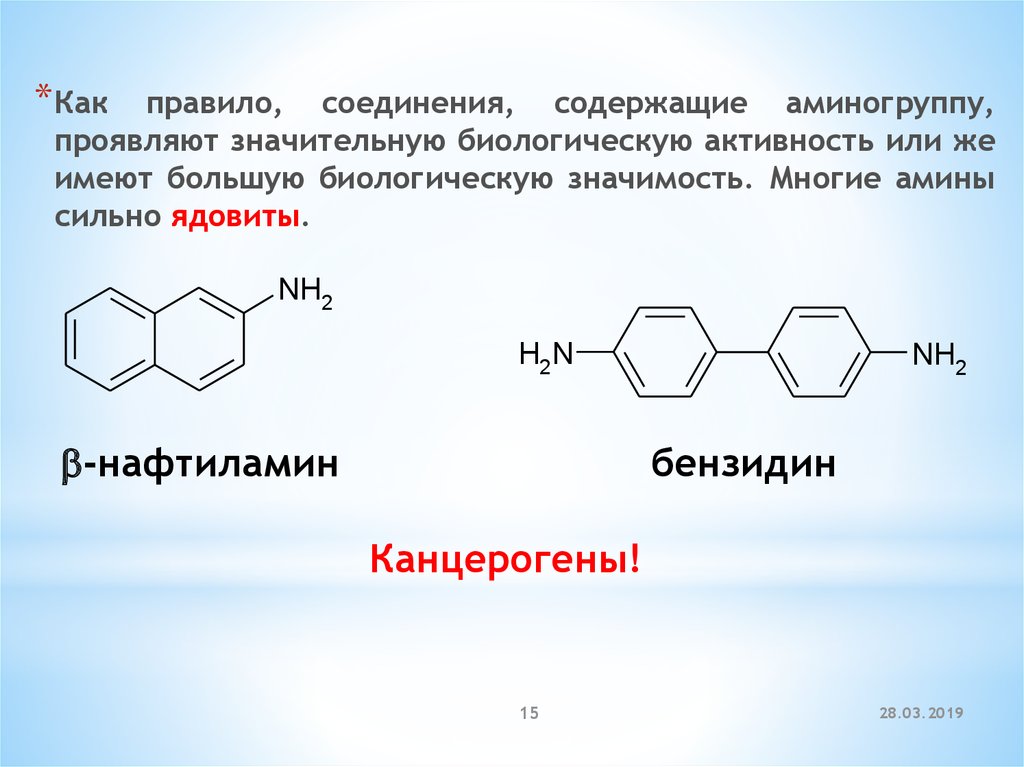
* Какправило, соединения, содержащие аминогруппу,
проявляют значительную биологическую активность или же
имеют большую биологическую значимость. Многие амины
сильно ядовиты.
NH2
H2N
b-нафтиламин
NH2
бензидин
Канцерогены!
15
28.03.2019
16.
Амины алифатического (жирного) ряда –обладаютрезким аммиачным запахом. Применяются в
производстве ускорителей вулканизации,
фармацевтических препаратов, красителей. Низшие
амины малотоксичны; с увеличением молекулярного
веса токсическое действие в первую очередь на
центральную нервную систему, возрастает. Кроме того,
под влиянием аминов происходят изменения в крови
(уменьшение количества гемоглобина и эритроцитов) и
функций печени и почек.
16
28.03.2019
17.
Ароматические амины применяются ванилинокрасочной, химико-фармацевтической
промышленности, производстве резин, пластмасс,
инсектицидов в парфюмерной, мыловаренной и
текстильной промышленности. Они гораздо более
токсичны, чем алифатические амины. Способны
вызывать острые, подострые и хронические отравления.
Отравления при проникновении через неповрежденную
кожу – характерная особенность ароматических аминов.
В действии аминов на организм наиболее типичны
образование метгемоглобина ( метгемоглобин содержит
Fe окисленное до трёхвалентного состояния, которое не
способно переносить кислород) и дегенеративные
изменения эритроцитов .
17
28.03.2019
18.
V. Строение аминовРис. 1. Структура триметиламина
Рис. 2. Структура катиона
триметиламмония
Нижник Я.П.
http://norgchem.professorjournal.ru
18
28.03.2019
19.
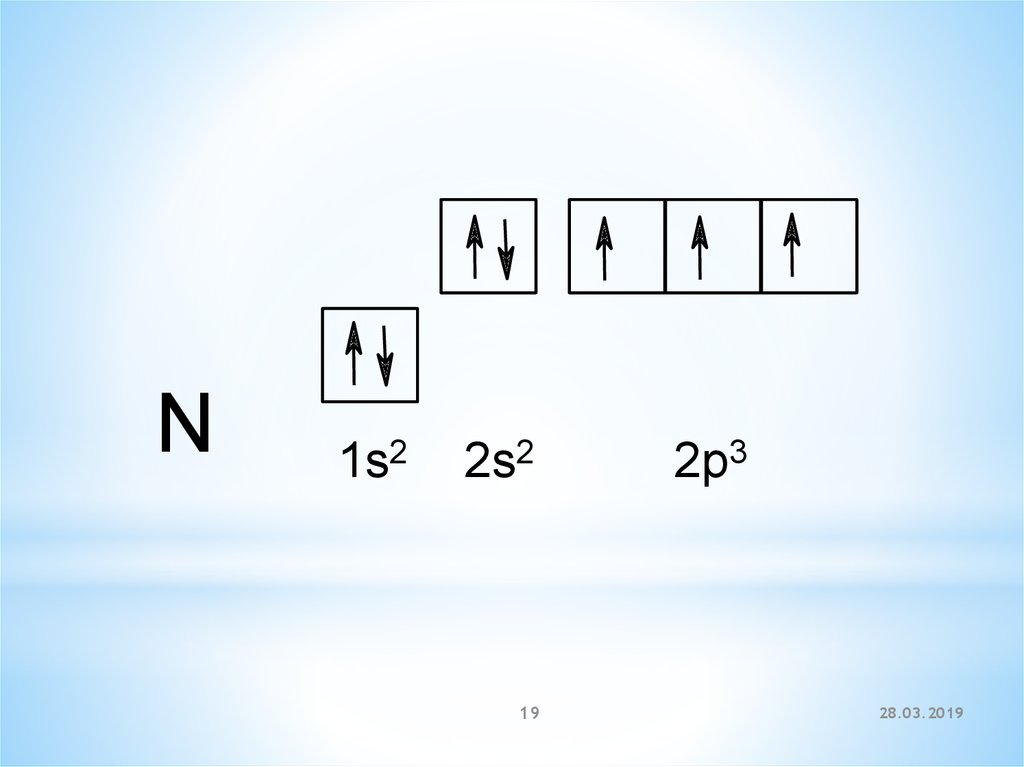
N1s2
2s2
19
2p3
28.03.2019
20.
VI. Химические свойства1.Проявление основных свойств:
CH3 – NH2
+
[CH3 – NH3]+Cl–
HCl
хлорид метиламмония
2. Взаимодействие с водой:
CH3 – NH2
+
[CH3 – NH3]+OH–
H2O
20
гидроксид метиламмония
28.03.2019
21.
22.
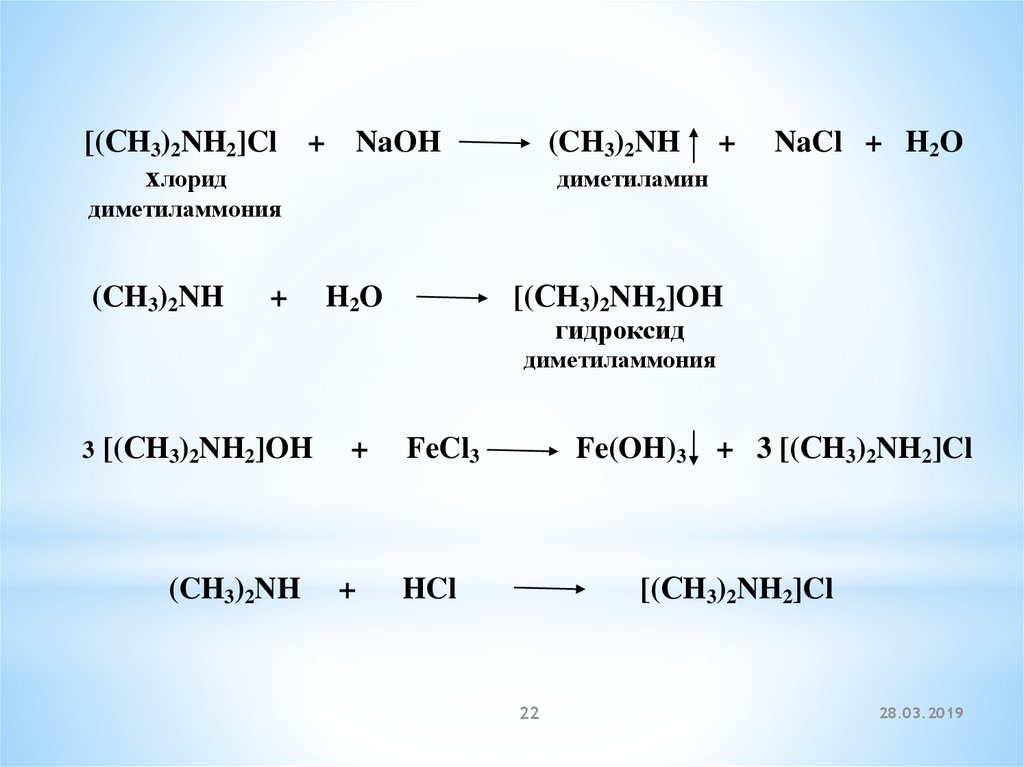
[(СH3)2NH2]Cl + NaOHхлорид
(CH3)2NH
+
NaCl + H2O
диметиламин
диметиламмония
(CH3)2NH
+
H2O
[(СH3)2NH2]OH
гидроксид
диметиламмония
3
[(СH3)2NH2]OH
(CH3)2NH
+
+
FeCl3
Fe(OH)3 + 3 [(СH3)2NH2]Cl
HCl
[(СH3)2NH2]Cl
22
28.03.2019
23.
Ряд убывания основных свойств:..
H–N–H
|
H
<
аммиак
..
CH3 – N – CH3
|
CH3
третичный
..
CH3 – N – H
|
H
<
первичный
>
..
- NH2
вторичный
..
–N–
>
ароматический
первичный амин
23
..
CH3 – N – H
|
CH3
ароматический
третичный амин
28.03.2019
24.
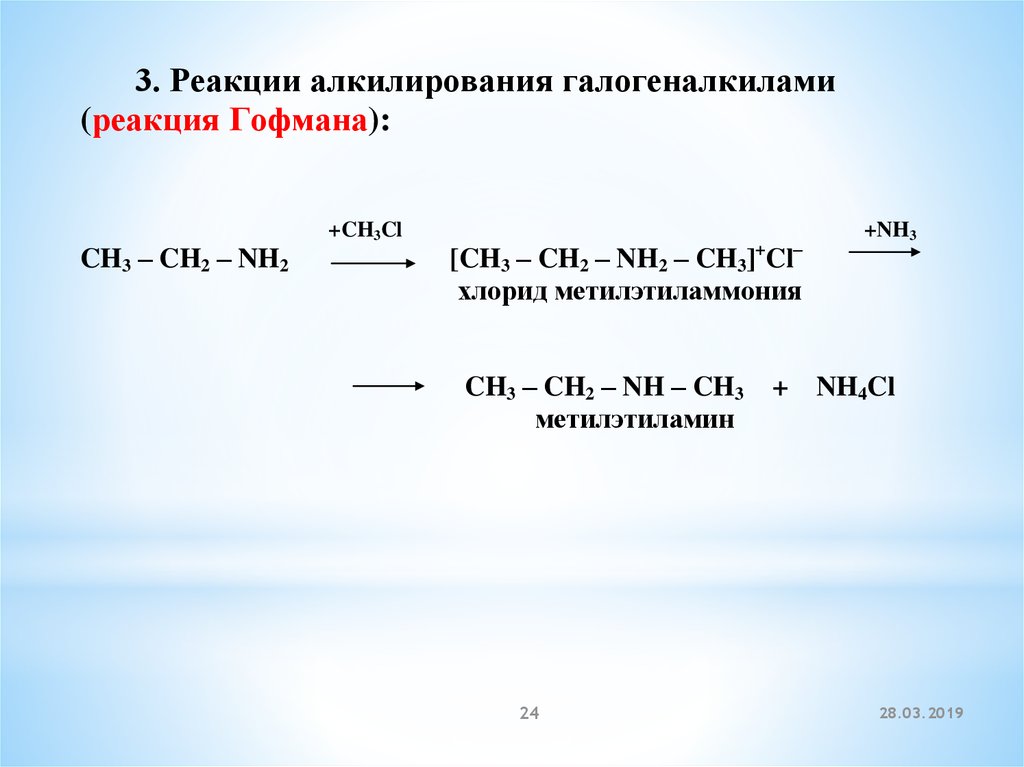
3. Реакции алкилирования галогеналкилами(реакция Гофмана):
CH3 – CH2 – NH2
+CH3Cl
–
[CH3 – CH2 – NH2 – CH3] Cl
хлорид метилэтиламмония
+
CH3 – CH2 – NH – CH3
метилэтиламин
24
+NH3
+ NH4Cl
28.03.2019
25.
26.
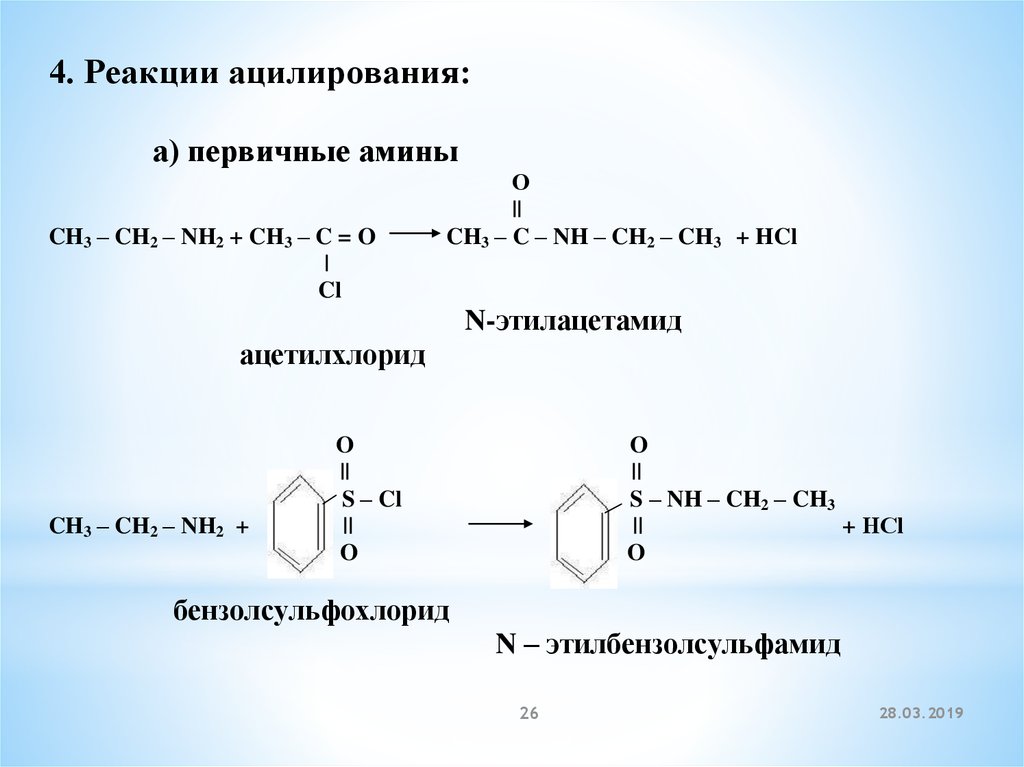
4. Реакции ацилирования:а) первичные амины
CH3 – CH2 – NH2 + CH3 – C = O
|
Cl
О
||
CH3 – C – NH – CH2 – CH3 + HCl
N-этилацетамид
ацетилхлорид
CH3 – CH2 – NH2 +
O
||
S – Cl
||
O
O
||
S – NH – CH2 – CH3
||
+ НСl
O
бензолсульфохлорид
N – этилбензолсульфамид
26
28.03.2019
27.
б) вторичные аминыСH3 – CH2 – NH + CH3 – C = O
|
|
CH3
Cl
CH3 – CH2 – NH
|
CH3
+
O CH3
||
|
CH3 – C – N – CH2 – CH3 +
N, N – метилэтилацетамид
O
||
S – Cl
||
O
O CH3
|| |
S – N – CH2 – CH3
||
O
HCl
+ HCl
N, N – метилэтилбензолсульфамид
27
28.03.2019
28.
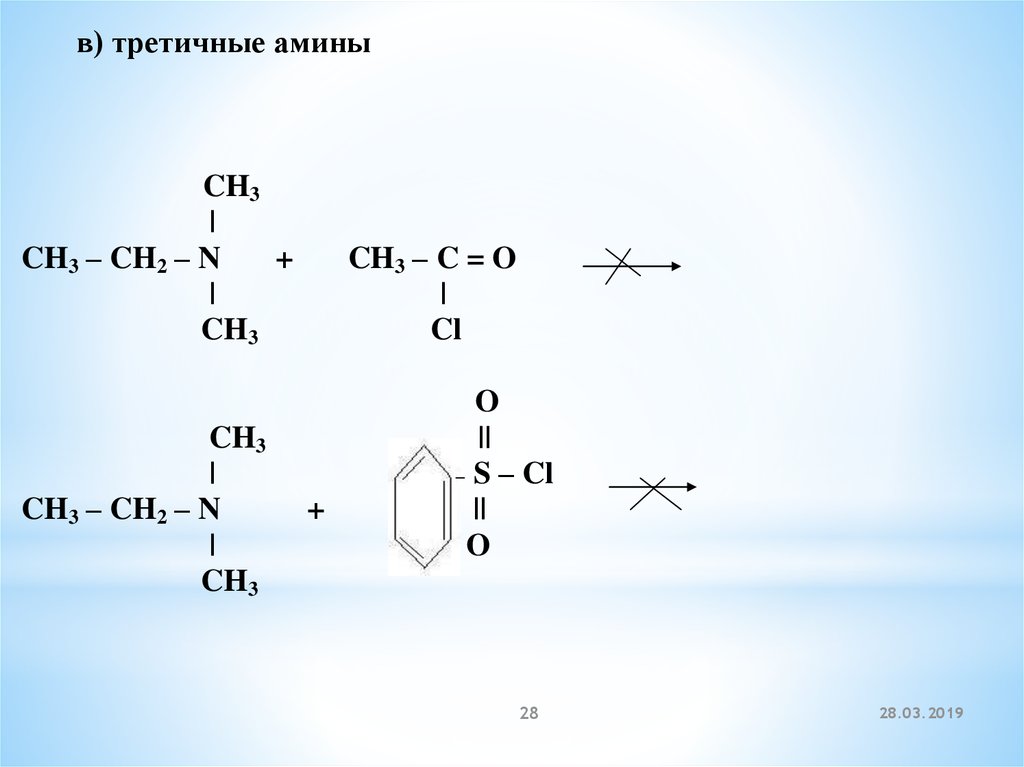
в) третичные аминыCH3
|
CH3 – CH2 – N
+
|
CH3
CH3
|
CH3 – CH2 – N
|
CH3
CH3 – C = O
|
Cl
+
O
||
S – Cl
||
O
28
28.03.2019
29.
5. Реакции с азотистой кислотой:а) первичные амины
CH3 – CH2 – NH2 + HONO
CH3 – CH2 – OH + N2 + H2O
б) вторичные амины
N=O
|
CH3 – CH2 – N – CH3 + H2O
CH3 – CH2 – NH – CH3 + HONO
N – нитрозо – N – метиламиноэтан
Нитрозоамины – сильные канцерогены!
29
28.03.2019
30.
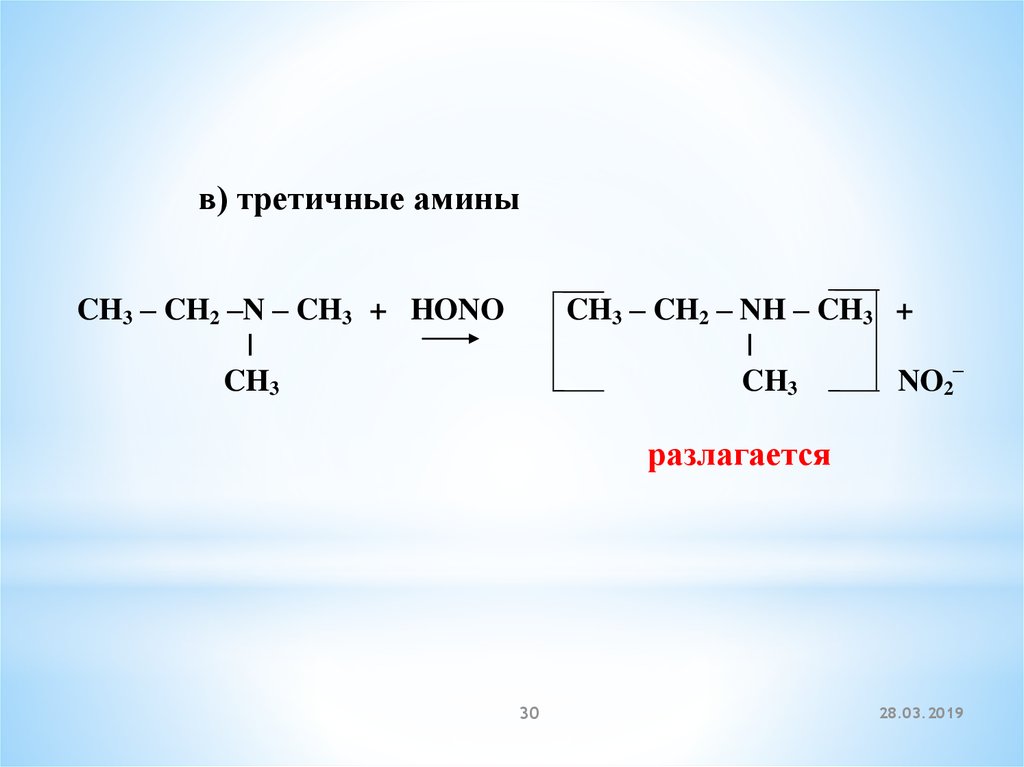
в) третичные аминыCH3 – CH2 –N – CH3 + HONO
|
CH3
CH3 – CH2 – NH – CH3 +
|
CH3
NO2–
разлагается
30
28.03.2019
31.
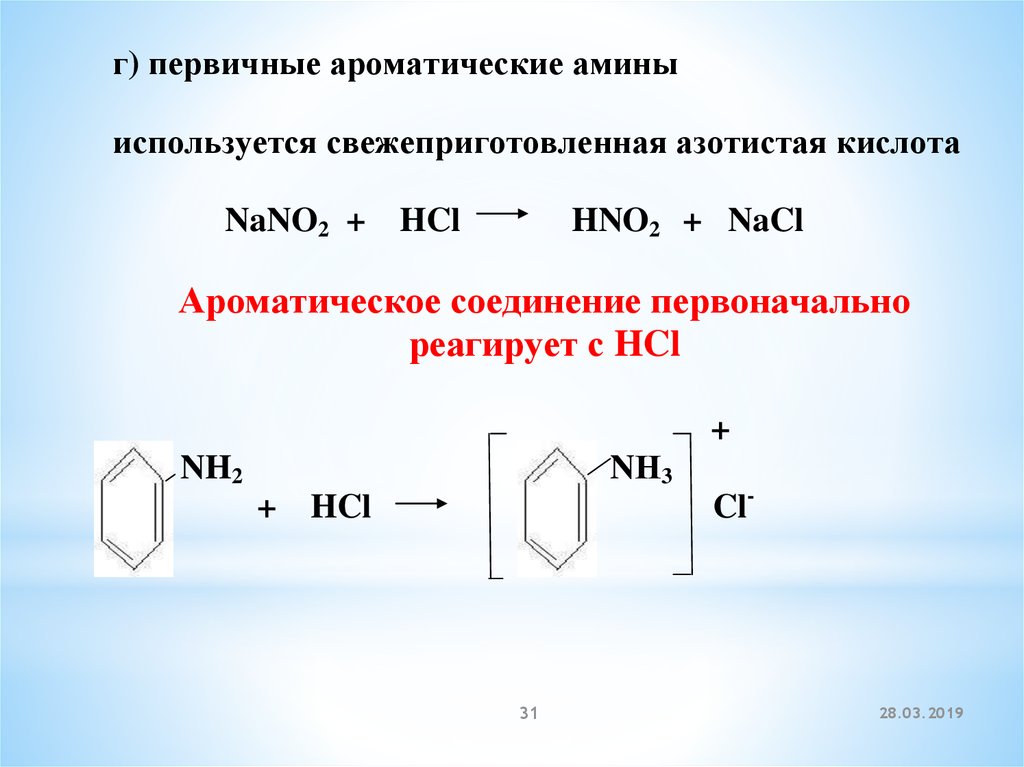
г) первичные ароматические аминыиспользуется свежеприготовленная азотистая кислота
NaNO2 + HCl
HNO2 + NaCl
Ароматическое соединение первоначально
реагирует с HCl
+
NH2
NН3
+
HCl
31
Cl-
28.03.2019
32.
33.
NH3 +Cl
N≡N
-
+
HNO2
Cl
-
+ H2O
фенилдиазонийхлорид
(соль диазония)
вторичные и третичные ароматические амины с азотистой
кислотой дают продукты реакции электрофильного
замещения
NH – CH3
+
NH – CH3
HNO2
+
H2 O
N=O
N-метил-п-нитрозоанилин
33
28.03.2019
34.
6.Реакции
бензольного
электрофильного замещения):
кольца
(все
реакции
Аминогруппа – заместитель 1-го рода (сильноактивирующий)
Направляет следующий заместитель в орто- и параположения
1) Галогенирование
NH2
NH2
Br
Br
+ Br2
+ HBr
Br
Выпадает осадок белого цвета
Качественная реакция на анилин
34
28.03.2019
35.
36.
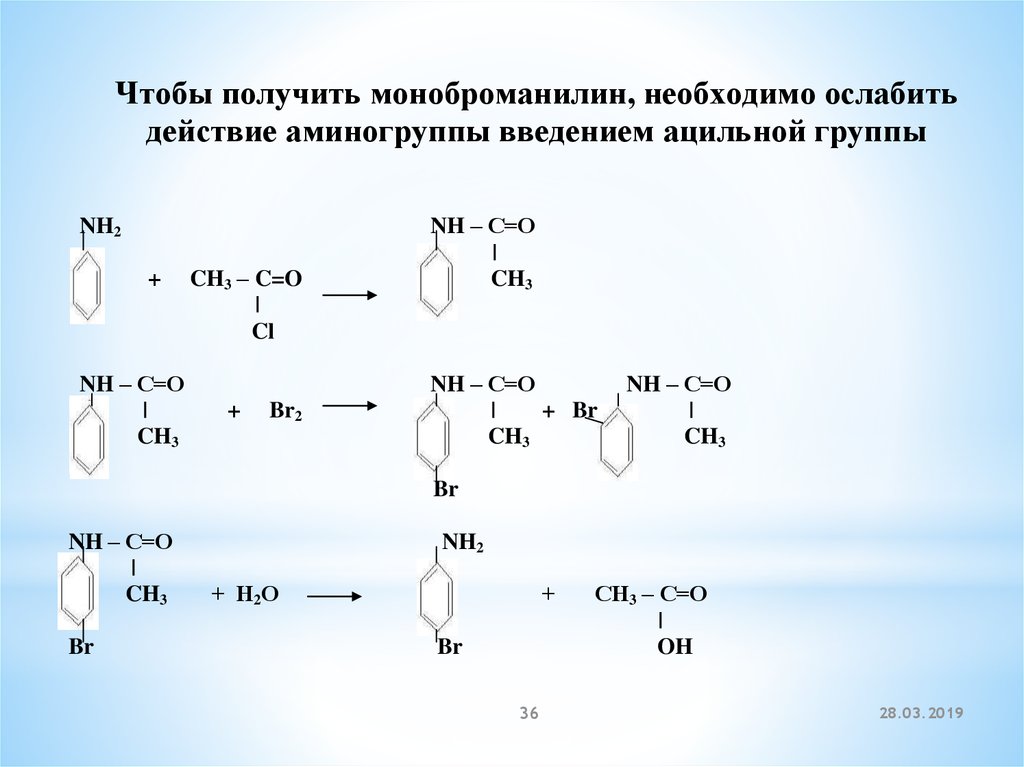
Чтобы получить моноброманилин, необходимо ослабитьдействие аминогруппы введением ацильной группы
NH2
+
NH – С=О
|
CH3
CH3 – C=O
|
Cl
+
Br2
NH – С=О
|
CH3
NH – С=О
|
+ Br
CH3
NH – С=О
|
CH3
Br
NH – С=О
|
CH3
Br
NH2
+ Н2О
+
Br
36
СН3 – С=О
|
OH
28.03.2019
37.
2) нитрованиеПри нитровании анилина образуется мета-нитроанилин, т.к.
аминогруппа проявляет основные свойства
NH2
NH3
+
H2SO4
НNO3 (H2SO4)
NH3
HSO4
NH2
HSO4
NO2
NO2
мета-нитроанилин
37
28.03.2019
38.
Чтобы получить орто- и пара-нитроанилины необходимоввести защиту в виде ацильной группы
NH2
+
NH – С=О
|
CH3
CH3 – C=O
|
Cl
+
НNO3
NH – С=О
|
CH3
NH – С=О
| + O2N
CH3
NH – С=О
|
CH3
NO2
пара- и орто- нитроацетанилид
NH – С=О
|
CH3
NO2
NH2
+ Н2О
+
NO2
СН3 – С=О
|
OH
38
28.03.2019
39.
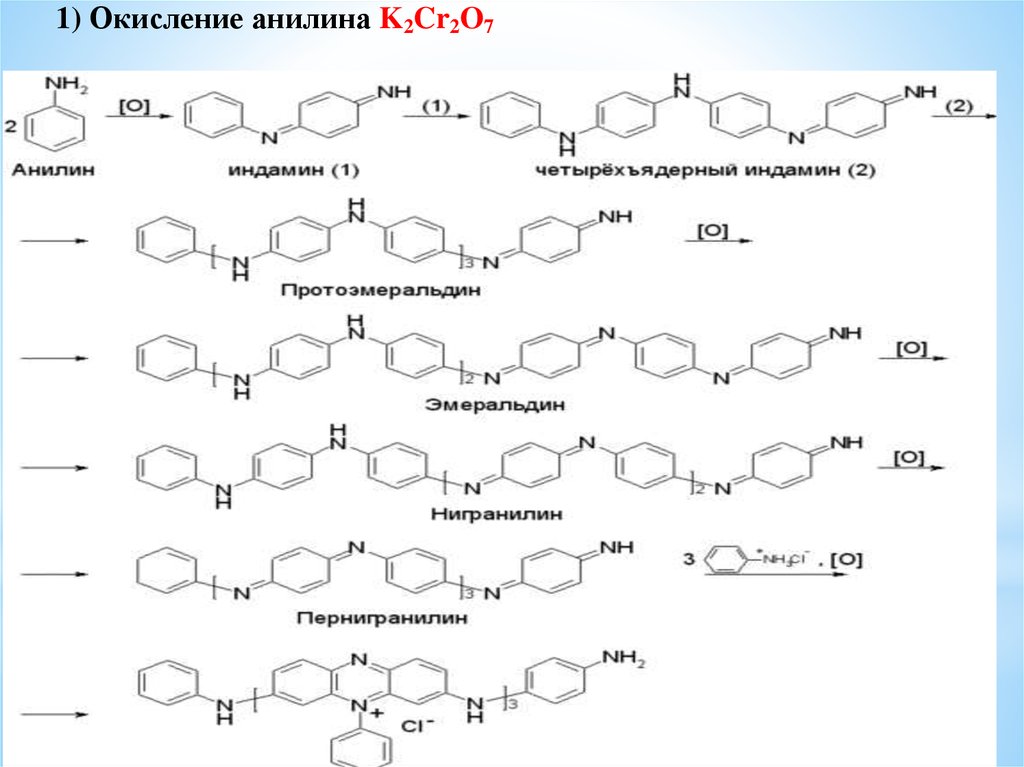
7. Окисление анилина(получение анилиновых красителей)
39
28.03.2019
40.
1) Окисление анилина K2Cr2O741.
42.
Окисление анилина раствором хлорной извести(СaOCl2)
42
28.03.2019
43.
44. Спасибо за Ваше внимание!
4428.03.2019



























 Химия
Химия