Похожие презентации:
Галогеналкены. Галогенарены
1.
Галогеналкены. Галогенарены.Реакционная способность галогенов со связью Csp2-Hal
..
Cl
.. ..
H2C CH
-I, +M
E=416 кДж/моль
..
.
.
Cl
..
NO2
O2N
Cl
-I, +M
E=344 кДж/моль
H3C
.. .
Cl
.. .
-I
E=293 кДж/моль
NO2
Активность в реакциях SNAr возрастает
Cl
Cl
Cl
Cl
Cl
I
II
III
IV
V
CH 2 =CH
Cl
CH 2
CH = Cl
1
2.
ГалогеналкеныH2C CH Cl
хлорэтен,
хлорвинил
Методы синтеза галогеналкенов
Дегидрогалогенирование вицинальных дигалогеналканов
Br
CH
H3C
CH
Br
OH
CH2
CH3
C
H3C
CH
CH2
CH3
Br
Присоединение галогенводородов к алкинам
H3C C C CH3 + HCl
HgCl2
Cl
H3C C C CH3
H
2
3.
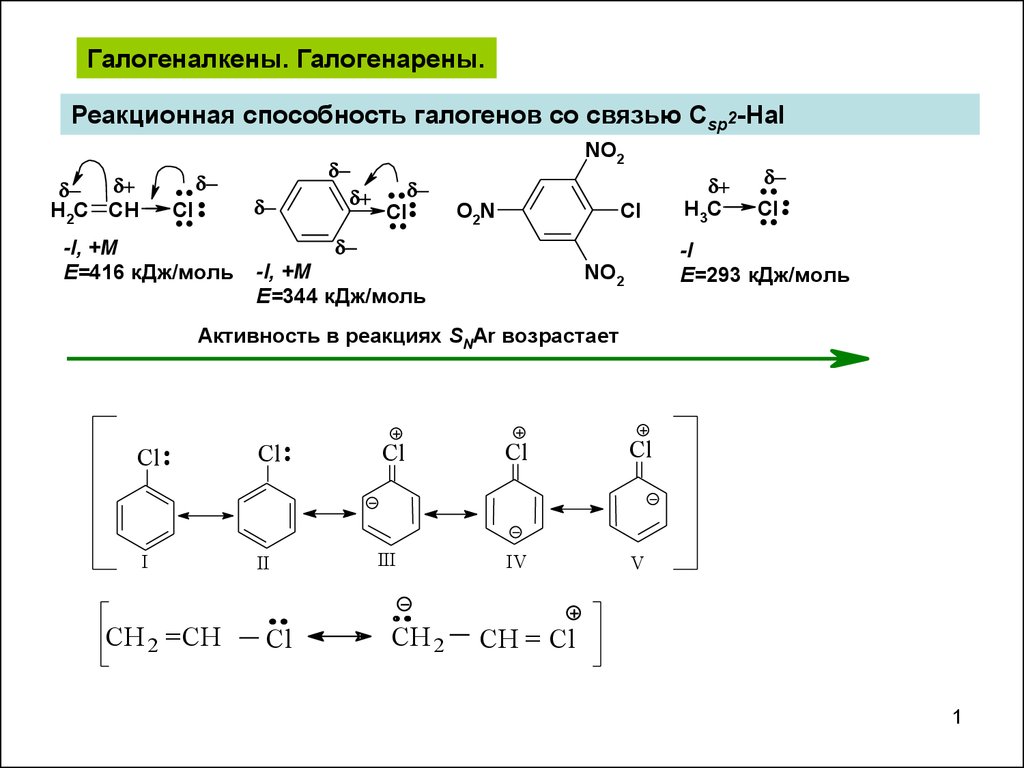
Химические свойстваРеакции AdE
Cl
HCl
H2C CH Cl
H3C CH Cl
Cl2
Скорость реакции ниже, чем для алкенов.
Почему?
Cl Cl
H2C CH Cl
Полимеризация
Cl
(n+2) H2C CH Cl
(n+2) F2C CF2
Cl
Cl
CH2 ПХВ
C
C
H3C H C H C
nH
H2
F
F
F
F
CF2 политетафторэтилен,
C
C
C
RF2C
C
фторопласт, тефлон
F n
F
F
CH2
Cl
H2
C
H
C
C
RCH
C
2
хлоропрен
H
(n+2) H2C
Cl
C
Cl
C
H2
C
C
H
H2
C
Cl
C
nH
C
C
H
CHR
хлоропреновый каучук
3
4.
ГАЛОГЕНАРЕНЫJ
Br
Cl
Cl
Методы синтеза галогенаренов
Хлорирование и бромирование аренов. Реакции SEAr
H
H
Cl
H
+ Cl2
H
Fe, 25 OC
H
H
H
+ HCl
H
H
Галогенирующие
реагенты: Cl2, Br2
Катализаторы: кислоты
Льюиса (AlCl3, FeCl3)
H
H
Хлорбензол
Br
+
+
Br2
Br
4-бромбифенил
2-бромбифенил
4
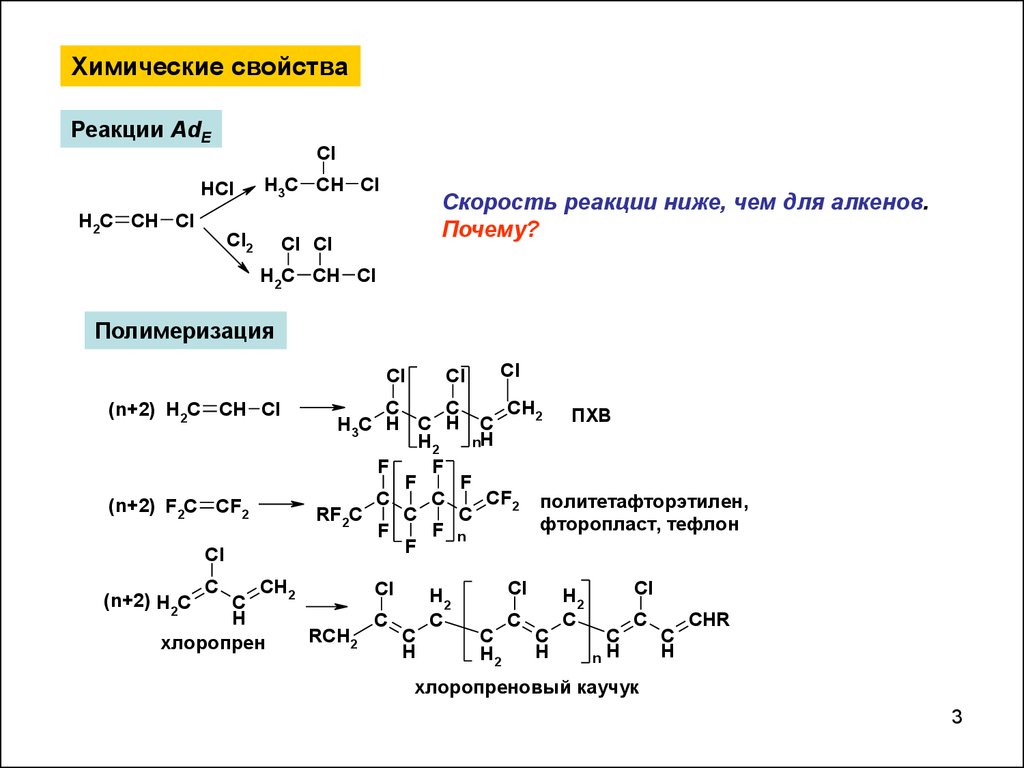
5.
Получение фтор-, иодбензола через соли диазония+
F
N2 BF4
NH2
200 OC
HNO2, HBF4
+
I
N2 Cl
NaNO2, HCl
BF3
CH3
CH3
CH3
NH2
+ N2 +
KI, H2O
25
OC
+ N2 +
KI
5
6.
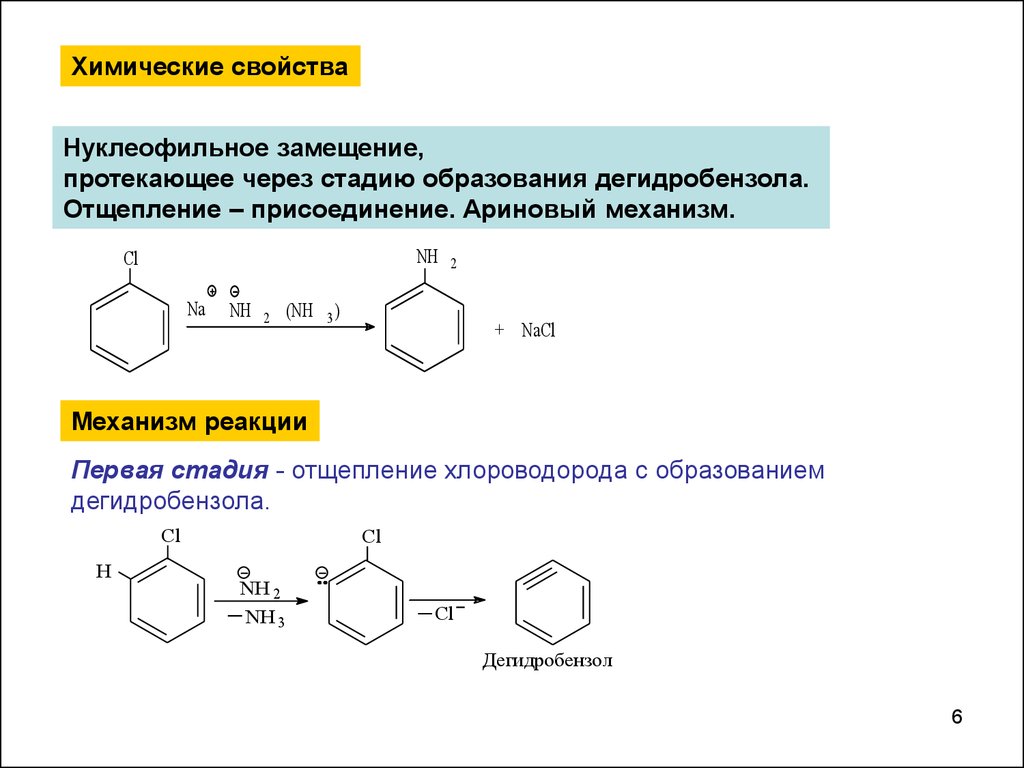
Химические свойстваНуклеофильное замещение,
протекающее через стадию образования дегидробензола.
Отщепление – присоединение. Ариновый механизм.
NH
Cl
Na
NH
2
(NH
2
3)
+ NaCl
Механизм реакции
Первая стадия - отщепление хлороводорода с образованием
дегидробензола.
Cl
H
Cl
NH 2
NH 3
Cl
Дегидробензол
6
7.
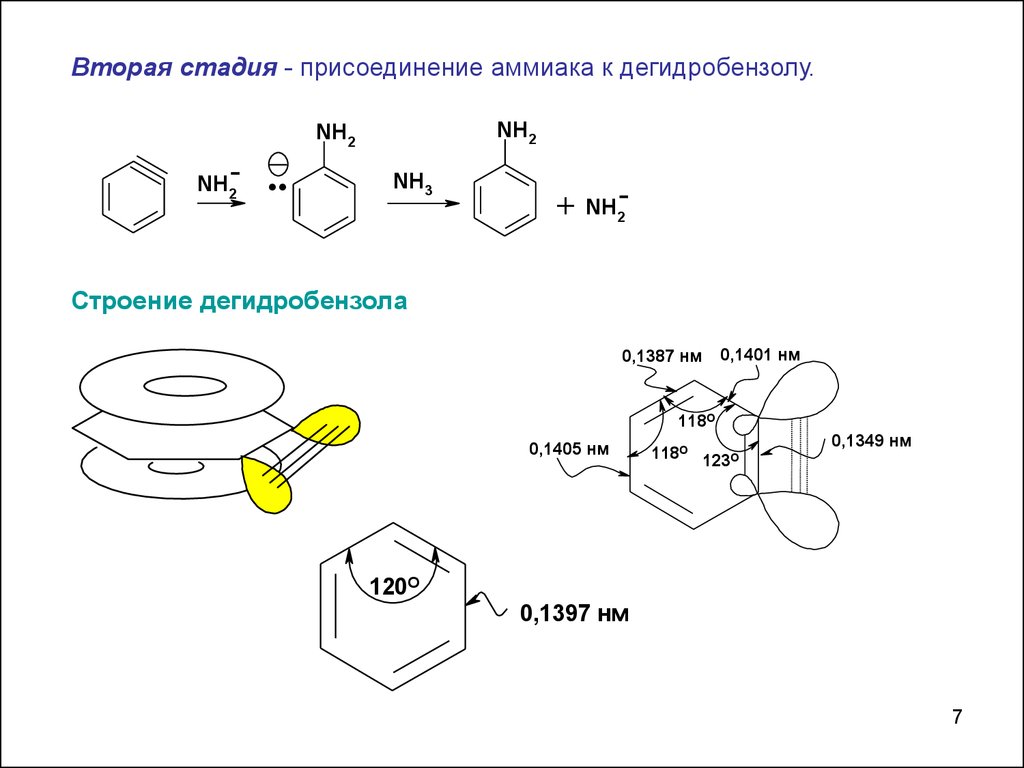
Вторая стадия - присоединение аммиака к дегидробензолу.NH2
NH2
NH2
..
NH3
+
NH2
Строение дегидробензола
0,1387 нм
0,1401 нм
118O
0,1405 нм
118O 123O
0,1349 нм
120O
0,1397 нм
7
8.
Cl*
NH 2
*
H
*
*
NH 3
NH 2
NH 2
и
NH 3
Cl
50%
50%
анилин-2-14С
анилин-1-14С
CH3
CH3
Cl
H
+
CH3
H2 O
NaOH
OH
350-400 OC
+
м-крезол
о-крезол
2
Br
H3C
OH
NH2 (NH3)
OMe
:
3
реакция не идет по ариновому,
механизму т.к. отсутствуют атомы
водорода в о-положениях к брому
OH
Br Li-Hg
Li
O
-LiF
-LiBr
F
O
HCl(C2H5OH)
F
(76%)
11-оксатрицикло[6.2.1.02,7]
ундеак-2,4,6,9-тетраен
8
9.
Бимолекулярное нуклеофильное замещение путемприсоединения - отщепления SN2Ar
Cl
OH
NaOH (68 %), 350 OC, P
OH
Cl
NaOH (15 %), 160 OC, P
+
+
N
N
O
O
O
N
O
H2O, ~100 OC
O
+
N
N
O
+
+
N
N
O
O
OH
+
+
N
O
O
O
Cl
+
O
O
O
O
O
9
10.
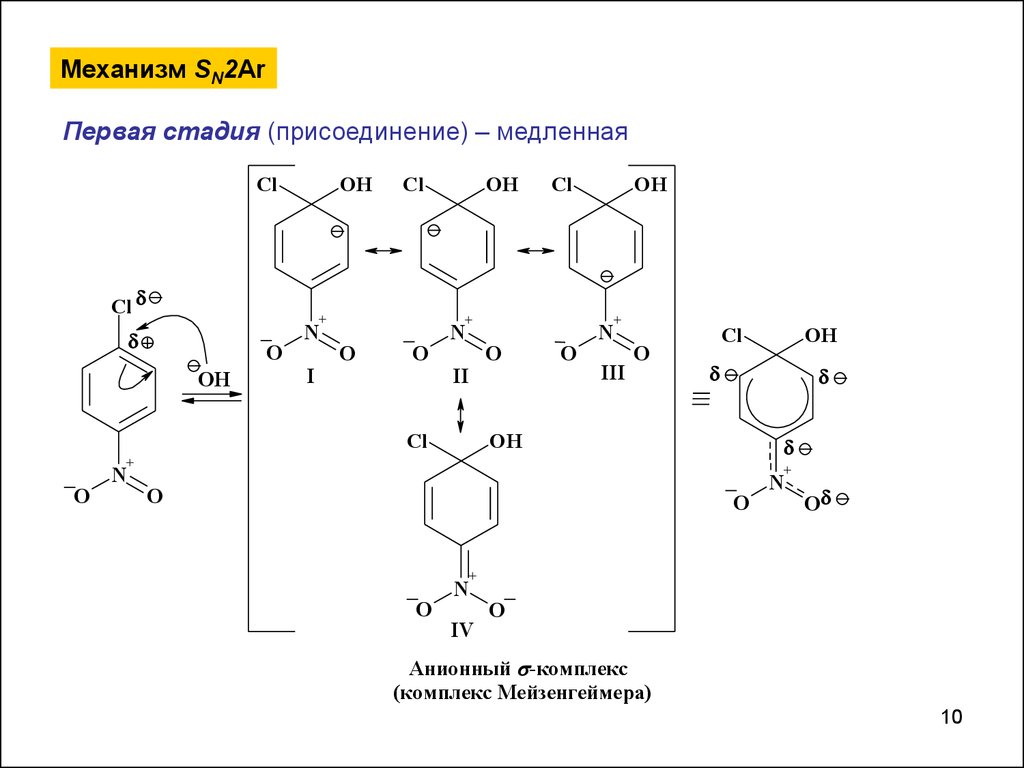
Механизм SN2ArПервая стадия (присоединение) – медленная
Cl
OH
Cl
+
O
OH
N
I
Cl
+
O
O
OH
N
+
II
Cl
O
N
Cl
O
O
OH
N
+
III
O
Cl
OH
OH
+
O
O
O
N
N
+
O
+
IV
O
Анионный -комплекс
(комплекс Мейзенгеймера)
10
11.
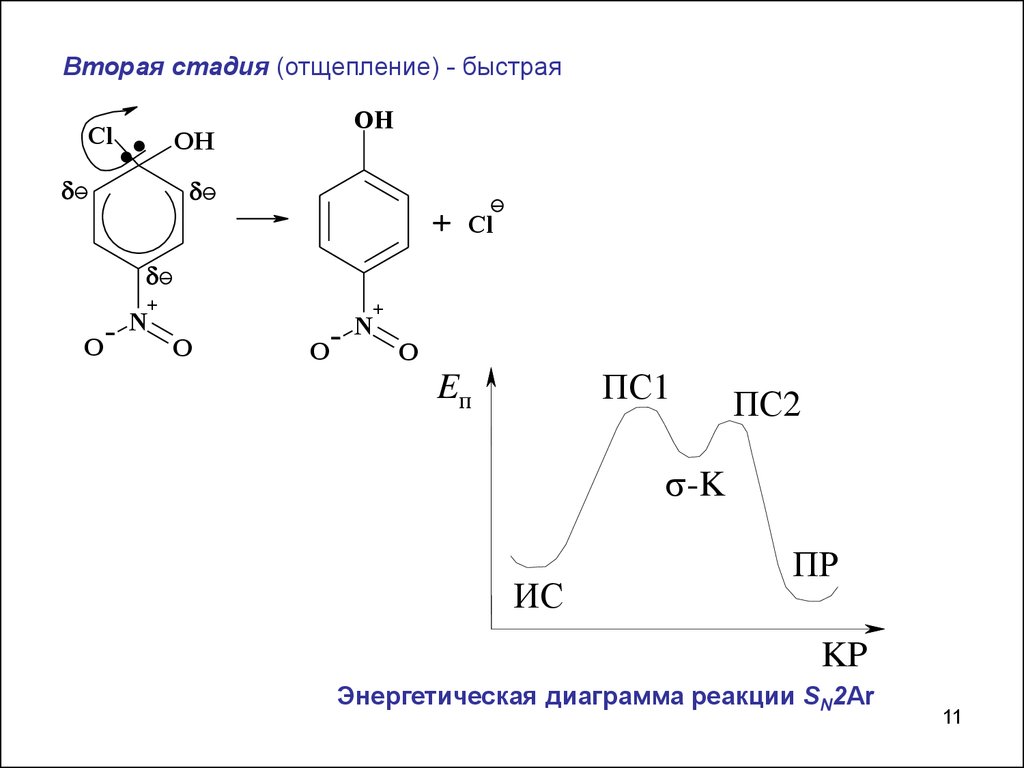
Вторая стадия (отщепление) - быстраяCl
..
OH
OH
Cl
O
N
+
O
O
N
+
O
ПС1
Eп
ПС2
-K
ИС
ПР
KP
Энергетическая диаграмма реакции SN2Ar
11
12.
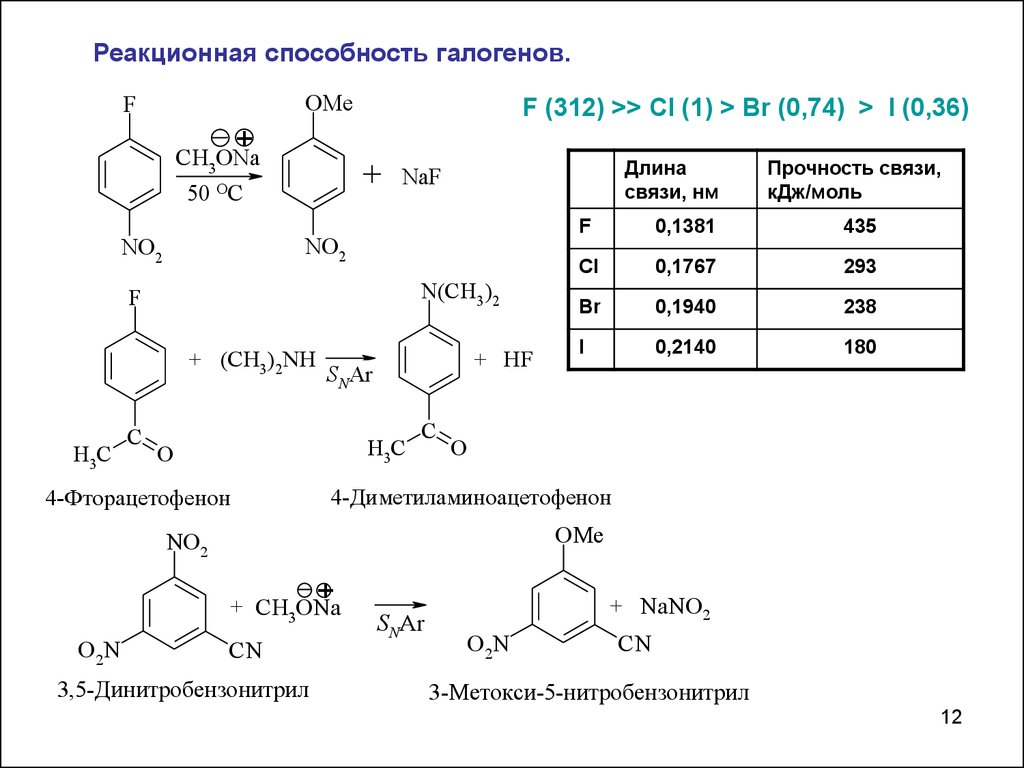
Реакционная способность галогенов.OMe
F
F (312) >> Cl (1) > Br (0,74) > I (0,36)
+
CH3ONa
+
50 OC
NO2
NO2
N(CH3)2
F
+ (CH3)2NH
H3C
C
Длина
связи, нм
NaF
+ HF
SNAr
H3C
O
4-Фторацетофенон
C
F
0,1381
435
Cl
0,1767
293
Br
0,1940
238
I
0,2140
180
O
4-Диметиламиноацетофенон
OMe
NO2
+
+ CH3ONa
O2N
Прочность связи,
кДж/моль
CN
3,5-Динитробензонитрил
SNAr
+ NaNO2
O2N
CN
3-Метокси-5-нитробензонитрил
12
13.
Ориентация при нуклеофильном замещении в ароматическомкольце
OH
Cl
OH
Cl
Cl
OH
OH
Cl
пара- -комплекс
N
N
O
O
O
N
O
Cl
OH
O
N
OH
мета- -комплекс
N
O
O
V
IV
III
Cl
O
O
O
O
II
OH
Cl
O
O
O
I
N
N
VI
VII
13
14.
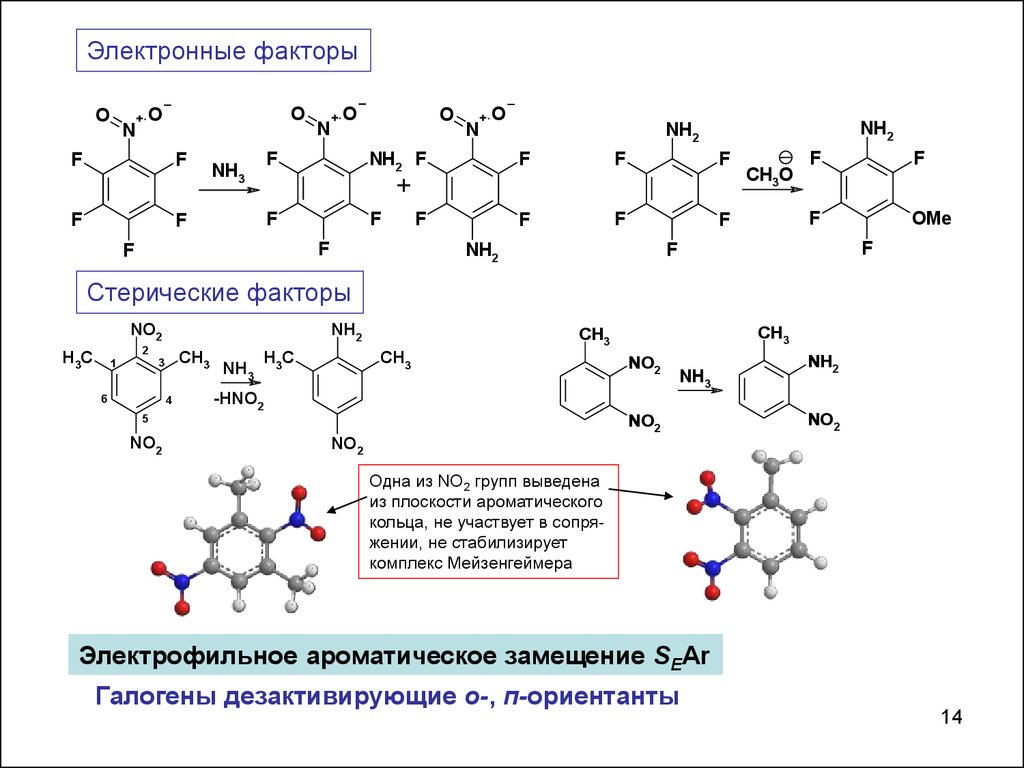
Электронные факторыO
N
+
O
O
F
F
F
N
+
O
F
NH3
O
N
+
O
NH2 F
NH2
NH2
F
F
F
F
F
F
+
F
F
F
F
F
F
NH2
CH3O
F
F
F
OMe
F
F
Стерические факторы
NO2
NH2
2
H3C
CH3
3
1
6
4
NH3
H3C
CH3
NO2
NH3
NH2
-HNO2
NO2
5
NO2
CH3
CH3
NO2
NO2
Одна из NO2 групп выведена
из плоскости ароматического
кольца, не участвует в сопряжении, не стабилизирует
комплекс Мейзенгеймера
Электрофильное ароматическое замещение SEAr
Галогены дезактивирующие о-, п-ориентанты
14
15.
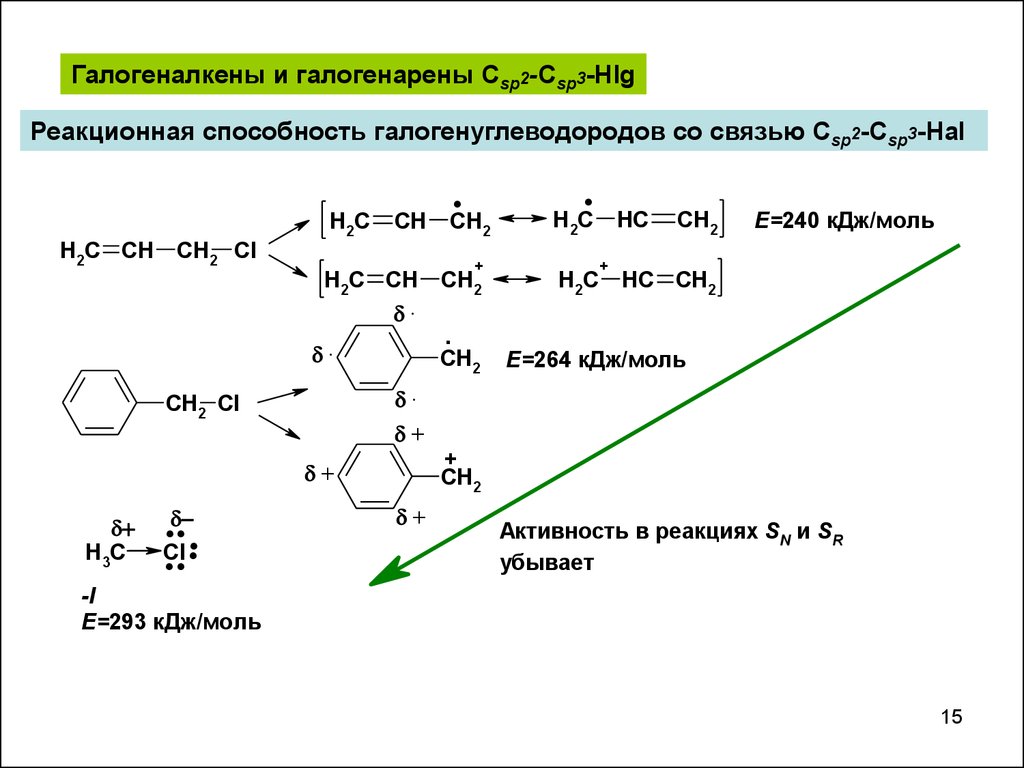
Галогеналкены и галогенарены Csp2-Csp3-HlgРеакционная способность галогенуглеводородов со связью Csp2-Csp3-Hal
H2C
H2C CH
CH
CH2
CH2 Cl
H2C CH
.
.
.
CH2
H2C
HC
+
CH2
Е=240 кДж/моль
HC CH2
Е=264 кДж/моль
+
+
CH2
+
.. .
Cl
.. .
+
CH2
.
H2C
.
CH2 Cl
H3C
.
+
Активность в реакциях SN и SR
убывает
-I
E=293 кДж/моль
15
16.
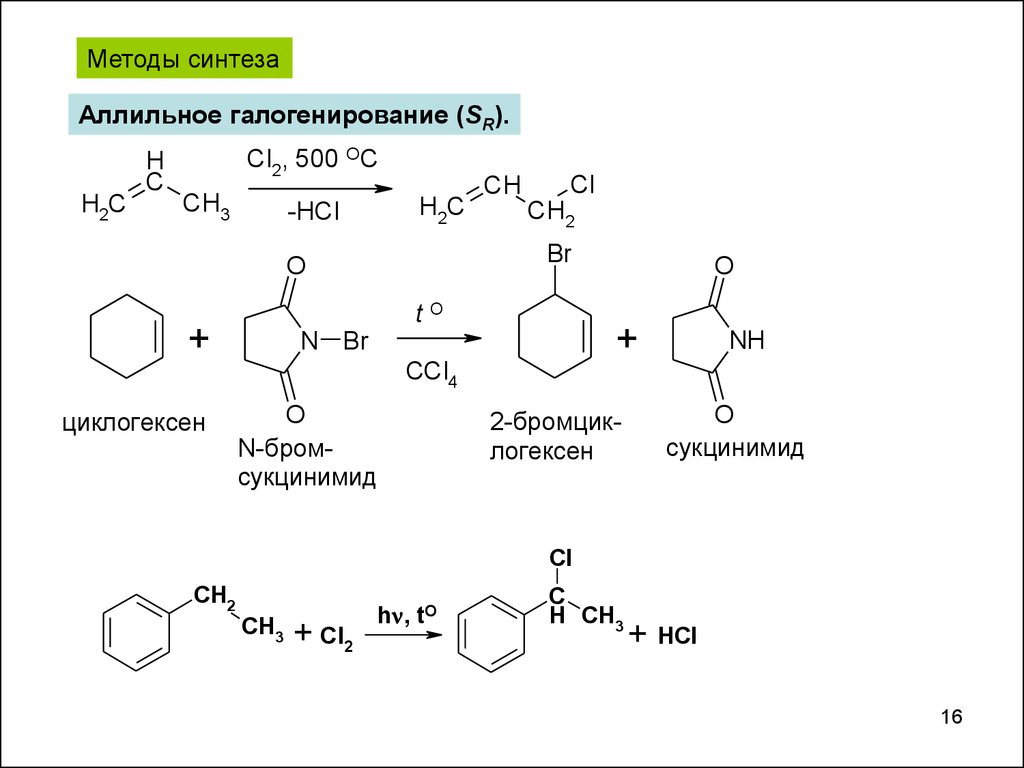
Методы синтезаАллильное галогенирование (SR).
H2C
H
C
Cl2, 500 OC
CH3
H2C
-HCl
CH
Cl
CH2
Br
O
tO
+
O
+
N Br
NH
CCl4
циклогексен
O
N-бромсукцинимид
2-бромциклогексен
O
сукцинимид
Cl
CH2
CH3
+ Cl2
h , tO
C
H CH3
+ HCl
16
17.
Химические свойства+
H3C CH2 CH HC CH CH3
I
+
H3C CH2 HC CH CH CH3
III
+
+
C
C
C
C
C
C
C
C
17
18.
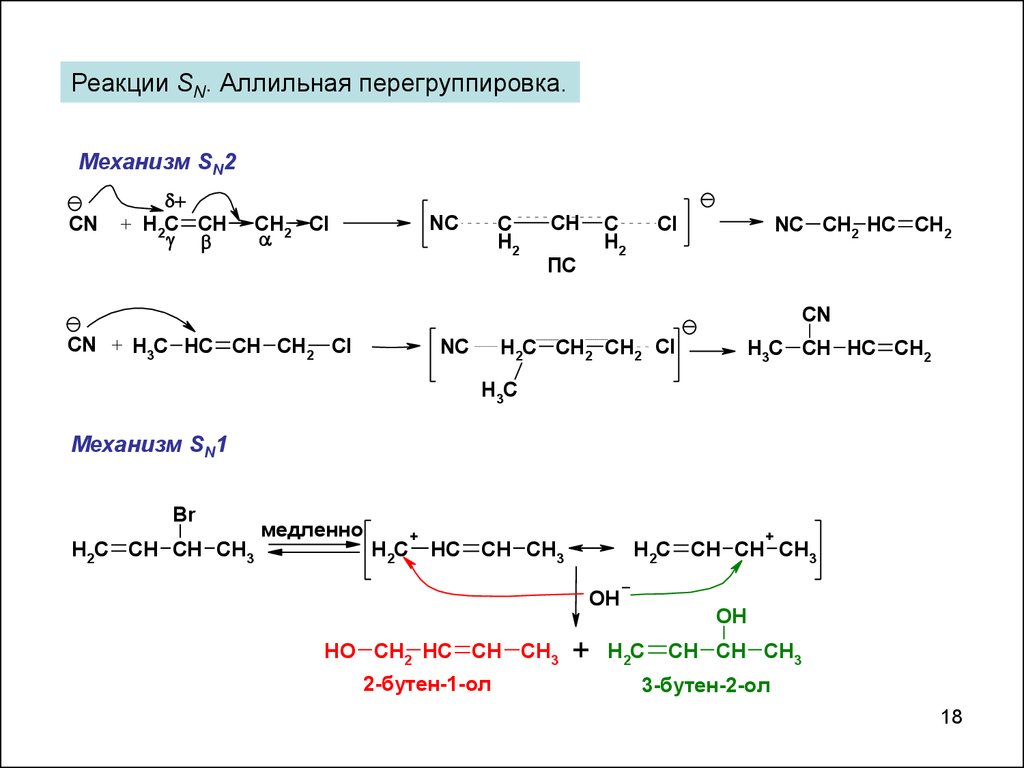
Реакции SN. Аллильная перегруппировка.Механизм SN2
CN
H2C CH
NC
CH2 Cl
C
H2
CH
C
H2
ПС
Cl
NC CH2 HC CH2
CN
CN H3C HC CH CH2 Cl
NC
H2C CH2 CH2 Cl
H3C CH HC CH2
H3C
Механизм SN1
Br
H2C CH CH CH3
медленно
H2C
+
+
HC CH CH3
H2C CH CH CH3
OH
HO CH2 HC CH CH3
2-бутен-1-ол
+
OH
H2C
CH CH CH3
3-бутен-2-ол
18
19.
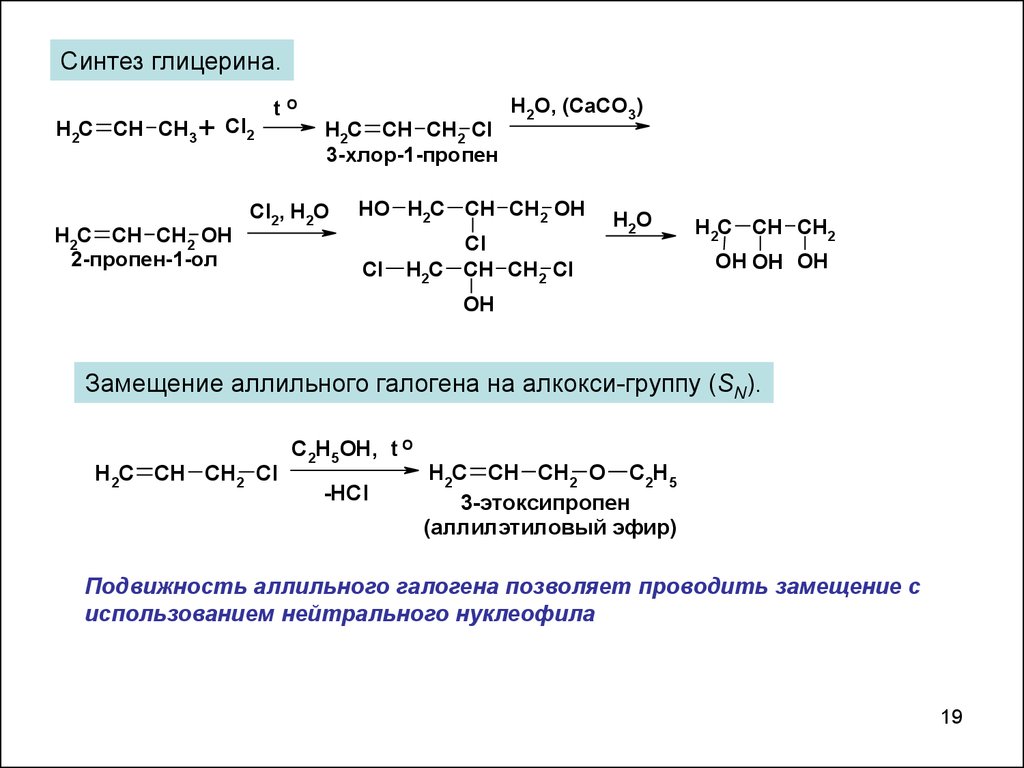
Синтез глицерина.H2C CH CH3 + Cl2
H2C CH CH2 OH
2-пропен-1-ол
tO
H2C CH CH2 Cl
3-хлор-1-пропен
Cl2, H2O
H2O, (CaCO3)
HO H2C CH CH2 OH
Cl
Cl
H2C CH CH2 Cl
H 2O
H2C CH CH2
OH OH OH
OH
Замещение аллильного галогена на алкокси-группу (SN).
H2C CH CH2 Cl
C2H5OH, t O
-HCl
H2C CH CH2 O C2H5
3-этоксипропен
(аллилэтиловый эфир)
Подвижность аллильного галогена позволяет проводить замещение с
использованием нейтрального нуклеофила
19
20.
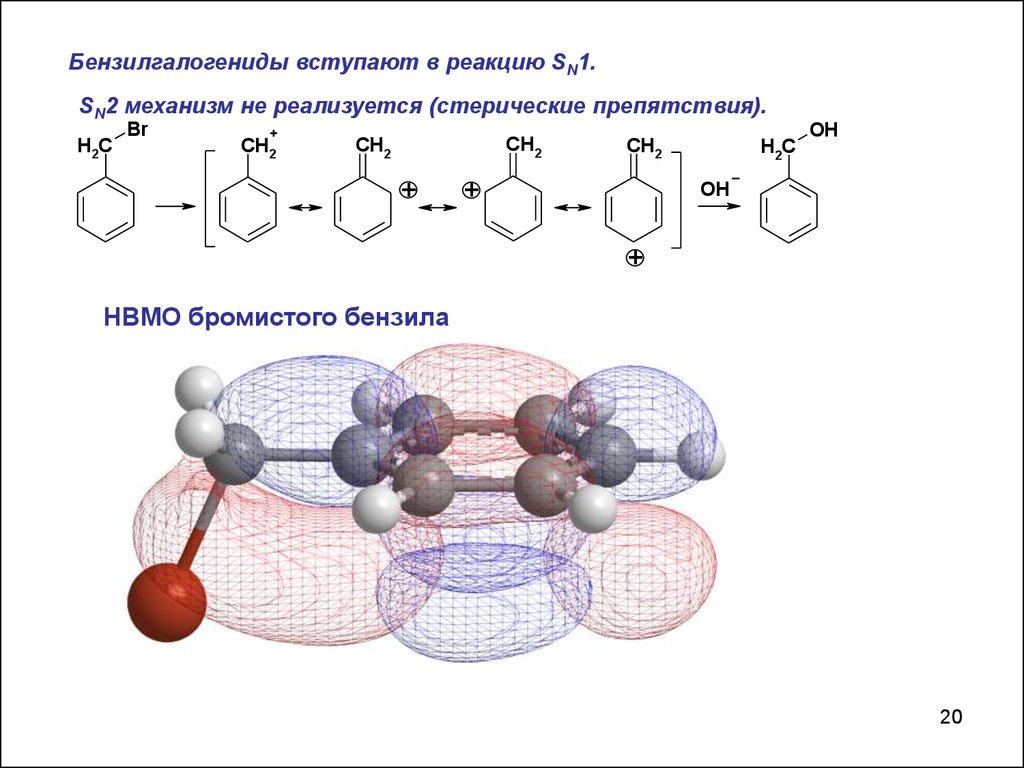
Бензилгалогениды вступают в реакцию SN1.SN2 механизм не реализуется (стерические препятствия).
H2C
Br
+
CH2
CH2
CH2
+
CH2
+
H2C
OH
OH
+
НВМО бромистого бензила
20
21.
Примеры реакций алкилирования бензилхлоридом (SN) .(C2H5)2NH, K2CO3
C6H5CH2N(C2H5)2
100 OC
N-бензил-N-этил-1-этанамин
(бензилэтиламин)
C6H5CH2CN
25 OC
80
CH3CONH2
OC
1/2 C6H5CH2SCH2C6H5
1-бензилсульфанилметилбензол
(дибензилсульфид)
C6H5CH2Cl
NaCN (C2H5OH)
1-фенилацетонитрил
(бензилцианид)
1/2 Na2S (C2H5OH)
200
CH3CONHCH2C6H5
N-бензилацетамид
OC
Бензилгалогениды – лакриматоры.
C6H5 CH2 Cl
NaI
H2O
C6H5 CH2 OH
+ HCl
H2O
C6H5 CH2 I
полицейский
газ
C6H5 CH2 OH
+
HI
21







 Химия
Химия