Похожие презентации:
Азотсодержащие соединения
1. ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
2.
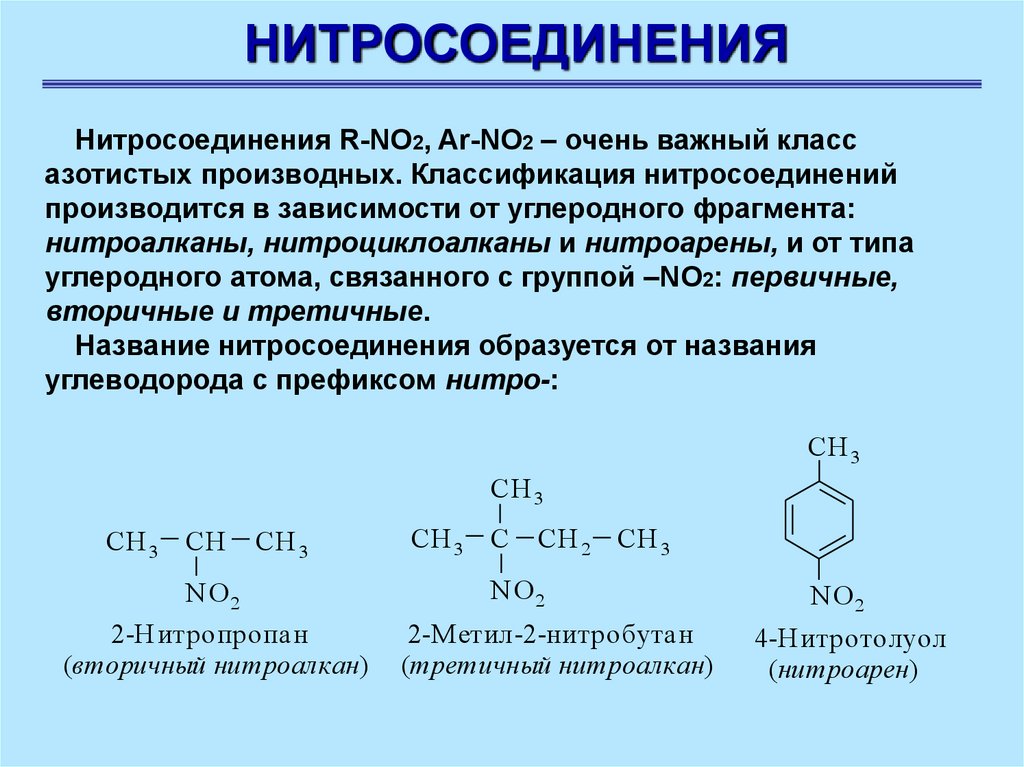
НИТРОСОЕДИНЕНИЯНитросоединения R-NO2, Ar-NO2 – очень важный класс
азотистых производных. Классификация нитросоединений
производится в зависимости от углеродного фрагмента:
нитроалканы, нитроциклоалканы и нитроарены, и от типа
углеродного атома, связанного с группой –NO2: первичные,
вторичные и третичные.
Название нитросоединения образуется от названия
углеводорода с префиксом нитро-:
СН 3
СН 3
CH 3
CH
CH 3
N O2
2-Н итропропан
(вторичный нитроалкан)
CH 3
C
CH 2
СН 3
N O2
2-М етил-2-нитробутан
(третичный нитроалкан)
N O2
4-Н итротолуол
(нитроарен)
3.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитрогруппа сильно полярна
+
R
N
O
O
R
+
N
O
O
+
R
N
O
1/2
O 1/2
В каждой из граничных структур показана семиполярная связь –
ковалентная донорно-акцепторная связь между азотом и
кислородом, образованная за счет пары электронов только одного
атома азота, вследствие чего оба атома получают заряды: атом
кислорода, акцептор пары электронов – отрицательный, атом азота,
донор пары электронов – положительный заряд
4.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
электроноакцепторная группа
(-I, -M – эффекты)
-NO2
O
N
+
..
..O
..
5.
НИТРОСОЕДИНЕНИЯСтроение и физические свойства
Нитроалканы представляют собой бесцветные жидкости с
высокими для их молекулярных масс температурами кипения.
Температура кипения нитрометана 101,2 оС; нитроэтана – 114 оС.
Они обладают приятным запахом, перегоняются без
разложения, мало растворимы в воде, ядовиты. Нитроалкены и
нитроарены – жидкие или твердые вещества желтого цвета. Они
тяжелее воды и не растворимы в ней. Эти нитросоединения
имеют острый запах и высокотоксичны, особенно нитробензол
6.
НИТРОСОЕДИНЕНИЯХимические свойства
Термодинамическая неустойчивость нитросоединений
Молярная теплота разложения нитрометана около 270 кДж/моль
СН3NO2→ 1/2 N2 + CO2 + 3/2 H2
Значительная энергия и большая скорость такого процесса
послужили основой для практического применения
нитросоединений в качестве взрывчатых веществ
7.
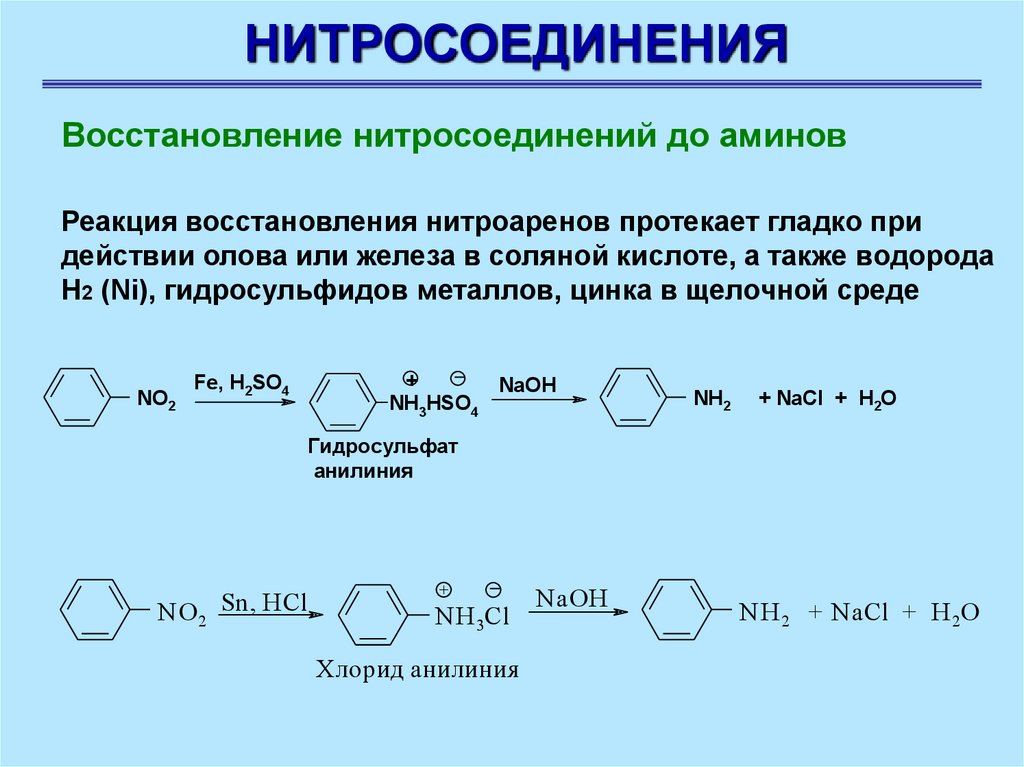
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Восстановление нитросоединений до аминов – наиболее
важная реакция для синтеза азотсодержащих соединений.
Нитроалканы восстанавливают до алкиламинов оловом или
железом в кислой среде, водородом в условиях гетерогенного
катализа
СН 3NO 2
H 2, Ni
СН 3NH 2 + 2H 2O,
∆Н= -356 кДж/моль
8.
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
Реакция восстановления нитроаренов протекает гладко при
действии олова или железа в соляной кислоте, а также водорода
Н2 (Ni), гидросульфидов металлов, цинка в щелочной среде
NO2
+
NaOH
NH3HSO4
Fe, H2SO4
NH2
+ NaCl + H2O
Гидросульфат
анилиния
NO 2 Sn, HCl
+
NH 3Cl
Хлорид анилиния
NaOH
NH 2 + NaCl + H 2O
9.
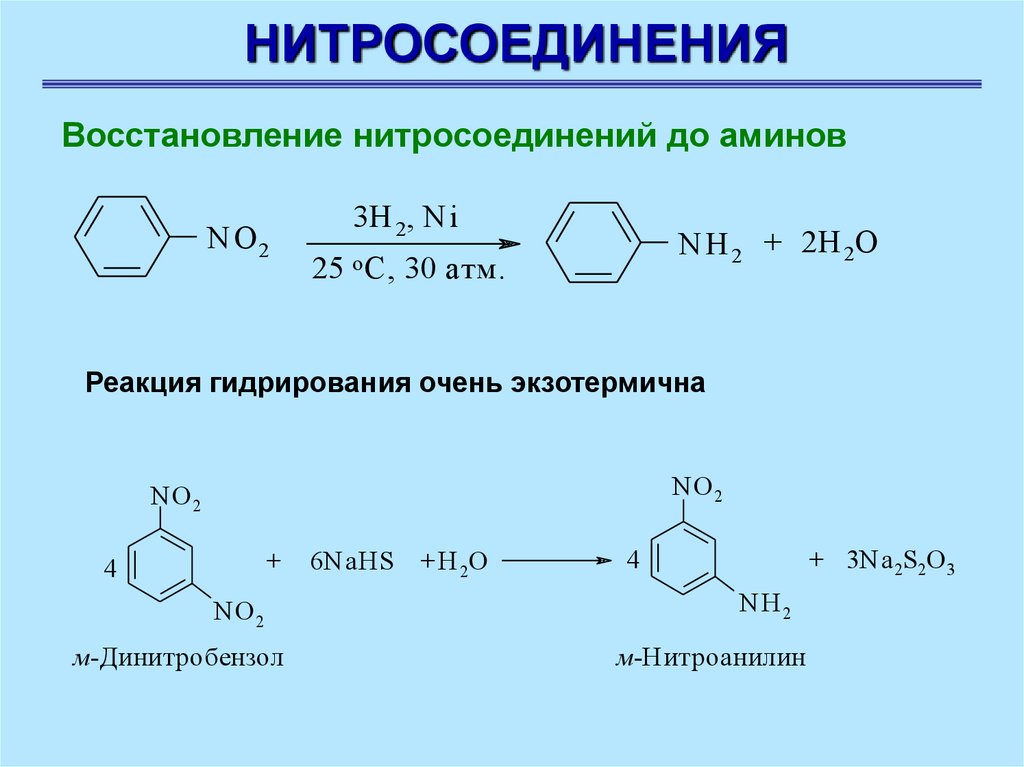
НИТРОСОЕДИНЕНИЯВосстановление нитросоединений до аминов
NO 2
3H 2, Ni
25
o C,
NH 2 + 2H 2O
30 атм.
Реакция гидрирования очень экзотермична
N O2
N O2
+
4
N O2
м-Динитробензол
6NaHS
+ H 2O
4
+ 3Na 2S2O 3
NH2
м-Н итроанилин
10.
НИТРОСОЕДИНЕНИЯЗИНИН
Николай Николаевич
(25.VIII.1812–18.II.1880)
академик, возглавлял кафедру
общей химии Медикохирургической академии в
Петербурге, организатор и
первый президент Русского
химического общества. Известен
своими работами в области
ароматических нитросоединений.
11.
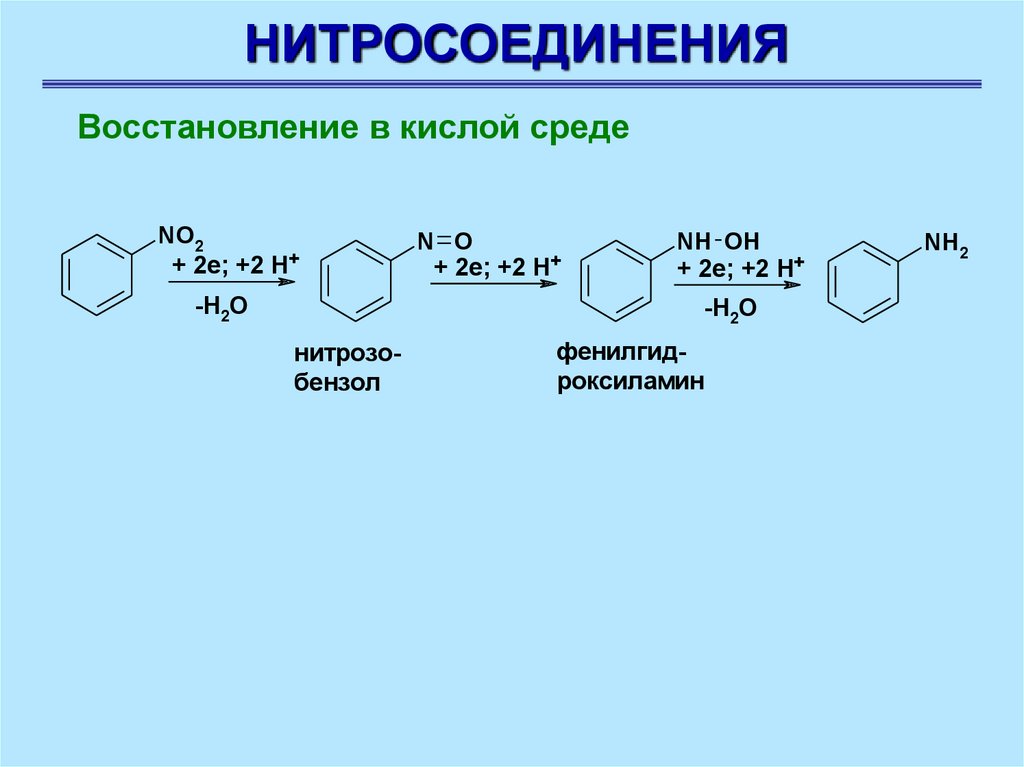
НИТРОСОЕДИНЕНИЯВосстановление в кислой среде
NO2
+ 2e; +2 H+
-H2O
N O
+ 2e; +2 H+
NH OH
+ 2e; +2 H+
-H2O
нитрозобензол
фенилгидроксиламин
NH2
12.
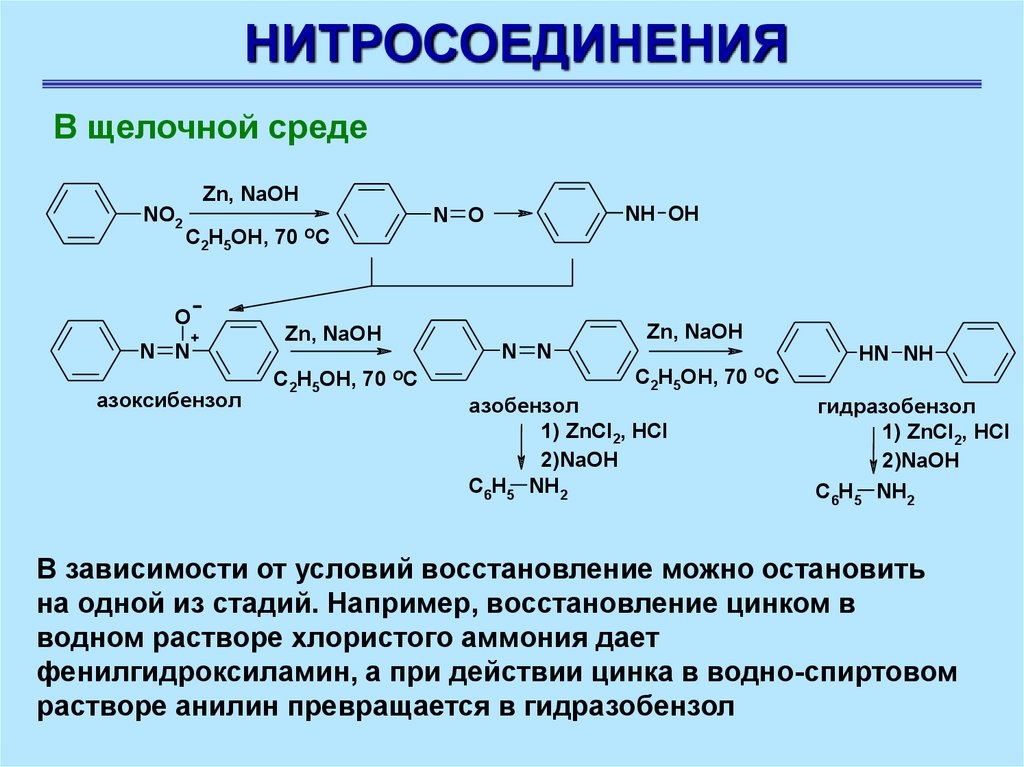
НИТРОСОЕДИНЕНИЯВ щелочной среде
NO2
Zn, NaOH
C2H5OH, 70
O
N N
+
азоксибензол
Zn, NaOH
C2H5OH, 70
NH OH
N O
OC
N N
OC
Zn, NaOH
C2H5OH, 70
азобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
HN NH
OC
гидразобензол
1) ZnCl2, HCl
2)NaOH
C6H5 NH2
В зависимости от условий восстановление можно остановить
на одной из стадий. Например, восстановление цинком в
водном растворе хлористого аммония дает
фенилгидроксиламин, а при действии цинка в водно-спиртовом
растворе анилин превращается в гидразобензол
13.
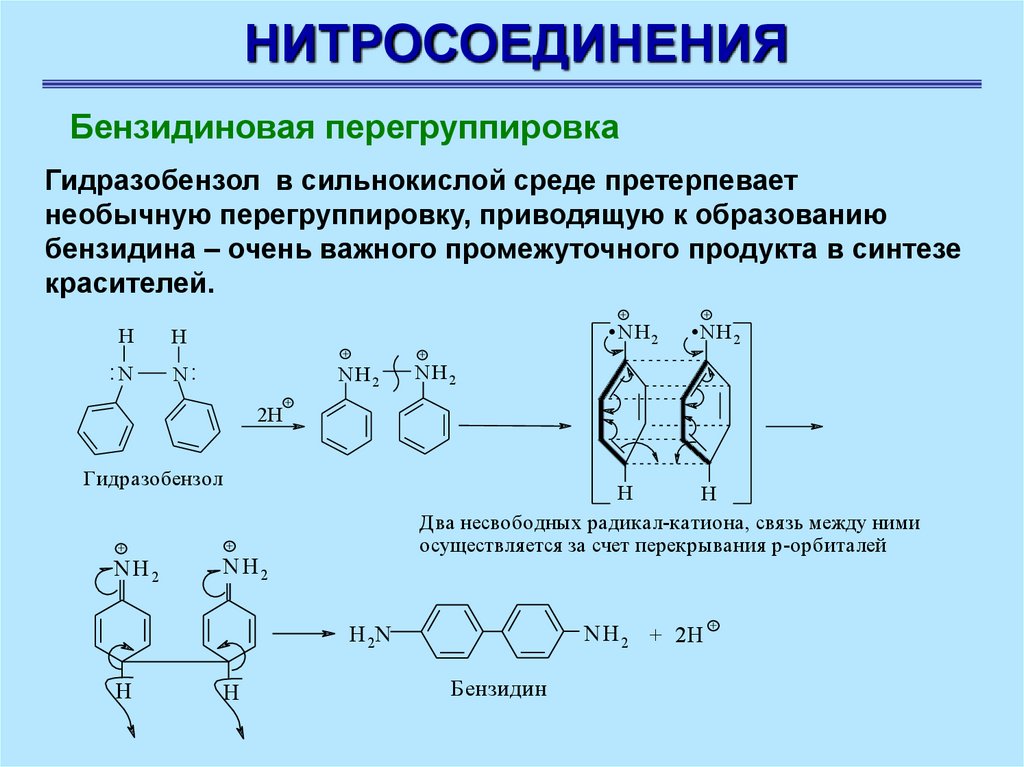
НИТРОСОЕДИНЕНИЯБензидиновая перегруппировка
Гидразобензол в сильнокислой среде претерпевает
необычную перегруппировку, приводящую к образованию
бензидина – очень важного промежуточного продукта в синтезе
красителей.
.N H .N H
+
H
:N
H
2
+
N:
NH2
+
Гидразобензол
NH 2
H
H
Два несвободных радикал-катиона, свя зь между ними
осуществля ется за счет перекрывания р-орбиталей
+
NH 2
NH 2 + 2H
H 2N
H
H
2
+
NH2
2H
+
+
Бензидин
+
14.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Нитрометан обладает настолько сильными кислотными
свойствами, что способен растворяться в едком натре
+
CH 2 N
H
OH
+
Na
O
O
+
-H 2O
CH 2 N
O
O
+
CH 2 N
+
Na
O
O
+
CH 2 N
O
O
15.
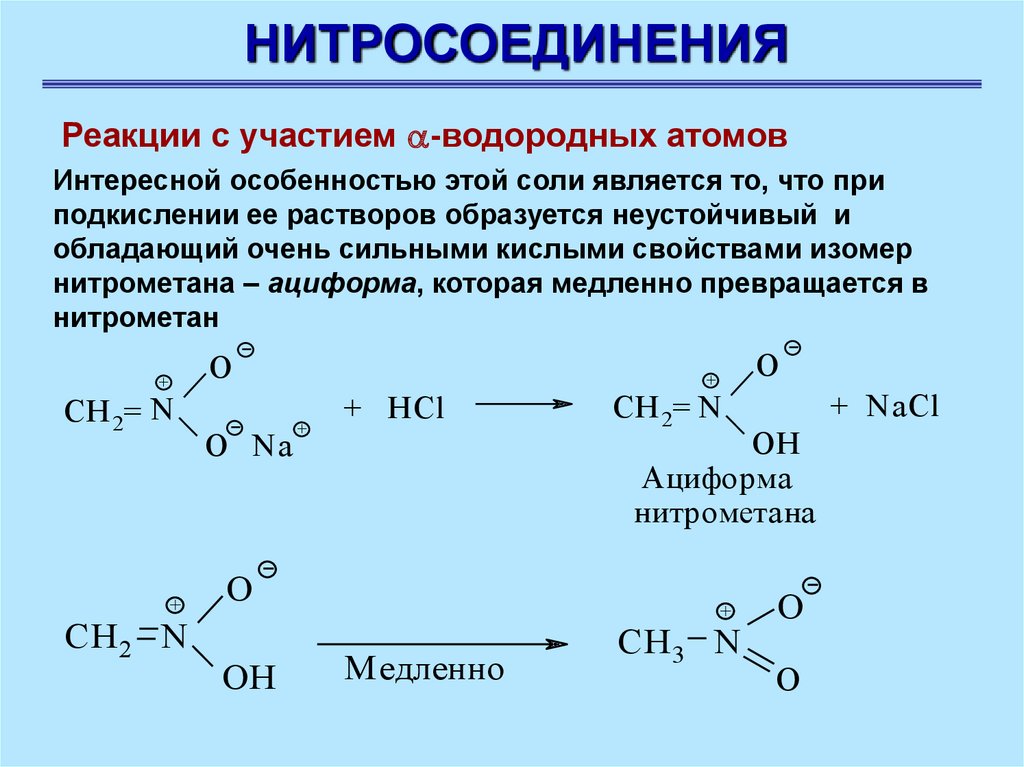
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Интересной особенностью этой соли является то, что при
подкислении ее растворов образуется неустойчивый и
обладающий очень сильными кислыми свойствами изомер
нитрометана – ациформа, которая медленно превращается в
нитрометан
O
+
CH 2= N
+
CH 2 N
O Na
+
+ HCl
+ NaCl
CH 2= N
OH
Ациформа
нитрометана
O
OH
O
+
+
Медленно
CH 3 N
O
O
16.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Первичные и вторичные нитросоединения вступают с
карбонильными соединениями в реакции типа альдольной
конденсации
CH3
CH
NO2
CH3
+
CH3
H
C O
H
2-Нитропропан
Реакция Генри
OH
AN
HO
CH2
C
NO2
CH3
2-Метил-2-нитро-1-пропанол
17.
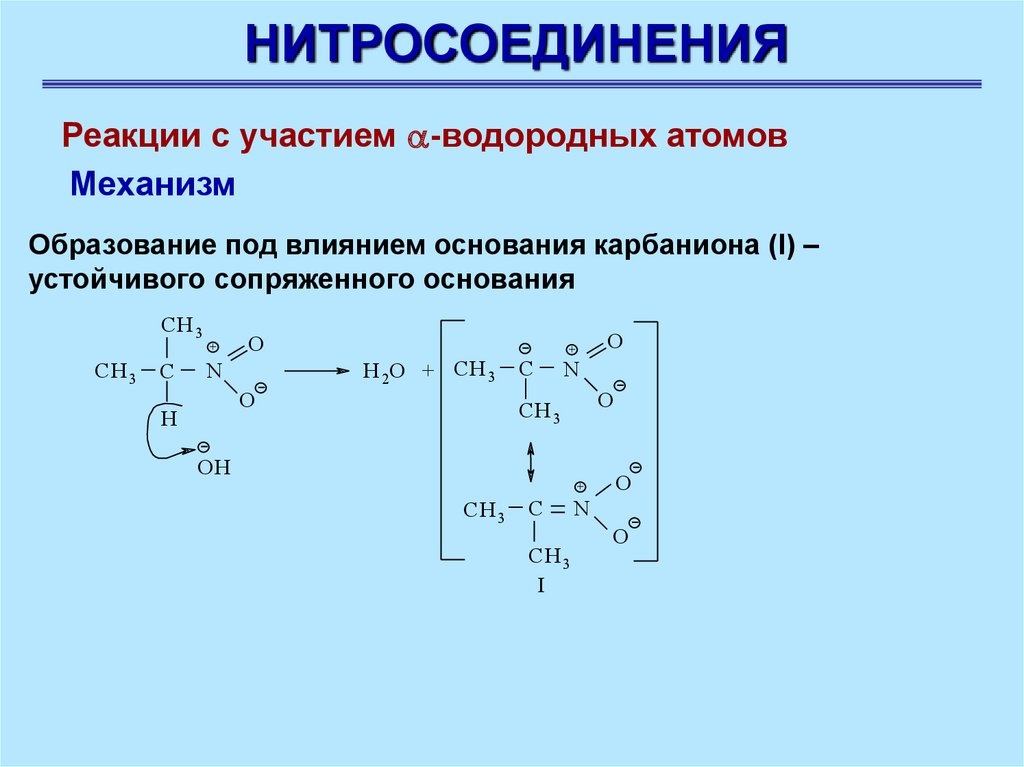
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Образование под влиянием основания карбаниона (I) –
устойчивого сопряженного основания
CH 3
CH 3
C
+
O
N
H 2O + CH 3
O
Н
C
O
+
N
O
CH 3
OH
+
CH 3
C
CH 3
I
O
N
O
18.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Далее происходит взаимодействие муравьиного альдегида с
нуклеофилом (I) и образование промежуточного продукта (II)
O
H 2C
CH 3
C
NO 2
CH 3
I
Н
O
CH 3
C
C
Н
CH 3
II
NO 2
19.
НИТРОСОЕДИНЕНИЯРеакции с участием -водородных атомов
Механизм
Стабилизация промежуточного продукта (II) осуществляется за счет
переноса протона от более слабого основания – гидроксид-иона к более
сильному
O
Н
C
-
CH 3
C
OH CH 3
NO 2 + HOH
Н CH 3
Более сильное основание
II
Н
C
Н
-
NO 2 + OH
Более слабое
CH 3
основание
C
20.
НИТРОСОЕДИНЕНИЯСпособы получения
Нитрование алканов. Реакция Коновалова
Известно несколько способов нитрования алканов.
По жидкофазному способу алканы нитруют разбавленной азотной
кислотой, с массовой долей 40-50 %
CH 3CH 2CH 2CH 3
HNO 3, 120-125 o C, P
SR
CH 3CHCH 2CH 3
+
H 2O
NO 2
2-Нитробутан
(основной продукт)
По парофазному способу алканы нитруют в парах при температуре
350-500 оС
CH 3CH 2CH 3
H N O3
П ропан
+
CH 3CH CH 3 +
CH 3CH 2CH 2N O 2
1-Н итропропан
Выход 25 %
N O2
2-Н итропропан
Выход 40 %
CH 3CH 2N O 2
+
CH 3N O 2
Н итроэтан
Выход 10 %
Н итрометан
Выход 25 %
+
H 2O
+
21.
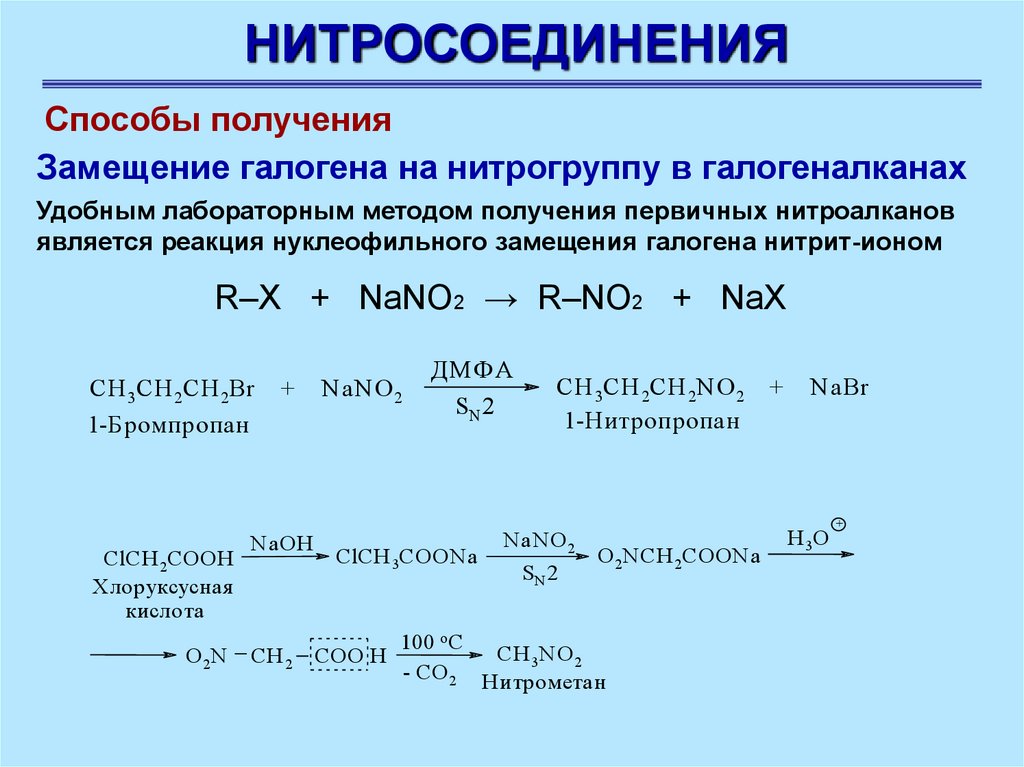
НИТРОСОЕДИНЕНИЯСпособы получения
Замещение галогена на нитрогруппу в галогеналканах
Удобным лабораторным методом получения первичных нитроалканов
является реакция нуклеофильного замещения галогена нитрит-ионом
R–X + NaNO2 → R–NO2 + NaX
CH 3CH 2CH 2Br
1-Бромпропан
ClCH 2COOH
Хлоруксусная
кислота
O 2N
+
N aOH
CH 2
NaNO 2
ДМФА
SN 2
ClCH 3COON a
CH 3CH 2CH 2NO 2 +
1-Нитропропан
N aN O 2
SN 2
O 2N CH 2COON a
100 o C
CH 3N O 2
COO H
- CO 2 Н итрометан
NaBr
H 3O
+
22.
НИТРОСОЕДИНЕНИЯСпособы получения
Синтез с использованием солей диазония
Нитроарены можно получить реакцией соли диазония с нитритом
натрия и солью одновалентной меди Cu+ (реакция Зандмейера)
+
N
N Cl +
NaNO 2
CuNO 2
NO 2
+
NaCl +
N2
23.
АМИНЫАмины – производные аммиака NH3. В соответствии с
числом алкильных или арильных групп, связанных с
азотом, различают
первичные R–NH2, ArNH2;
вторичные R1–NH–R2, R–NH–Ar;
третичные амины
R1
N
R3
Ar , R 1
N
R3
R2
24.
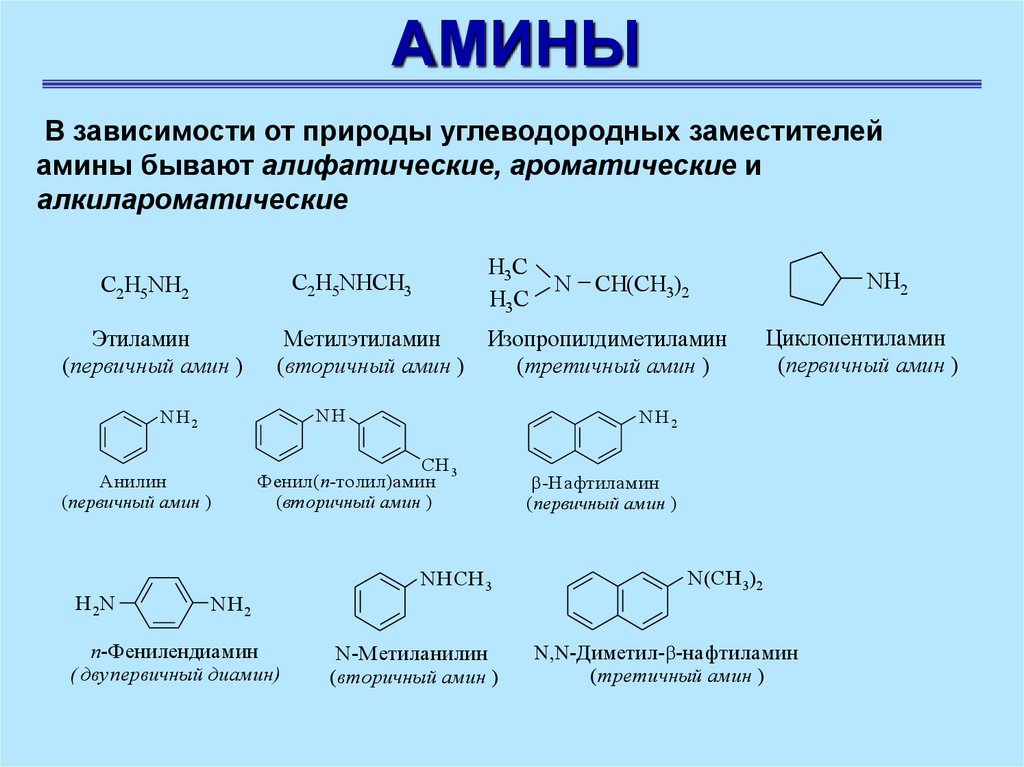
АМИНЫВ зависимости от природы углеводородных заместителей
амины бывают алифатические, ароматические и
алкилароматические
.
Этиламин
(первичный амин )
NH
Анилин
(первичный амин )
N
п-Фенилендиамин
( двупервичный диамин)
Циклопентиламин
(первичный амин )
NH2
CH 3
Фенил(п-толил)амин
(вторичный амин )
NH 2
NH2
CH(CH3)2
Метилэтиламин
Изопропилдиметиламин
(вторичный амин )
(третичный амин )
NH2
H 2N
Н3C
Н3C
С2Н5NHCH3
С2Н5NH2
NHСН 3
N-Метиланилин
(вторичный амин )
-Н афтиламин
(первичный амин )
N(СН 3)2
-Диметил- -нафтиламин
(третичный амин )
25.
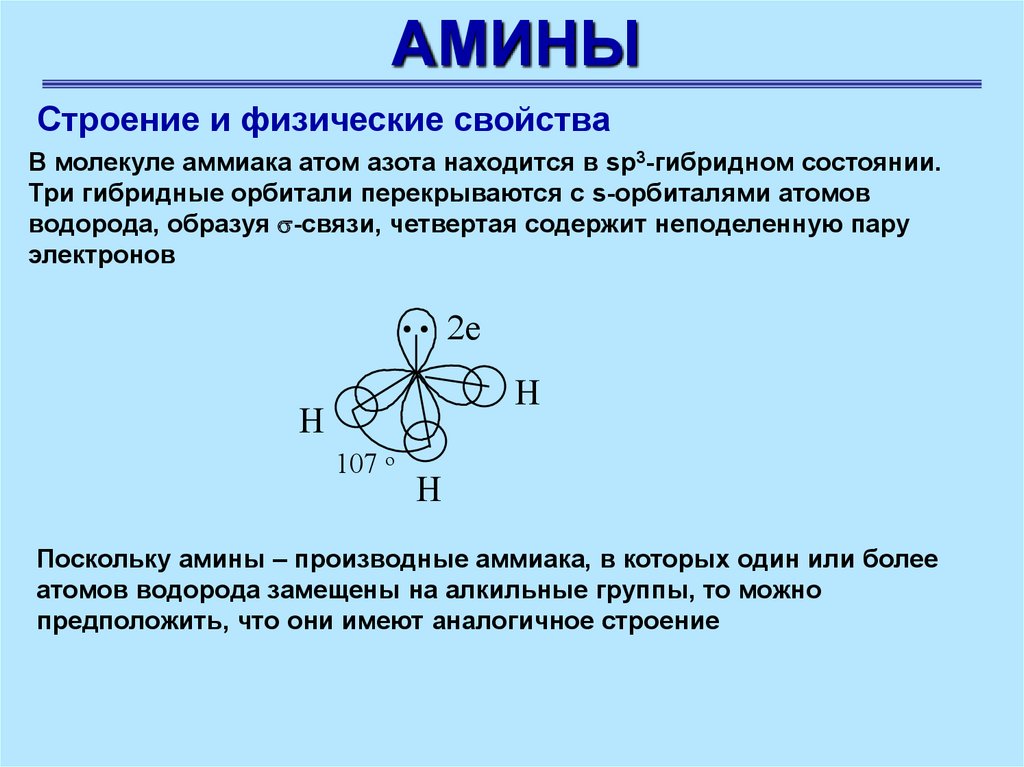
АМИНЫСтроение и физические свойства
В молекуле аммиака атом азота находится в sp3-гибридном состоянии.
Три гибридные орбитали перекрываются с s-орбиталями атомов
водорода, образуя -связи, четвертая содержит неподеленную пару
электронов
.. 2e
H
H
107 o
H
Поскольку амины – производные аммиака, в которых один или более
атомов водорода замещены на алкильные группы, то можно
предположить, что они имеют аналогичное строение
26.
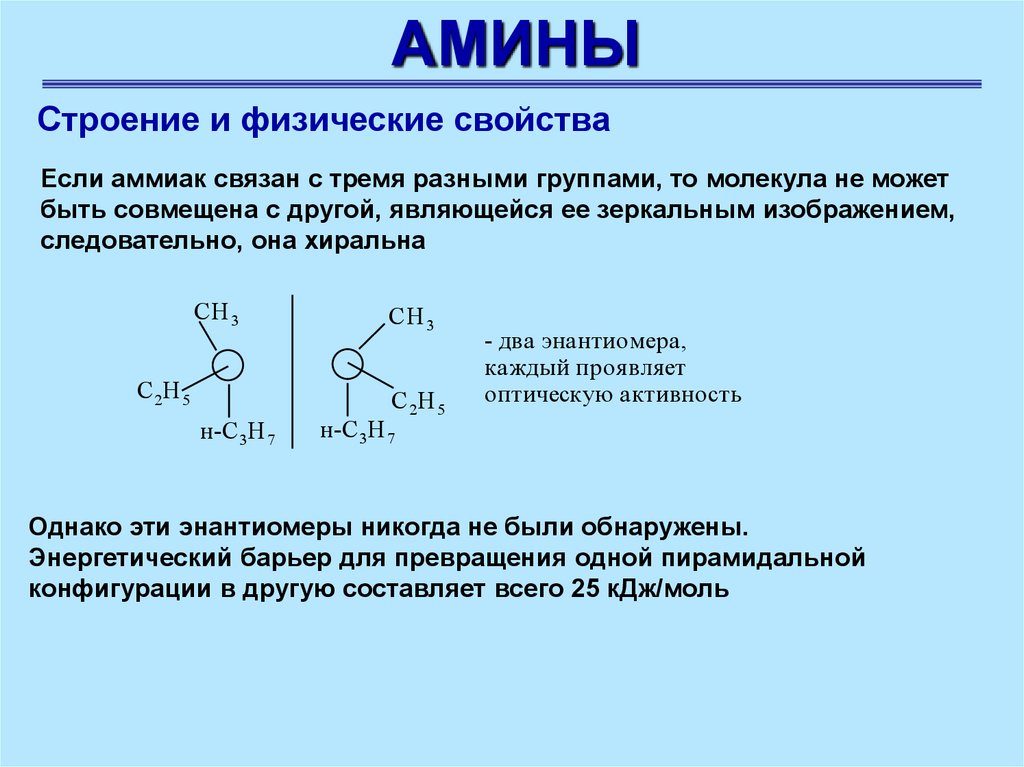
АМИНЫСтроение и физические свойства
Если аммиак связан с тремя разными группами, то молекула не может
быть совмещена с другой, являющейся ее зеркальным изображением,
следовательно, она хиральна
CH 3
С 2Н 5
н-C 3H 7
CH 3
С 2Н 5
- два энантиомера,
каждый проя вля ет
оптическую активность
н-C 3H 7
Однако эти энантиомеры никогда не были обнаружены.
Энергетический барьер для превращения одной пирамидальной
конфигурации в другую составляет всего 25 кДж/моль
27.
АМИНЫСтроение и физические свойства
Простейшие алифатические амины – метиламин, диметиламин и
триметиламин – газы, хорошо растворимые в воде и обладающие
аммиачным запахом. Остальные низшие амины – жидкости с запахом
аммиака. Более сложные амины – жидкости с неприятным запахом
рыбы. Высшие амины – твердые, не растворимые в воде вещества,
лишенные запаха.
При равном числе атомов углерода наиболее высокая температура
кипения у первичных аминов, несколько ниже у вторичных и третичных.
Ароматические амины – жидкости или твердые тела с характерным
неприятным запахом, сильно токсичны. В воде растворяются мало,
накопление аминогрупп ведет к увеличению растворимости
28.
АМИНЫХимические свойства
Многие химические свойства аминов обусловлены
стремлением аминов обобществить неподеленную пару
электронов азота с протоном, благодаря чему они являются
основаниями, либо с электронодефицитным атомом другой
молекулы, что определяет их способность выступать в
качестве нуклеофильных реагентов
29.
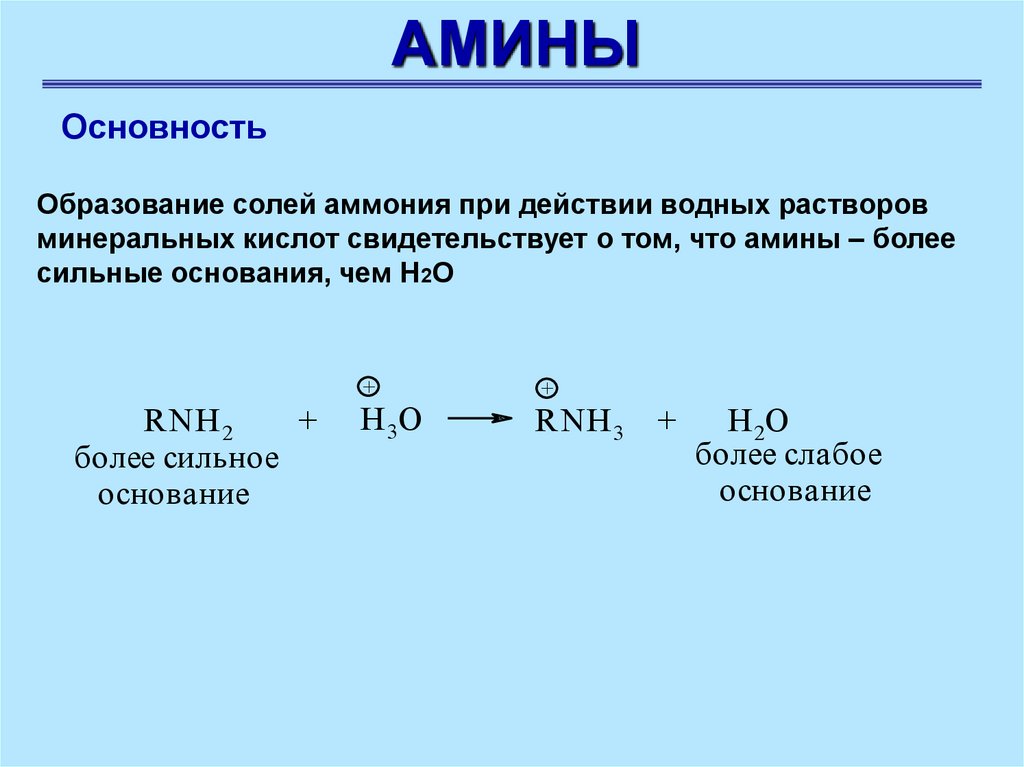
АМИНЫОсновность
Образование солей аммония при действии водных растворов
минеральных кислот свидетельствует о том, что амины – более
сильные основания, чем Н2О
RNH 2
+
более сильное
основание
+
+
H 3O
RNH 3
+
H 2O
более слабое
основание
30.
АМИНЫОсновность
Амины вытесняются из солей аммония при действии гидроксидиона, т.е. амины более слабые основания, чем гидроксид-ион
+
RNH 3
+
OH
RNH 2 +
более сильное более слабое
основание
основание
H 2O
Основность убывает в ряду ОН > RNH2 > H2O
31.
АМИНЫОсновность
По аналогии с кислотностью основность аминов удобно
сравнивать, определяя степень переноса протона с воды на
амин
RNH2 + H2O
более сильное
основание, чем
вода
+
RNH3 + OH
+
[RNH3][OH]
Kb=
[RNH2]
Чем больше константа основности Кb, тем сильнее основание.
Константа основности Kb для всех трех классов алифатических
аминов 10–3–10–4, т.е. алифатические амины более сильные
основания, чем аммиак Kb=1,8∙10-5. Для ароматических аминов
Kb<10–9
32.
АМИНЫСтруктура и основность
Наличие заместителей оказывает сильное влияние на
основность. Алифатические амины – более сильные основания,
чем аммиак
H
H N: + H
H
+
H
+
H N H,
H
H
H
R
N: +
H
+
H
R подает электроны,
делает 2е более доступными для атаки протона
R
+
N H
H
R подает электроны,
делает ион аммония
более устойчивым
увеличивает
Основность алифатических аминов увеличивается в ряду
NH3 < R1NH2 < R1–NH–R2
33.
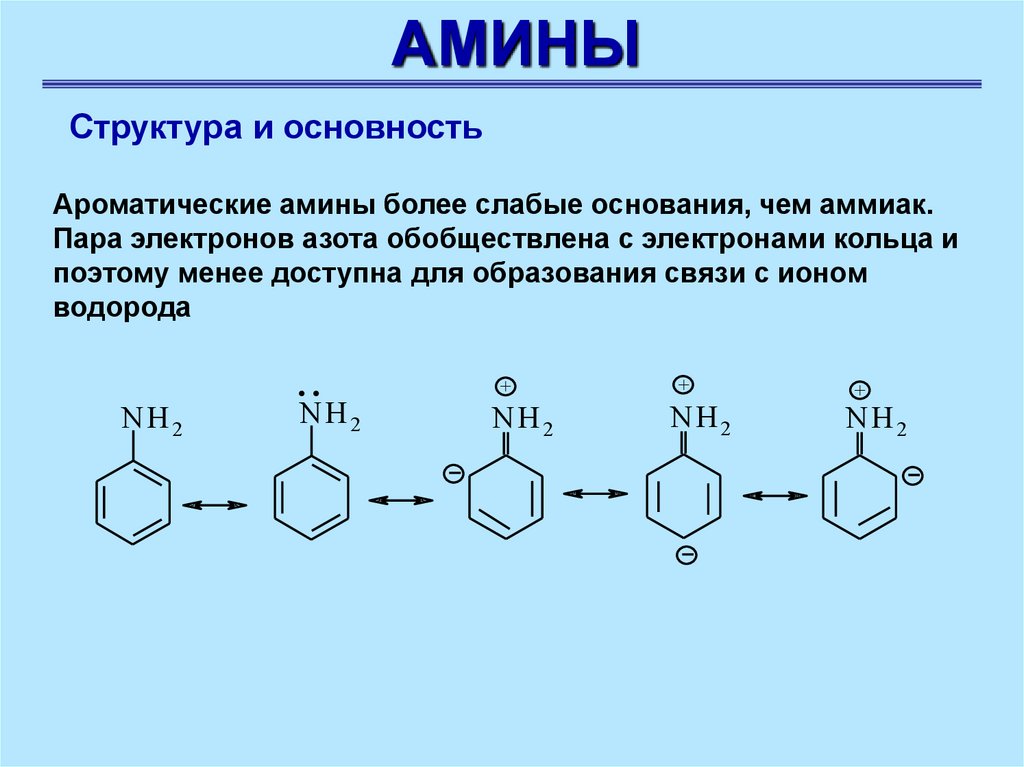
АМИНЫСтруктура и основность
Ароматические амины более слабые основания, чем аммиак.
Пара электронов азота обобществлена с электронами кольца и
поэтому менее доступна для образования связи с ионом
водорода
NH 2
..
NH 2
+
NH 2
+
NH 2
+
NH 2
34.
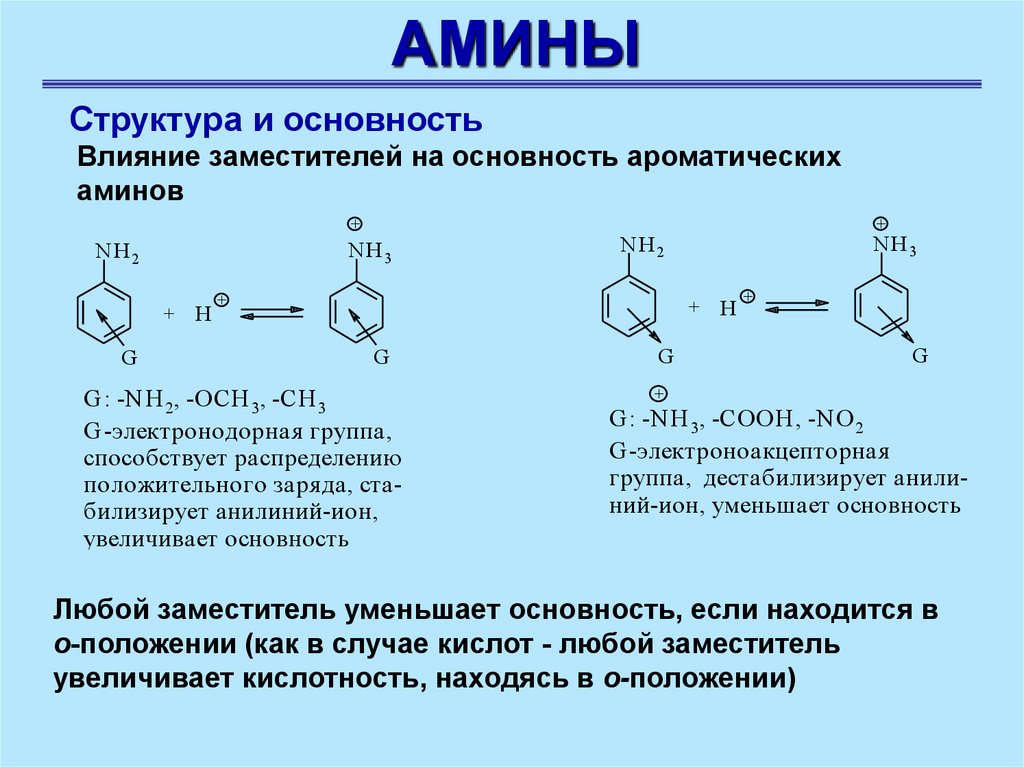
АМИНЫСтруктура и основность
Влияние заместителей на основность ароматических
аминов
+
NH 3
NH 2
+
G
H
+
NH 3
NH 2
+
+
G
G : -N H 2, -OCH 3, -CH 3
G -электронодорная группа,
способствует распределению
положительного заря да, стабилизирует анилиний-ион,
увеличивает основность
G
H
+
G
+
G : -N H 3, -COOH , -N O 2
G -электроноакцепторная
группа, деcтабилизирует анилиний-ион, уменьшает основность
Любой заместитель уменьшает основность, если находится в
о-положении (как в случае кислот - любой заместитель
увеличивает кислотность, находясь в о-положении)
35.
АМИНЫСтруктура и основность
Наиболее характерная реакция аминов - образование солей при
взаимодействии с кислотами
RNH2
перв.
R 2N H
втор.
R 3N
трет.
+ H
+
X
+
R N H 3X
OH
+ H
+
X
+
R 2N H 2X
OH
+ H
Н е растворимы
в воде
+
OH
+
X
R 3N H X
Соли - ионные соединения . Растворимы в воде, не растворимы
в неполя рных растворителя х
где X - Cl, N O 3, OSO 3H
Различие в растворимости аминов и их солей используют для
обнаружения и выделения аминов. Органическое соединение, не
растворимое в воде, но растворимое в холодной разбавленной
соляной кислоте, является основанием, почти наверняка - амином
36.
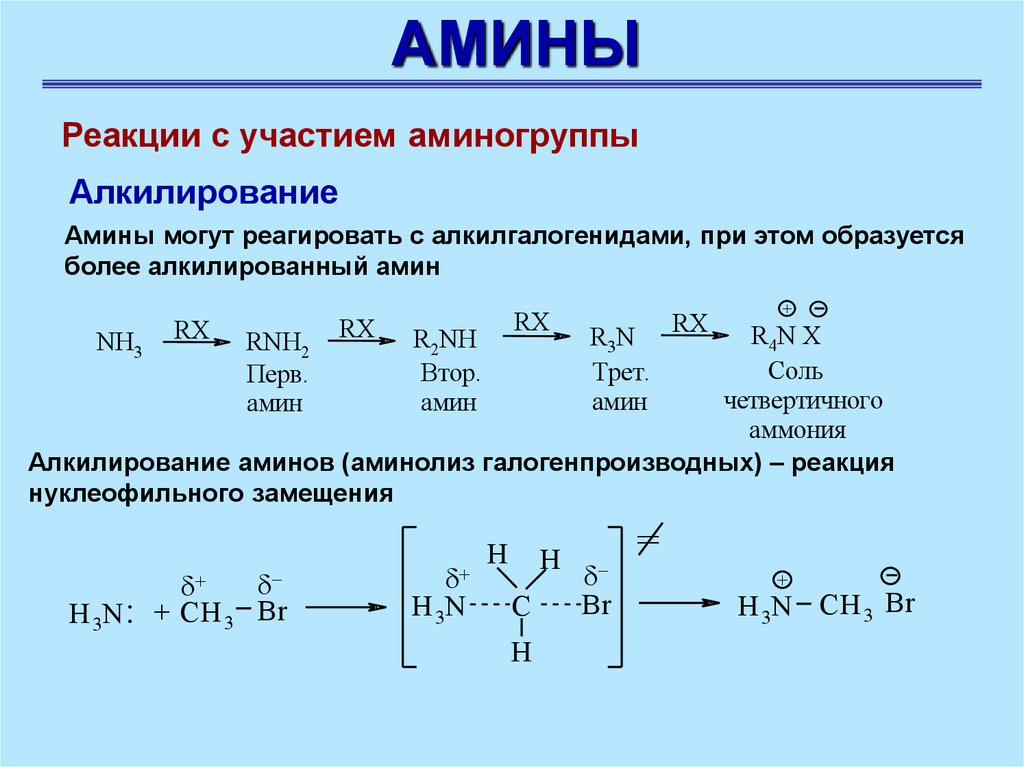
АМИНЫРеакции с участием аминогруппы
Алкилирование
Амины могут реагировать с алкилгалогенидами, при этом образуется
более алкилированный амин
RX
RX
RX
RX
+
R4N X
Соль
четвертичного
аммония
Алкилирование аминов (аминолиз галогенпроизводных) – реакция
нуклеофильного замещения
NH3
H 3N :
RNH2
Перв.
амин
+ CH 3 Br
R2NH
Втор.
амин
H 3N
H
H
C
H
R3N
Трет.
амин
Br
=
+
H 3N CH 3 Br
37.
АМИНЫРеакции с участием аминогруппы
Алкилирование
Свободный амин выделяется обработкой основанием
+
H 3N
..
CH 3 Br
CH 3NH 2 + CH 3Br
+ NH 3
H 2N
+
(CH 3)2NH 2 Br
NaOH
CH 3 + NН 4Br
(CH 3)2NH + NaBr + H 2O
При аминолизе первичных галогеналканов главный продукт - амин, а при
аминолизе третичных образуется значительное количество алкена
38.
АМИНЫРеакции с участием аминогруппы
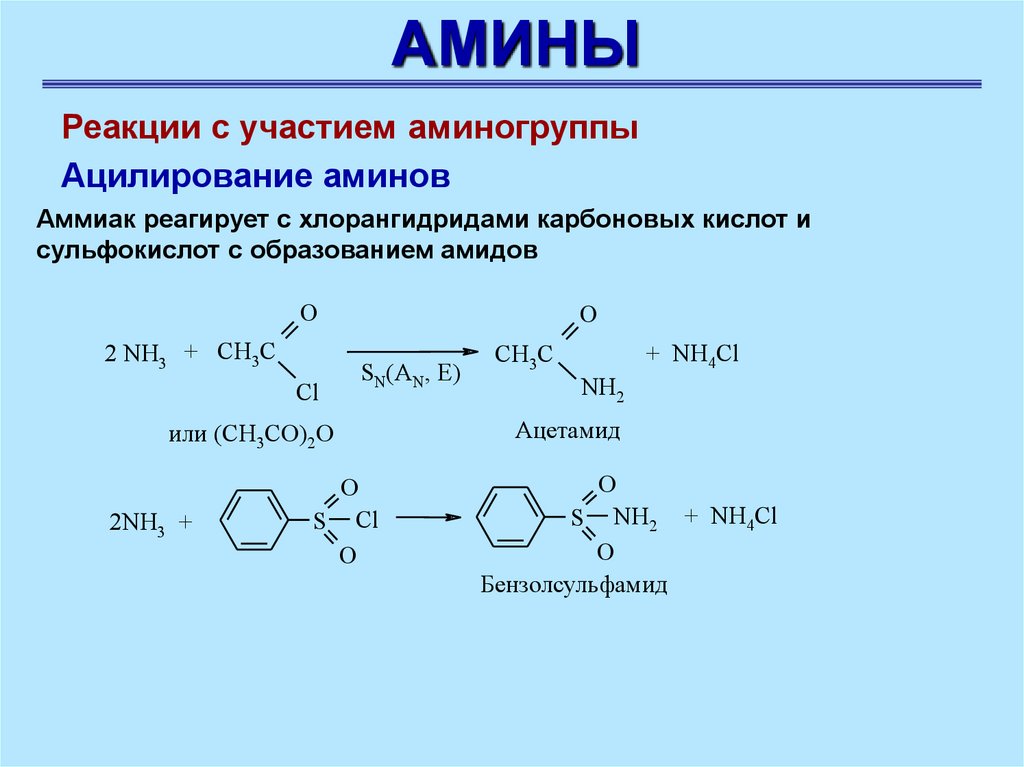
Ацилирование аминов
Аммиак реагирует с хлорангидридами карбоновых кислот и
сульфокислот с образованием амидов
O
2 NH3 + CH3C
Cl
O
SN(AN, E)
или (CH3CO)2O
2NH3 +
O
S Cl
O
CH3C
+ NH4Cl
NH2
Aцетамид
O
S NH2 + NH4Cl
O
Бензолсульфамид
39.
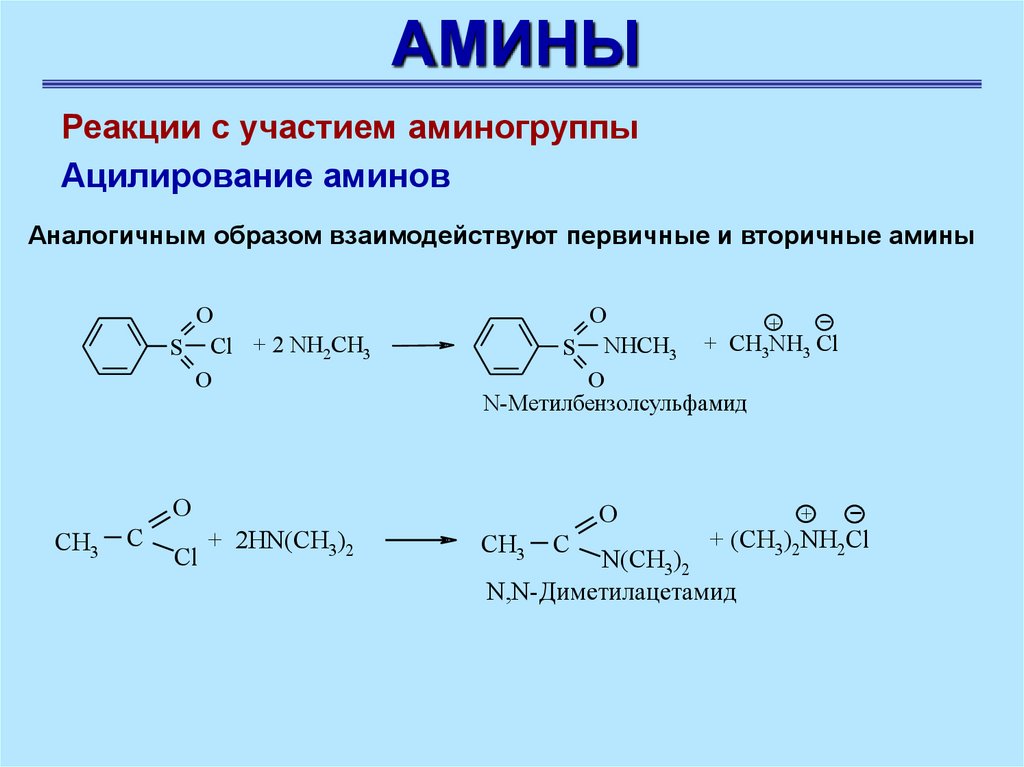
АМИНЫРеакции с участием аминогруппы
Ацилирование аминов
Аналогичным образом взаимодействуют первичные и вторичные амины
O
S Cl + 2 NH2CH3
O
O
+
+
CH
S NHCH3
3NH3 Cl
O
N-Метилбензолсульфамид
O
CH3
C
Сl
+ 2HN(CH3)2
O
+
+ (CH3)2NH2Cl
N(CH3)2
N,N-Диметилацетамид
CH3
C
40.
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
При рассмотрении электрофильного замещения в ароматическом ядре
амина, амида или аммонийной соли следует иметь в виду, что, хотя во
всех случаях с углеродом ядра связан атом азота ориентанта, влияние
его будет различно
..
NH 2,
..
NHR,
O
..
NH
+
C
NH3
R
..
NR 2 – сильные активирующие о-, п-ориентанты
– менее сильный активирующий о-, п-ориентант
– дезактивирующий м-ориентант
41.
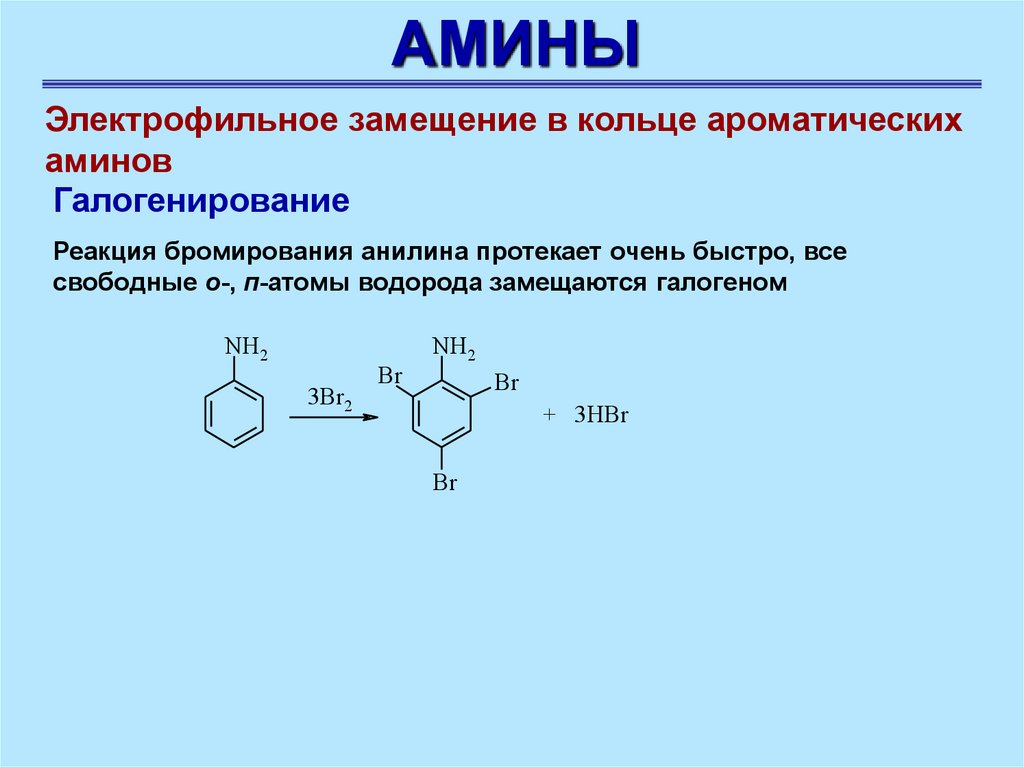
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Реакция бромирования анилина протекает очень быстро, все
свободные о-, п-атомы водорода замещаются галогеном
NH2
3Br2
Br
NH2
Br
+ 3НBr
Br
42.
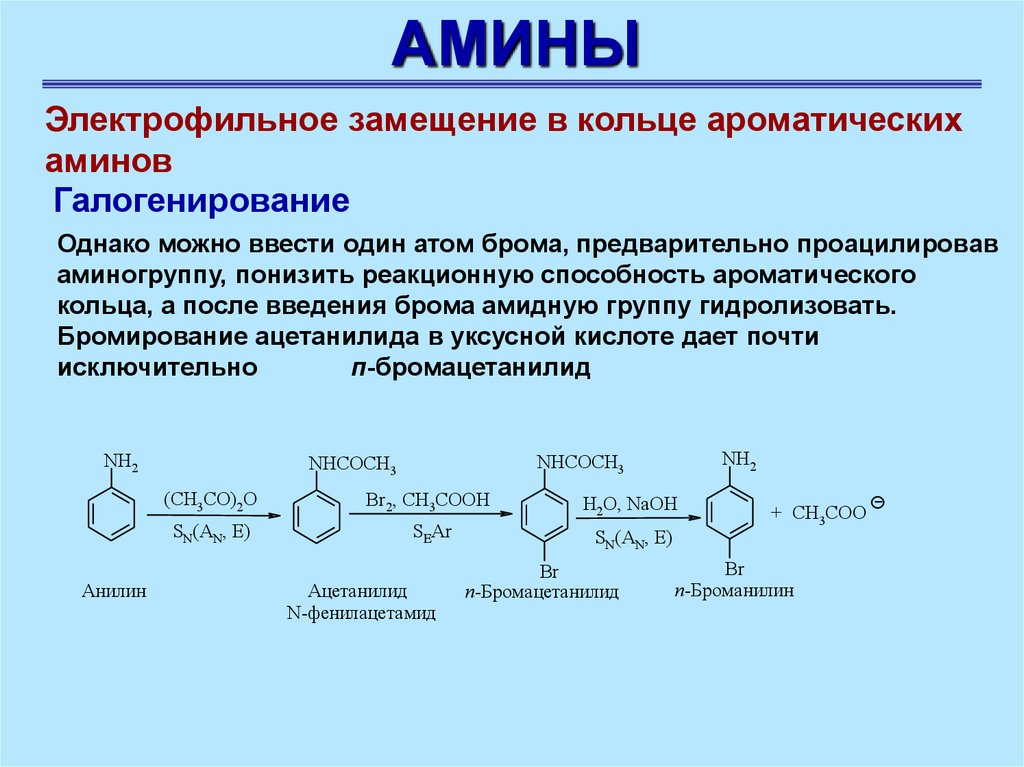
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Галогенирование
Однако можно ввести один атом брома, предварительно проацилировав
аминогруппу, понизить реакционную способность ароматического
кольца, а после введения брома амидную группу гидролизовать.
Бромирование ацетанилида в уксусной кислоте дает почти
исключительно
п-бромацетанилид
NH2
Анилин
NH2
NHCOCH3
NHCOCH3
(CH3CO)2O
Br2, СН3СООН
H2O, NaOH
SN(AN, E)
SEAr
SN(AN, E)
Ацетанилид
N-фенилацетамид
Br
п-Бромацетанилид
+ CH3COO
Br
п-Броманилин
43.
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Нитрование
Нитрование проводят с использованием ацетилированного, а не
чистого амина. Во-первых, ацетилирование снижает реакционную
способность кольца. Реакционноспособное кольцо ароматического
амина крайне чувствительно к окислению. Во-вторых, из свободного
амина получается смесь, содержащая 1/3 пара- (ориентант – NH2) и 2/3
мета-продуктов замещения (ориентант –NH3 ). Ацетилированный
амин гладко нитруется главным образом в
п-положение
NH2
(CH3CO)2O
Анилин H+
SN(AN, E)
NHCOCH3
HNO3, H2SO4
SEAr
Ацетанилид
+
NH3
NHCOCH3
+
H2O, H
SN(AN, E)
NO2
п-Нитроацетанилид
NH2
+ CH3COOН
NO2
п-Нитроанилин
44.
АМИНЫЭлектрофильное замещение в кольце ароматических
аминов
Сульфирование
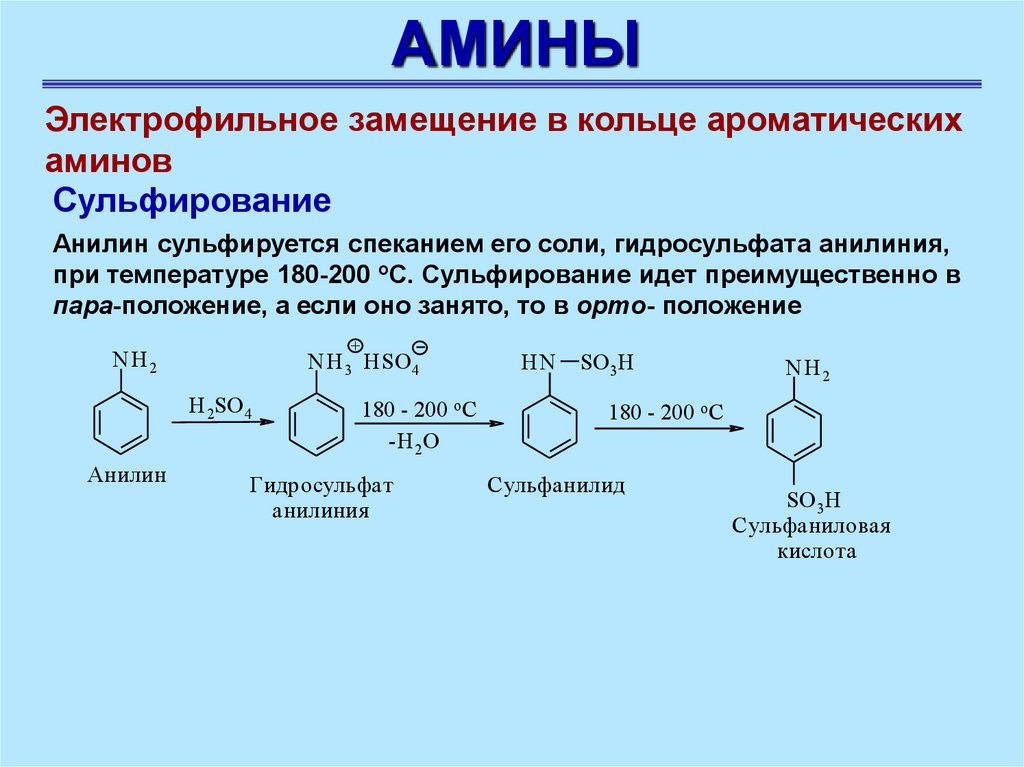
Анилин сульфируется спеканием его соли, гидросульфата анилиния,
при температуре 180-200 оС. Сульфирование идет преимущественно в
пара-положение, a если оно занято, то в opтo- положение
+
NH 2
NH 3 HSO 4
H 2SO 4
Анилин
180 - 200 o C
-H 2O
Гидросульфат
анилиния
HN
SO 3H
NH 2
180 - 200 o C
Сульфанилид
SO 3H
Сульфаниловая
кислота
45.
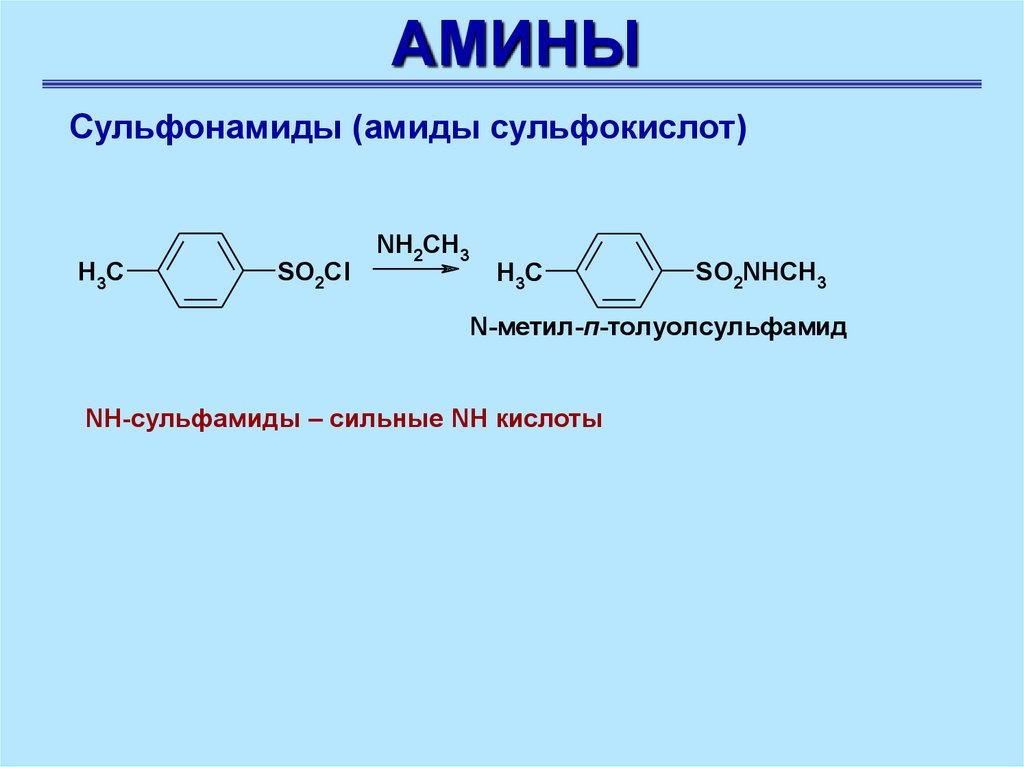
АМИНЫСульфонамиды (амиды сульфокислот)
H3C
SO2Cl
NH2CH3
H3C
SO2NHCH3
N-метил-п-толуолсульфамид
NH-сульфамиды – сильные NH кислоты
46.
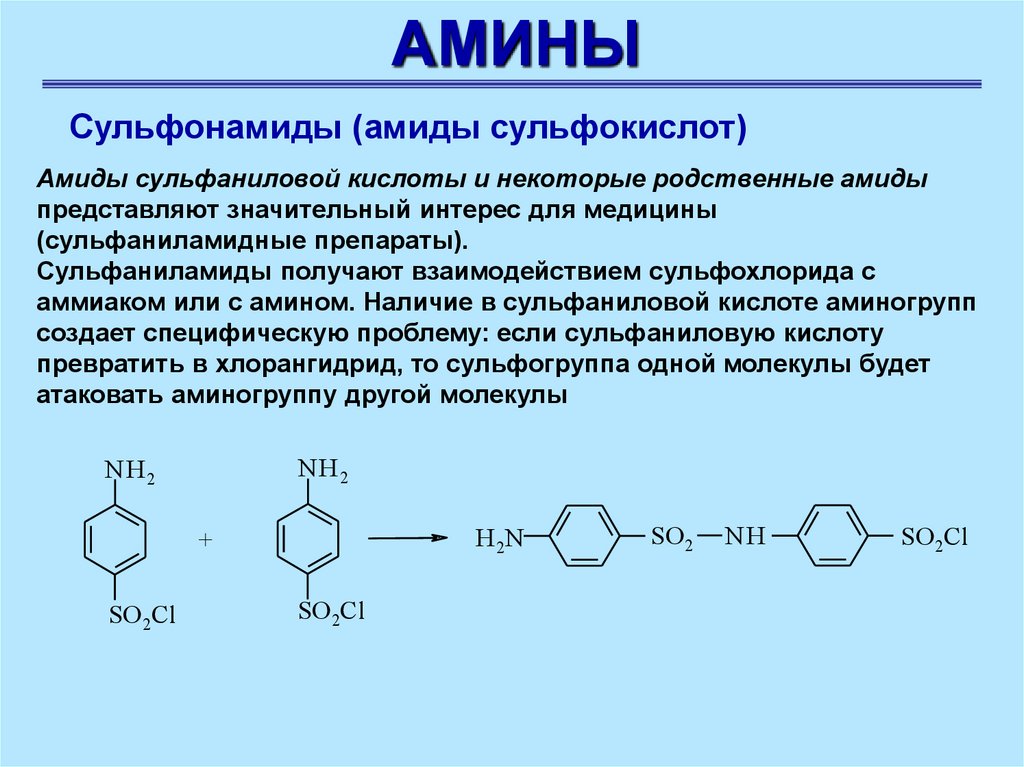
АМИНЫСульфонамиды (амиды сульфокислот)
Амиды сульфаниловой кислоты и некоторые родственные амиды
представляют значительный интерес для медицины
(сульфаниламидные препараты).
Сульфаниламиды получают взаимодействием сульфохлорида с
аммиаком или с амином. Наличие в сульфаниловой кислоте аминогрупп
создает специфическую проблему: если сульфаниловую кислоту
превратить в хлорангидрид, то сульфогруппа одной молекулы будет
атаковать аминогруппу другой молекулы
NH 2
NH 2
H 2N
+
SO 2Cl
SO 2Cl
SO 2
NH
SO 2Cl
47.
АМИНЫСульфонамиды (амиды сульфокислот)
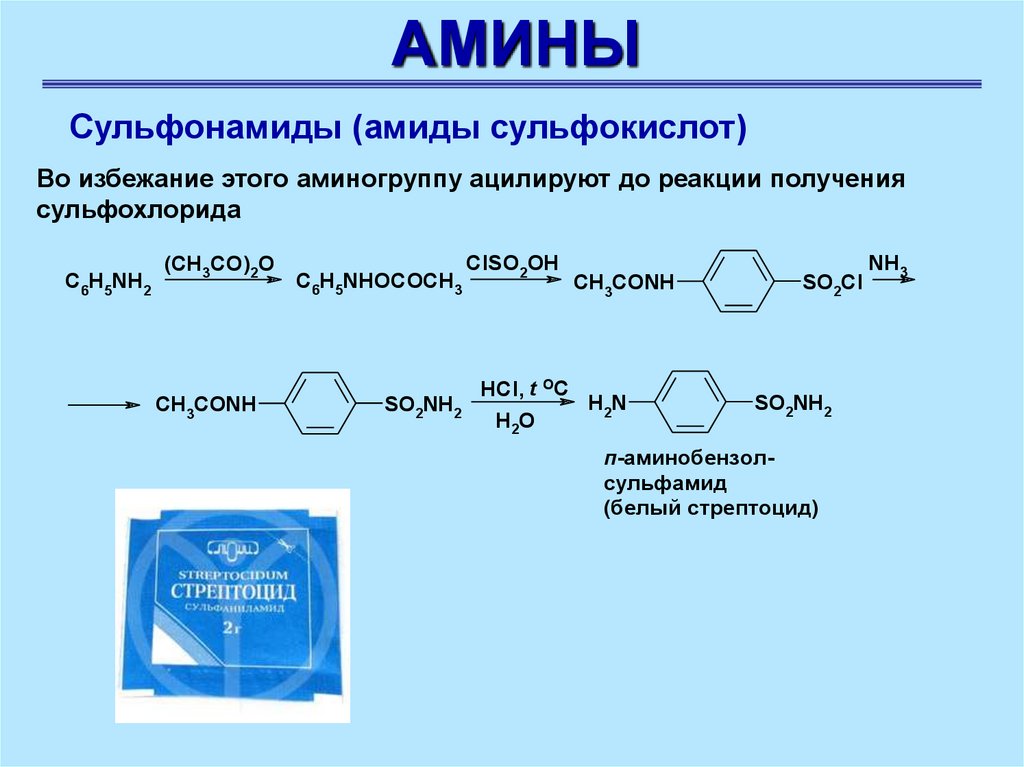
Во избежание этого аминогруппу ацилируют до реакции получения
сульфохлорида
C6H5NH2
(CH3CO)2O
CH3CONH
C6H5NHOCOCH3
SO2NH2
ClSO2OH
CH3CONH
HCl, t OC
H2N
H2O
SO2Cl
SO2NH2
п-аминобензолсульфамид
(белый стрептоцид)
NH3
48.
АМИНЫСульфонамиды (амиды сульфокислот)
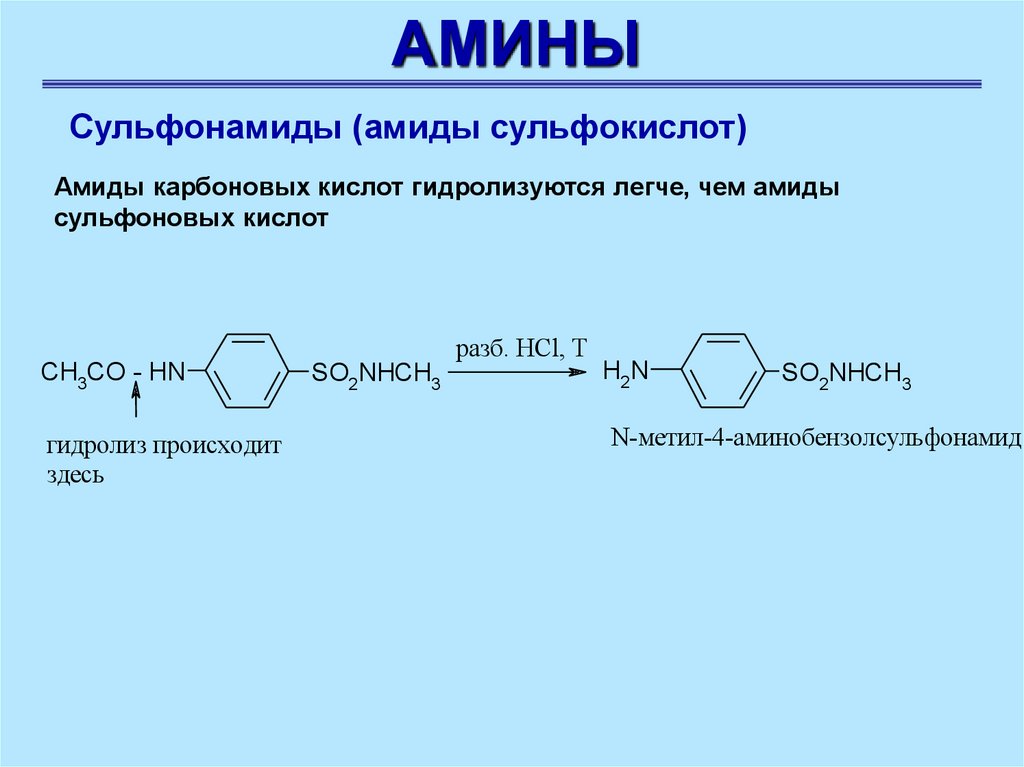
Амиды карбоновых кислот гидролизуются легче, чем амиды
сульфоновых кислот
CH3CO - HN
гидролиз происходит
здесь
разб. HCl, T
SO2NHCH3
H2N
SO2NHCH3
N-метил-4-аминобензолсульфонамид
49.
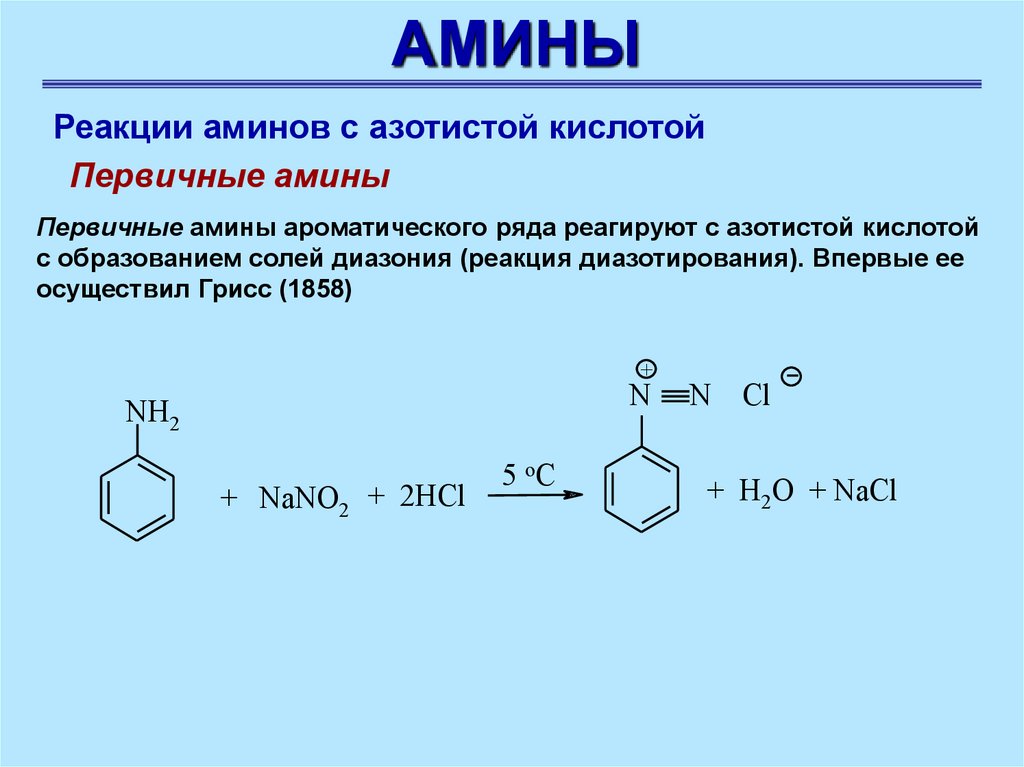
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
Первичные амины ароматического ряда реагируют с азотистой кислотой
с образованием солей диазония (реакция диазотирования). Впервые ее
осуществил Грисс (1858)
+
N
NH2
+ NaNO2 + 2HСl
5 оС
N Cl
+ H2O + NaCl
50.
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
На первой стадии при взаимодействии нитрита натрия с соляной
кислотой образуется азотистая кислота
NaNO2 + HCl
HNO2 + NaCl
Азотистая кислота является более слабой кислотой, чем азотная.
Поэтому в отсутствие сильных минеральных кислот электрофильная
реакционная способность азотистой кислоты невысока. Увеличить ее
можно, проводя реакции с аминами в присутствии сильных
минеральных кислот (чаще для этой цели используют хлороводородную
кислоту). При этом, по-видимому, происходят протонированне атома
кислорода гидроксильной группы, отщепление воды и генерирование
нитрозонийкатиона. В соляной кислоте образуется нитрозилхлорид,
который и является диазотирующим агентом
51.
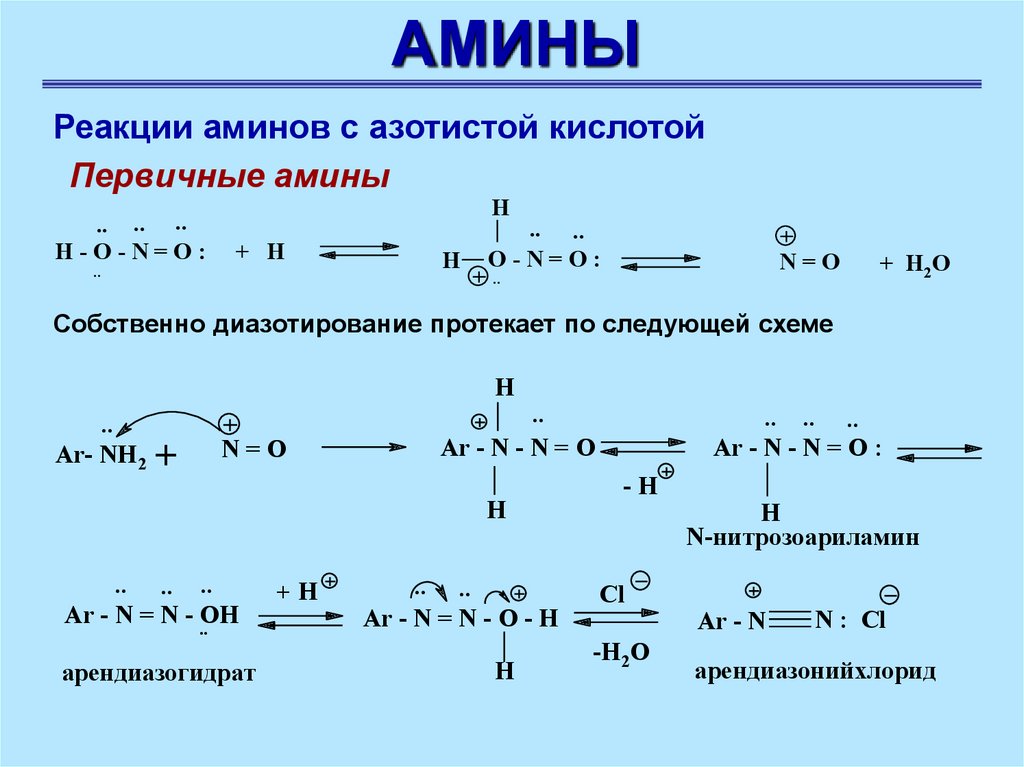
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
.. .. ..
H-O-N=O:
..
H
+ H
H
.. ..
O-N=O:
N=O
..
+ H2O
Собственно диазотирование протекает по следующей схеме
H
..
Ar- NH2
+
N=O
..
Ar - N - N = O
H
.. .. ..
Ar - N = N - ..OH
арендиазогидрат
+H
.. ..
Ar - N = N - O - H
H
.. .. ..
Ar - N - N = O :
-H
Cl
-H2O
H
N-нитрозоариламин
Ar - N
N : Cl
арендиазонийхлорид
52.
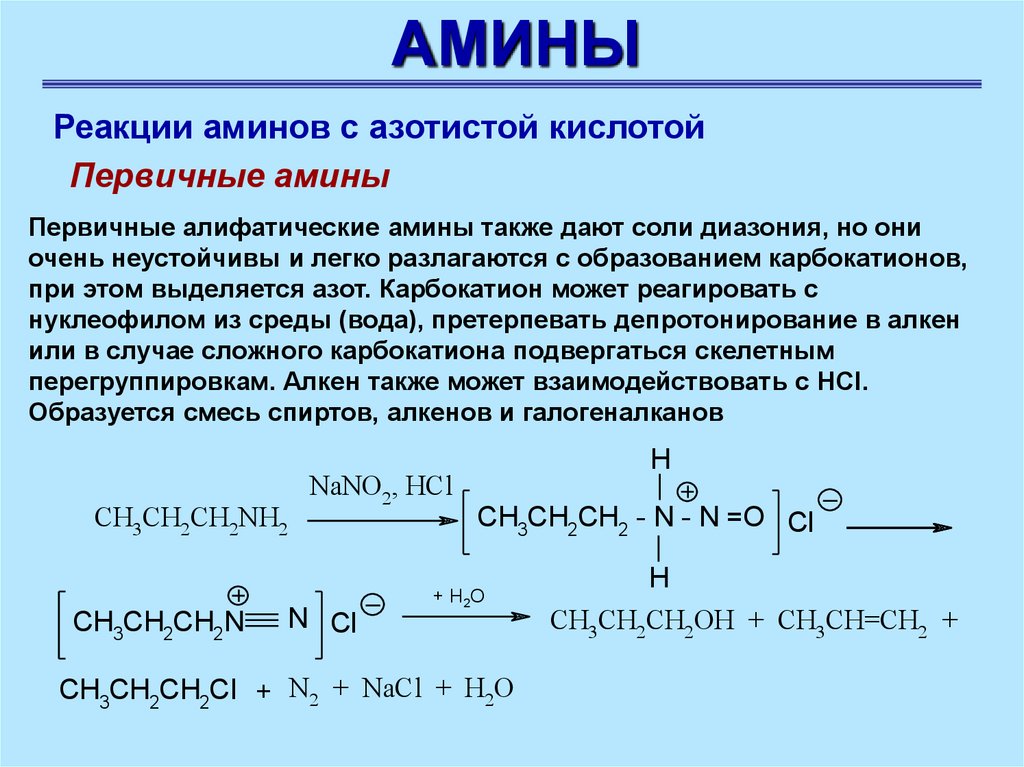
АМИНЫРеакции аминов с азотистой кислотой
Первичные амины
Первичные алифатические амины также дают соли диазония, но они
очень неустойчивы и легко разлагаются с образованием карбокатионов,
при этом выделяется азот. Карбокатион может реагировать с
нуклеофилом из среды (вода), претерпевать депротонирование в алкен
или в случае сложного карбокатиона подвергаться скелетным
перегруппировкам. Алкен также может взаимодействовать с HCl.
Образуется смесь спиртов, алкенов и галогеналканов
CH3CH2CH2NH2
CH3CH2CH2N
NaNO2, HCl
N Cl
H
CH3CH2CH2 - N - N =O Cl
+ H2O
CH3CH2CH2Cl + N2 + NaCl + H2O
H
CH3CH2CH2OH + CH3CH=CH2 +
53.
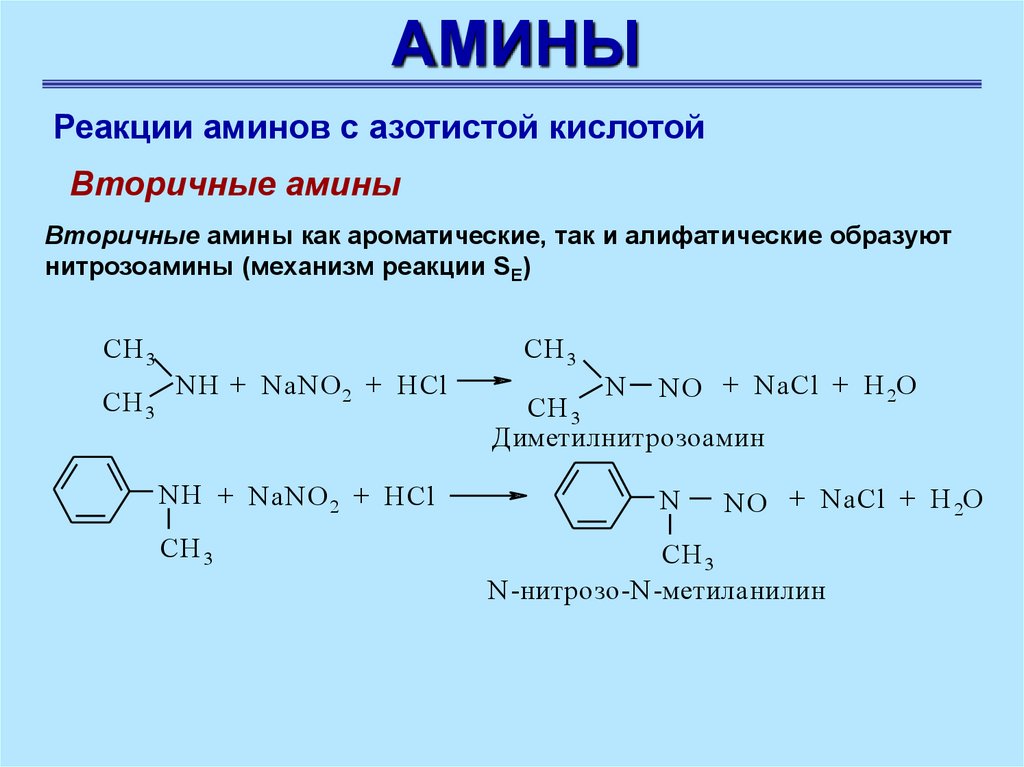
АМИНЫРеакции аминов с азотистой кислотой
Вторичные амины
Вторичные амины как ароматические, так и алифатические образуют
нитрозоамины (механизм реакции SE)
CH 3
CH 3
CH 3
NH + NaNO 2 + HCl
NH + NaNO 2 + HCl
CH 3
N
NO + NaCl + H 2O
CH 3
Диметилнитрозоамин
N
NO + NaCl + H 2O
CH 3
N-нитрозо-N-метиланилин
54.
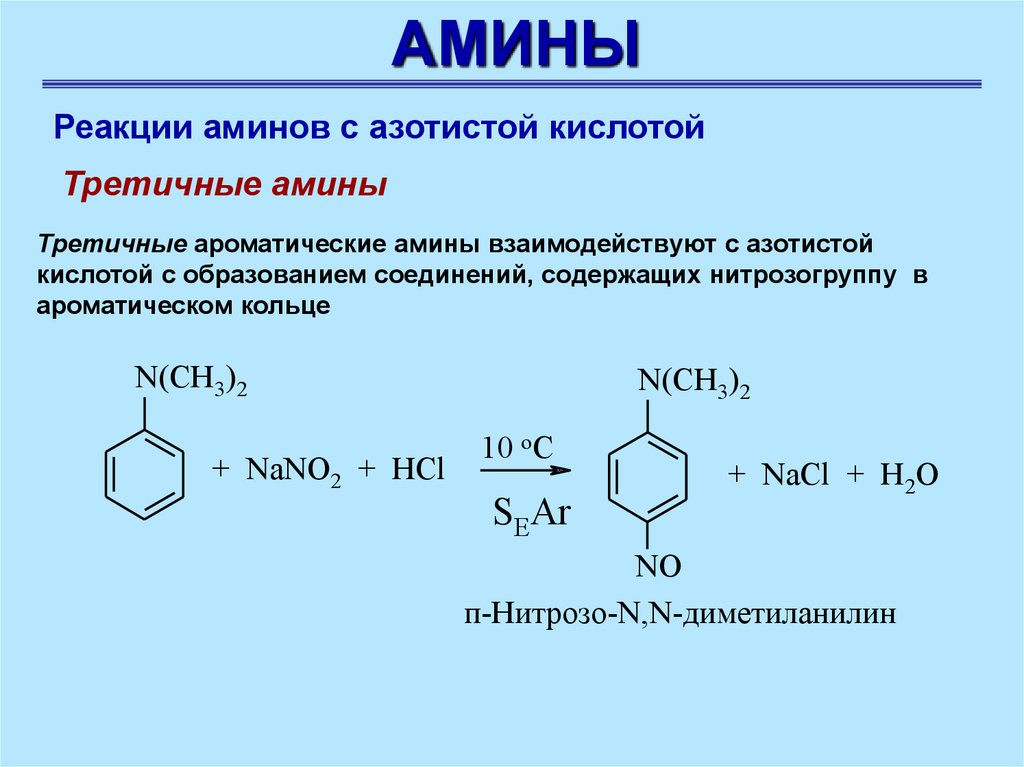
АМИНЫРеакции аминов с азотистой кислотой
Третичные амины
Третичные ароматические амины взаимодействуют с азотистой
кислотой с образованием соединений, содержащих нитрозогруппу в
ароматическом кольце
N(CH3)2
+ NaNO2 + HCl
N(CH3)2
10 oC
SEAr
+ NaCl + H2O
NO
п-Нитрозо-N,N-диметиланилин
55.
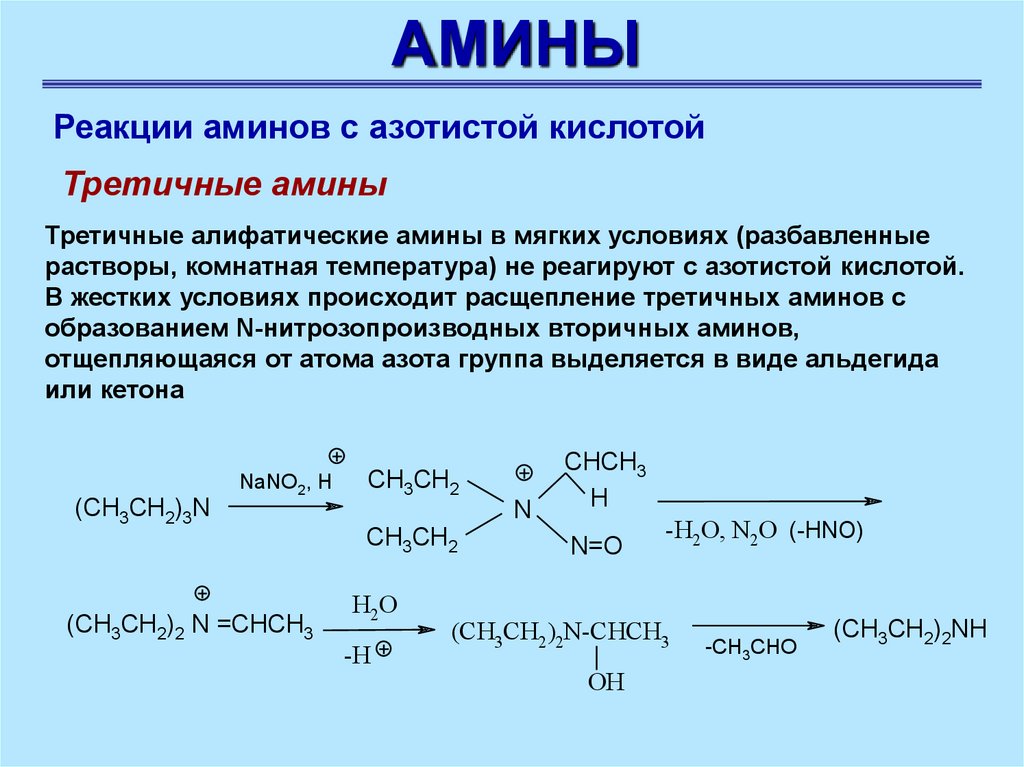
АМИНЫРеакции аминов с азотистой кислотой
Третичные амины
Третичные алифатические амины в мягких условиях (разбавленные
растворы, комнатная температура) не реагируют с азотистой кислотой.
В жестких условиях происходит расщепление третичных аминов с
образованием N-нитрозопроизводных вторичных аминов,
отщепляющаяся от атома азота группа выделяется в виде альдегида
или кетона
NaNO2, H
(CH3CH2)3N
CH3CH2
N
CH3CH2
(CH3CH2)2 N =CHCH3
H2O
-H
CHCH3
H
N=O
-H2O, N2O (-HNO)
(CH3CH2 )2N-CHCH3
OH
-CH3CHO
(CH3CH2)2NH
56.
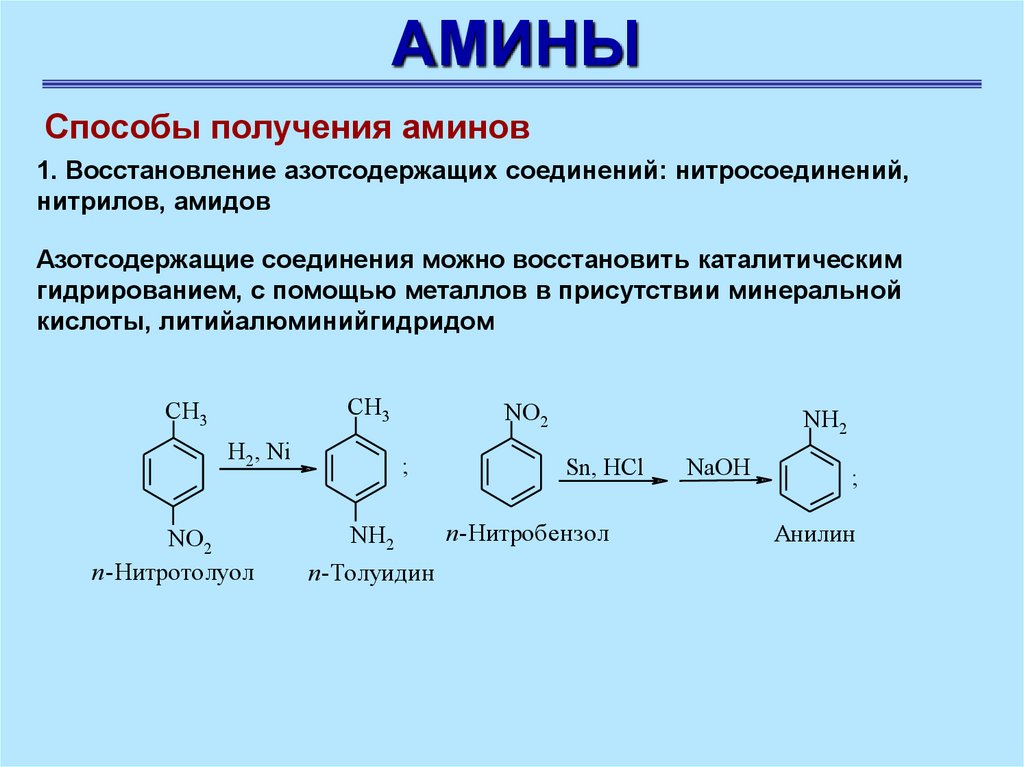
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
Азотсодержащие соединения можно восстановить каталитическим
гидрированием, с помощью металлов в присутствии минеральной
кислоты, литийалюминийгидридом
СН3
СН3
H2, Ni
NO2
п-Нитротолуол
NO2
;
NH2
п-Толуидин
NH2
Sn, HCl
п-Нитробензол
NaOH
;
Анилин
57.
АМИНЫСпособы получения аминов
1. Восстановление азотсодержащих соединений: нитросоединений,
нитрилов, амидов
CH3-N-COCH3
CH3-N-CH2CH3
LiAlH4
N-Метилацетанилид
СH3CH2CH2CN
Бутанонитрил
N-Метил-N-этиланилин
LiAlH4
СH3CH2CH2СН2NH2
Бутиламин
58.
АМИНЫСпособы получения аминов
2. Взаимодействие галогенпроизводных и спиртов с аммиаком
СH3CH2Br
+
_
+
[CH3CH2NH3] Br
NH3
_
+
[CH3CH2NH2CH2CH3] Br
СH3CH2Br + CH3CH2NH2
СH3CH2Br + (C2H5)2NH
NH3
ROH
Al2O3, T
RNH2
+
[(C2H5)2NHCH2CH3] Br
ROH
Al2O3, T
R2NH
NH3(изб)
NaOH
CH3CH2NH2
Этиламин
+
NH4Br
(CH3CH2)2NH + NaBr + H2O
Диэтиламин
NaOH
(CH3CH2)3N + NaBr + H2O
Триэтиламин
ROH
Al2O3, T
R3N
59.
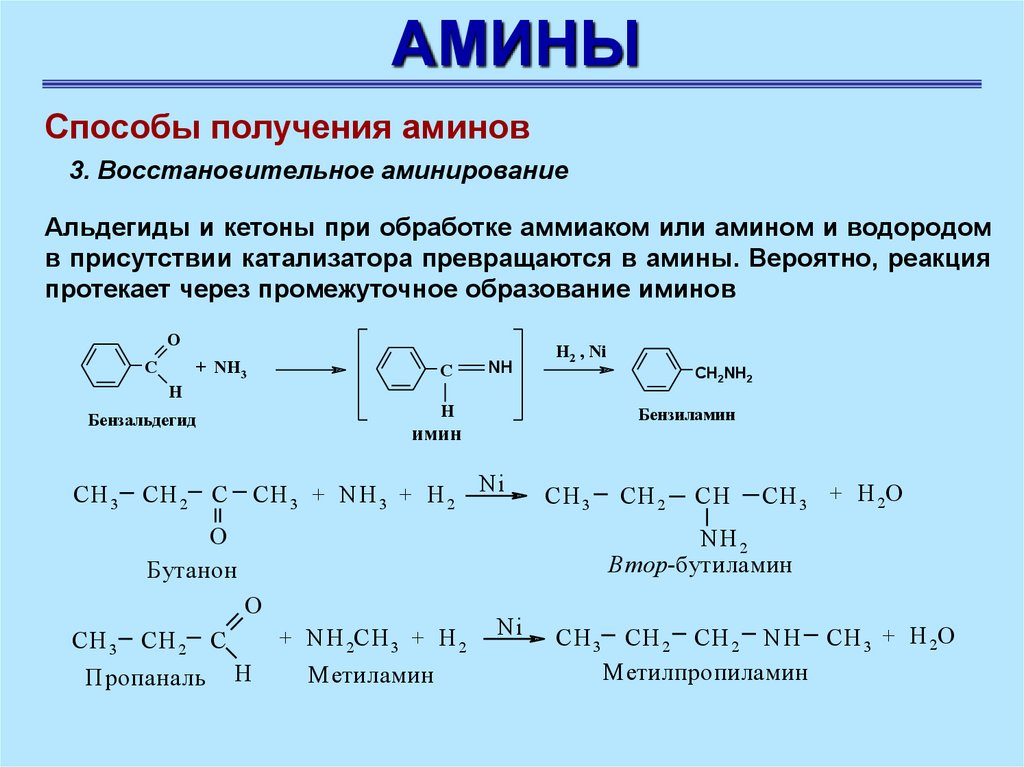
АМИНЫСпособы получения аминов
3. Восстановительное аминирование
Альдегиды и кетоны при обработке аммиаком или амином и водородом
в присутствии катализатора превращаются в амины. Вероятно, реакция
протекает через промежуточное образование иминов
O
С
+ NH3
С
Н
CH 2
H2 , Ni
CH2NH2
Н
Бензальдегид
СH 3
NH
Бензиламин
имин
C
CH 3 + NH 3 + H 2
Ni
СH 3
O
Бутанон
CH 2
Пропаналь
CН
CH 3 + H 2O
NH 2
Втор-бутиламин
O
СH 3
CH 2
+ NH 2СН 3 + H 2
C
Н
Метиламин
Ni
СH 3
CH 2 CН 2 NH CH 3 + H 2O
Метилпропиламин
60.
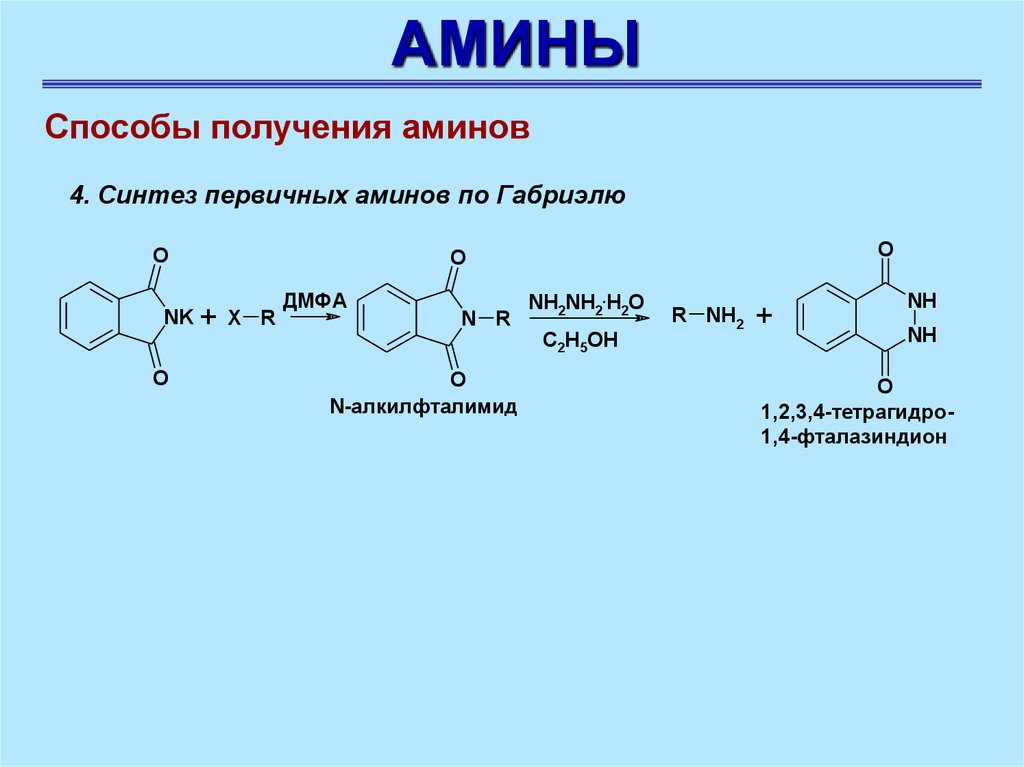
АМИНЫСпособы получения аминов
4. Синтез первичных аминов по Габриэлю
O
NK + X R
O
O
O
ДМФА
N R
O
N-алкилфталимид
NH2NH2.H2O
C2H5OH
R NH2
+
NH
NH
O
1,2,3,4-тетрагидро1,4-фталазиндион
61.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСоединения, в которых группа –N2– связана с углеводородным
радикалом и неуглеводородным радикалом Х, относятся к
диазосоединениям.
Ar–N2X, где X - Br–, Cl–, NO3–, HSO4– - cоли диазония
Ar–N2OH - диазогидрат
Ароматические соли диазония получают диазотирования при
взаимодействии первичных ароматических аминов с
азотистокислым натрием в присутствии минеральной кислоты
при 0–5 оС
NH2 + NaNO2 + 2 HCl
.. .. ..
H-O-N=O:
..
+
0-5
N
o
H
+ H
H
.. ..
O-N=O:
..
Cl
N Cl
+ NaCl + 2H2O
Cl - N = O
+ H2O
62.
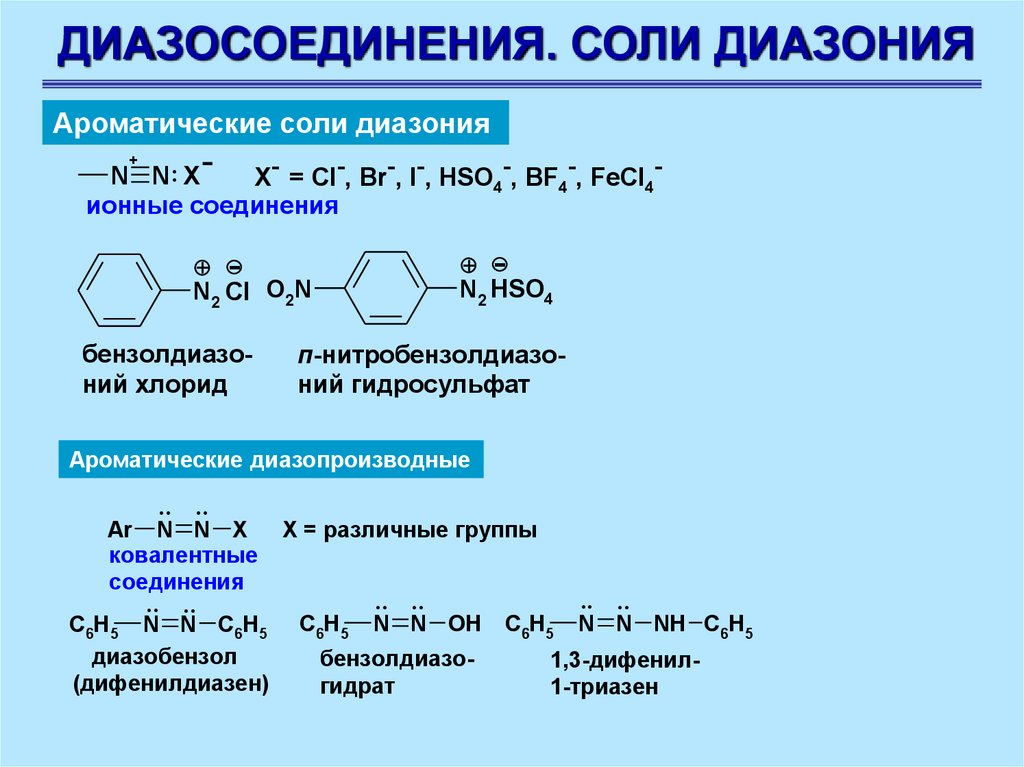
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯАроматические соли диазония
+
N N: X
X- = Cl-, Br-, I-, HSO4-, BF4-, FeCl4ионные соединения
+ N2 HSO4
+ N2 Cl O2N
бензолдиазоний хлорид
п-нитробензолдиазоний гидросульфат
Ароматические диазопроизводные
.. ..
Ar N N X
ковалентные
соединения
.. ..
C6H5 N N C6H5
диазобензол
(дифенилдиазен)
X = различные группы
C6H5
.. ..
N N OH
бензолдиазогидрат
C6H5
.. ..
N N NH C6H5
1,3-дифенил1-триазен
63.
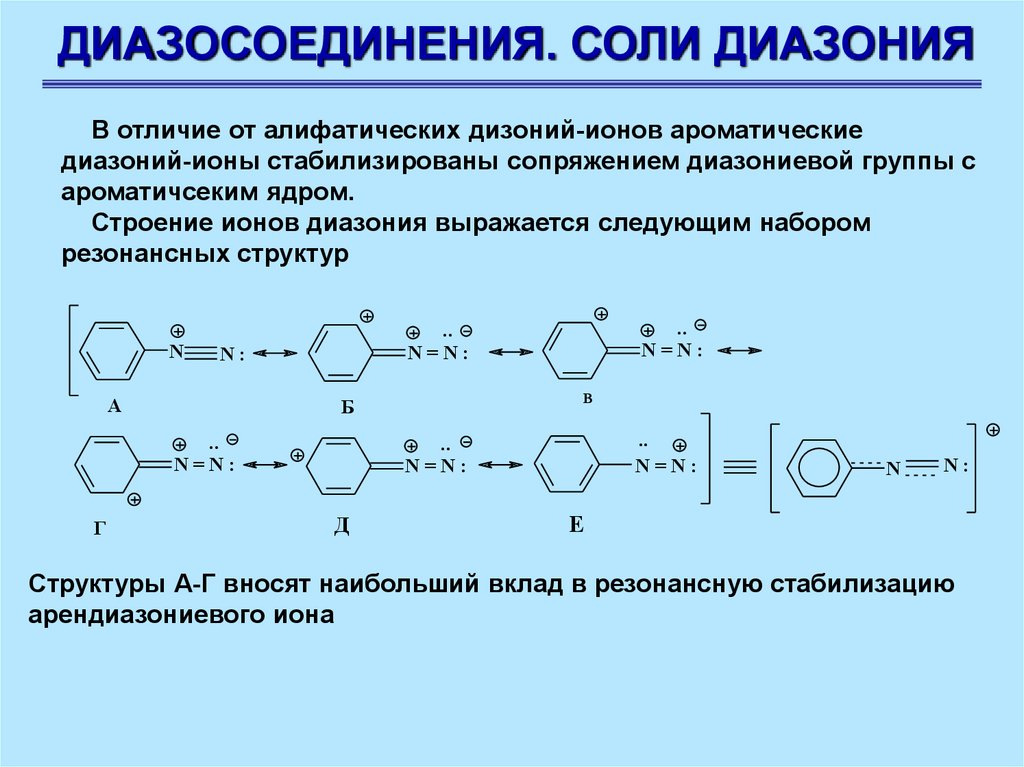
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯВ отличие от алифатических дизоний-ионов ароматические
диазоний-ионы стабилизированы сопряжением диазониевой группы с
ароматичсеким ядром.
Строение ионов диазония выражается следующим набором
резонансных структур
N
N:
А
В
Б
..
N=N:
Г
..
N=N:
..
N=N:
..
N=N:
..
N=N:
Д
N
N:
Е
Структуры А-Г вносят наибольший вклад в резонансную стабилизацию
арендиазониевого иона
64.
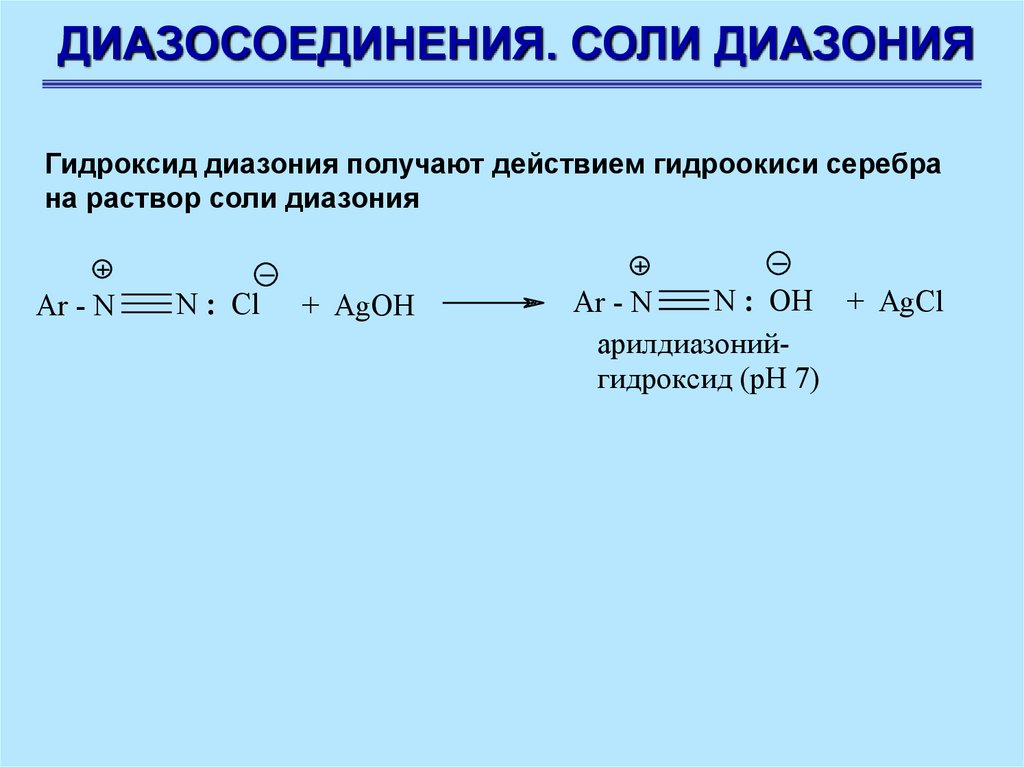
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯГидроксид диазония получают действием гидроокиси серебра
на раствор соли диазония
Ar - N
N : Cl
+ AgOH
N : OH + AgCl
Ar - N
арилдиазонийгидроксид (рН 7)
65.
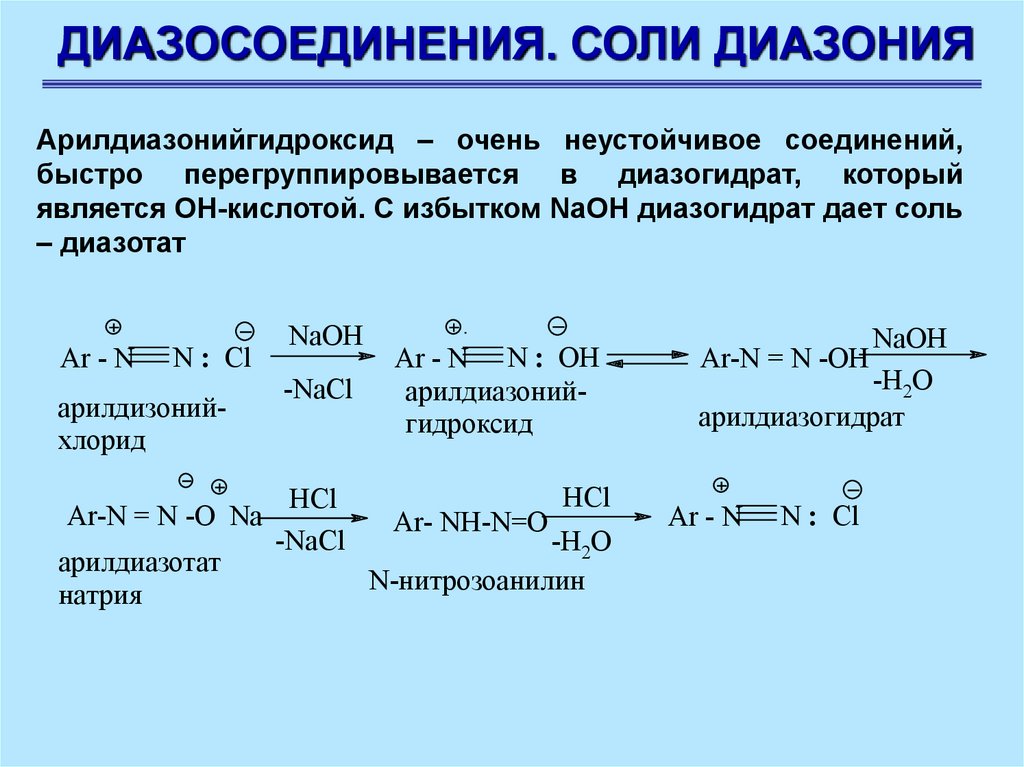
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯАрилдиазонийгидроксид – очень неустойчивое соединений,
быстро перегруппировывается в диазогидрат, который
является ОН-кислотой. С избытком NaOH диазогидрат дает соль
– диазотат
Ar - N
N : Cl
арилдизонийхлорид
Ar-N = N -O Na
арилдиазотат
натрия
NaOH
-NaCl
HCl
-NaCl
Ar - N N : OH
арилдиазонийгидроксид
Ar- NH-N=O
HCl
-H2O
N-нитрозоанилин
NaOH
-H2O
арилдиазогидрат
Ar-N = N -OH
Ar - N
N : Cl
66.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
Соли диазония ценны в синтезе не только потому, что они
способны давать большое число соединений, но и потому,
что их можно получать почти из всех первичных
ароматических аминов. Амины получают восстановлением
нитросоединений, а они могут быть получены из
углеводородов прямым нитрованием
67.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
Ar H
Ar NO 2
Ar
NH 2
Ar N
+
N Cl
Ar Cl
Ar Br
Ar I
Ar
CN
Ar OH
Ar H
68.
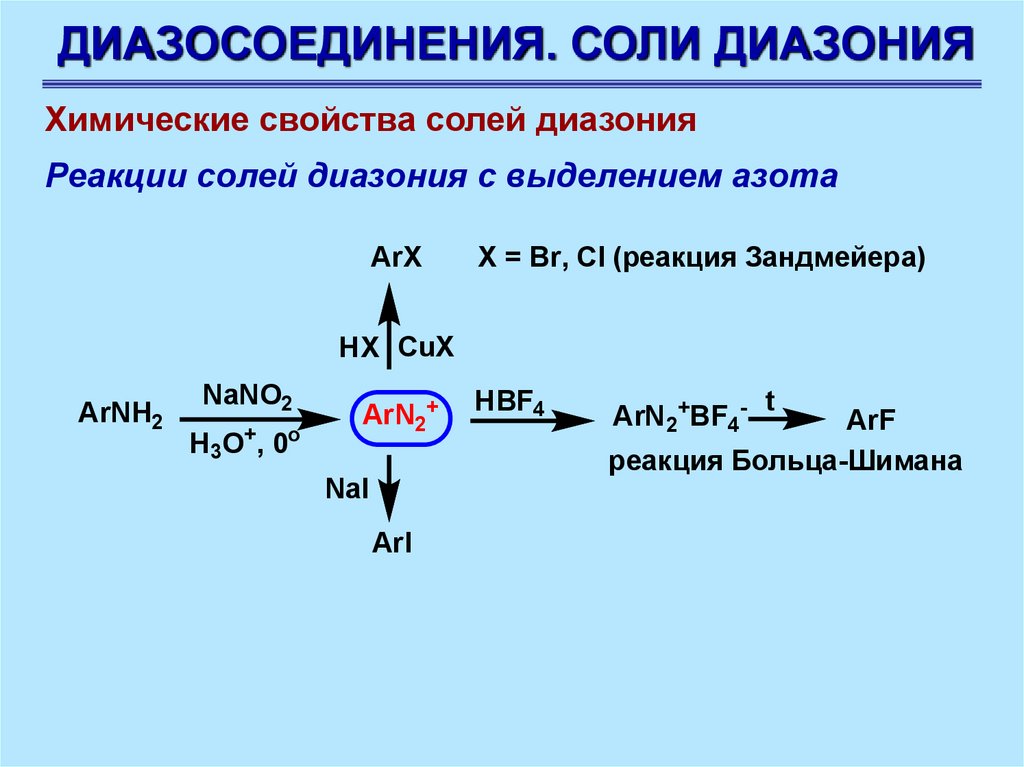
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
ArX
Х = Br, Cl (реакция Зандмейера)
HX CuX
ArNH2
NaNO2
+
o
H3O , 0
ArN2+
NaI
ArI
HBF4
ArN2+BF4-
t
ArF
реакция Больца-Шимана
69.
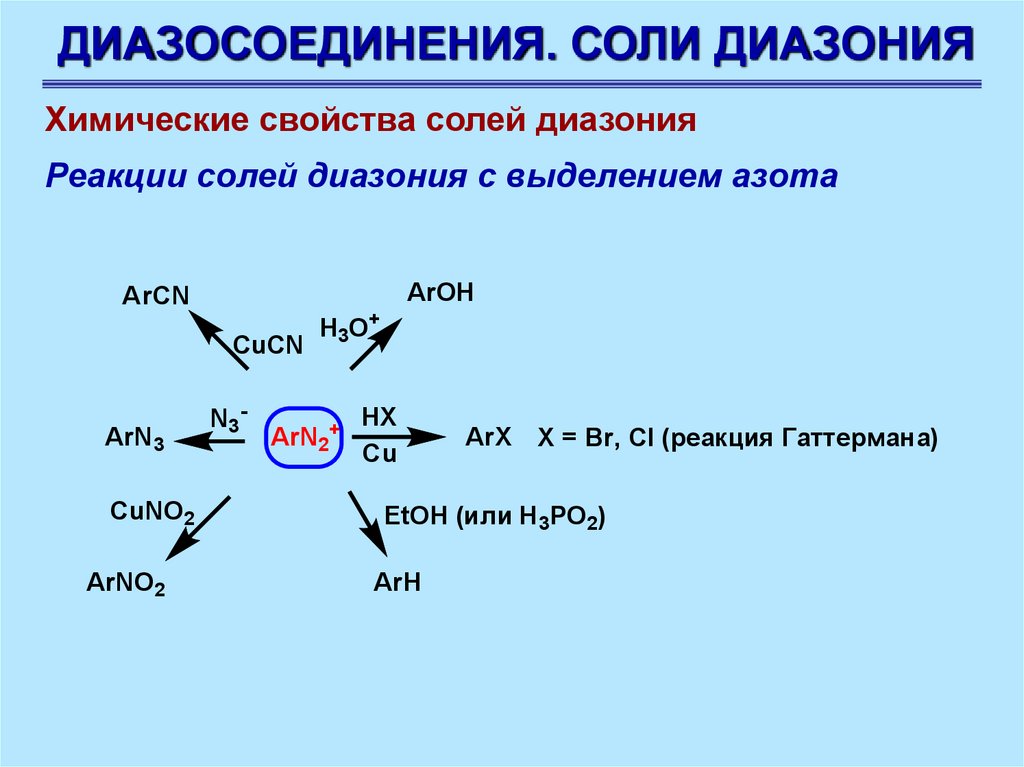
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯХимические свойства солей диазония
Реакции солей диазония с выделением азота
ArOH
ArCN
CuCN
ArN3
CuNO2
ArNO2
N3 -
H3O+
ArN2+
HX
Cu
ArX Х = Br, Cl (реакция Гаттермана)
EtOH (или H3PO2)
ArH
70.
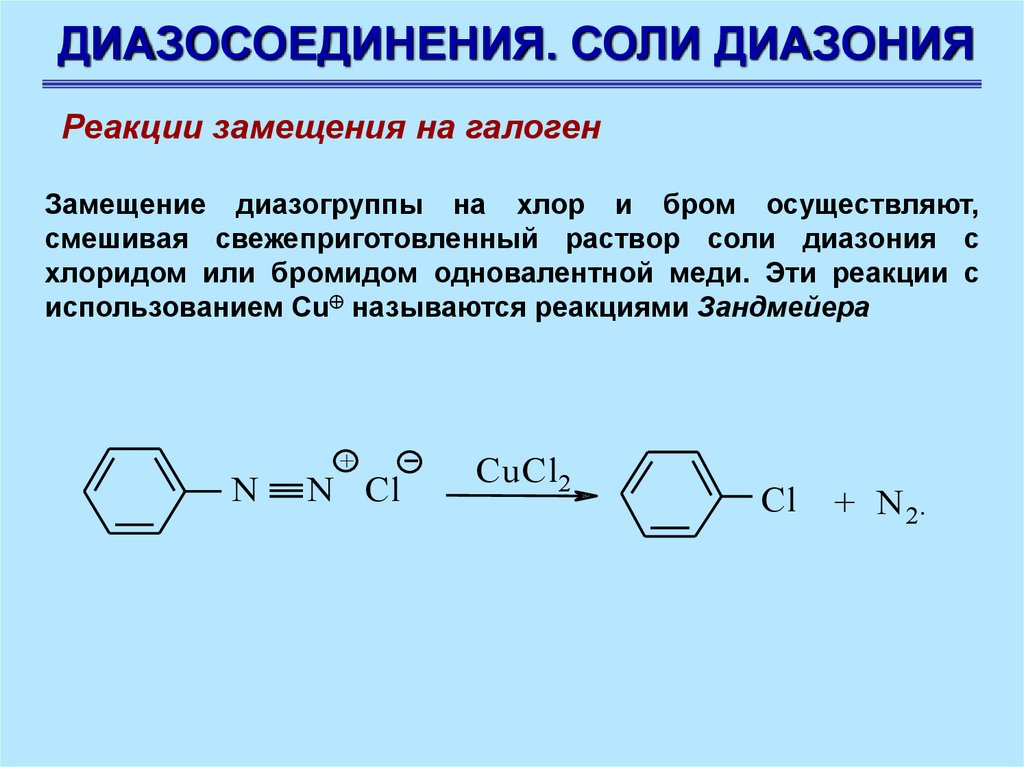
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции замещения на галоген
Замещение диазогруппы на хлор и бром осуществляют,
смешивая свежеприготовленный раствор соли диазония с
хлоридом или бромидом одновалентной меди. Эти реакции с
использованием Сu называются реакциями Зандмейера
N
+
N Cl
CuCl2
Cl
+ N 2.
71.
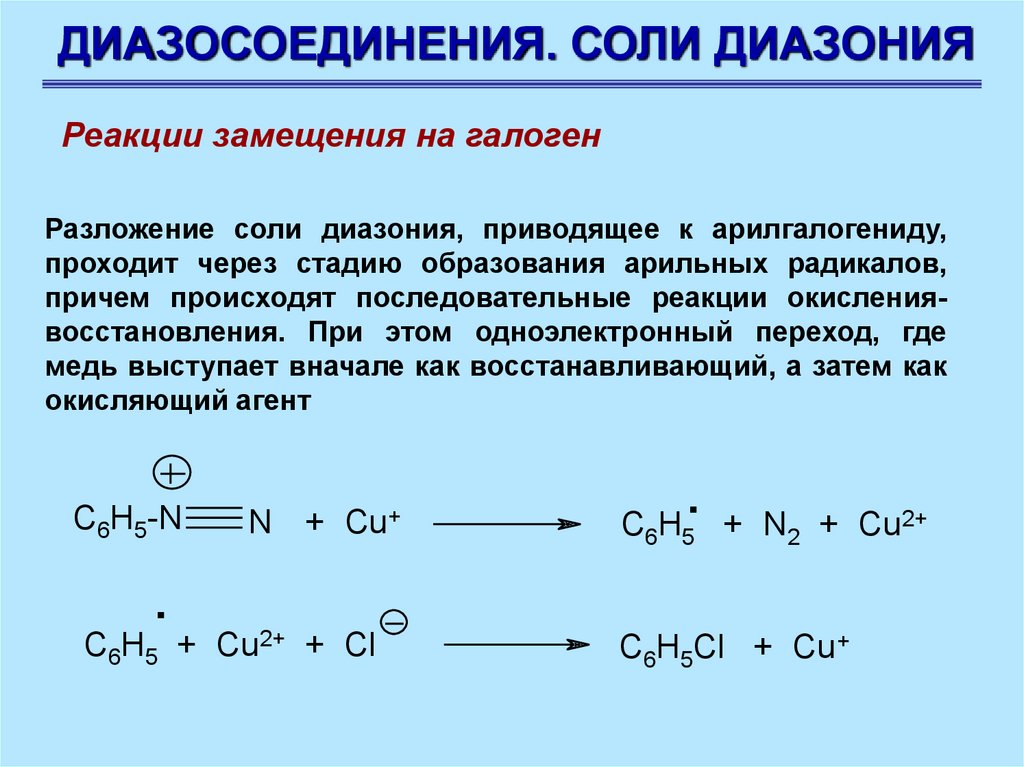
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции замещения на галоген
Разложение соли диазония, приводящее к арилгалогениду,
проходит через стадию образования арильных радикалов,
причем происходят последовательные реакции окислениявосстановления. При этом одноэлектронный переход, где
медь выступает вначале как восстанавливающий, а затем как
окисляющий агент
C6H5-N
N + Cu+
.
C6H5 + N2 + Cu2+
.
C6H5 + Cu2+ + Cl
C6H5Cl + Cu+
72.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции замещения на галоген
Характер действия металлической меди аналогичен, поскольку
на ее поверхности всегда имеется некоторое количество ионов
Сu . Замещение диазогруппы на I не требует применения
меди Сu или порошка меди, поскольку сам иодид-ион
вызывет разложение диазониевой соли
73.
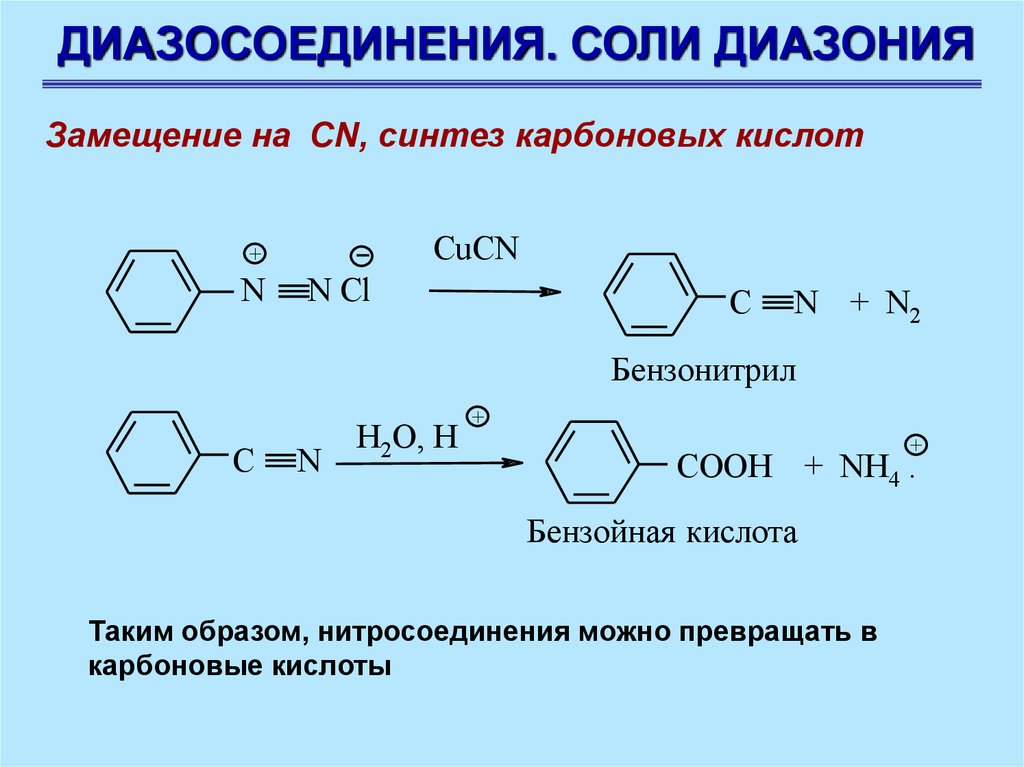
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на CN, синтез карбоновых кислот
CuCN
+
N
N Cl
C
N + N2
Бензонитрил
C
N
H2O, H
+
+
COOH + NH4 .
Бензойная кислота
Таким образом, нитросоединения можно превращать в
карбоновые кислоты
74.
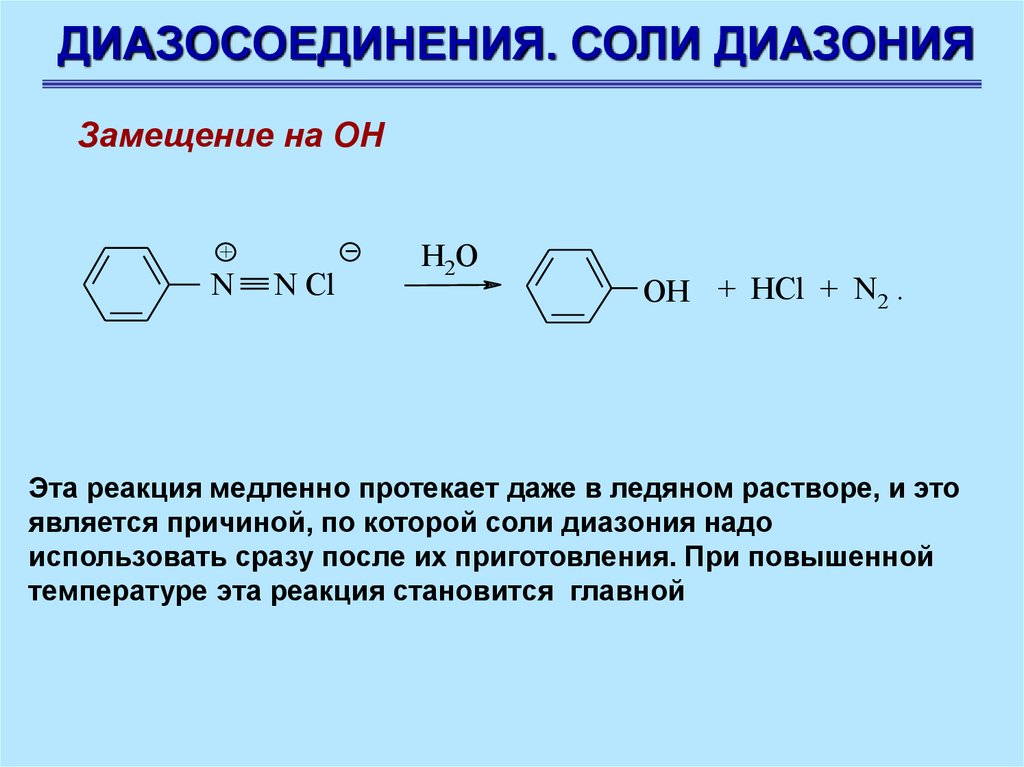
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на ОН
+
N
N Cl
H2O
OH + HCl + N2 .
Эта реакция медленно протекает даже в ледяном растворе, и это
является причиной, по которой соли диазония надо
использовать сразу после их приготовления. При повышенной
температуре эта реакция становится главной
75.
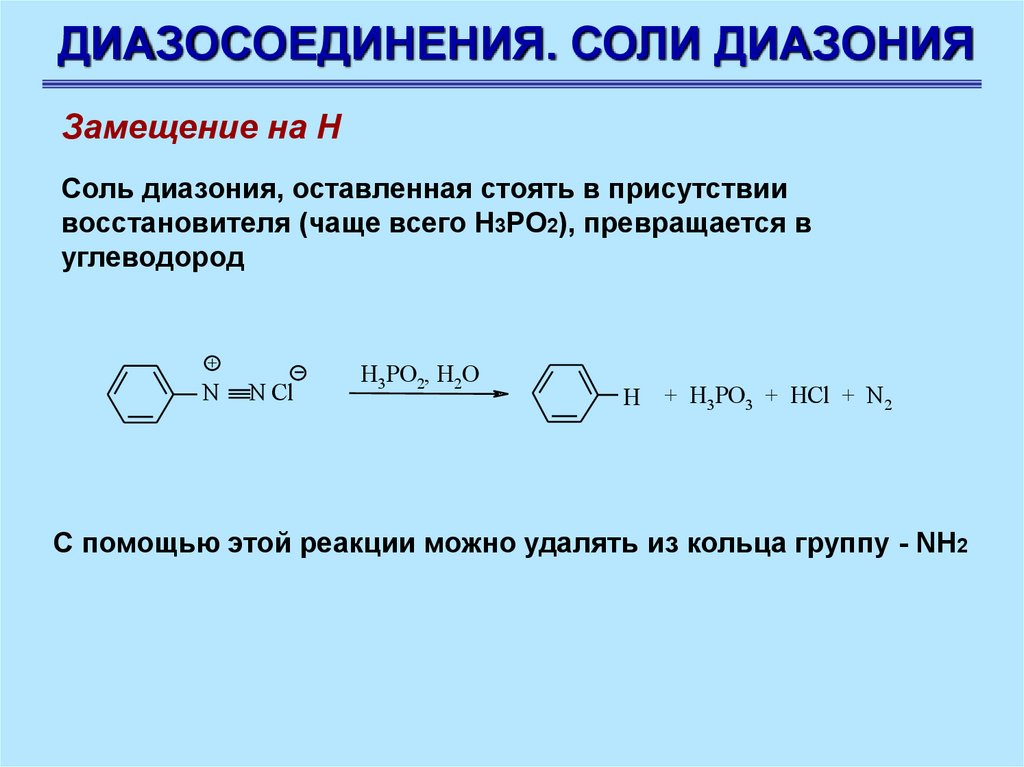
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯЗамещение на Н
Соль диазония, оставленная стоять в присутствии
восстановителя (чаще всего Н3РО2), превращается в
углеводород
+
N
N Cl
H3PO2, H2O
H
+ H3PO3 + HCl + N2
С помощью этой реакции можно удалять из кольца группу - NH2
76.
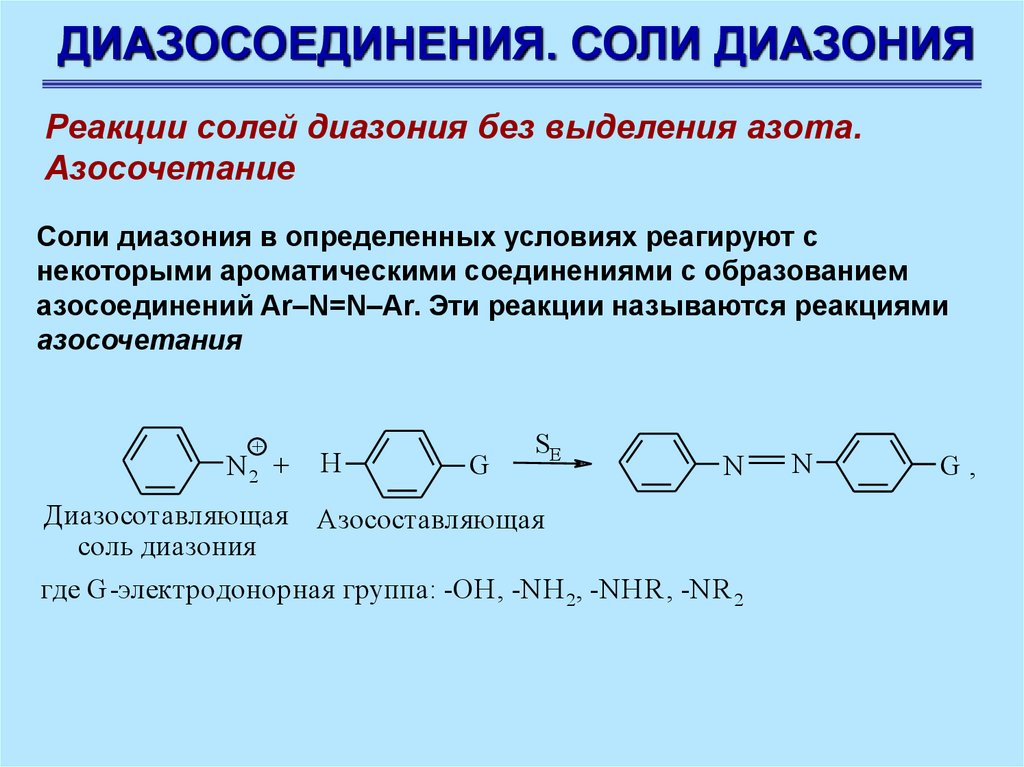
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Соли диазония в определенных условиях реагируют с
некоторыми ароматическими соединениями с образованием
азосоединений Ar–N=N–Ar. Эти реакции называются реакциями
азосочетания
+
N2 +
Диазосотавля ющая
соль диазония
H
G
SE
N
Азосоставля ющая
где G-электродонорная группа: -OH, -NH 2, -NHR, -NR 2
N
G,
77.
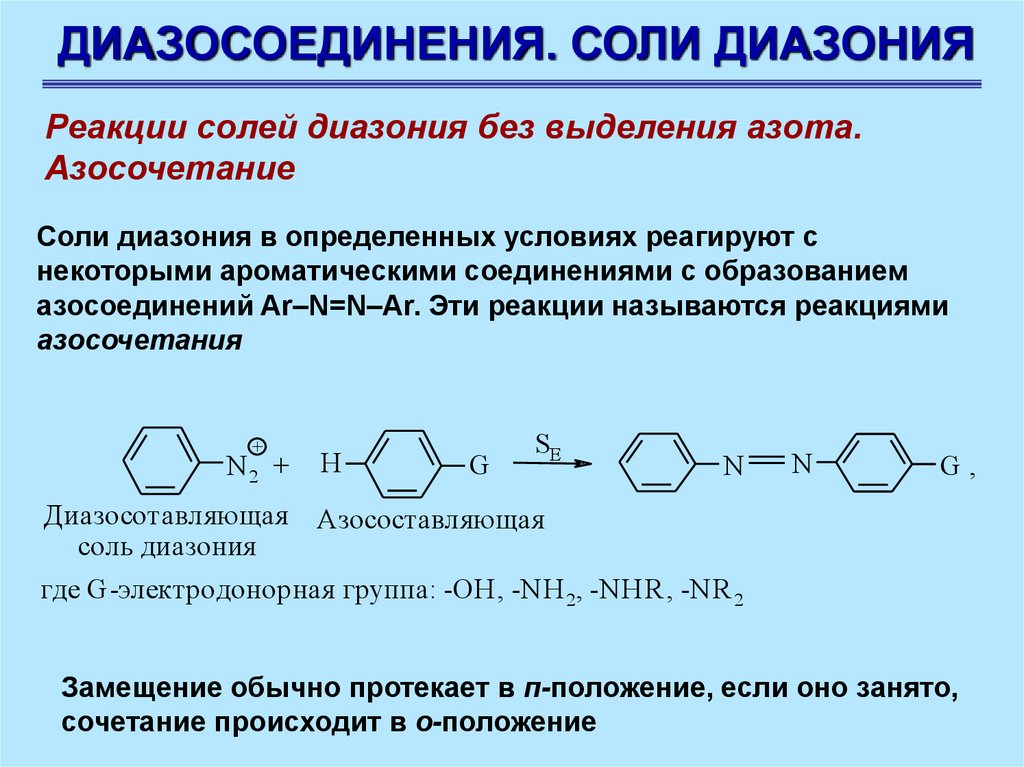
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Соли диазония в определенных условиях реагируют с
некоторыми ароматическими соединениями с образованием
азосоединений Ar–N=N–Ar. Эти реакции называются реакциями
азосочетания
+
N2 +
Диазосотавля ющая
соль диазония
H
G
SE
N
N
G,
Азосоставля ющая
где G-электродонорная группа: -OH, -NH 2, -NHR, -NR 2
Замещение обычно протекает в п-положение, если оно занято,
сочетание происходит в о-положение
78.
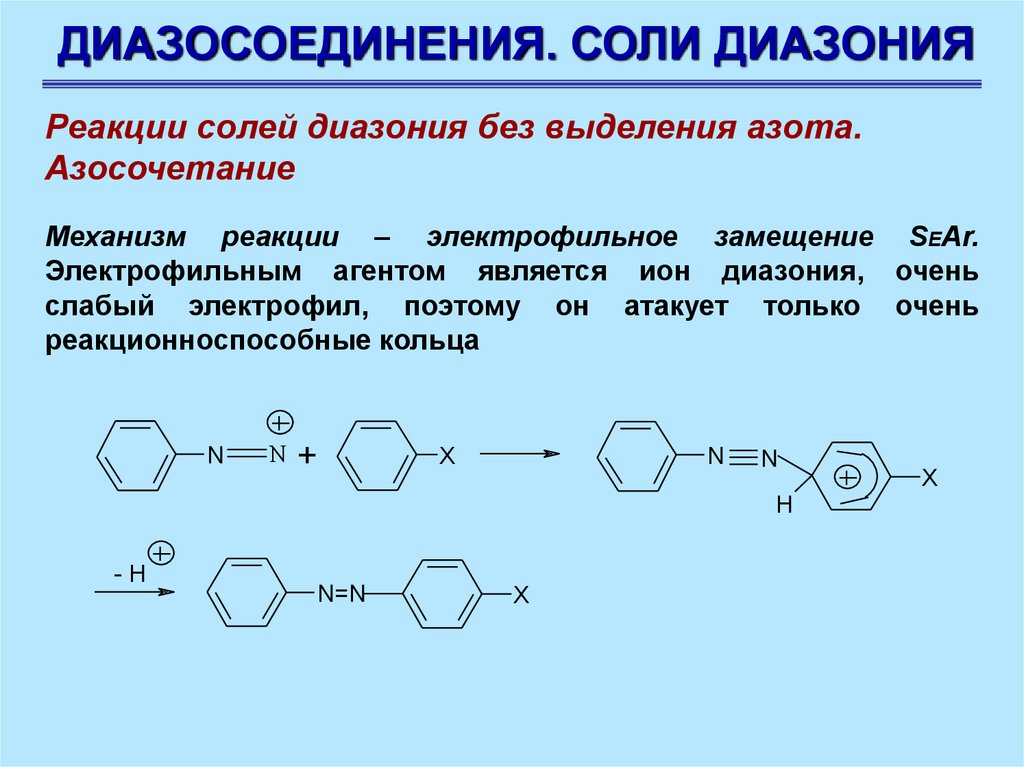
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Механизм реакции – электрофильное замещение SEAr.
Электрофильным агентом является ион диазония, очень
слабый электрофил, поэтому он атакует только очень
реакционноспособные кольца
N
N
+
X
N
N
H
-H
N=N
X
X
79.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Поскольку положительнфй заряд в арендиазониевом ионе
делокализован по системе -связей, включая ароматическое
кольцо, то электрофильность такого катиона не велика.
Вследствие этого ион арендиазония может вступать в реакции
электрофильного замещения только с соединениями,
содержащими сильные электронодонорные заместители
80.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Диазоний-катион
атакует
азокомпонент
крайним,
а
не
четырехвалентным атомом азота, на котором должна быть
сосредоточена большая часть положительного заряда диазогруппы. Вопервых, на крайнем атоме азота также имеется переданный по индукции
от соседнего атома азота значительный дефицит электронной
плотности, при этом одной из резонансных структур диазоний катиона
является форма (Е) с секстететом электронов на крайнем атоме азота
(нитрен)
+
+
N N:
..
N N:
+
+
N
+
..
N:
..
N
+
+
N:
..
N N:
+
+
N N:
Предполагают, что оба атома азота несут приблизительно одинаковые
положительные заряды
81.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯРеакции солей диазония без выделения азота.
Азосочетание
Во-вторых, если предположить, что азокомпонент образует связь с
четырехвалентным атомом азота, то при этом должна была бы
образоваться чрезвычайно невыгодная биполярная структура
N
X
N
Обычно диазоний катион атакует пара-, а не орто-положение
азокомпонента. Возможно это связано с тем, что в орто-положениях в
большей степени сказывается – I – эффект заместителей типа N(CH3)2 и
ОСН3, а также их экранирующее действие
82.
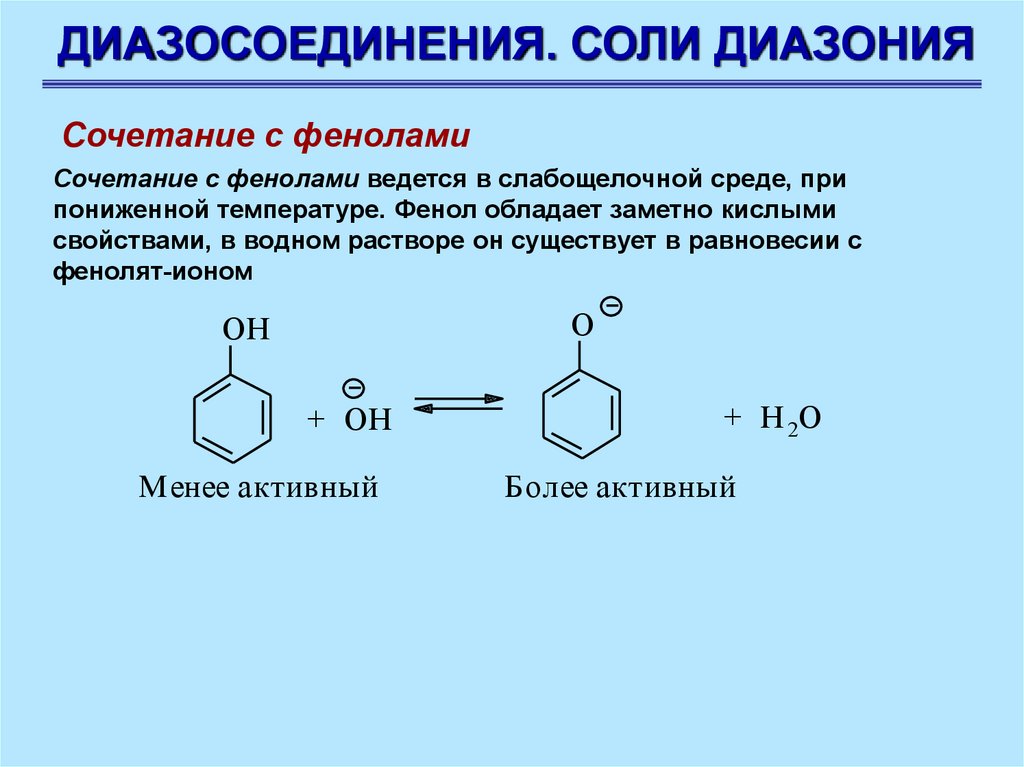
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСочетание с фенолами
Сочетание с фенолами ведется в слабощелочной среде, при
пониженной температуре. Фенол обладает заметно кислыми
свойствами, в водном растворе он существует в равновесии с
фенолят-ионом
O
OH
+ OH
Менее активный
+ H 2О
Более активный
83.
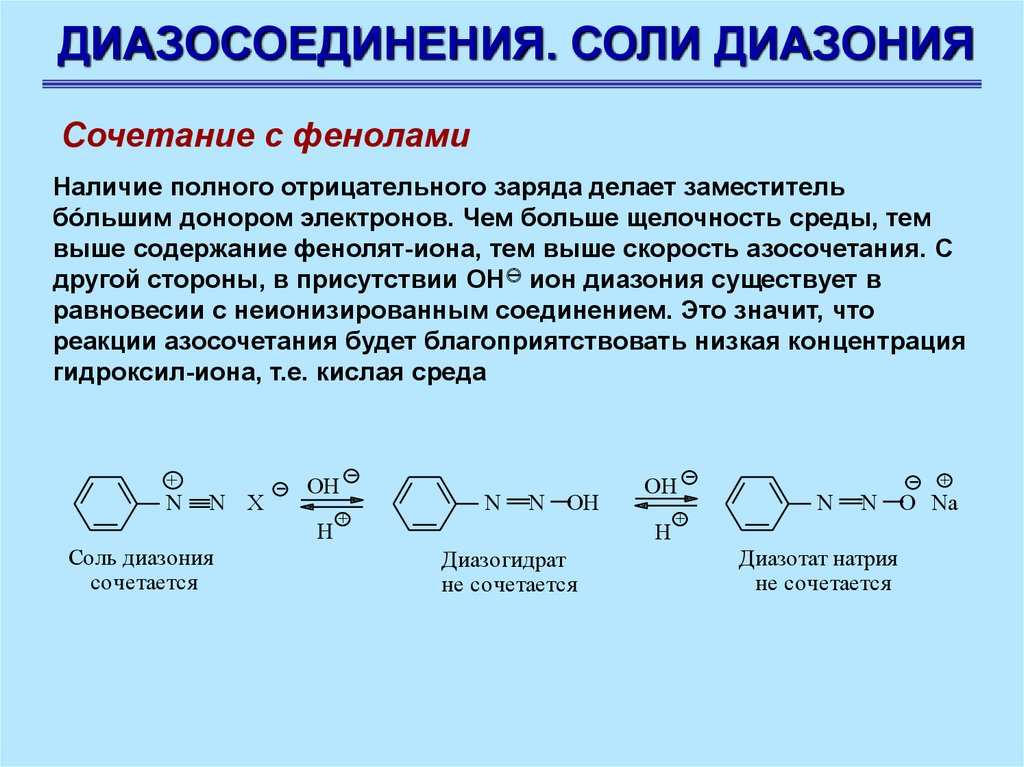
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСочетание с фенолами
Наличие полного отрицательного заряда делает заместитель
бóльшим донором электронов. Чем больше щелочность среды, тем
выше содержание фенолят-иона, тем выше скорость азосочетания. С
другой стороны, в присутствии ОН ион диазония существует в
равновесии с неионизированным соединением. Это значит, что
реакции азосочетания будет благоприятствовать низкая концентрация
гидроксил-иона, т.е. кислая среда
+
N
N Х
OH
Н
Соль диазония
сочетается
+
N
N OH
OH
Н
Диазогидрат
не сочетается
+
+
N
N O Na
Диазотат натрия
не сочетается
84.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСочетание с фенолами
Условия, при которых протекает реакция сочетания с фенолами
являются компромиссными: раствор не должен быть слишком
щелочным, чтобы концентрация диазотат-иона не стала слишком
высокой, и не должен быть слишком кислым, чтобы
концентрация фенолят-иона была достаточной для успешного
протекания реакции, т.е. поддерживается слабощелочная среда
85.
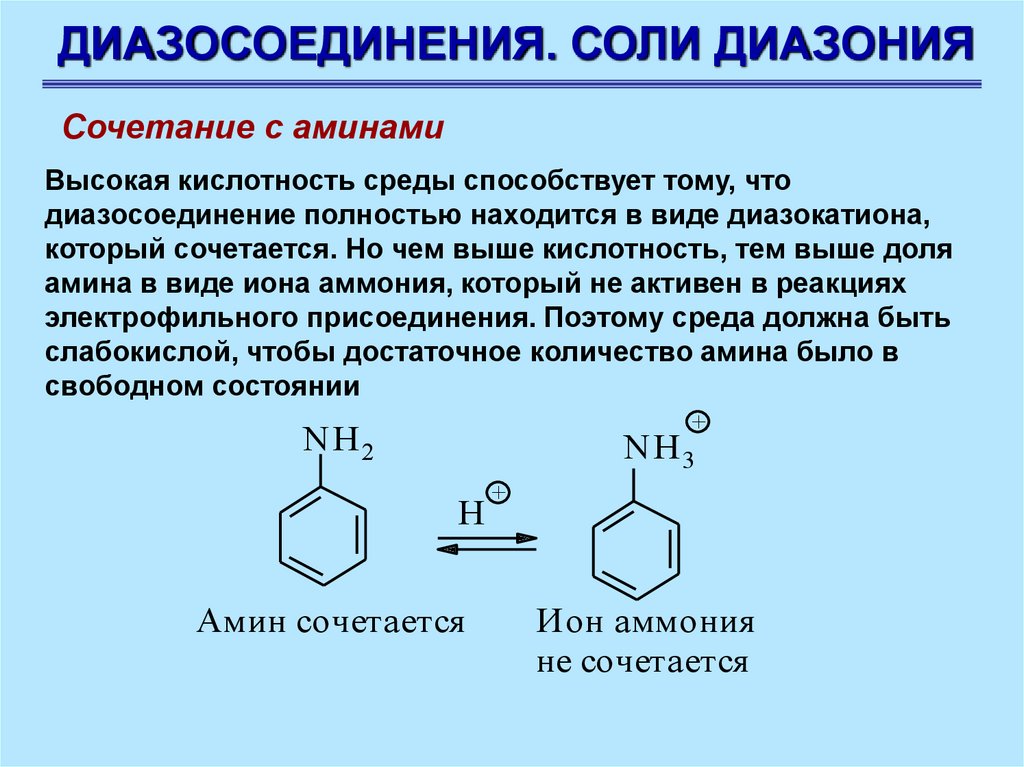
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯСочетание с аминами
Высокая кислотность среды способствует тому, что
диазосоединение полностью находится в виде диазокатиона,
который сочетается. Но чем выше кислотность, тем выше доля
амина в виде иона аммония, который не активен в реакциях
электрофильного присоединения. Поэтому среда должна быть
слабокислой, чтобы достаточное количество амина было в
свободном состоянии
+
NH 2
NH 3
H
Амин сочетается
+
Ион аммония
не сочетается
86.
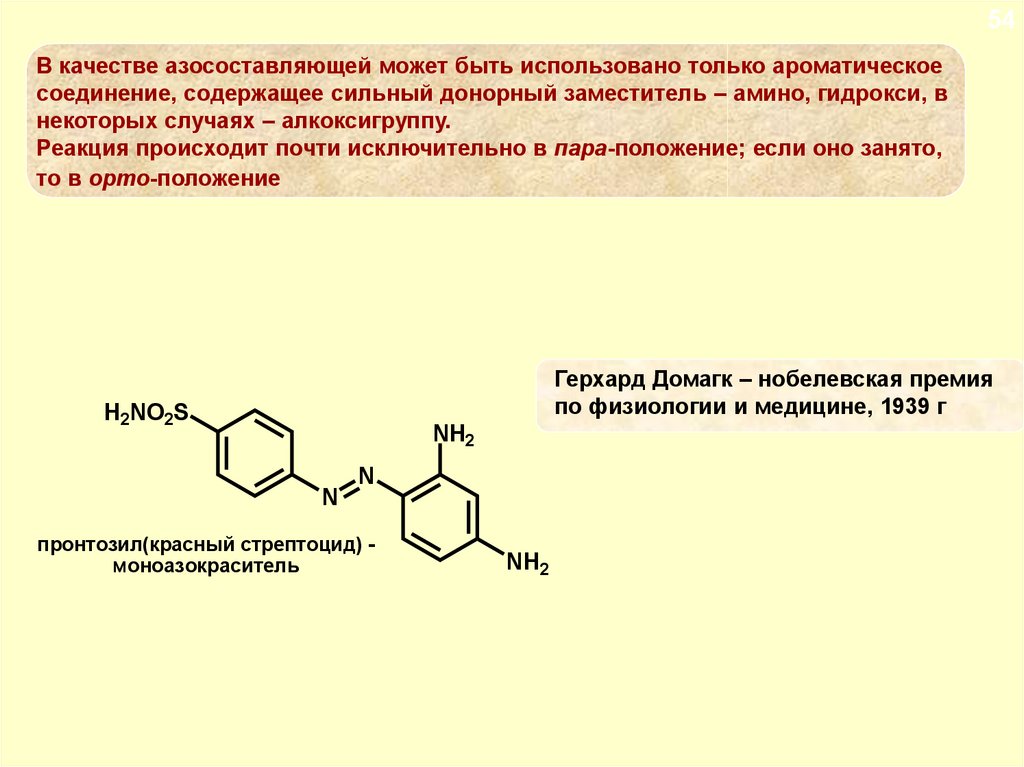
54В качестве азосоставляющей может быть использовано только ароматическое
соединение, содержащее сильный донорный заместитель – амино, гидрокси, в
некоторых случаях – алкоксигруппу.
Реакция происходит почти исключительно в пара-положение; если оно занято,
то в орто-положение
Герхард Домагк – нобелевская премия
по физиологии и медицине, 1939 г
H2NO2S
NH2
N
N
пронтозил(красный стрептоцид) моноазокраситель
NH2
87.
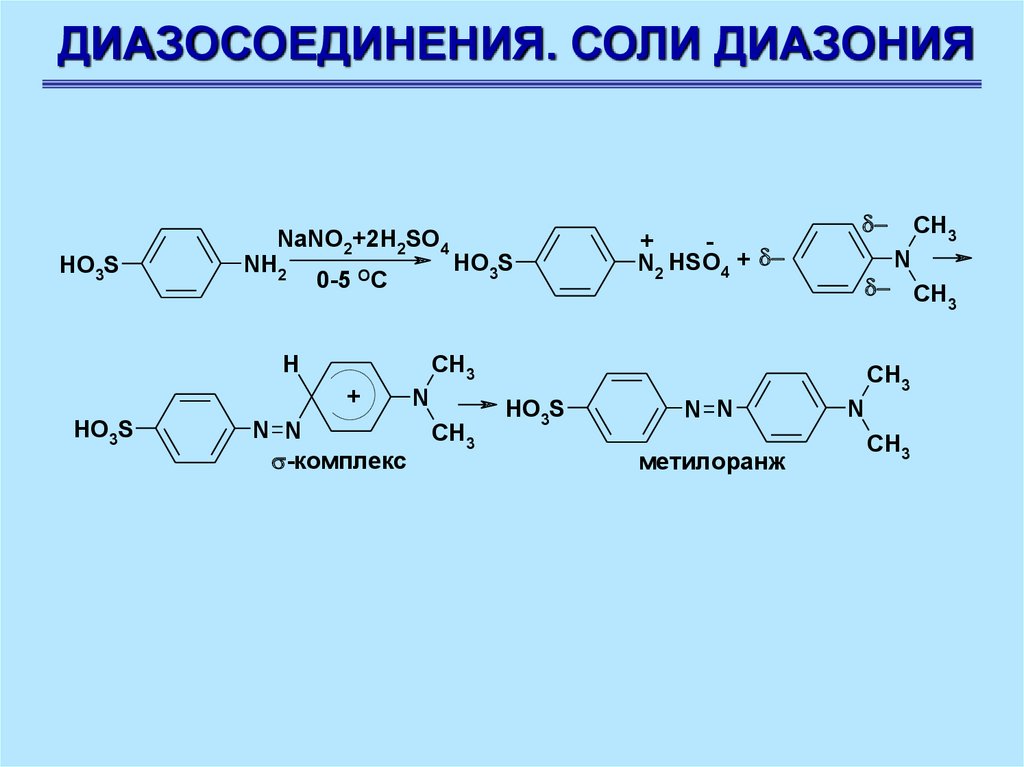
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯHO3S
NaNO2+2H2SO4
HO3S
NH2
0-5 OC
H
+
HO3S
N N
-комплекс
+
N2 HSO4 +
N
CH
3
CH3
N
CH3
CH3
CH3
HO3S
N N
метилоранж
N
CH3
88.
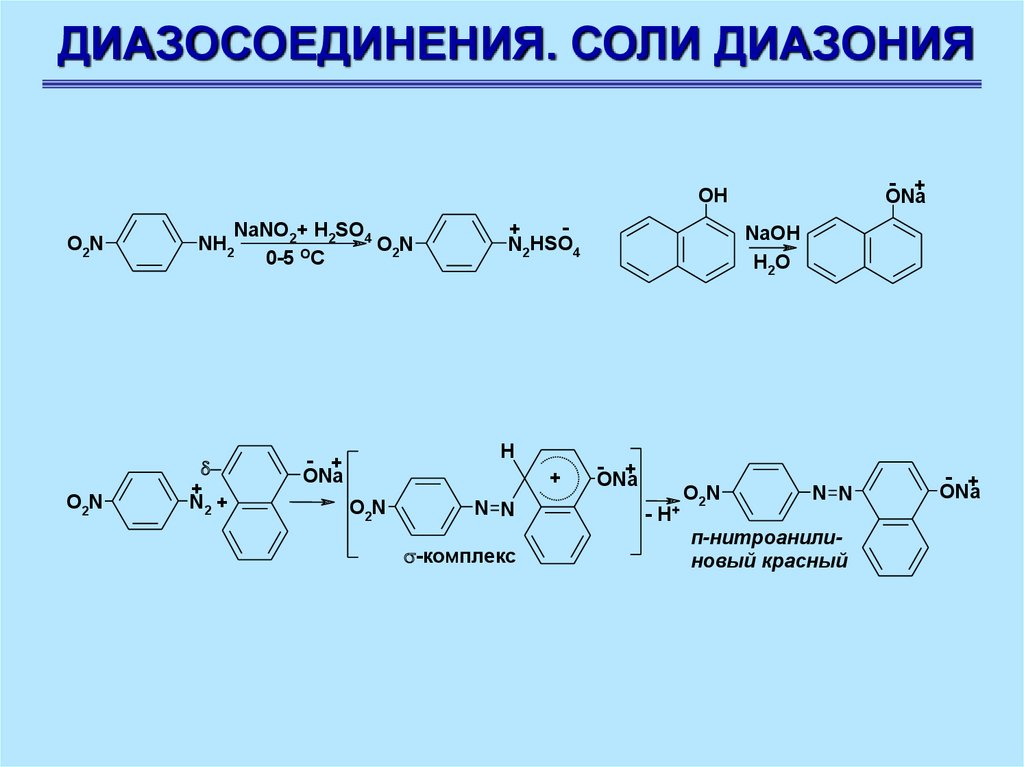
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ- +
ONa
OH
O2N
O2N
NaNO2+ H2SO4
NH2
O2N
0-5 OC
+
N2 +
+
N2HSO4
H
- +
ONa
+
O2N
N N
-комплекс
NaOH
H2O
- +
ONa
- H+
O2N
N N
п-нитроанилиновый красный
- +
ONa
89.
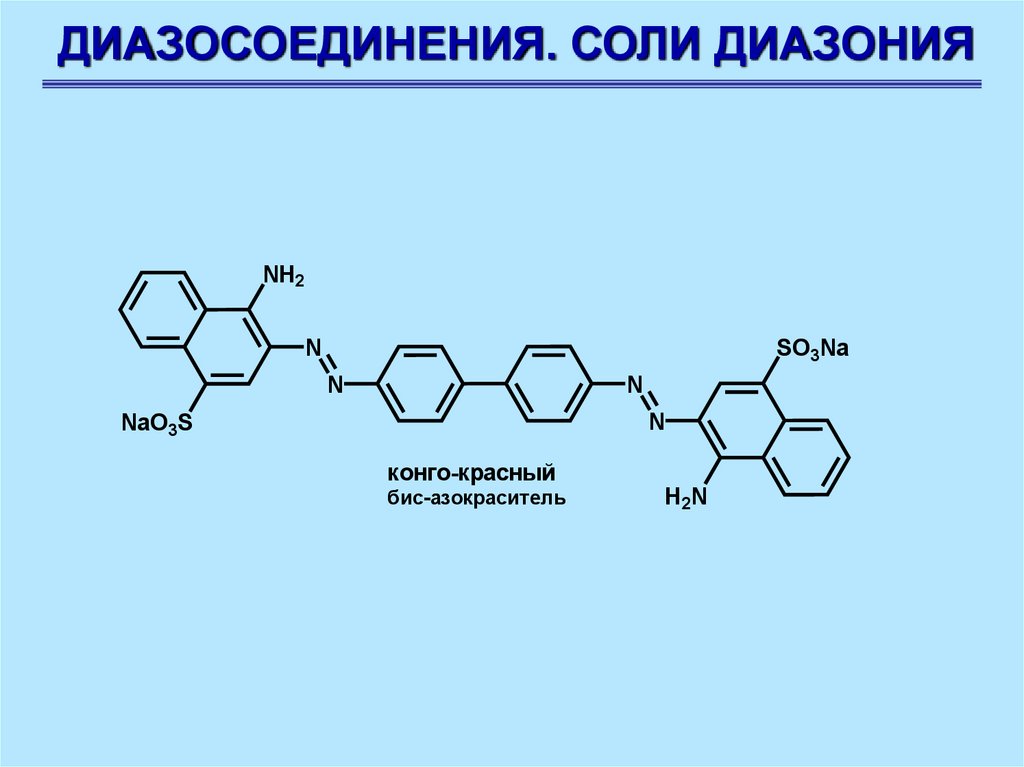
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯNH2
N
SO3Na
N
N
N
NaO3S
конго-красный
бис-азокраситель
H2N
90.
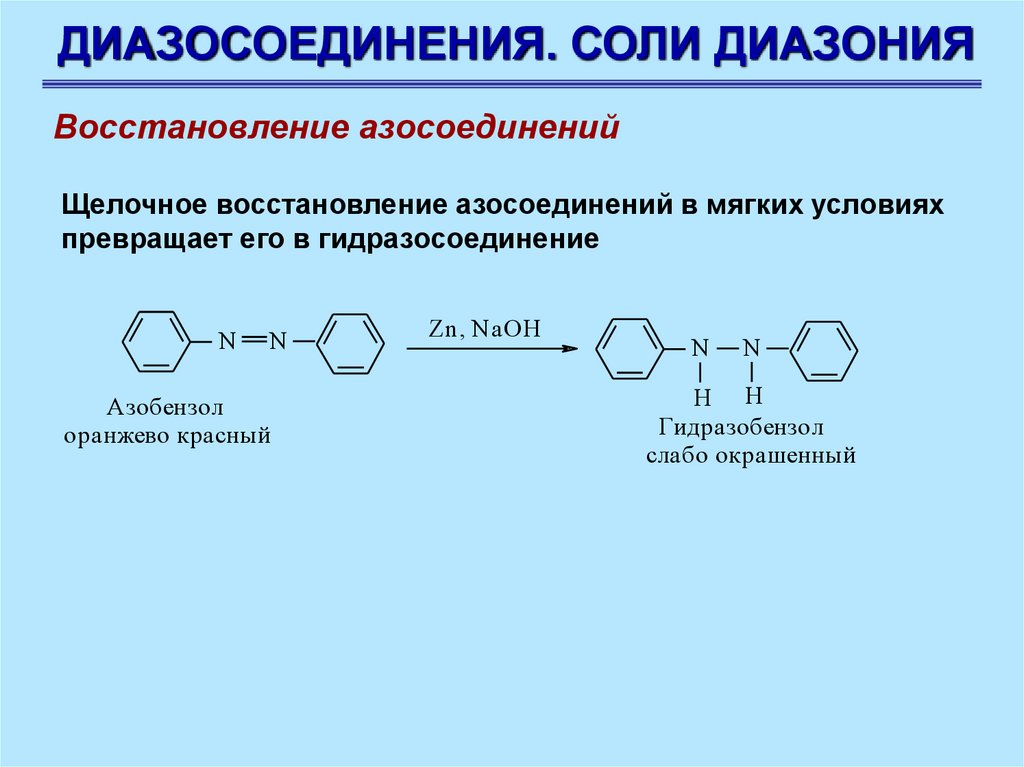
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯВосстановление азосоединений
Щелочное восстановление азосоединений в мягких условиях
превращает его в гидразосоединение
N
N
Азобензол
оранжево красный
Zn, NaOH
2H 2SO 4
N
N
H H
Гидразобензол
слабо окрашенный
91.
ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯВосстановление азосоединений
Действием более сильных восстановителей азокраситель
расщепляется по связи –N=N–. Эта реакция приводит к
образованию двух аминов. Она очень полезна при определении
структуры азасоединений
NaO 3S
N
N
N(CH 3)2
SnCl2, Н
+
NaO 3S
NH 2 + NH 2
N(CH 3)2



































 Химия
Химия








