Похожие презентации:
Периодическая система химических элементов Д.И. Менделеева
1.
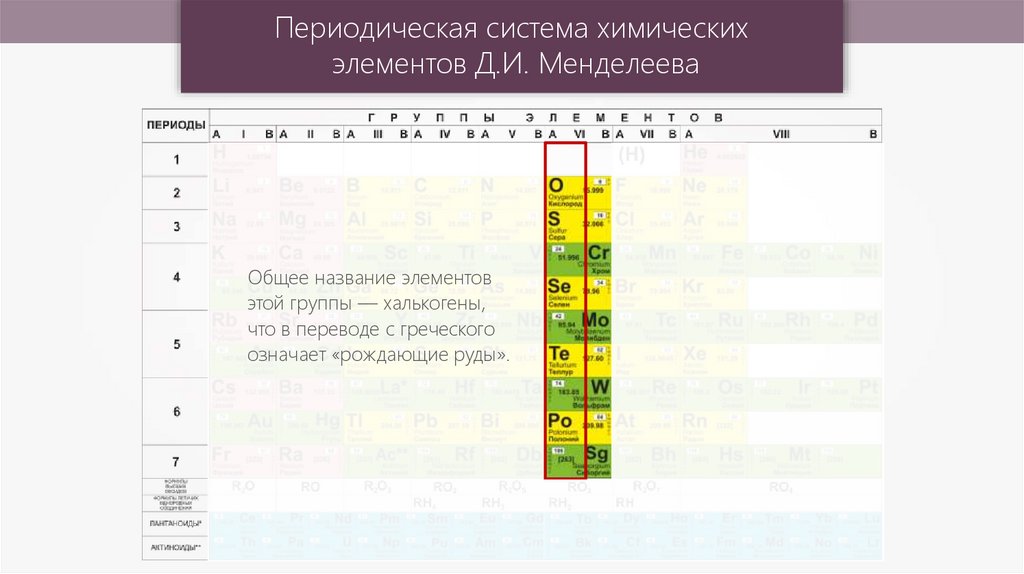
Периодическая система химическихэлементов Д.И. Менделеева
Общее название элементов
этой группы — халькогены,
что в переводе с греческого
означает «рождающие руды».
2.
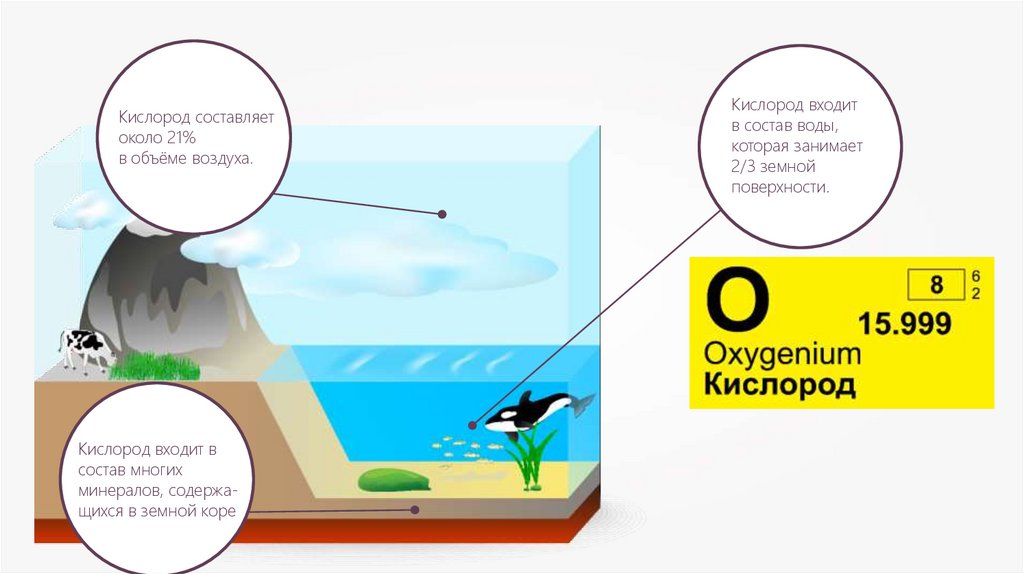
Кислород составляетоколо 21%
в объёме воздуха.
Кислород входит в
состав многих
минералов, содержащихся в земной коре
Кислород входит
в состав воды,
которая занимает
2/3 земной
поверхности.
3.
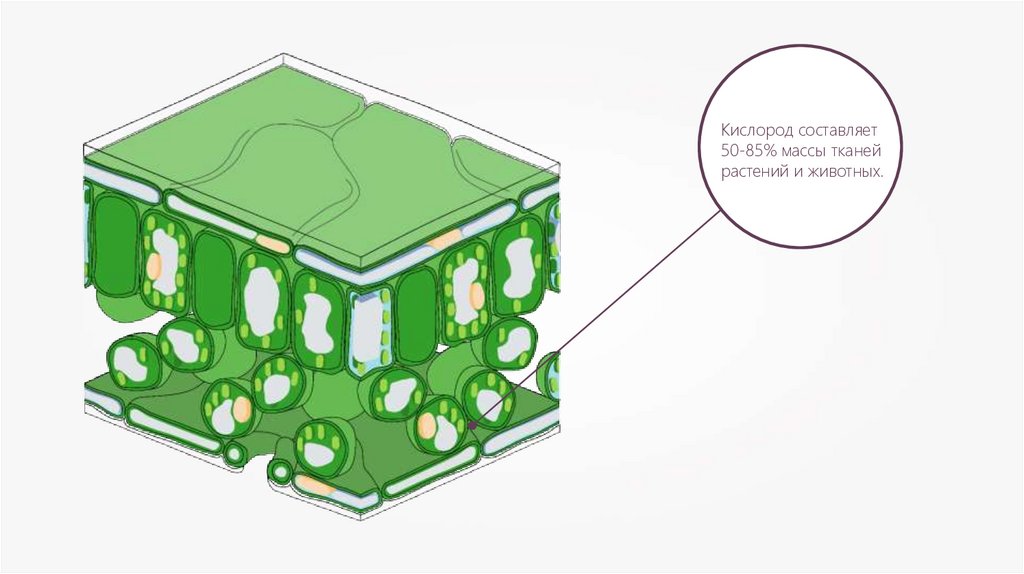
Кислород составляет50-85% массы тканей
растений и животных.
4.
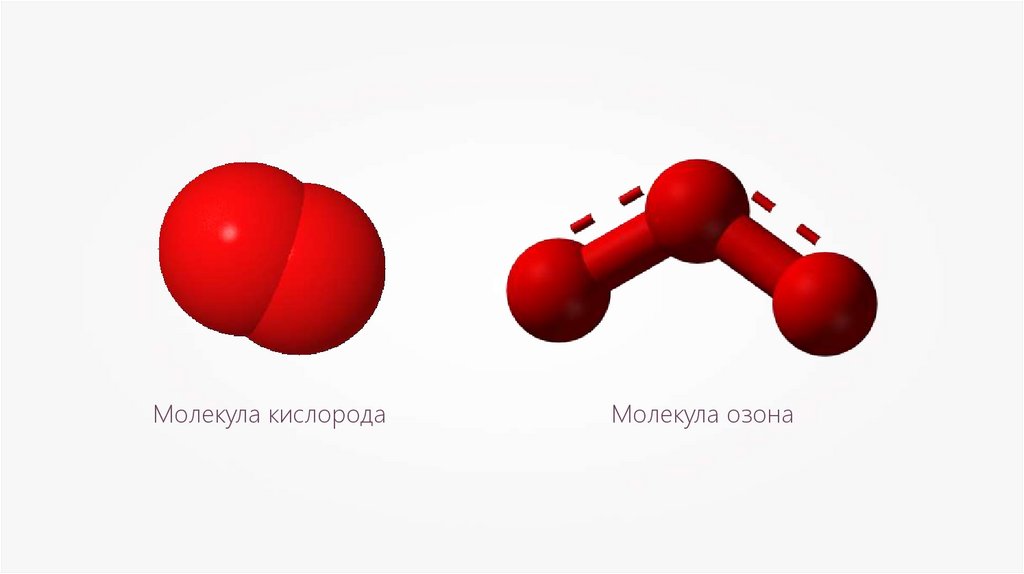
Молекула кислородаМолекула озона
5.
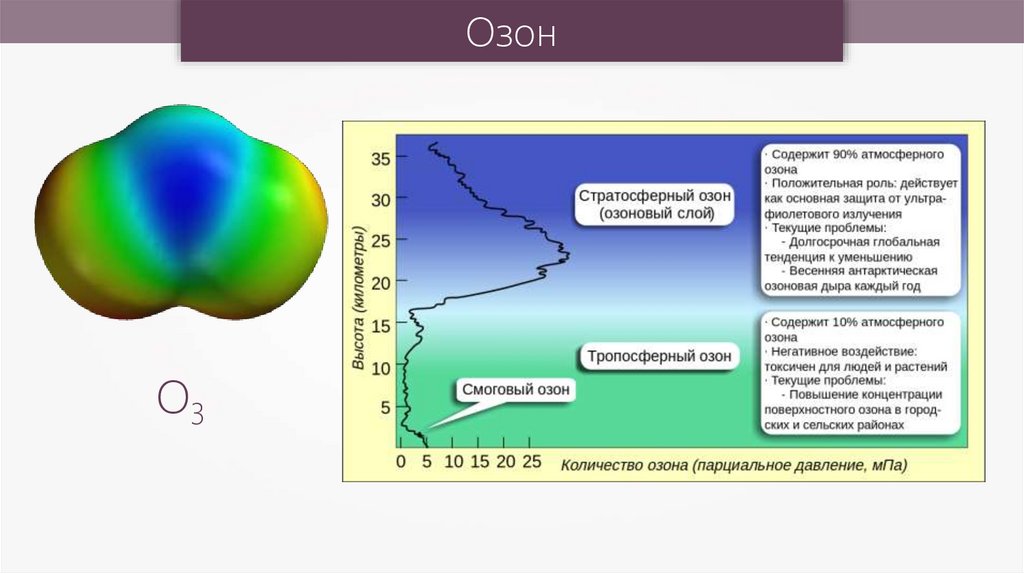
ОзонО3
6.
КислородКислород О2 — газ без цвета, запаха,
вкуса, содержится в воздухе в
большом объёме, поддерживает
реакции дыхания и горения.
О2
7.
Получение кислорода2KMnO4 = K2MnO4 + MnO2 + O2↑
2H2O2 = 2H2O + O2↑
2KClO3 = 2KCl + 3O2↑
2HgO = 2Hg + O2↑
8.
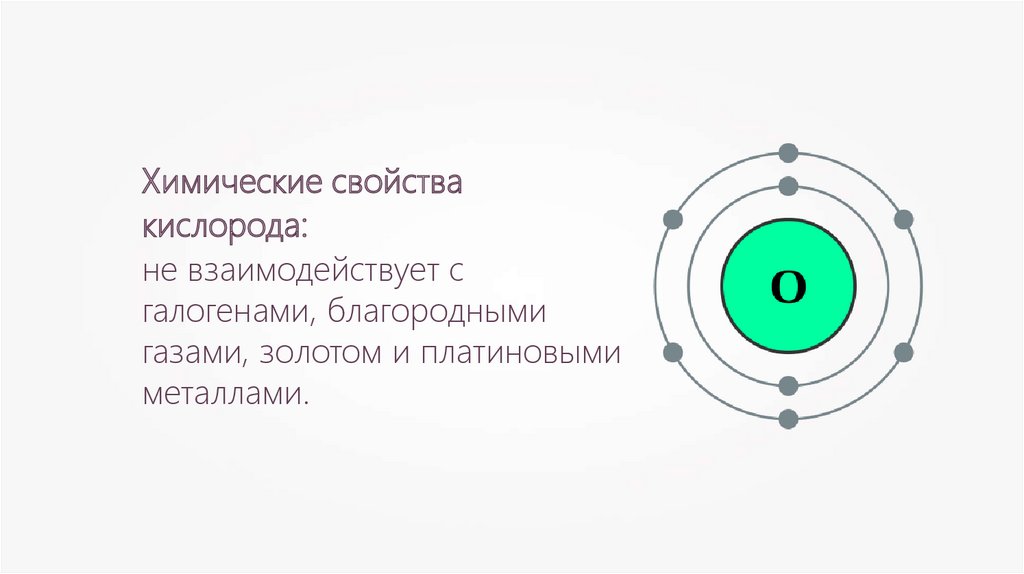
Химические свойствакислорода:
не взаимодействует с
галогенами, благородными
газами, золотом и платиновыми
металлами.
9.
4Li + O2 = 2Li2O3Fe + 2O2 = Fe3O4
2Mg + O2 = 2MgO
Кислород активно взаимодействует со
щелочными металлами даже без нагревания.
Металлы средней и низкой активности
реагируют с кислородом при нагревании.
10.
Реакция горенияS + O2 = SO2
4P + 5O2 = 2P2O5
C + O2 = CO2
При взаимодействии металлов и
неметаллов с кислородом зачастую
происходит выделение большого
количества тепла и даже воспламенение.
11.
N2 + O2 = 2NOВзаимодействие кислорода с азотом
происходит только при нагревании свыше
2000 °C или же при электрическом разряде.
12.
CH4 + 2O2 = 2H2O + CO22NO + O2 = 2NO2
2BaO + O2 = 2BaO2
Кислород довольно активно
взаимодействует не только с простыми, но
и со сложными веществами.
13.
Горение всех видов топливаосновано на высокой
окислительной способности
кислорода.
14.
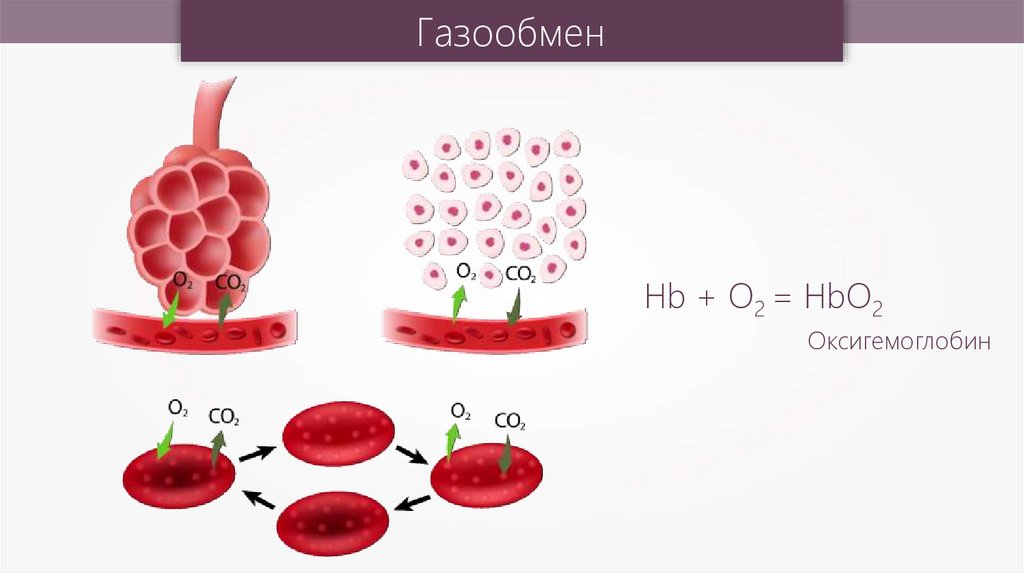
ГазообменHb + O2 = HbO2
Оксигемоглобин
15.
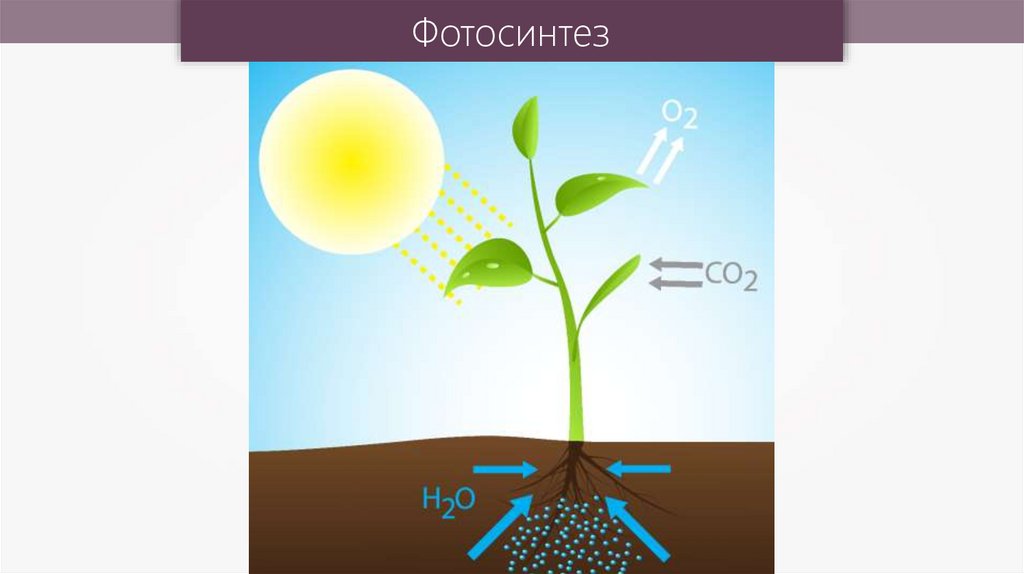
Фотосинтез16.
17.
Применение кислородаМеталлургия
Химическая промышленность
Запуск ракетных двигателей
Использование в медицине, авиации, на
космических кораблях, подводных лодках,
при работе водолазов и пожарных
18.
Газометр19.
Впервые обнаружили,что при нагревании
некоторых веществ
выделяется газ, в
котором, как и в воздухе,
горит свеча.
Дж. Пристли
1737–1804 гг.
К. Шееле
1742–1786 гг.
20.
Открыл, что этот газ активноучаствует в образовании едких
жидкостей — кислот.
Антуан Лавуазье
1778–1825 гг.












 Химия
Химия








