Похожие презентации:
Строение электронных оболочек атомов
1.
31СТРОЕНИЕ
ЭЛЕКТРОННЫХ
ОБОЛОЧЕК
АТОМОВ
2. Электронное облако — это модель движения электрона в атоме; область пространства, в каждой точке которой может находиться
Электронное облако —это модель движения электрона
в атоме; область пространства,
в каждой точке которой может
находиться данный электрон
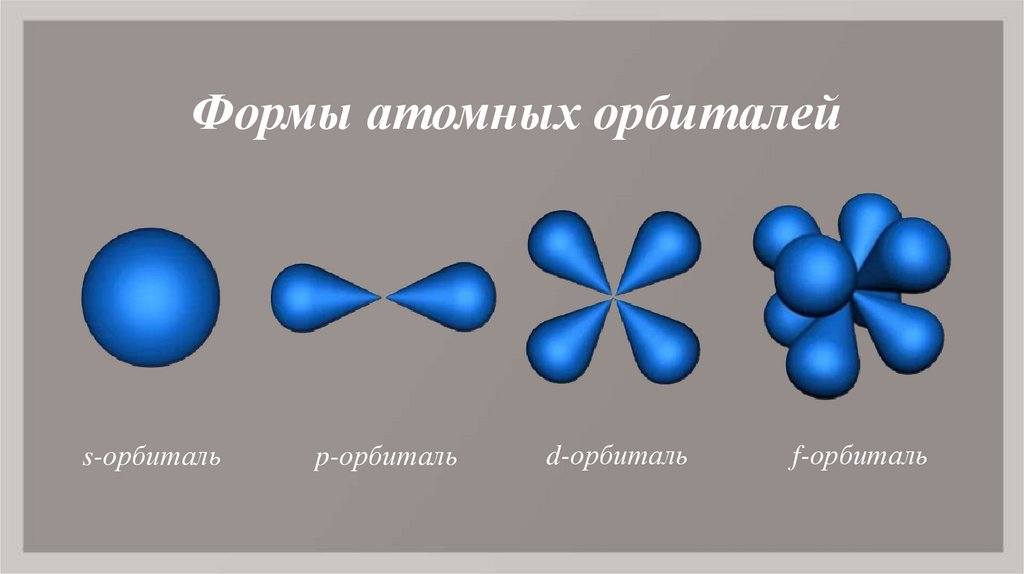
3. Формы атомных орбиталей
s-орбитальp-орбиталь
d-орбиталь
f-орбиталь
4. Чем дальше электрон от ядра, тем больше его энергия и слабее связь с ядром:
E4Чем дальше
электрон от ядра,
тем больше его
энергия и слабее
связь с ядром:
E3
E2
E4 > E3 > E2 > E1
E1
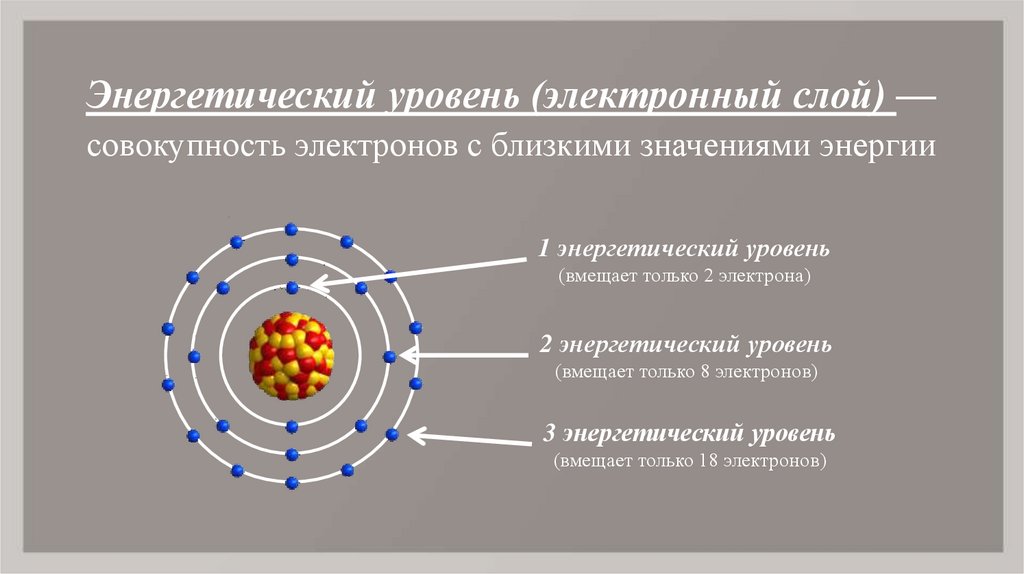
5. Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии
Энергетический уровень (электронный слой) —совокупность электронов с близкими значениями энергии
1 энергетический уровень
(вмещает только 2 электрона)
2 энергетический уровень
(вмещает только 8 электронов)
3 энергетический уровень
(вмещает только 18 электронов)
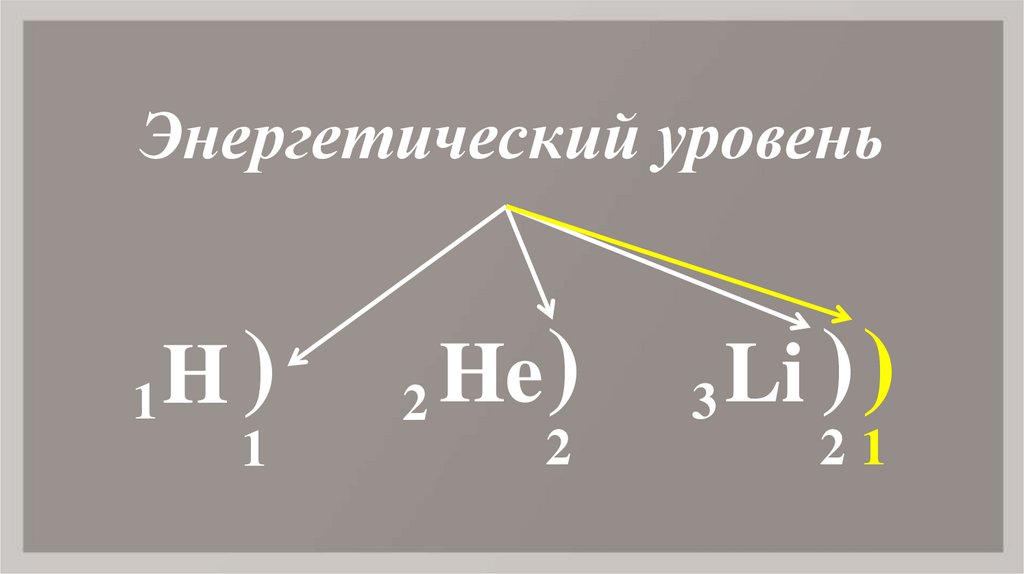
6. H
Энергетический уровень1
H)
1
2
He )
2
3
Li ) )
21
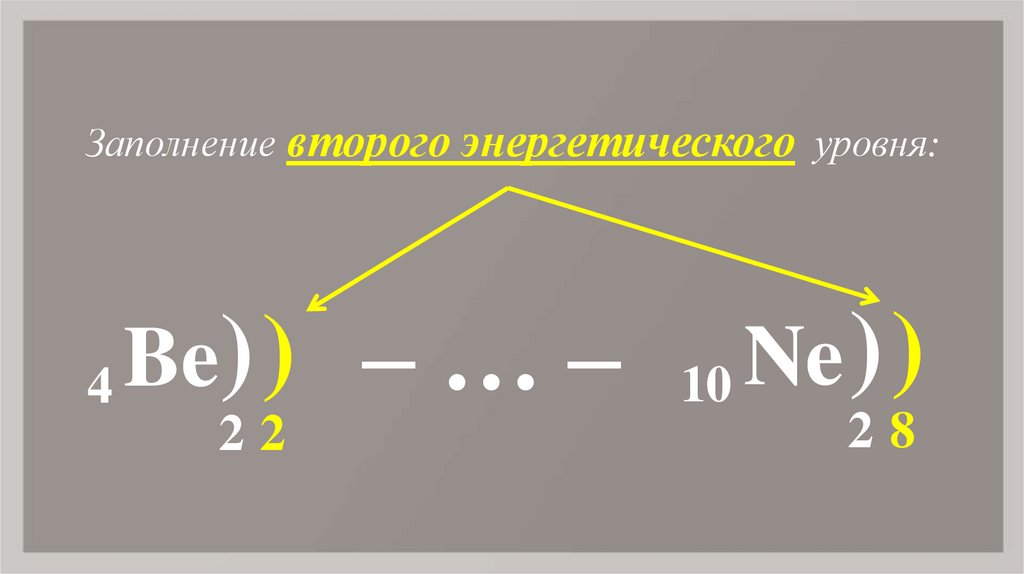
7. Be
Заполнение второго энергетического уровня:4
Be) ) – … –
22
10
Ne ) )
28
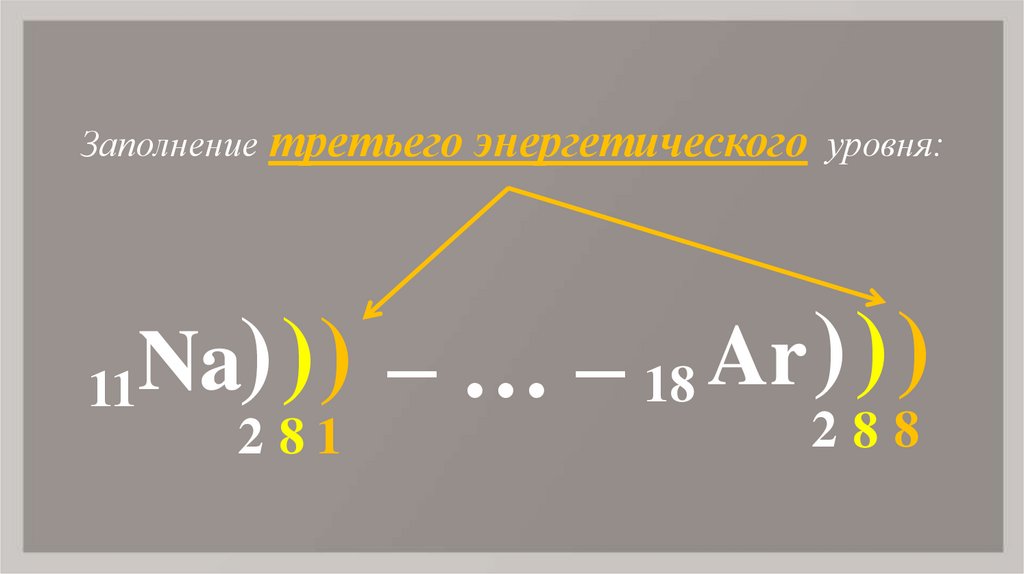
8. Na
Заполнение третьего энергетического уровня:)
)
)
Ar
)
)
)
Na
–
…
–
18
11
2 81
288
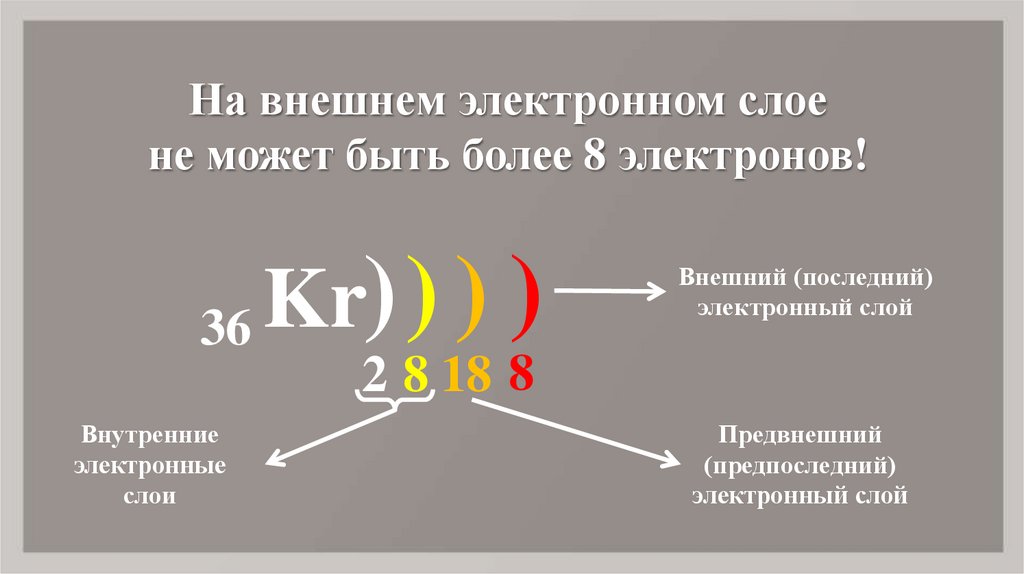
9. Kr
На внешнем электронном слоене может быть более 8 электронов!
36
Внутренние
электронные
слои
Kr) ) ) )
Внешний (последний)
электронный слой
2 8 18 8
Предвнешний
(предпоследний)
электронный слой
10.
Число энергетических уровней в атомехимического элемента равно номеру
периода, в котором этот элемент
находится в Периодической таблице
)
)
)
Cl
17
287
11.
Число валентных электронов для элементовA-групп совпадает с номером группы:
7
N))
25
15
P) ) )
285
В атомах элементов VA-группы азота и фосфора на
внешних электронных слоях находится по 5 электронов
12.
Физический смысл периодического закона:«Число электронов на внешнем уровне атомов
периодически повторяется, поэтому периодически
повторяются свойства химических элементов»






 Химия
Химия








