Похожие презентации:
Строение электронных оболочек атомов
1. Строение электронных оболочек атомов
2.
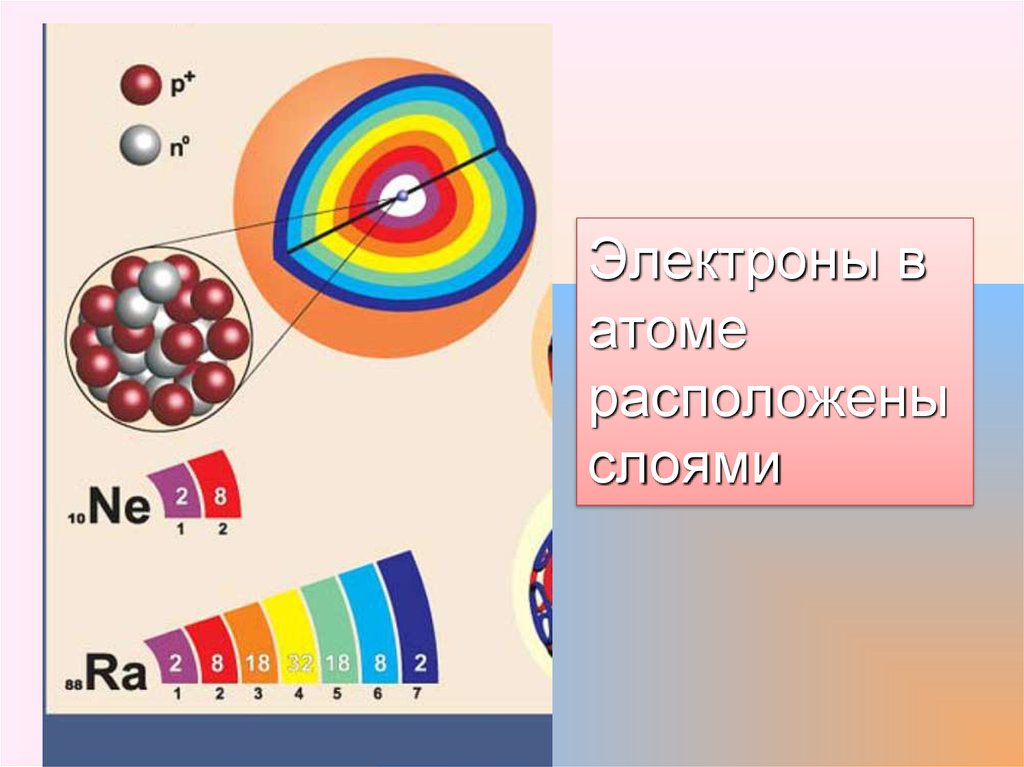
Электроны ватоме
расположены
слоями
3.
Электронная оболочка – это совокупность электронов,двигающихся вокруг ядра атома.
Электроны, которые близки по значениям энергии образуют
электронные слои или энергетические уровни. Число
энергетических уровней в атоме химического элемента
равно соответствующему ему номеру периода в таблице Д.
И. Менделеева: У атома Al, элемента lll периода – три
уровня, А у атома Pb, элемента Vl периода,– шесть уровней.
Количество электронных уровней = номеру периода n
Число электронов (N) на внутреннем
уровне рассчитывается по формуле.
N = 2n2
На внешнем уровне не может быть больше
электронов
8ми
4.
• Энергетические уровни, содержащиемаксимальное число электронов, называются
завершенными. Если энергетические уровни
содержат меньшее число электронов, то они
называются незавершенными.
• Электроны, расположенные на последней
электронной оболочке, называются
внешними.
• Число внешних электронов для химических
элементов главных подгрупп равно номеру
группы, в которой находится элемент
5.
6.
7.
8.
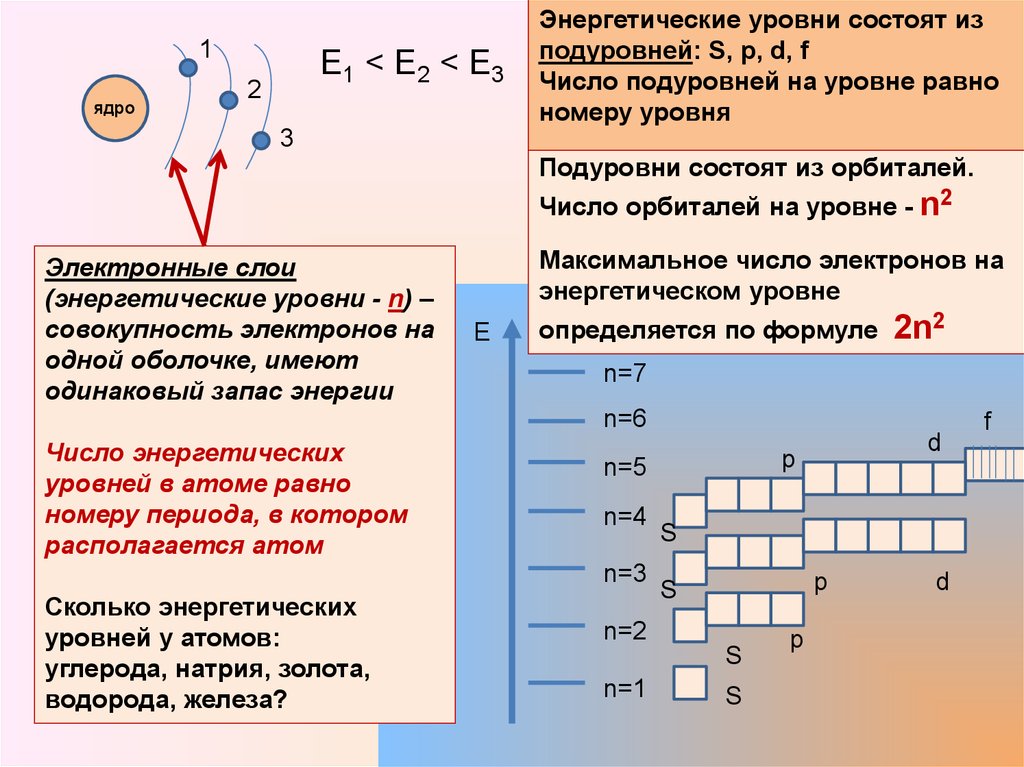
1ядро
Е1 < E2 < E3
2
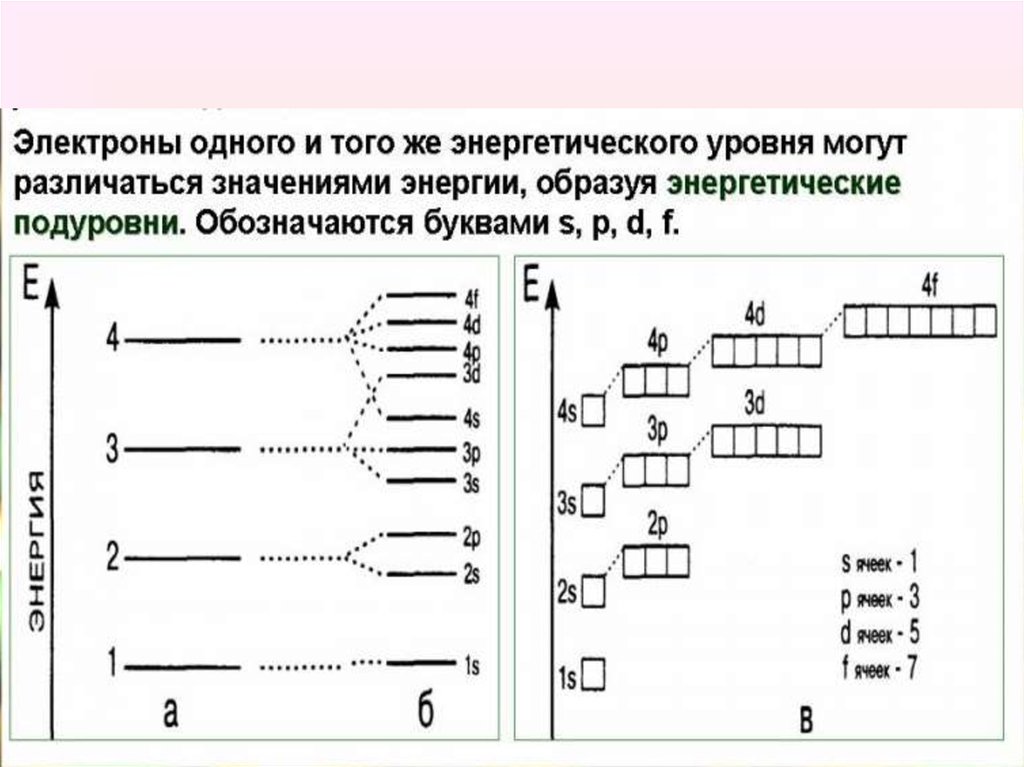
Энергетические уровни состоят из
подуровней: S, p, d, f
Число подуровней на уровне равно
номеру уровня
3
Подуровни состоят из орбиталей.
Число орбиталей на уровне - n2
Электронные слои
(энергетические уровни - n) –
совокупность электронов на
одной оболочке, имеют
одинаковый запас энергии
Максимальное число электронов на
энергетическом уровне
Е
определяется по формуле
2n2
n=7
n=6
Число энергетических
уровней в атоме равно
номеру периода, в котором
располагается атом
n=5
n=4
n=3
Сколько энергетических
уровней у атомов:
углерода, натрия, золота,
водорода, железа?
S
p
S
n=2
S
n=1
d
p
S
p
d
f









 Химия
Химия








