Похожие презентации:
Что такое кислоты
1. Презентация по теме «Кислоты».
Презентация по теме«Кислоты».
Выполнил работу
Студент 24 группы
Лескин
Даниил
2. Что такое кислоты
Кислоты – это вещества молекулярного строения. Атомы в молекулахкислот связаны ковалентными полярными связями. Чем больше
поляризована связь между атомом водорода, способным отщепляться, и
электроотрицательным атомом (кислорода, серы или атомом галогена), то
тем более эта связь склонна диссоциировать по гетеролитическому пути. А
значит, тем больше в растворе будет катионов водорода и тем кислее будет
среда. Большое значение имеет не только полярность, но и поляризуемость
связи. Поляризуемость – это способность связи поляризоваться под
действием определенных реагентов. Например, молекул воды.
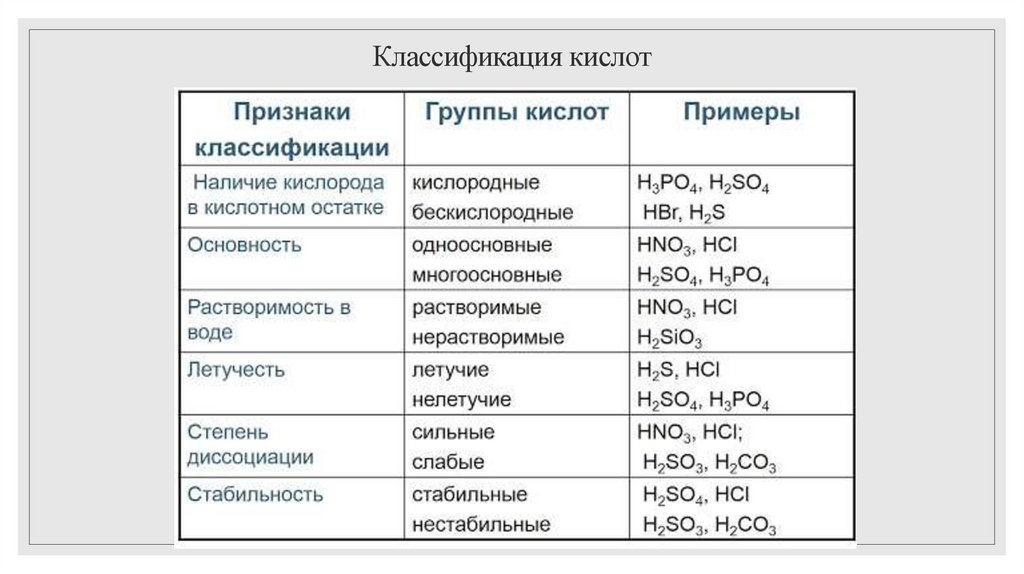
3. Классификация кислот
4. Химические свойства кислот
1.Реакция с металлами.Металлы, расположенные в ряду напряжений металлов до водорода,
вытесняют водород из кислот.
Mg + 2HCl = MgCl2 + H2↑
С концентрированной азотной и серной кислотой реакции идут за счет
анионного остатка. Водород не выделяется.
Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑ + H2O
Cu + 2H2SO4(конц) = Cu SO4 + SO2↑ + H2O
5.
2. Реакция с основными и амфотерными оксидами с образованием соли иводы.
K2O+ HNO3 = KNO3 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
3.Реакция с солями. Кислоты реагируют с растворами солей, если в результате
реакции один из продуктов выпадает в осадок, поскольку образование
нерастворимых соединений смещает равновесие вправо и делает её
практически необратимой.
Н2SO4 + BaCl2 = BaSO4↓ +2 HCl
H2CO3 + BaCl2 = BaCO3↓ +2 HCl
6.
4. Реагируют с основаниями и амфотерными гидроксидами.KOН+ HNO3 = KNO3 + H2O
Al(OН)3 + 3HCl = AlCl3 + 3H2O
NaOH + HNO3 = NaNO3 + H2O
5. Обнаружение кислот при помощи кислотно-основных индикаторов.
В кислой среде лакмус приобретает красную окраску. Метиловый оранжевый
– красную, а фенолфталеиновый – бесцветный.
7. Общие способы получения кислот
1. Бескислородные кислоты получают при растворении в воде газообразныхсоединений неметаллов с водородом.
Так, например, соляная кислота образуется в результате растворения газа
хлороводорода HCl в воде, а сероводородная кислота образуется при
растворении газа сероводорода H2S в воде. Сами же упомянутые газообразные
соединения можно получить в реакциях соединения водорода с
соответствующими неметаллами:
H2+Cl2−→2HCl(свет)
H2+S−→H2S(температура)
8.
◦ 2. Кислородсодержащие кислоты можно получить взаимодействиемсоответствующих кислотных оксидов с водой:
N2O5+H2O→2HNO3
SO3+H2O→H2SO4.
9.
3. Кислоты можно получить из соответствующих солей. Реакции обменапротекают в соответствии с вытеснительным рядом кислот.
Например, соляная кислота вытесняет уксусную из растворов её солей, а
фосфорная кислота может быть вытеснена серной:
CH3COONa+HCl→CH3COOH+NaCl
Ca3(PO4)2+3H2SO4→2H3PO4+3CaSO4.
10. Кислоты в организме человека
Витамины: аскорбиновая, фолиевая , оротовая ,пангамовая , никотиновая и другие.
Гиалуроновая кислота – основной компонент
смазки суставов.
Аминокислоты образуют белки.
Соляная кислота в желудке активирует фермент
пепсиноген , разлагающий белки пищи, а также
уничтожает гнилостную микрофлору. Кислоты в
организме человека.










 Химия
Химия








