Похожие презентации:
Электронная природа химических связей в органических соединениях. Строение атома углерода
1.
Электронная природахимических связей в
органических соединениях.
Строение атома углерода
2.
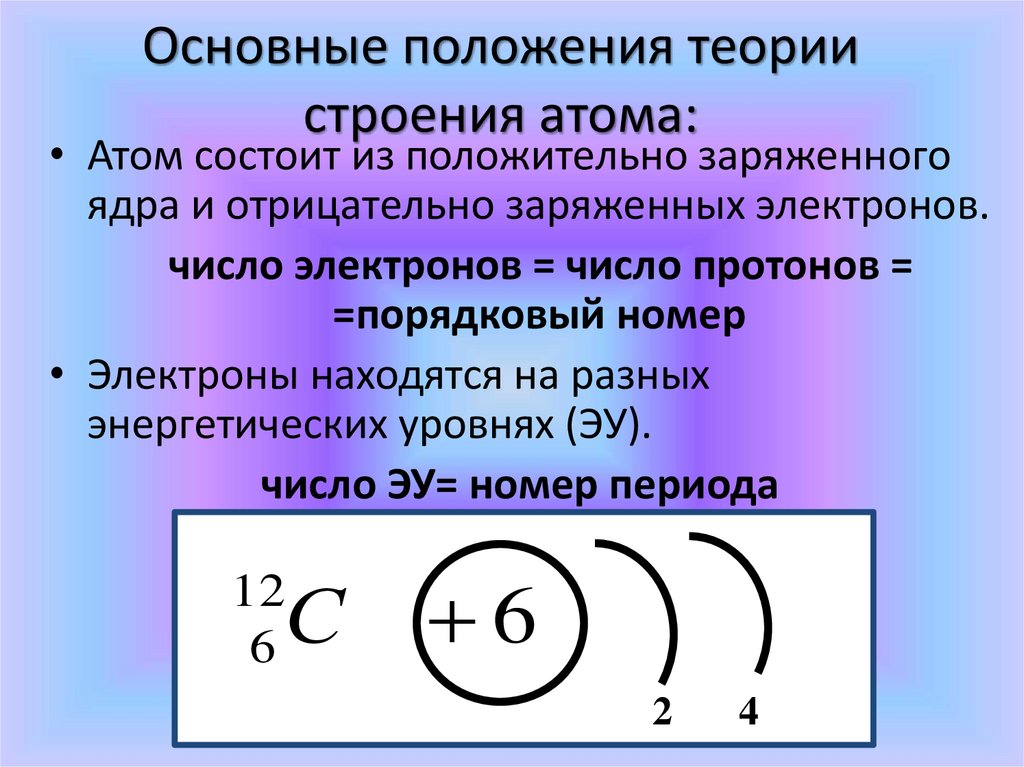
Основные положения теориистроения атома:
• Атом состоит из положительно заряженного
ядра и отрицательно заряженных электронов.
число электронов = число протонов =
=порядковый номер
• Электроны находятся на разных
энергетических уровнях (ЭУ).
число ЭУ= номер периода
С
12
6
6
2
4
3.
Основные положения теориистроения атома:
• Нельзя проследить траекторию движения
электрона. Область, в которой нахождение
электрона наиболее вероятно, называют
орбиталью.
• Орбитали различаются по форме, размерам
и энергии.
На одной орбитали – не более 2-х
электронов!
4.
Виды орбиталей (по форме):• s-орбиталь
• р-орбиталь
• d-орбиталь
• f-орбиталь
5.
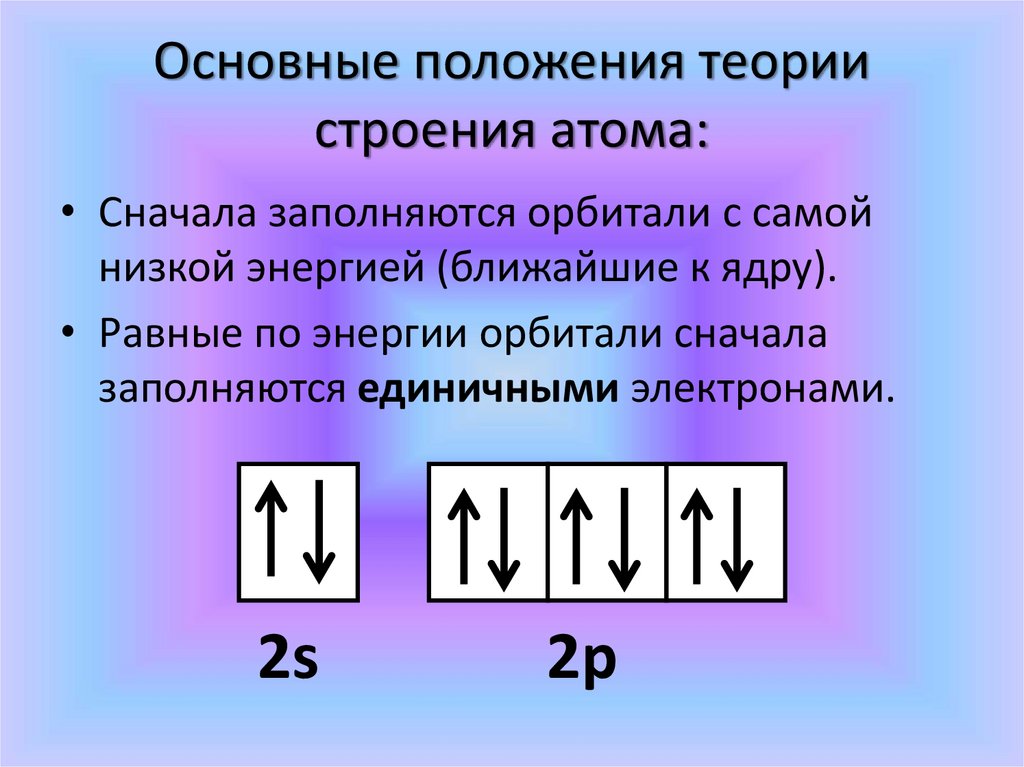
Основные положения теориистроения атома:
• Сначала заполняются орбитали с самой
низкой энергией (ближайшие к ядру).
• Равные по энергии орбитали сначала
заполняются единичными электронами.
2s
2р
6.
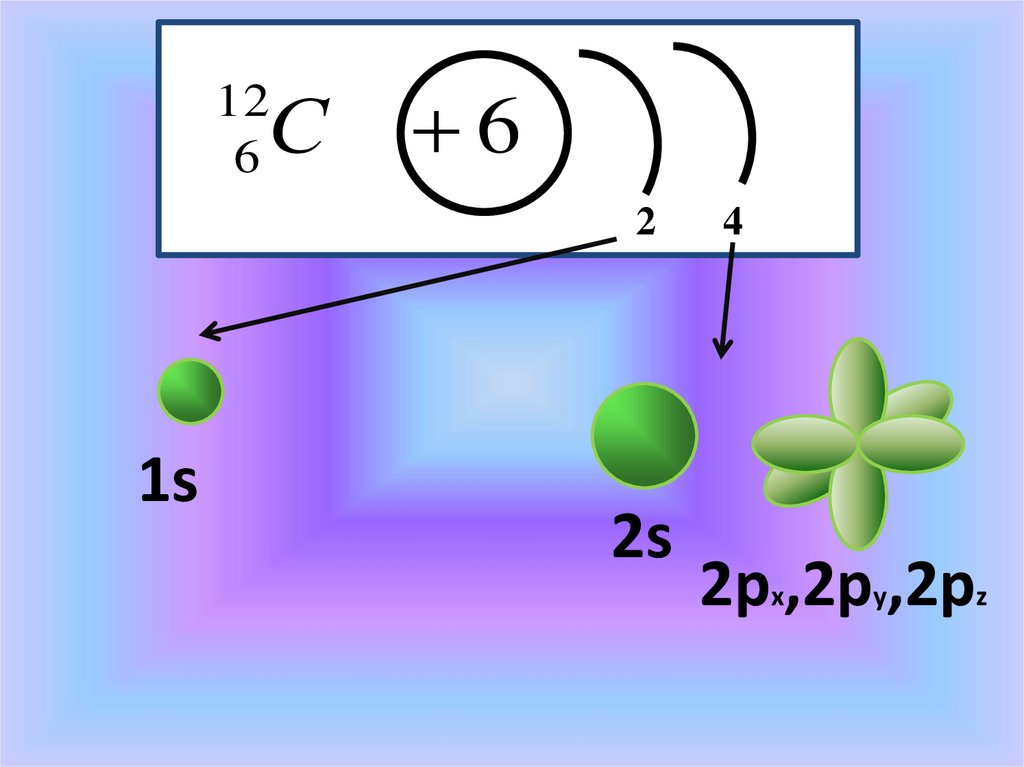
С12
6
6
2
1s
2s
4
2px,2py,2pz
7.
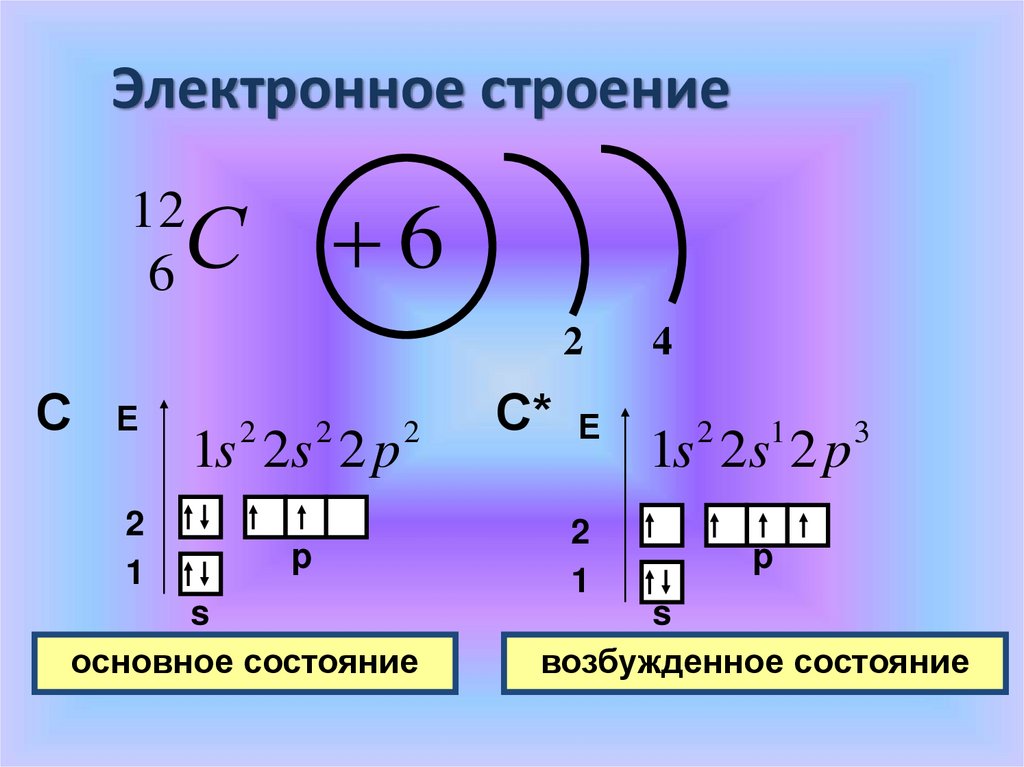
Электронное строениеС 6
12
6
2
С
Е
2
1
2
2
1s 2s 2 p
2
p
s
основное состояние
С* Е
2
1
4
2
1
1s 2s 2 p
3
p
s
возбужденное состояние
8.
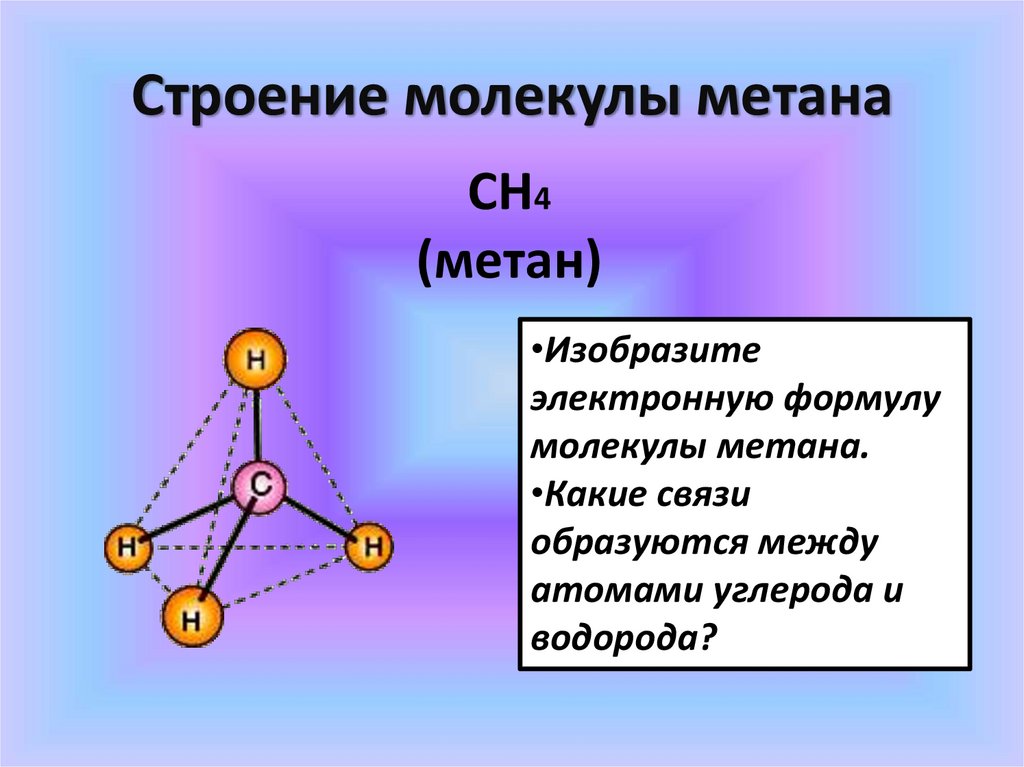
Строение молекулы метанаСН4
(метан)
•Изобразите
электронную формулу
молекулы метана.
•Какие связи
образуются между
атомами углерода и
водорода?
9.
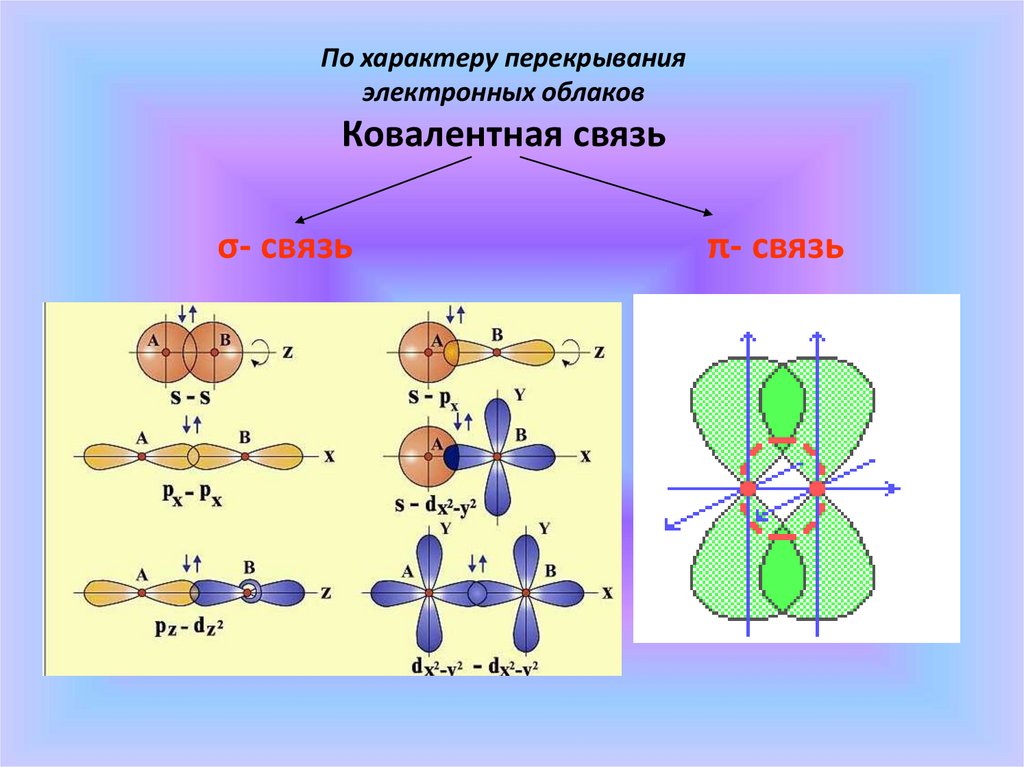
По характеру перекрыванияэлектронных облаков
Ковалентная связь
σ- связь
π- связь
10.
Химические связи, образующиеся врезультате перекрывания орбиталей вдоль
линии, соединяющей центры ядер двух
атомов, называют σ-связями.
Химические связи, образующиеся в
результате перекрывания орбиталей в двух
областях, называют π-связями.
11.
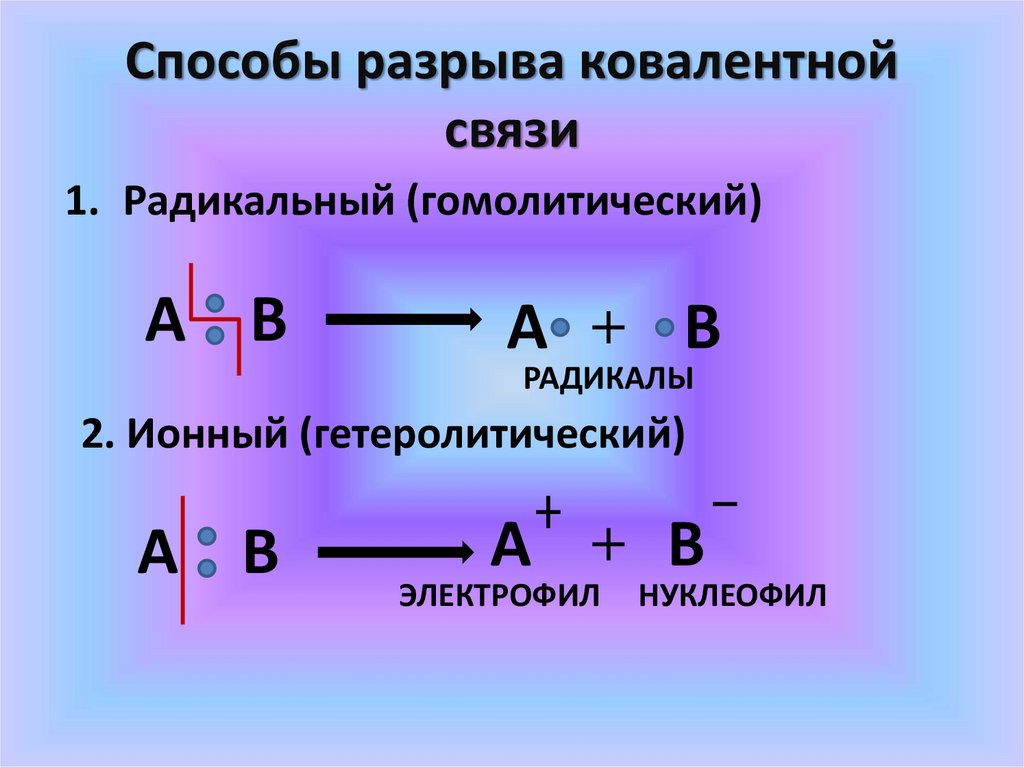
Способы разрыва ковалентнойсвязи
1. Радикальный (гомолитический)
A В
A
В
РАДИКАЛЫ
2. Ионный (гетеролитический)
A В
A
ЭЛЕКТРОФИЛ
В
НУКЛЕОФИЛ




 Химия
Химия








