Похожие презентации:
Хинолин. Строение хинолина
1.
Химиягетероциклических
соединений
Лекция 6
Хинолин
1
2.
Строение хинолина5
4
4a
6
7
8
8a
3
N
2
хинолин
1
+
N
N
N
-
+
N
-
+
N
-
N
N
N
N
снижение ароматических свойств
2
3.
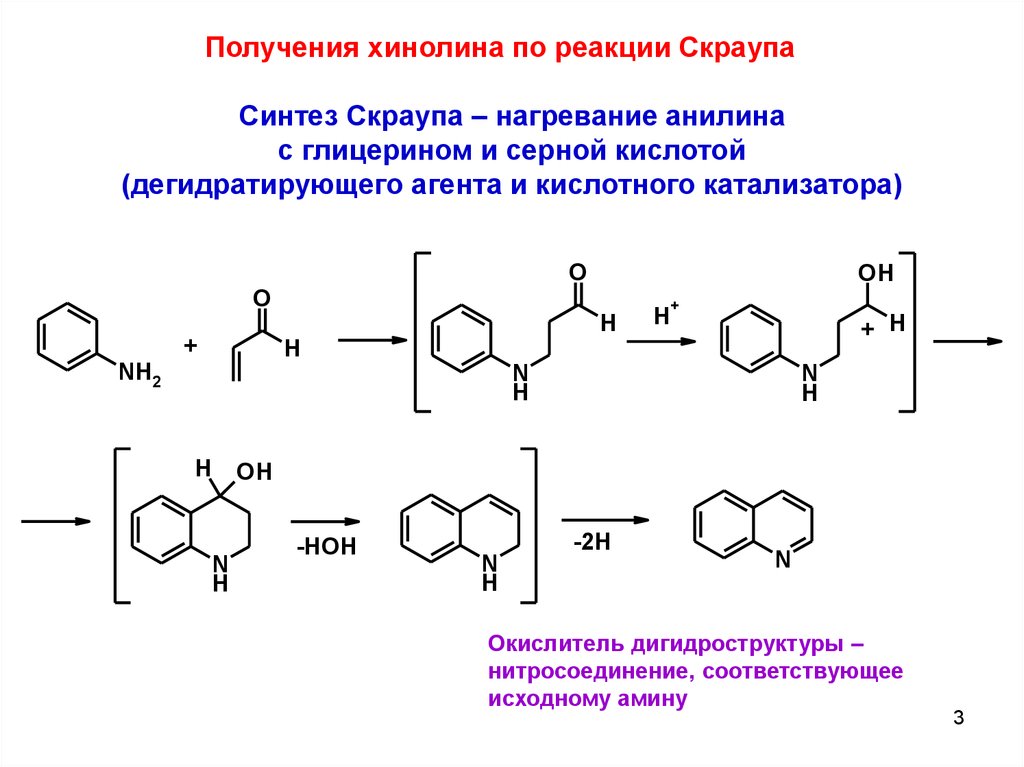
Получения хинолина по реакции СкраупаСинтез Скраупа – нагревание анилина
с глицерином и серной кислотой
(дегидратирующего агента и кислотного катализатора)
O
OH
O
+
H
+
H
+ H
H
NH2
N
H
H
N
H
N
H
OH
-HOH
N
H
-2H
N
Окислитель дигидроструктуры –
нитросоединение, соответствующее
исходному амину
3
4.
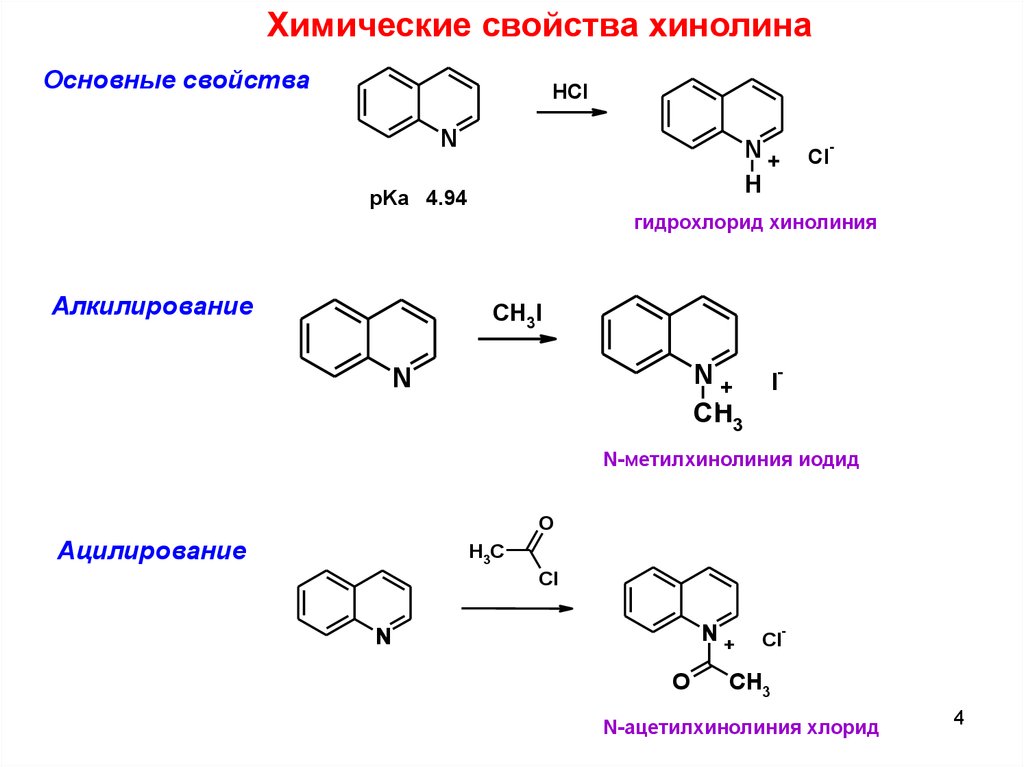
Химические свойства хинолинаОсновные свойства
HCl
N
N+
H
pKa 4.94
-
Cl
гидрохлорид хинолиния
Алкилирование
CH3I
N+
CH3
N
-
I
N-метилхинолиния иодид
O
Ацилирование
H3C
Cl
N+
N
O
-
Cl
CH3
N-ацетилхинолиния хлорид
4
5.
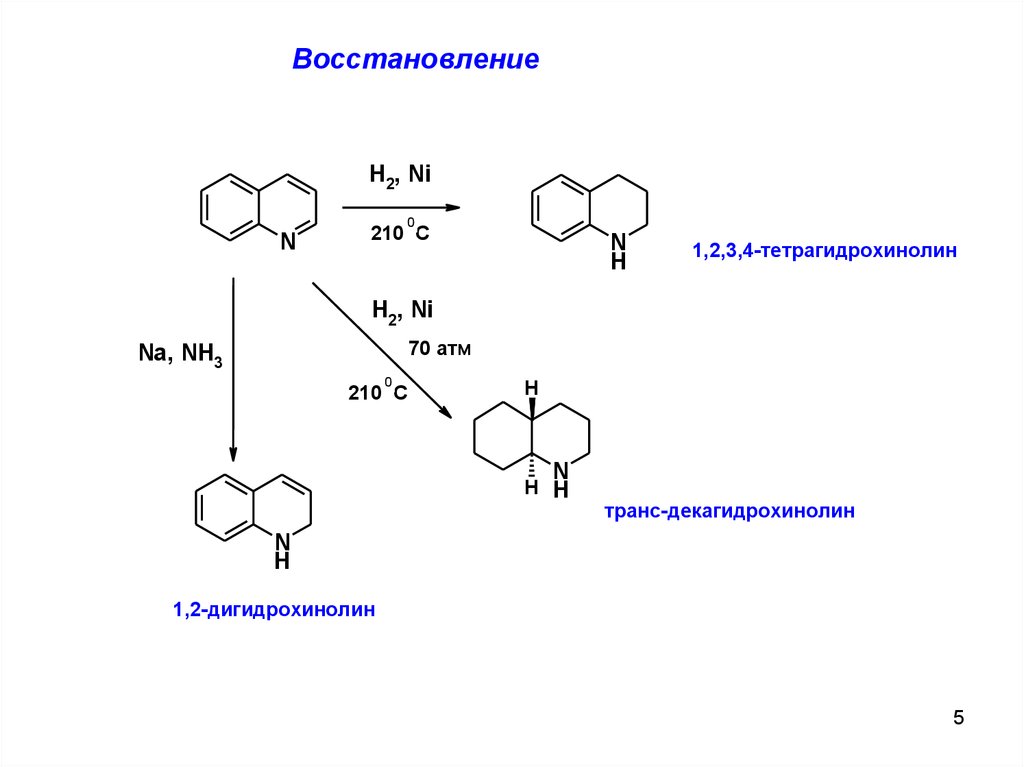
ВосстановлениеH2, Ni
N
0
210 C
N
H
1,2,3,4-тетрагидрохинолин
H2, Ni
70 атм
Na, NH3
0
210 C
H
N
H H
транс-декагидрохинолин
N
H
1,2-дигидрохинолин
5
6.
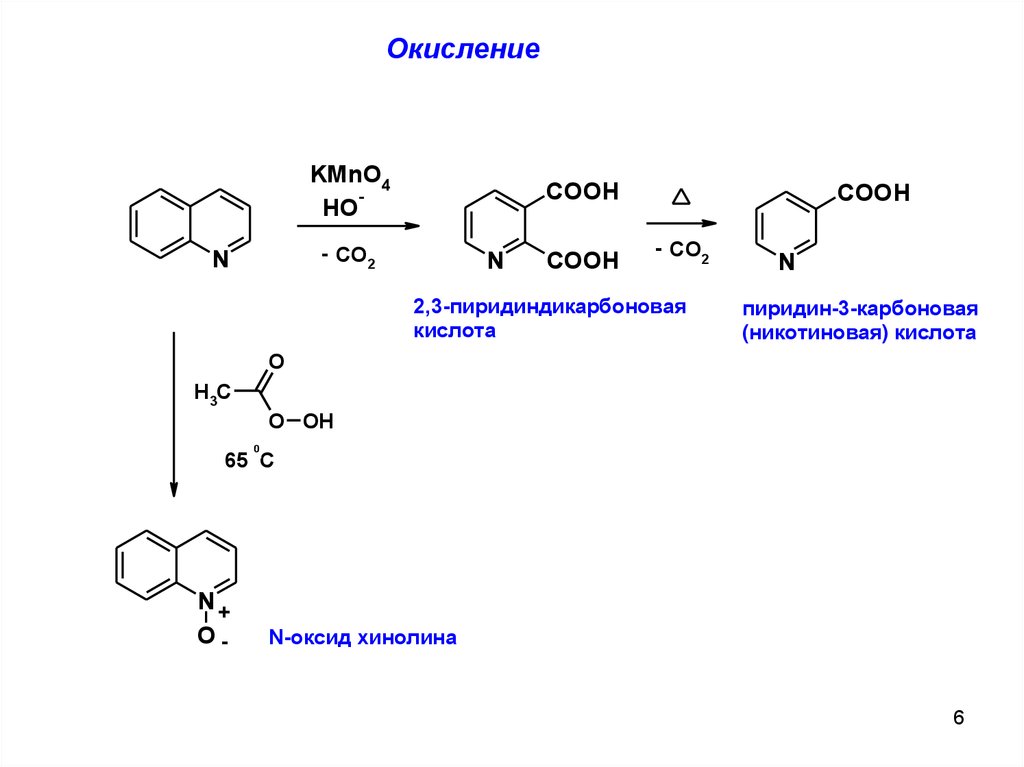
ОкислениеKMnO4
HO
COOH
- CO2
N
N
COOH
COOH
- CO2
2,3-пиридиндикарбоновая
кислота
N
пиридин-3-карбоновая
(никотиновая) кислота
O
H3C
O OH
0
65 C
N+
O-
N-оксид хинолина
6
7.
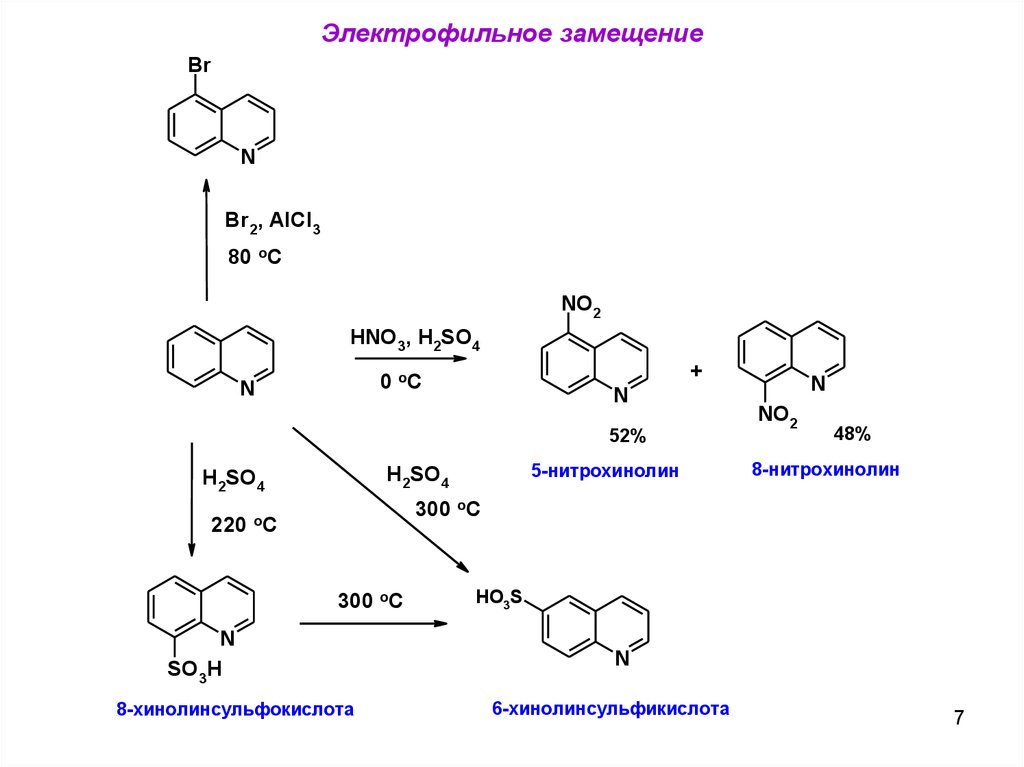
Электрофильное замещениеBr
N
Br2, AlCl3
80 oC
NO2
HNO3, H2SO4
+
0 oC
N
N
52%
220
5-нитрохинолин
H2SO4
H2SO4
N
NO2
48%
8-нитрохинолин
300 oC
oC
300 oC
N
SO3H
8-хинолинсульфокислота
HO3S
N
6-хинолинсульфикислота
7
8.
Нуклеофильное замещение водородаВ реакции нуклеофильного замещения хинолин вступает значительно легче, чем пиридин.
При этом реакции протекают по положению 2.
NaNH2
N
NH2
KOH
NH3 ж.
N
0
300 C
N
OH
2-гидроксихинолин
2-аминохинолин
Для 2-амино- и 4-аминохинолинов характерны
таутомерные превращения
N
N
NH2
OH
N
H
N
H
NH
O
хинолин-2-он
8
9.
8-Гидроксихинолинтрис(8-оксихинолин)алюминий –
основа флуоресцентных материалов
9
10.
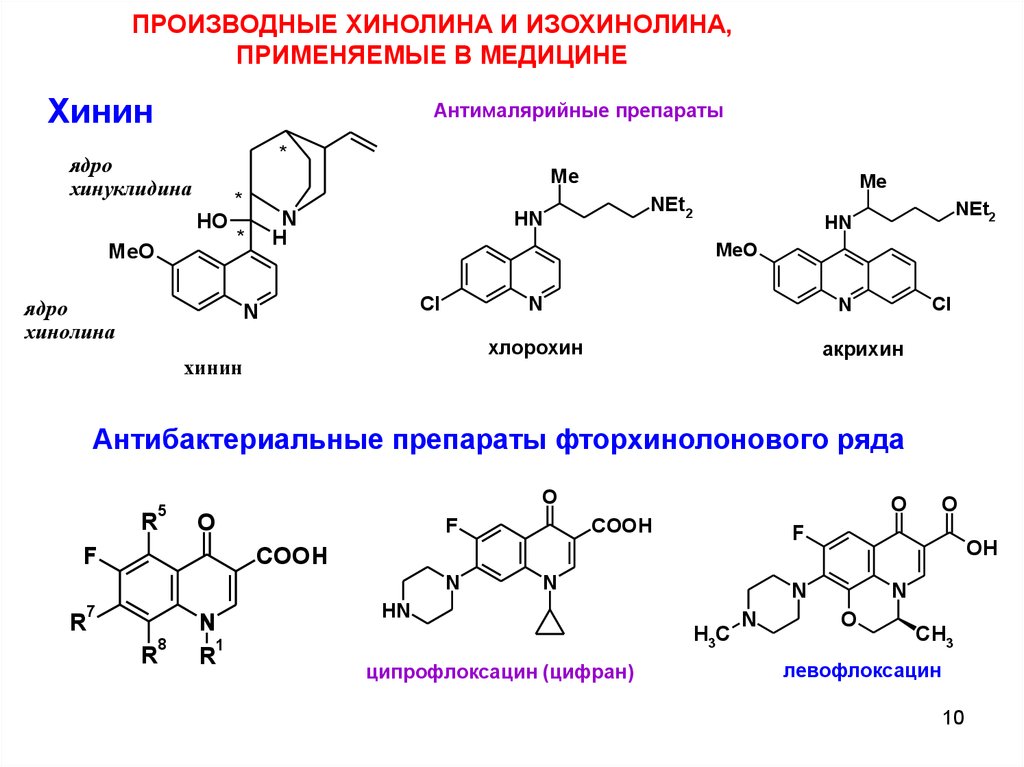
ПРОИЗВОДНЫЕ ХИНОЛИНА И ИЗОХИНОЛИНА,ПРИМЕНЯЕМЫЕ В МЕДИЦИНЕ
Хинин
Антималярийные препараты
*
ядро
хинуклидина
Me
Me
*
HO
MeO
N
H
*
ядро
хинолина
NEt2
HN
NEt2
HN
MeO
N
Cl
N
хлорохин
хинин
Cl
N
акрихин
Антибактериальные препараты фторхинолонового ряда
5
R
O
O
F
F
O
COOH
O
F
OH
COOH
N
7
R
8
R
N
1
R
N
N
HN
H3C
ципрофлоксацин (цифран)
N
N
O
CH3
левофлоксацин
10
11.
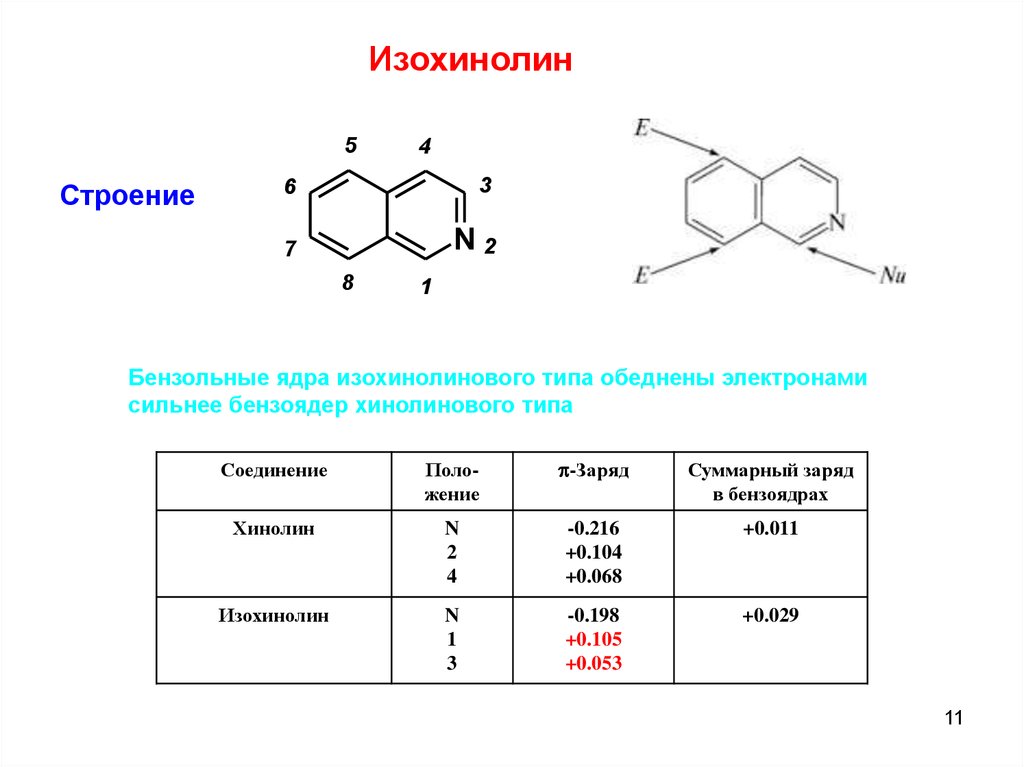
Изохинолин5
Строение
4
6
3
7
N2
8
1
Бензольные ядра изохинолинового типа обеднены электронами
сильнее бензоядер хинолинового типа
Соединение
Положение
p-Заряд
Суммарный заряд
в бензоядрах
Хинолин
N
2
4
-0.216
+0.104
+0.068
+0.011
Изохинолин
N
1
3
-0.198
+0.105
+0.053
+0.029
11
12.
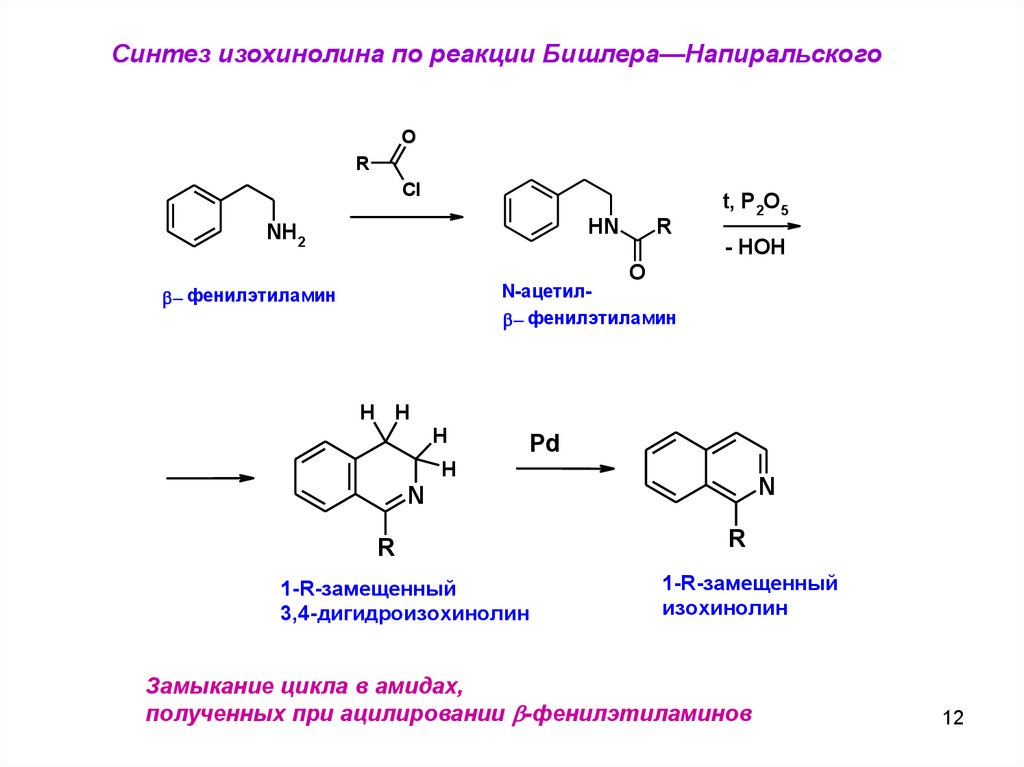
Синтез изохинолина по реакции Бишлера—НапиральскогоO
R
Cl
R
HN
NH2
t, P2O5
- HOH
O
N-ацетилb фенилэтиламин
b фенилэтиламин
H H
H
Pd
H
N
N
R
1-R-замещенный
3,4-дигидроизохинолин
R
1-R-замещенный
изохинолин
Замыкание цикла в амидах,
полученных при ацилировании b-фенилэтиламинов
12
13.
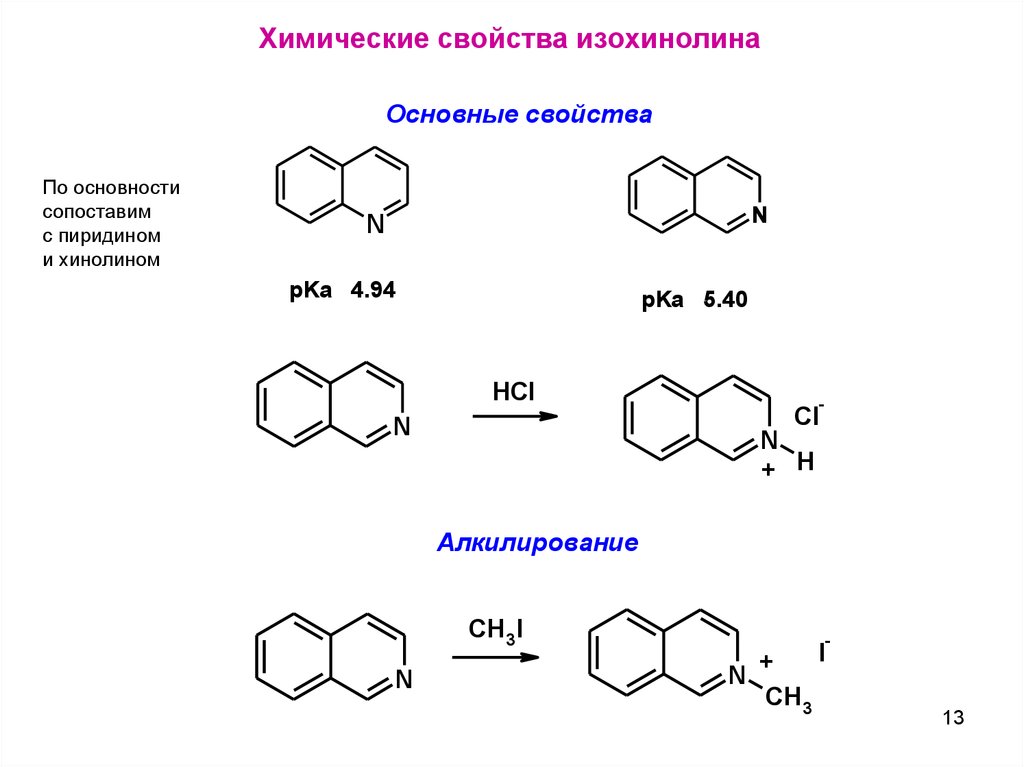
Химические свойства изохинолинаОсновные свойства
По основности
сопоставим
с пиридином
и хинолином
N
N
pKa 4.94
pKa 5.40
HCl
-
Cl
N
N
+ H
Алкилирование
CH3I
N
-
N
+
CH3
I
13
14.
Взаимодействие с нуклеофилами – атака по положению 1NaNH2
KOH, t
N
N
N
NH2
OH
Гидрирование (восстанавливается труднее, чем хинолин)
H2, Pt
H2, Pt
NH
N
Окисление
NH
окислению подвергаются оба ядра,
в результате образуется смесь фталевой
и 3,4-пиридиндикарбоновой кислот
COOH
COOH
KMnO4
N
COOH
COOH
+
N
14
15.
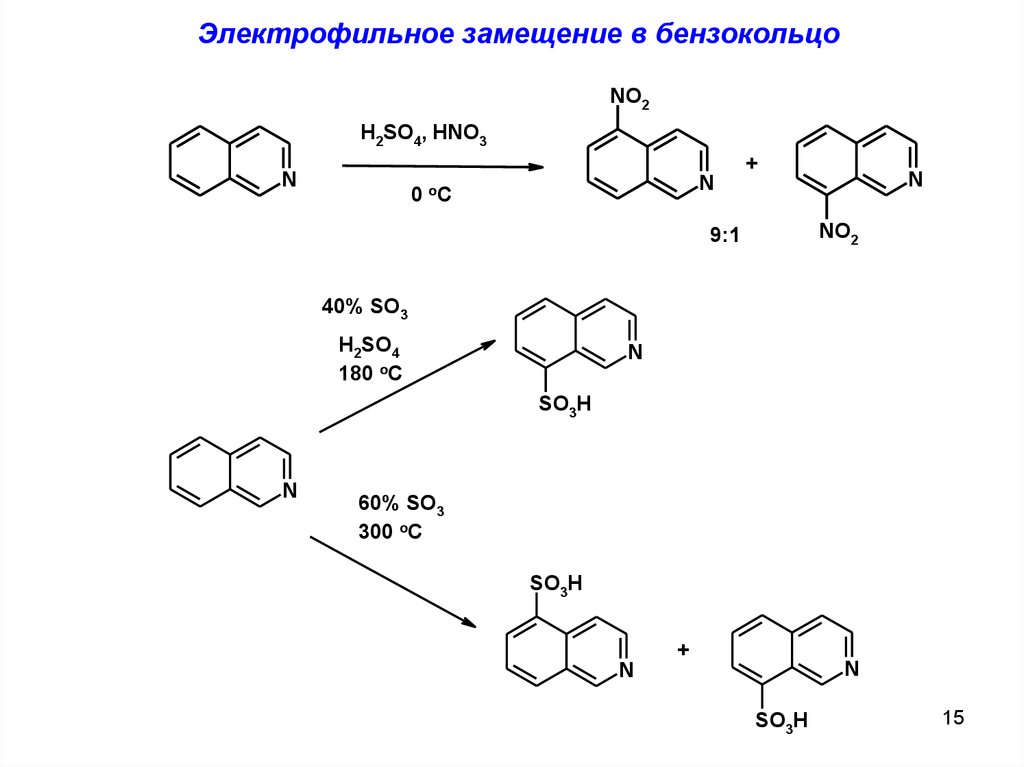
Электрофильное замещение в бензокольцоNO2
H2SO4, HNO3
N
N
0 oC
+
N
NO2
9:1
40% SO3
H2SO4
180 oC
N
SO3H
N
60% SO3
300 oC
SO3H
+
N
N
SO3H
15
16.
Свойства 1-метилизохинолинаR-CH=O,
ZnCl2
N
CH3
N
CH=CH-R
Таутомерия 1-амино- и 1-гидроксиизохинолинов
N
NH2
NH
NH
N
OH
NH
O
16
17.
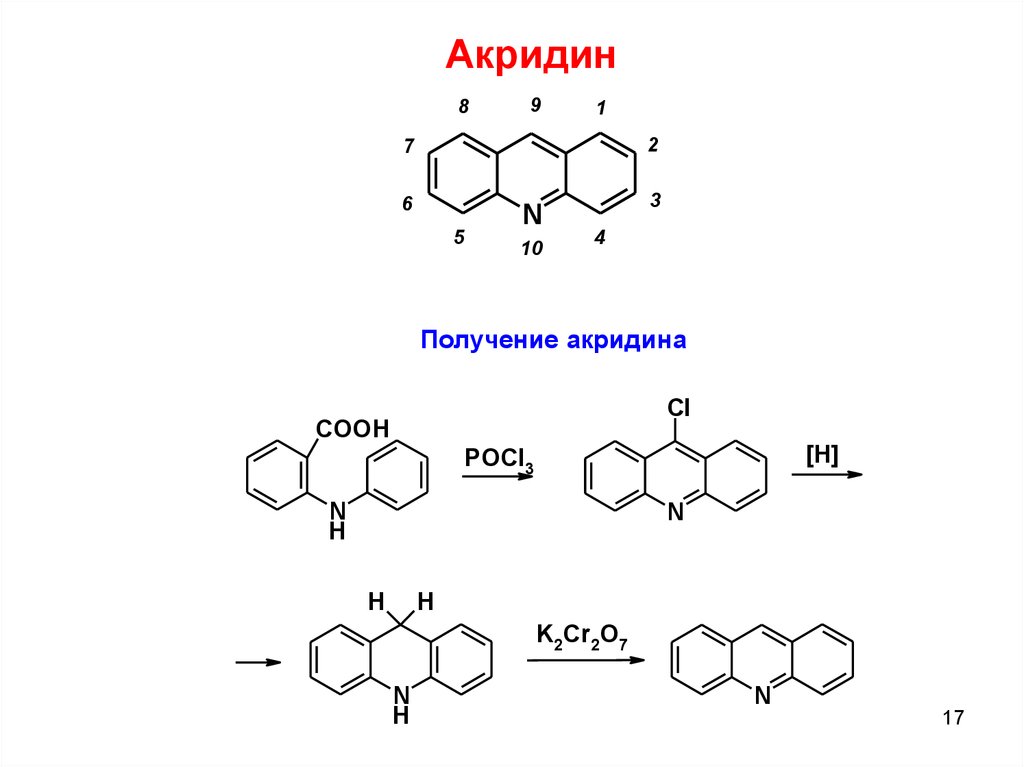
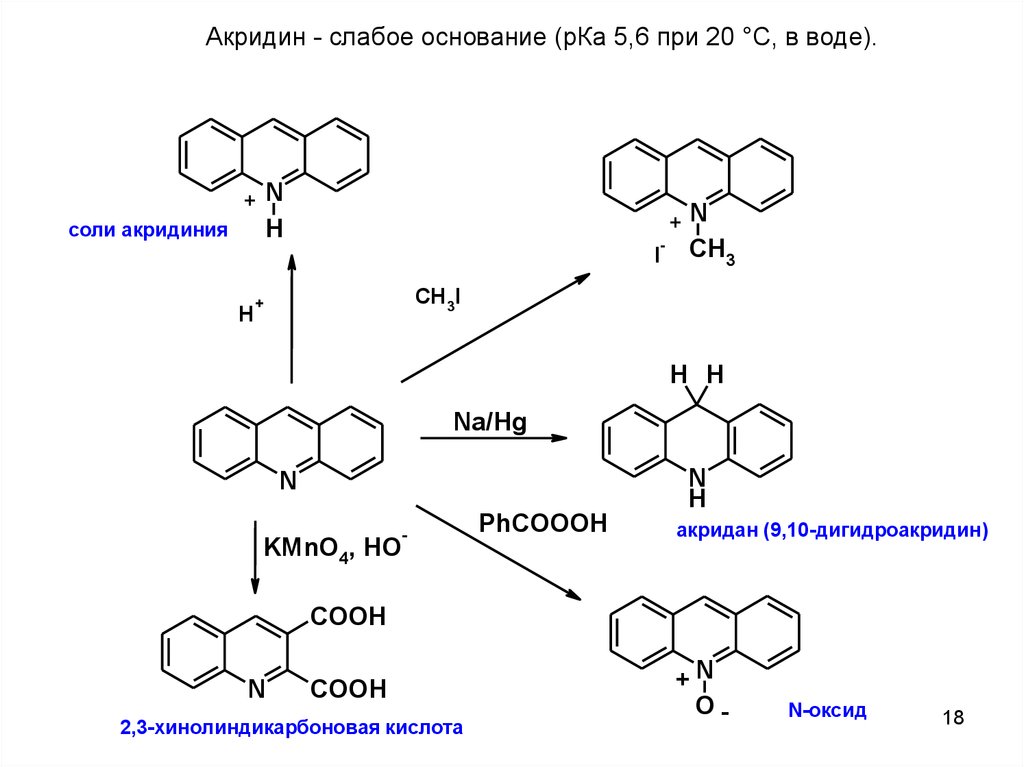
Акридин8
9
1
2
7
6
5
N
10
3
4
Получение акридина
Cl
COOH
[H]
POCl3
N
H
N
H
H
K2Cr2O7
N
H
N
17
18.
Акридин - слабое основание (рКа 5,6 при 20 °С, в воде).+N
+N
H
соли акридиния
-
I
H
CH3
CH3I
+
H H
Na/Hg
N
H
N
KMnO4, HO
-
PhCOOOH
акридан (9,10-дигидроакридин)
COOH
N
COOH
2,3-хинолиндикарбоновая кислота
+N
O-
N-оксид
18
19.
Реакции электрофильного замещенияNO2
HNO3, H2SO4
+ изомеры
N
N
При нитровании акридина образуется смесь изомерных нитроакридинов
с преимущественным содержанием 2-нитроакридина
Br2, CH3COOH
Br
Br
Br
+
N
N
N
Реакции нуклеофильного замещения в положение 9
NH2
NaNH2
N
N
19
20.
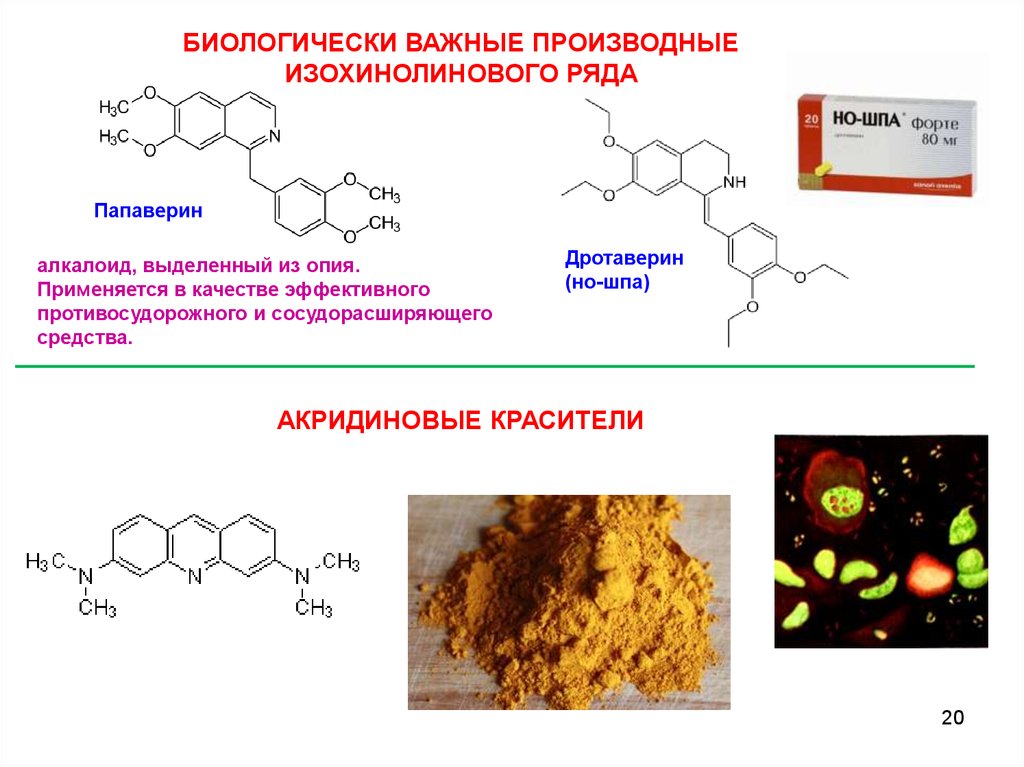
БИОЛОГИЧЕСКИ ВАЖНЫЕ ПРОИЗВОДНЫЕИЗОХИНОЛИНОВОГО РЯДА
Папаверин
алкалоид, выделенный из опия.
Применяется в качестве эффективного
противосудорожного и сосудорасширяющего
средства.
Дротаверин
(но-шпа)
АКРИДИНОВЫЕ КРАСИТЕЛИ
20
21.
Курс лекций является частью учебно-методического комплекса«Химия гетероциклических соединений»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической химии УГТУ-УПИ
Учебно-методический комплекс подготовлен на кафедре органической и
биомолекулярной химии химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
21 18








 Химия
Химия