Похожие презентации:
План характеристики элемента. Химия
1.
С1 Охарактеризовать элемент … по плану1
2
3
3 2
10 2
2
1)…4s
2…5s 5p
3)…3d 4s
4)…3d 4s
5) 4s 4p
К
Sb
V
Zn
As
Определите элементы по их электронной
формуле
Это нужно для написания характеристики
элемента, т к будет указан «хвостик» : …
3
2.
ПЛАН ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА1. Положение элемента в периодической
системе
№ периода, группы, подгруппа, порядковый №,
Ar
2. Строение атома: а) заряд ядра и его состав
б) кол-во электронов.
3. Электронное строение атома.
а) число энергетических уровней;
б) распределение ē по уровням;
в)электронная формула и ее графическое
изображение
3.
4. Характеристика наружного энергетическогоуровня
а) завершенный или незавершенный;
б) кол-во валентных ē на уровне;
в) какие это ē (s или р, спаренные или нет)
5. металл или неметалл (или амфотерен).
s, p или d-элемент
6.Высшая и низшая степени окисления
элемента
*валентные возможности атома
4.
7. Высший оксид и его характер.8. Высший гидроксид и его характер.
9. Летучее водородное соединение
(для элементов IV-VII групп)
10. Сравнить свойства элемента с
соседними (по периоду и по главной
подгруппе)
Характеристика
элемента … 4s24p3
5.
Характеристика мышьяка по положениюв Периодической системе
мышьяк расположен в 4(большом) периоде, V группе,
главной подгруппе, №33, Аr (As)= 75.
Строение атома мышьяка: заряд ядра +33,
75As (33 p+; 42 n0) 33ē
33
Электронное строение атома:
В атоме мышьяка 4 энергетических уровня, электроны
расположены следующим образом: +33 As : 2ē 8ē 18ē 5ē
Электронная формула: 1S22S2 2P63S23P63d10 4S2 4P3
Графическая формула: … валент: III, V
Мышьяк – неметалл, р-элемент
6.
низшая : -3 Высшая с.о. : +5As2+5О5-2 –высший оксид мышьяка,
кислотный
H3AsO4 – гидроксид мышьяка, кислота
(мышьяковая к-та)
As-3 Н3+1 - летучее водородное соединение
(арсин)
7.
Мышьяк как неметалл активней, чемгерманий, но менее активен, чем селен.
Мышьяк как неметалл активней, чем сурьма,
но менее активен, чем фосфор.
8.
C2 . Д/зBaO2 , ВаCrO4, NaH, HNO2, K2MnO4,
HClO, Nа2О2 , Ca(HSO3)2
9.
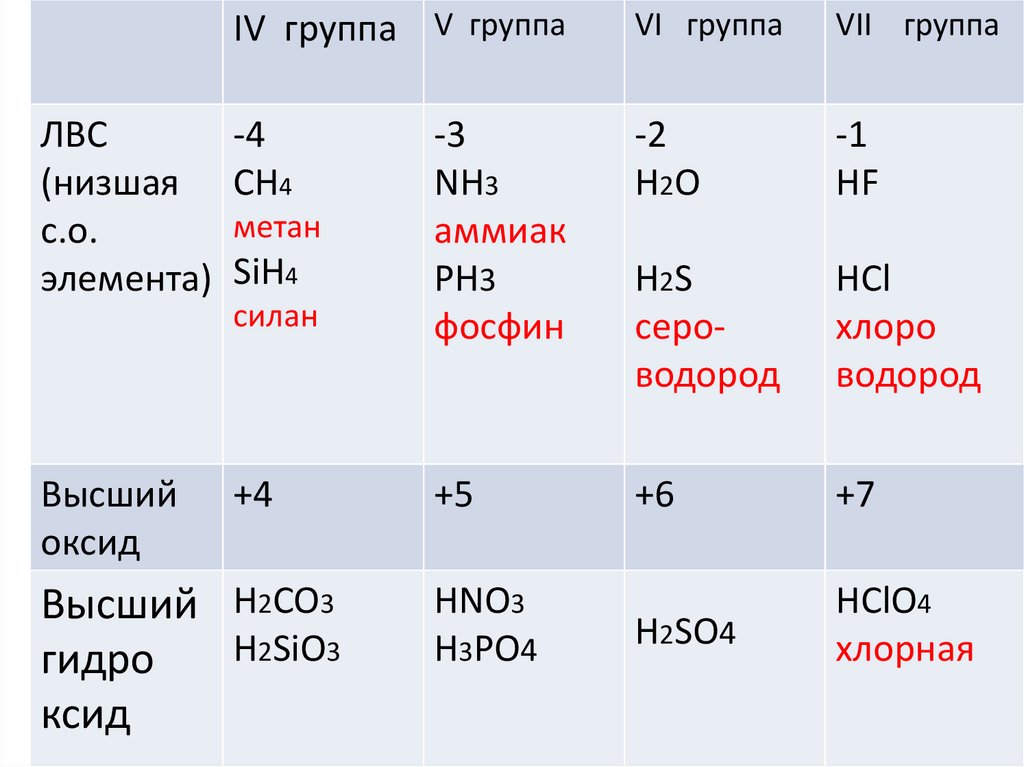
IV группа V группаVI группа
VII группа
-2
Н2О
-1
НF
силан
-3
NН3
аммиак
PH3
фосфин
H2S
сероводород
НCl
хлоро
водород
+4
+5
+6
+7
Н2SO4
НClO4
хлорная
ЛВС
-4
(низшая СН4
метан
с.о.
элемента) SiH4
Высший
оксид
Высший Н2CO3
Н2SiO3
гидро
ксид
НNO3
Н3PO4
10.
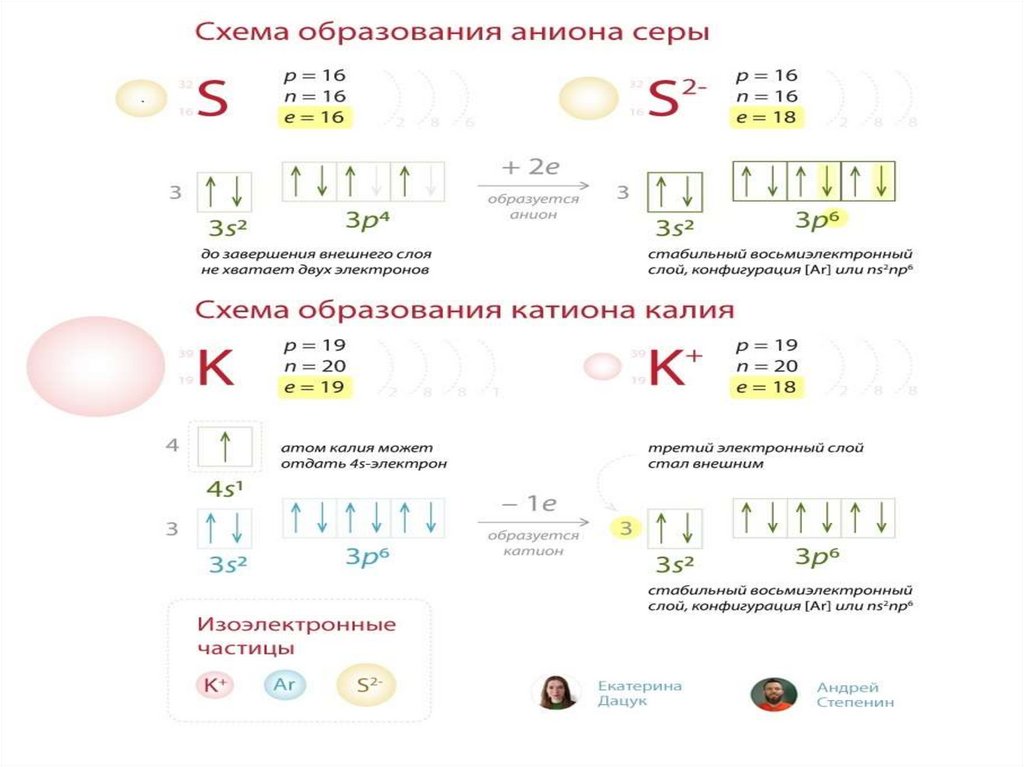
В1 Установите соответствие(цифры в ответах могут повторяться)
Частица
Электронная схема
0
А) Сl
1) 2ē 8ē 2ē
-1
2) 2ē 8ē 6ē
Б) Сl
+7
В) Сl
+5
Г) Сl
3) 2ē 8ē
4) 2ē 8ē 8ē
5) 2ē 8ē 7ē
11.
Какие частицы имеют электроннуюконфигурацию
2
2
6 2
6
1S 2S 2P 3S 3P ?
-4
-3 -2 -1
0
+1
+2
+3
+4
Si P S Cl Ar K Ca Sc Ti …
анионы атом
катионы
12.
В2 Выберите 3 верных утверждения:В ряду химических элементов As- P - N
1) увеличивается заряд ядер атомов
2) уменьшается атомный радиус
3) увеличивается электроотрицательность
4) увеличивается число энергетических
уровней
5) свойства высших оксидов меняются от
амфотерных к кислотным
6) усиливаются кислотные свойства
образуемых гидроксидов
236
13.
В3 Охарактеризуйте свойства веществс ионной (1 вар)
и
молекулярной (2 вар)
кристаллической решёткой:
1)твёрдые 2) летучие 3) растворимые в воде
4)газообразные 5)тугоплавкие 6) легкоплавкие
7) их растворы и расплавы-электропроводны
8)жидкие 1вар: 1357 2 вар: 2468
Общее свойство для веществ с атомной и
ионной кристаллической решеткой
1) хорошо растворимы в воде
2) тугоплавки
3)в твердом состоянии проводят электрический
ток
4) высокая плотность













 Химия
Химия








