Похожие презентации:
Комплексные соединения. Лекция 12
1.
12 лекцияКомплексные соединения
2.
Комплексныесоединения
–
сложные соединения, в узлах
кристаллов которых находятся
наряду с простыми ионами и
сложные
ионы,
способные
существовать
также
в
растворах.
3.
Комплексным соединением называют сложноесоединение, образующееся при взаимодействии
более простых неизменных частиц (атомов, ионов
или молекул), каждая из которых способна
существовать независимо в обычных условиях.
[Cu(NH3)4]SO4
NH3
CuSO4
Na[Al(OH)4]
NaOH
Al(OH)3
Комплексными соединениями, или просто комплексами,
мы будем называть и комплексные ионы, и комплексные
молекулы.
4.
Наиболее удачно строение исвойства
таких
соединений
объясняет
координационная
теория.
Предложена в 1893 г. швейцарским
химиком, лауреатом Нобелевской
премии, профессором Цюрихского
университета Альфредом
Вернером и дополненная русскими (1866 – 1919)
учёными Л.А Чугаевым,
И.Л.Черняевым и А.А.Гринбергом.
5.
Основные положения координационной теории1 Комплексообразователь
(центральный катион) катион металла, который
обладает вакантными
орбиталями.
Катионы:
металлов (d-элементов):
Сu+2, Co+3, Fe+3, Hg+2 и др.
(реже р-элементы): Al+3
(иногда неметаллы):В+3, Si+4.
+ +3
K[Fe(CN)
Fe
6]
6.
Вокругкомплексообразователя
расположены
2.
лиганды – частицы, обладающие
неподеленными электронными парами.
Молекулы:
.. ..
H2O,
.. NH3,
Анионы:
CN-, OH-,
Cl-, Br-, NO2-
7.
3. Координационноечисло – количество
лигандов, которые может присоединять
комплексообразователь.
Координационное
число – в 2 раза
больше чем С.О.
центрального
иона.
+1 (2)
+2 (4, 6)
+2
+3 (6, 4)
+2
[Cu(NH
)
]
+4 (8, 6)
3 4
8.
4. Комплексообразователь и лигандысоставляют внутреннюю сферу
комплекса.
[Cu(NH3)4]+2
Как
определить
суммарный
заряд
внутренней
сферы?
9.
Образование комплексногосоединения
1. Реакция присоединения:
Fe(CN)2 + 4KCN = K4[Fe(CN)6]
2. Реакция внедрения
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
10.
K4[Fe(CN)6]Fe2+ - комплексообразователь
CN- - лиганд
6 – координационное число
[Fe(CN)6]4- - внутренняя сфера
К+ - внешняя сфера
11.
[Pt(NH3)2Cl4]Pt4+ - комплексообразователь
NH3 и Cl- - лиганды
6=2+4 – координационное число
Внешней сферы нет
12.
[Cu(NH3)4]SO4Cu2+ - комплексообразователь
NH3 - лиганд
4 – координационное число
[Cu(NH3)4]2+ - внутренняя сфера
SO42- - внешняя сфера
13.
МЕХАНИЗМ ОБРАЗОВНИЯ К.С.Теория: гибридизация центрального атома и донорноакцепторный механизм.
Центральный ион – акцептор электронов
(электронный дефицит).
Лиганды – доноры электронной пары за счет
неподеленной электронной пары (атома N, O, S,
галогенов).
Сu2+ 3d94s04p0 sp3-гибридизация
14.
15.
16.
Классификация комплексныхсоединений
Комплексные соединения
классифицируют
по заряду комплекса
по виду лигандов
по составу внешней сферы
17.
КлассификацияПо заряду комплекса
Катионные
Нейтральные
[Cr(H2O)4]3+Cl3
[PtCl4(NH3)2]
Катионно анионные
[Cu(NH3)4]2+[PtCl4]2-
Анионные
K2[PtCl6]2-
18.
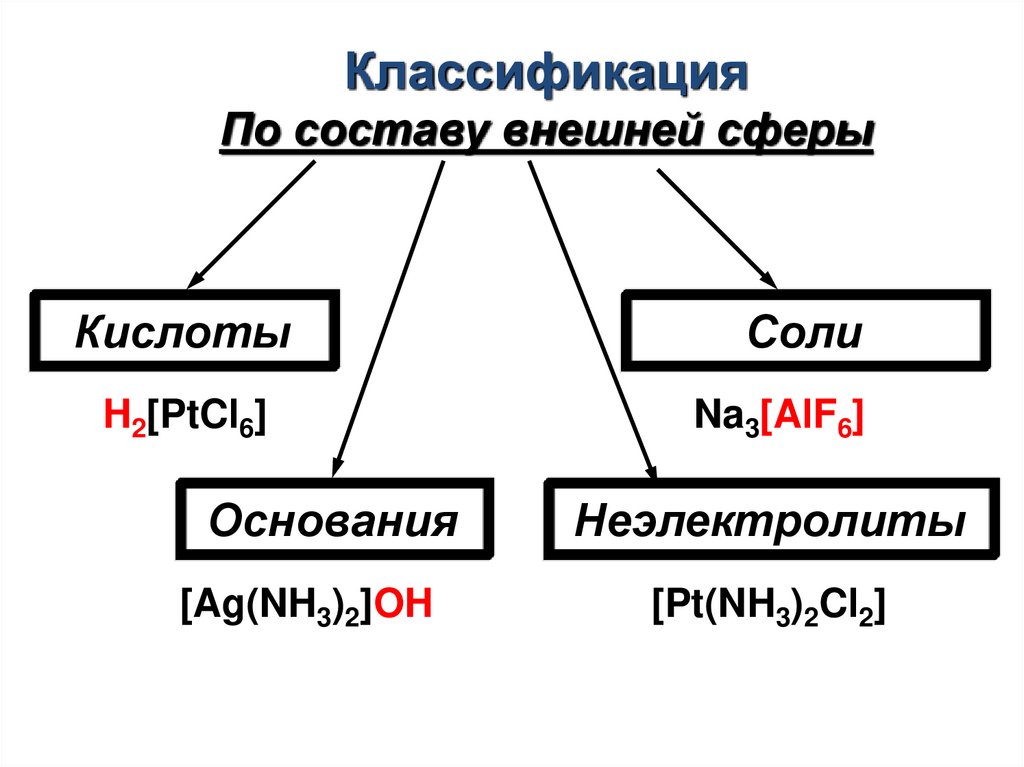
КлассификацияПо составу внешней сферы
Кислоты
Соли
H2[PtCl6]
Na3[AlF6]
Основания
Неэлектролиты
[Ag(NH3)2]OH
[Pt(NH3)2Cl2]
19.
КлассификацияПо виду лигандов
Аквакомплексные
Ацидокомплексные
[Fe(H2O)6]SO4
K[Au(CN)4]
Смешанные
[CoCl(NH3)3(H2O)2](NO3)2
Аминокомплексные
[Zn(NH3)4]Cl2
20.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
2- ди-
H2O - аква
3- три-
NH3 - амин
4- тетра-
СO - карбонил
5- пента-
OН- - гидроксо-
6- гекса-
(СN)- - циано
(NO2)- - нитро
F-, Cl-, Br-, I- - фторо-, хлоро-,
бромо-, йодо-
21.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ КОМПЛЕКСНЫХ АНИОНОВ:
+3
Fe - феррат
+2
Cu - купрат
+
Ag - аргентат
+3
Au - аурат
+2
Hg - меркурат
+2
Zn - цинкат
+3
Al - алюминат
От латинского названия
комплексообразователя с
добавлением суффикса
ат
22.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХСОЕДИНЕНИЙ
Na+2[Zn+2 (OH)-4]
тетра гидроксо цинкат натрия
[Cr+3(H2O)0 6] Cl-3
хлорид
гексааква xрома (III)
K+2 [Hg+2 I- 4]
тетрайодомеркурат (II) калия
23.
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]
Гексафтороалюминат натрия
Na[Al(OH)4]
Тетрагидроксоалюминат натрия
K4[Fe(CN)6]
Гексационоферрат (II) калия
24.
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
[Cr(H2O)6]Cl3
Хлорид гексааквахрома (III)
25.
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВГексахлороплатинат (IV) калия
Ответ: K2[PtCl6]
Нитрат хлоронитротетраамминкобальта (III)
Ответ: [Co(NH3)4(NO2)Cl]NO3
Гексагидроксохромат (III) натрия
Ответ: Na3[Cr(OH)6]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
26.
ИЗОМЕРИЯ1. Координационная
[Co(NH3)6][Cr(CN)6]
[Cr(NH3)6][Co(CN)6]
27.
ИЗОМЕРИЯ2. Ионизационная
[Co(NH3)5Cl]SO4
[Co(NH3)5SO4]Cl
28.
ИЗОМЕРИЯ3. Гидратная
[Co(H2O)6]Cl3
[Co(H2O)4Cl2]Cl 2H2O
29.
ИЗОМЕРИЯ4. Геометрическая (цис - транс)
[Pt(NH3)2Cl2]
[Cr(NH3)6][Co(CN)6]
30.
ДИССОЦИАЦИЯ К.С.1. Если есть внешняя сфера –
первичная диссоциация как
сильного электролита
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
31.
ДИССОЦИАЦИЯ К.С.2. Внутренняя сфера –
вторичная диссоциация как
слабого электролита обратимо.
Применим З.Д.М.
[Ag(NH3)2]+ Ag+ + 2NH3






























 Химия
Химия








