Похожие презентации:
Типы химических реакций
1. Типы химических реакций
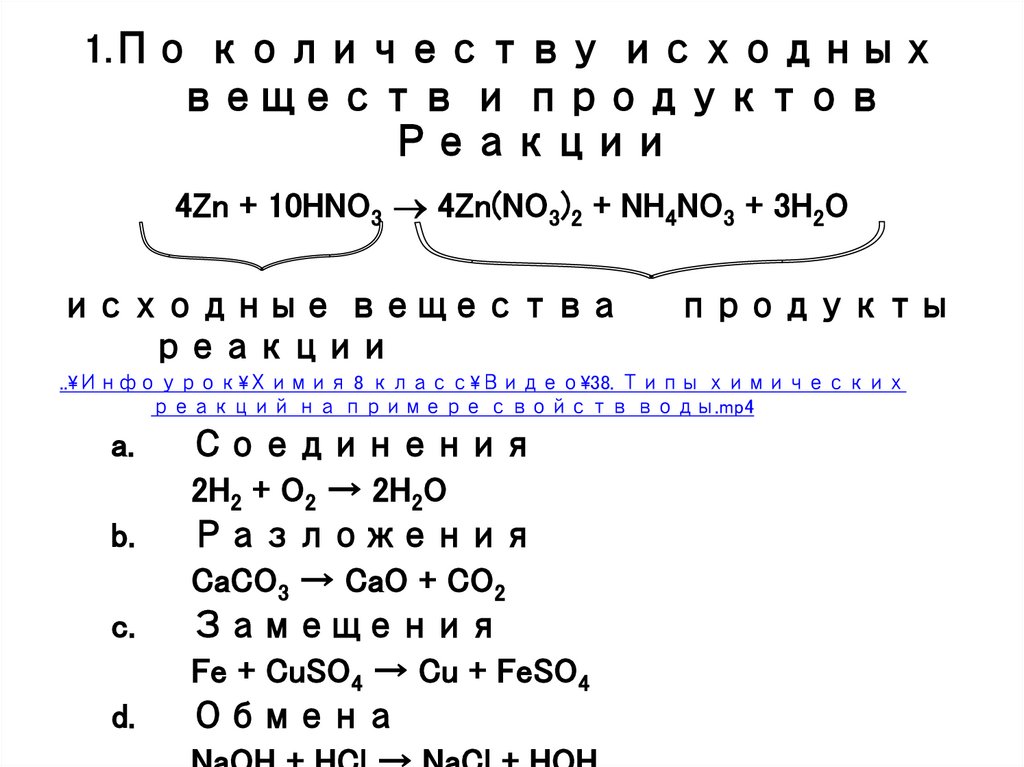
2. 1.По количеству исходных веществ и продуктов Реакции
4Zn + 10HNO3 4Zn(NO3)2 + NH4NO3 + 3H2Oисходные вещества
реакции
продукты
..\Инфоурок\Химия 8 класс\Видео\38. Типы химических
реакций на примере свойств воды.mp4
a.
b.
c.
d.
Соединения
2H2 + O2 → 2H2O
Разложения
CaCO3 → CaO + CO2
Замещения
Fe + CuSO4 → Cu + FeSO4
Обмена
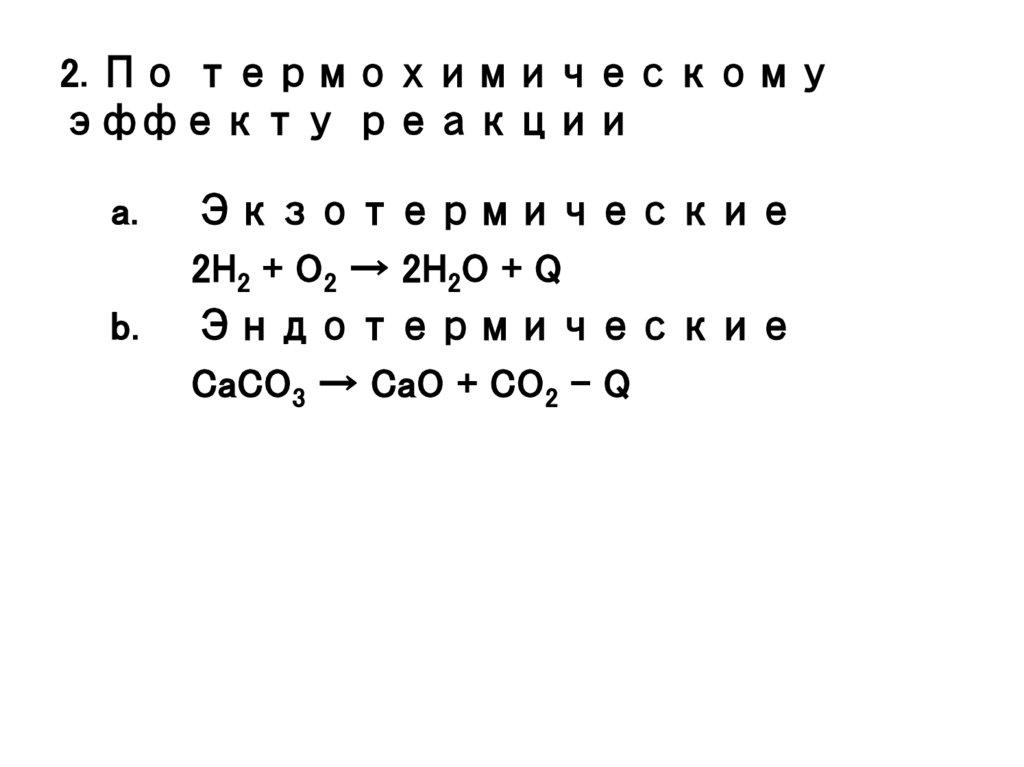
3. 2. По термохимическому эффекту реакции
a.b.
Экзотермические
2H2 + O2 → 2H2O + Q
Эндотермические
CaCO3 → CaO + CO2 - Q
4. 3. Окислительно-восстановительные реакции (ОВР)
3. Окислительновосстановительныереакции (ОВР)
Mg + HNO3 (разб.) Mg(NO3)2 + N2 + H2O
Mg0 + H+1N+5O-23 Mg+2(N+5O-23)2 + N02 + H+12O-2
что произошло с атомом?
5 Mg0 - 2е Mg+2 (отдал)окислился/восстановитель
2
N+5 + 5е- N0 (взял)восстановился/окислитель
5Mg + 2HNO3 5Mg(NO3)2 + N2 + H2O
5Mg + 12HNO3 5Mg(NO3)2 + N2 + H2O
5Mg + 12HNO3 5Mg(NO3)2 + N2 + 6H2O
5Mg + 12HNO3 = 5Mg(NO3)2 + N2 + 6H2O
5.
Правила составления уравнений ОВР1. Найти степени окисления всех атомов всех веществ;
2. Выделить (подчеркнуть) атомы, которые меняют
свою степень окисления;
3. Написать электронные уравнения. Найти
окислитель, восстановитель, указать процессы
окисления и восстановления;
4. Найти коэффициенты для окислителя и
восстановителя методом электронного баланса.
(Найти наименьшее общее кратное НОК и
разделить его последовательно на число
электронов, отданных восстановителем, и число
электронов, принятых окислителем, определить
для них коэффициент);
6.
5. Поставить найденныекоэффициенты
окислителя и
восстановителя в левой
и правой частях
уравнения;
6. Подобрать коэффициенты
для веществ, у которых
атомы не изменяли свою
степень окисления;
7. Подобрать коэффициенты
для остальных веществ
8. Уравнять количество
атомов водорода;
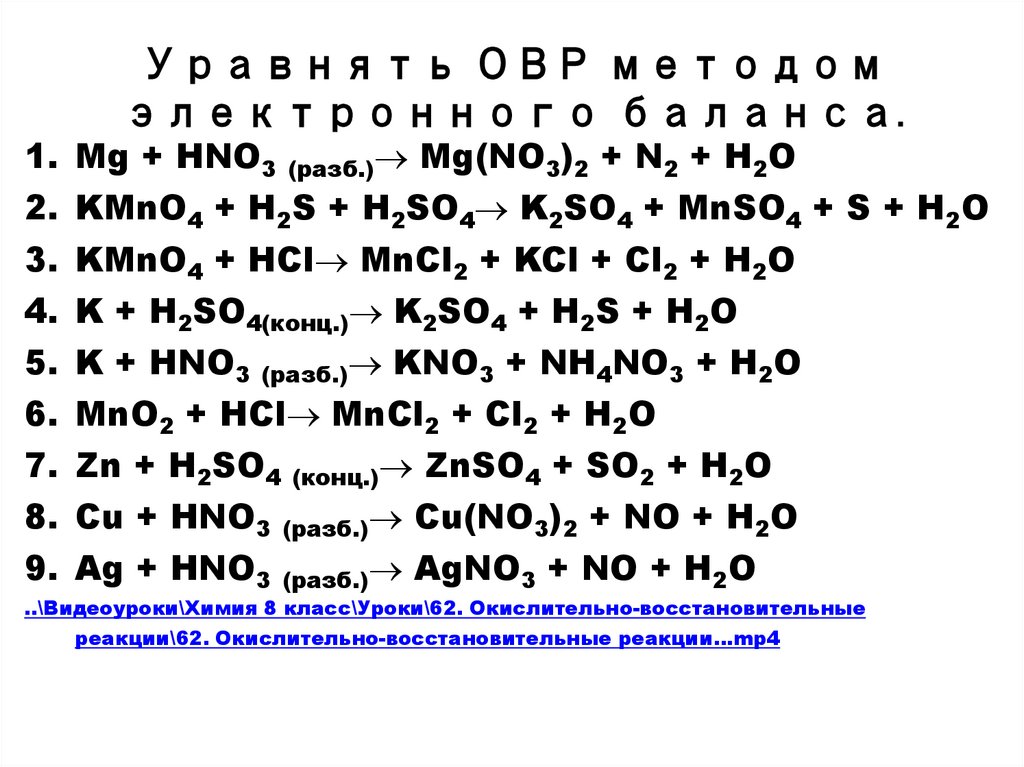
7. Уравнять ОВР методом электронного баланса.
1. Mg + HNO3 (разб.) Mg(NO3)2 + N2 + H2O2. KMnO4 + H2S + H2SO4 K2SO4 + MnSO4 + S + H2O
3. KMnO4 + HCl MnCl2 + KCl + Cl2 + H2O
4. K + H2SO4(конц.) K2SO4 + H2S + H2O
5. K + HNO3 (разб.) KNO3 + NH4NO3 + H2O
6. MnO2 + HCl MnCl2 + Cl2 + H2O
7. Zn + H2SO4 (конц.) ZnSO4 + SO2 + H2O
8. Cu + HNO3 (разб.) Cu(NO3)2 + NO + H2O
9. Ag + HNO3 (разб.) AgNO3 + NO + H2O
..\Видеоуроки\Химия 8 класс\Уроки\62. Окислительно-восстановительные
реакции\62. Окислительно-восстановительные реакции...mp4
8.
10. KI + KMnO4 + H2SO4 I2 + K2SO4 + MnSO4 + H2O11.FeSO4+K2Cr2O7+H2SO4 Fe2(SO4)3+K2SO4+Cr2(SO4)3+H2O
12. Zn + K2Cr2O7 + HСl ZnCl2 + KCl+ CrCl3 + H2O
13. H2O2 + KМnO4 + H2SO4 MnSO4 + K2SO4+ O2 + H2O
14. KМnO4 + MnSO4 + КОН K2МnO4 + K2SO4+ H2O
15. KI + K2Cr2O7 + H2SO4 I2 + K2SO4 + Cr2(SO4)3+ H2O





 Химия
Химия








