Похожие презентации:
Фосфор. 9 класс
1.
2. Открытие фосфора
Гамбургскийалхимик
Хеннинг Бранд
1669 год
«Фосфор» от греческого
«светоносный»
3.
Фосфор как химический элементпериод
III
группа
VА
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
водородное соединение
Р2О5
РН3
4. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Сравнитефизические свойства
АЛЛОТРОПНЫЕ
МОДИФИКАЦИИ
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
БЕЛЫЙ
Р
ЧЕРНЫЙ
КРАСНЫЙ
5. БЕЛЫЙ ФОСФОР
Молекулы P4 имеют форму тетраэдра. Этолегкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое,
бесцветное
воскообразное
вещество.
Хорошо
растворяется в сероуглероде и ряде других
органических
растворителей.
Ядовит,
воспламеняется на воздухе, светится в темноте.
Хранят его под слоем воды.
6. КРАСНЫЙ ФОСФОР
Существует несколько форм красного фосфора Ихструктуры окончательно не установлены. Известно, что
они являются атомными веществами с полимерной
кристаллической решеткой. Их температура плавления
585-600оС, цвет от темно-корчневого до красного и
фиолетового. Не ядовит.
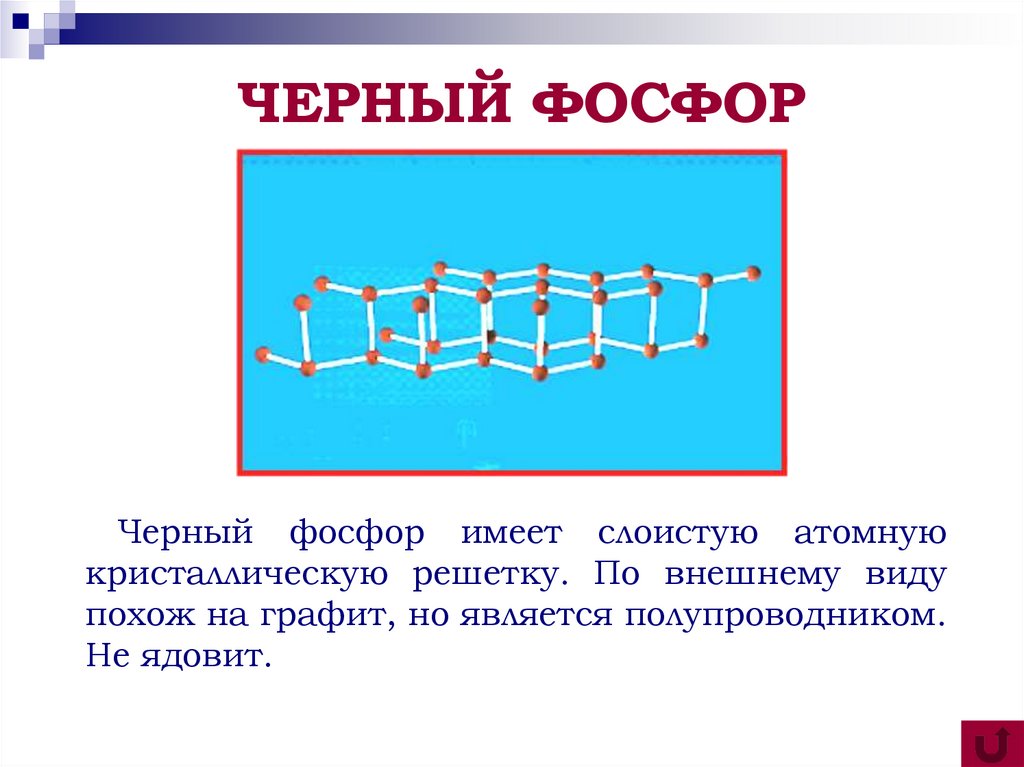
7. ЧЕРНЫЙ ФОСФОР
Черный фосфор имеет слоистую атомнуюкристаллическую решетку. По внешнему виду
похож на графит, но является полупроводником.
Не ядовит.
8. ХИМИЧЕСКИЕ СВОЙСТВА
С металлами:Ca + P =
C неметаллами:
P + O2 =
P+S=
9.
с бертолетовой солью приударе взрывается,
воспламеняется:
KClO3 + P = P2O5 + KCl
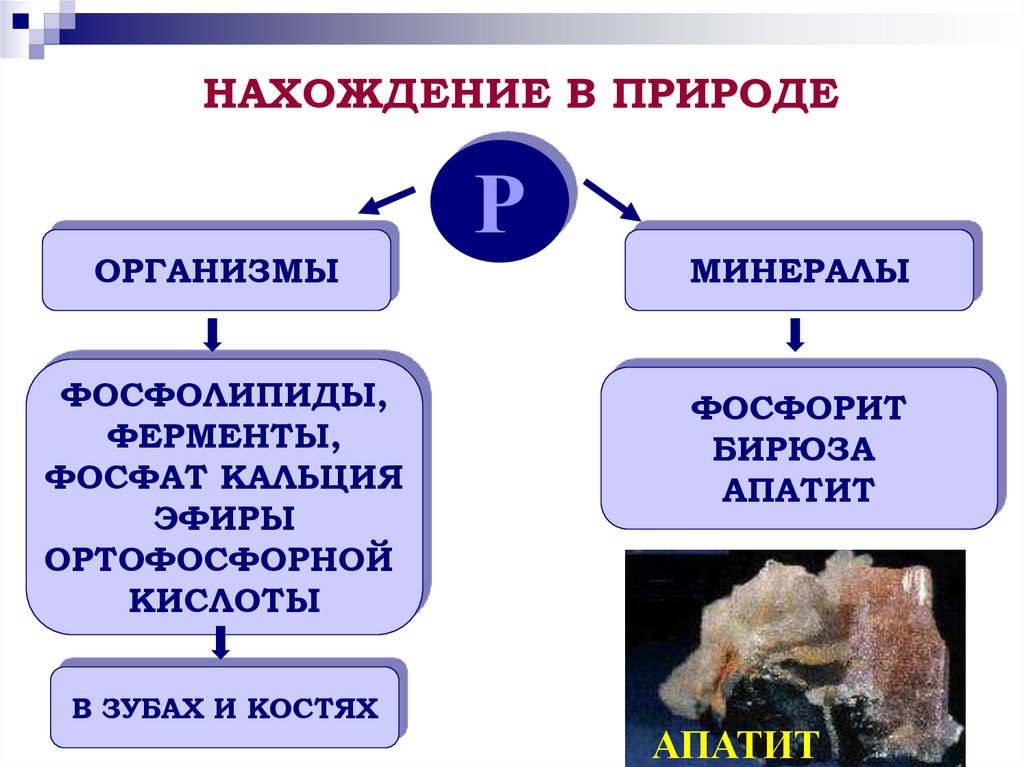
10. НАХОЖДЕНИЕ В ПРИРОДЕ
ОРГАНИЗМЫФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
Р
МИНЕРАЛЫ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
АПАТИТ
11. Физиологическое действие белого фосфора
Появление лягушек суродствами -результат
применения фосфорных
удобрений, которые
смываются в реки и пруды,
Фосфорный некроз
– поражение
челюстей
Результат применения
чрезмерного количества
фосфора
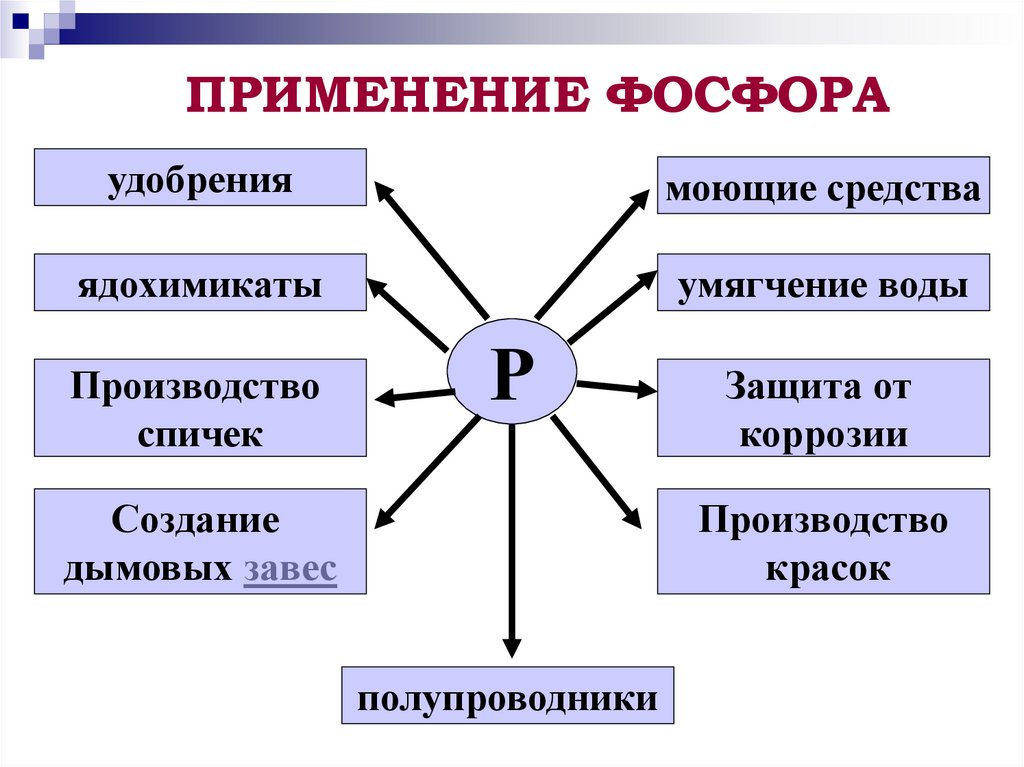
12. ПРИМЕНЕНИЕ ФОСФОРА
удобрениямоющие средства
ядохимикаты
умягчение воды
Производство
спичек
Р
Создание
дымовых завес
Защита от
коррозии
Производство
красок
полупроводники
13.
Войска СШАиспользовали
фосфорные
Бомбы
в Ираке,
2004 г.










 Химия
Химия








