Похожие презентации:
Фосфор и его соединения. 9 класс
1.
Урок в 9 классеТхайцухова Ф.Б., учитель географии, .
биологии, химии МБОУ «СОШ№11»
2.
обеспечить усвоение учащимися знаний офосфоре как о химическом элементе и простом
веществе;
познакомить с аллотропными видоизменениями
фосфора;
развивать умение сравнивать;
3.
Гамбургский алхимикХеннинг Бранд
1669 год
«Фосфор» от греческого
«светоносный»
4.
Фосфор как химический элементпериод
группа
валентных электронов
степени окисления
высший оксид
водородное соединение
5.
Фосфор как химический элементпериод
III
группа
VА
валентных электронов
степени окисления
5
-3, +3, +5
высший оксид
водородное соединение
Р2О5
РН3
6.
Сравните физические свойстваАЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
БЕЛЫЙ
Р
ЧЕРНЫЙ
КРАСНЫЙ
7.
Молекулы P4 имеют форму тетраэдра. Этолегкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое,
бесцветное
воскообразное
вещество.
Хорошо
растворяется в сероуглероде и ряде других
органических
растворителей.
Ядовит,
воспламеняется на воздухе, светится в темноте.
Хранят его под слоем воды.
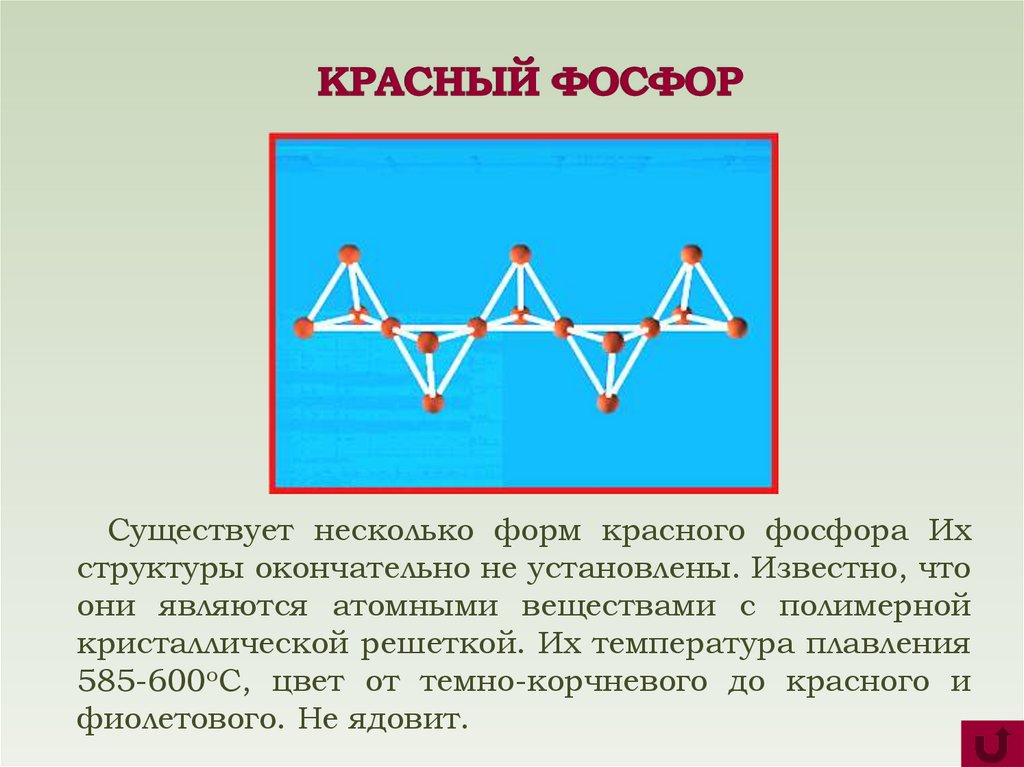
8.
Существует несколько форм красного фосфора Ихструктуры окончательно не установлены. Известно, что
они являются атомными веществами с полимерной
кристаллической решеткой. Их температура плавления
585-600оС, цвет от темно-корчневого до красного и
фиолетового. Не ядовит.
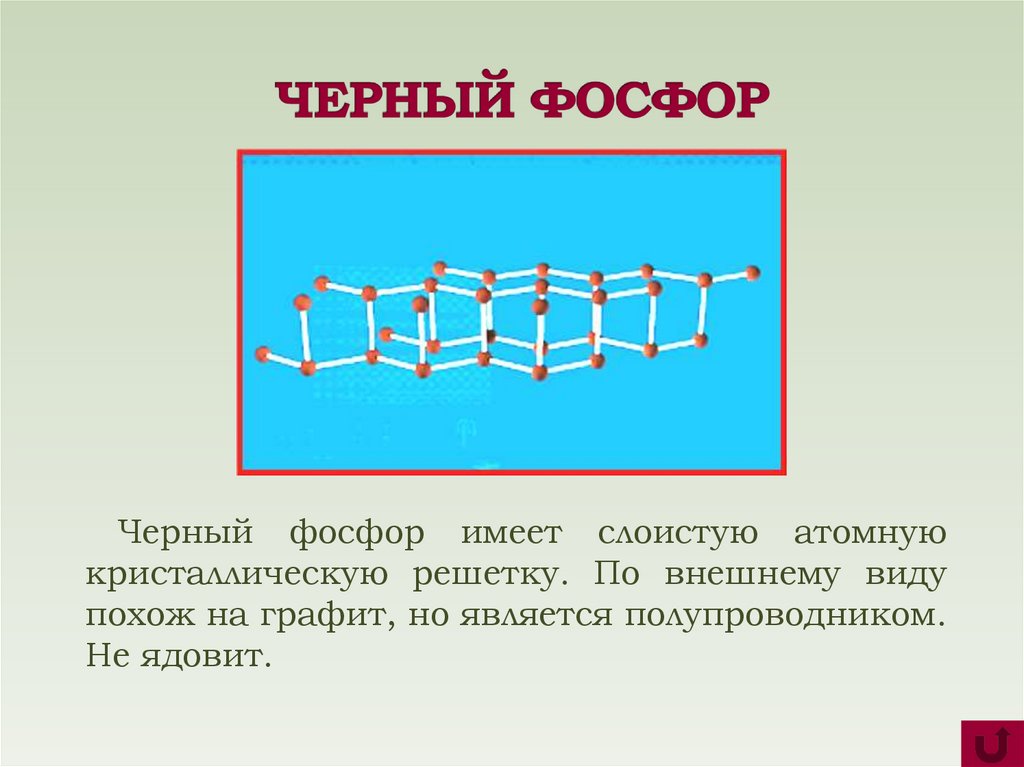
9.
Черный фосфор имеет слоистую атомнуюкристаллическую решетку. По внешнему виду
похож на графит, но является полупроводником.
Не ядовит.
10.
С металлами:Ca + P =
C неметаллами:
P + O2 =
P+S=
11.
с бертолетовой солью приударе взрывается,
воспламеняется:
KClO3 + P = P2O5 + KCl
12.
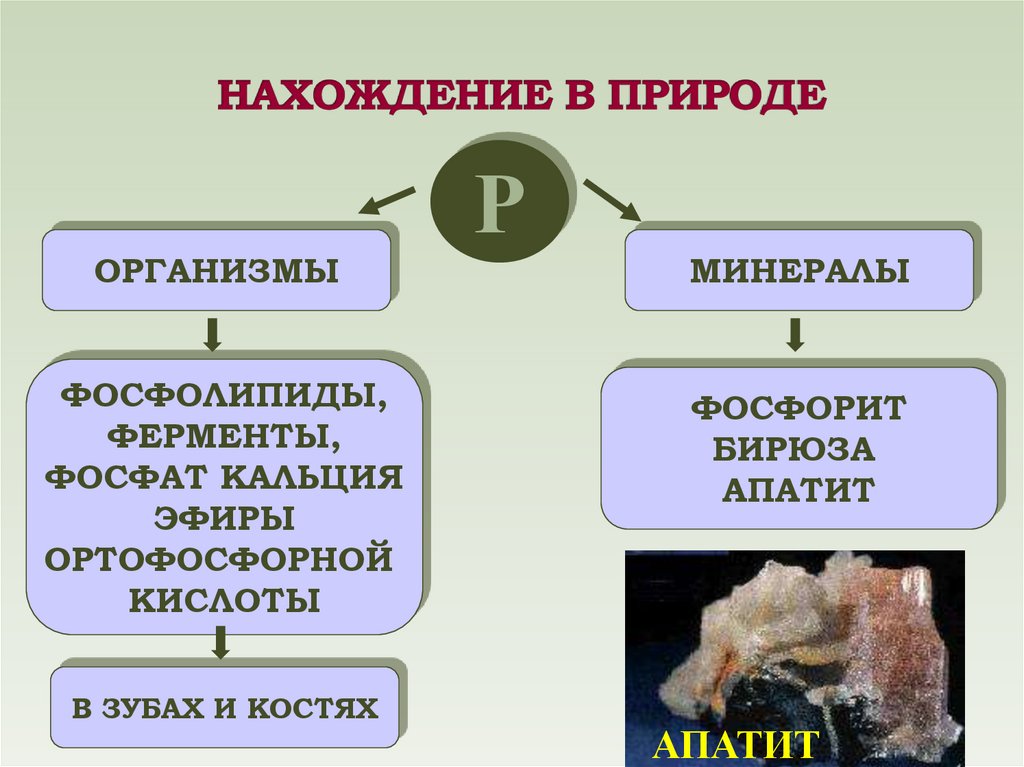
ОРГАНИЗМЫФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
Р
МИНЕРАЛЫ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
АПАТИТ
13.
14.
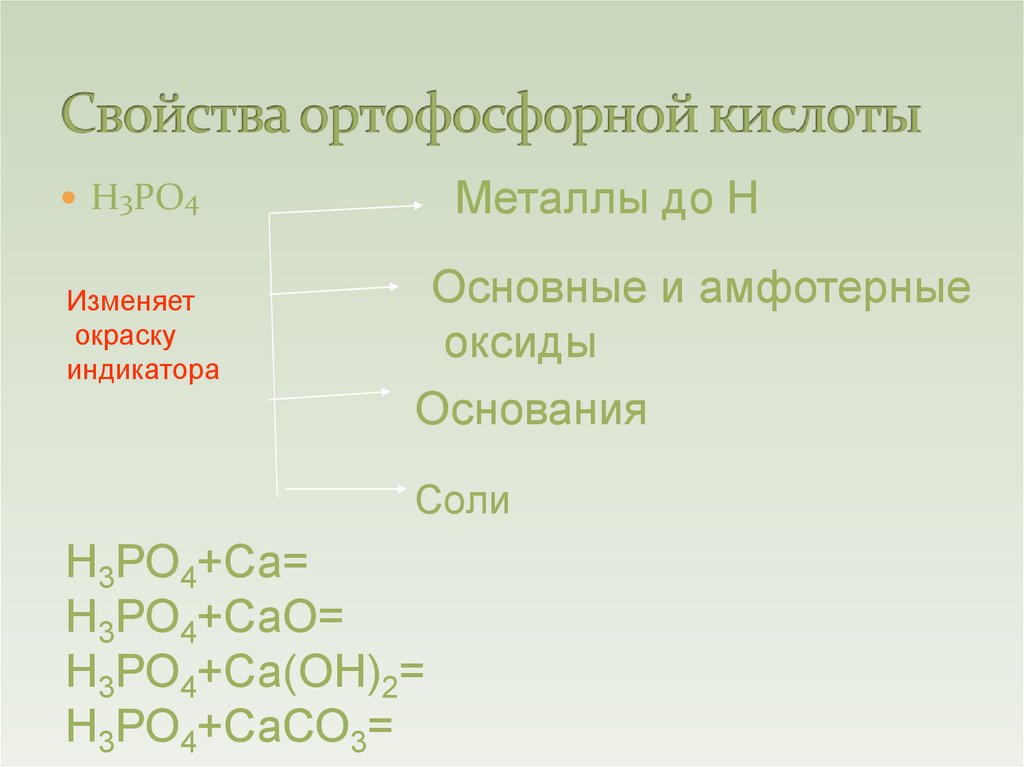
Металлы до НН3РО4
Изменяет
окраску
индикатора
Основные и амфотерные
оксиды
Основания
Соли
Н3РО4+Са=
Н3РО4+СаО=
Н3РО4+Са(ОН)2=
Н3РО4+СаСО3=
15.
16.
K3PO4+3AgNO3=Ag3PO4↓+3KNO3при этом выпадает жёлтый осадок нитрата серебра
17.
Появление лягушек суродствами -результат
применения фосфорных
удобрений, которые
смываются в реки и пруды,
Фосфорный некроз
– поражение
челюстей
Результат применения
чрезмерного количества
фосфора
18.
нагреванием смеси фосфорита, угля ипеска в электропечи:
Ca3(PO4)2 + C + SiO2 → P4 + CaSiO3 + CO
19.
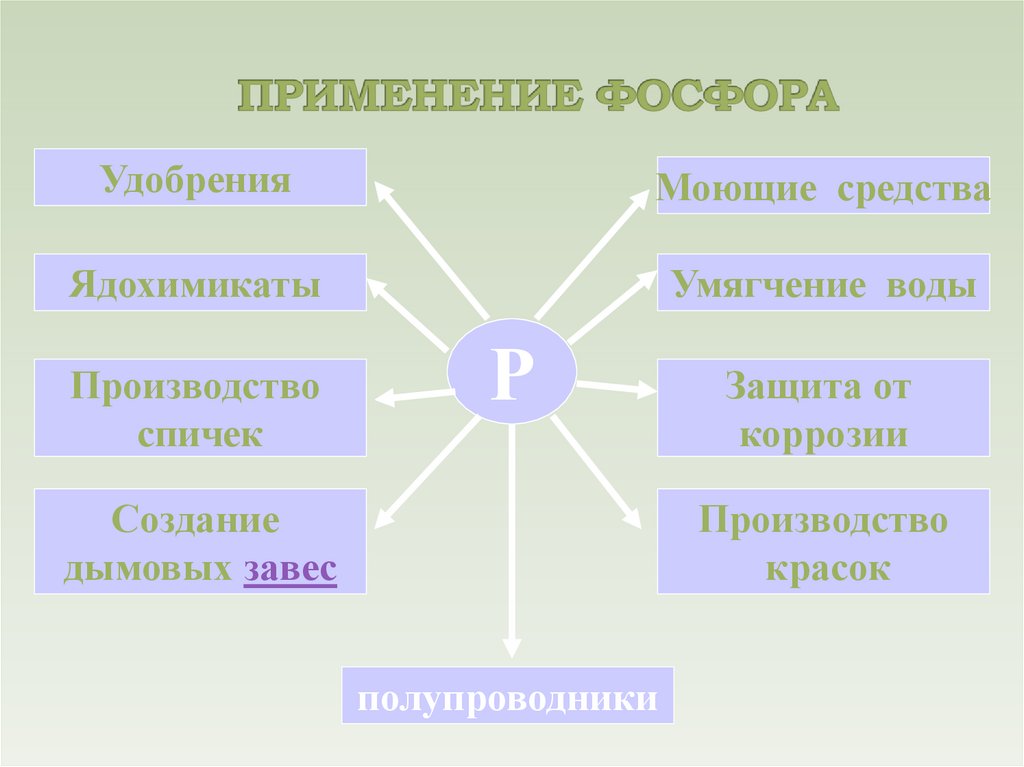
УдобренияМоющие средства
Ядохимикаты
Умягчение воды
Производство
спичек
Р
Создание
дымовых завес
Защита от
коррозии
Производство
красок
полупроводники
20.
Войска СШАиспользовали
фосфорные
Бомбы
в Ираке,
2004 г.
21.
1.ЗАКОНЧИТЕ УРАВНЕНИЯ:Р + F2 =
Al + P =
2. Задача:
Какова масса фосфора в вашем теле, если известно,
что фосфор составляет ≈1% от массы тела?
3.Осуществите превращения:
Р
РН3
Р2О5
Н3РО4
22.
Индивидуальные задания.Подготовить сообщения:
1)об истории спичек;
2) о биологической роли
фосфора и его соединений.

















 Химия
Химия








