Похожие презентации:
Атомы химических элементов
1.
АТОМЫ ХИМИЧЕСКИХЭЛЕМЕНТОВ
2.
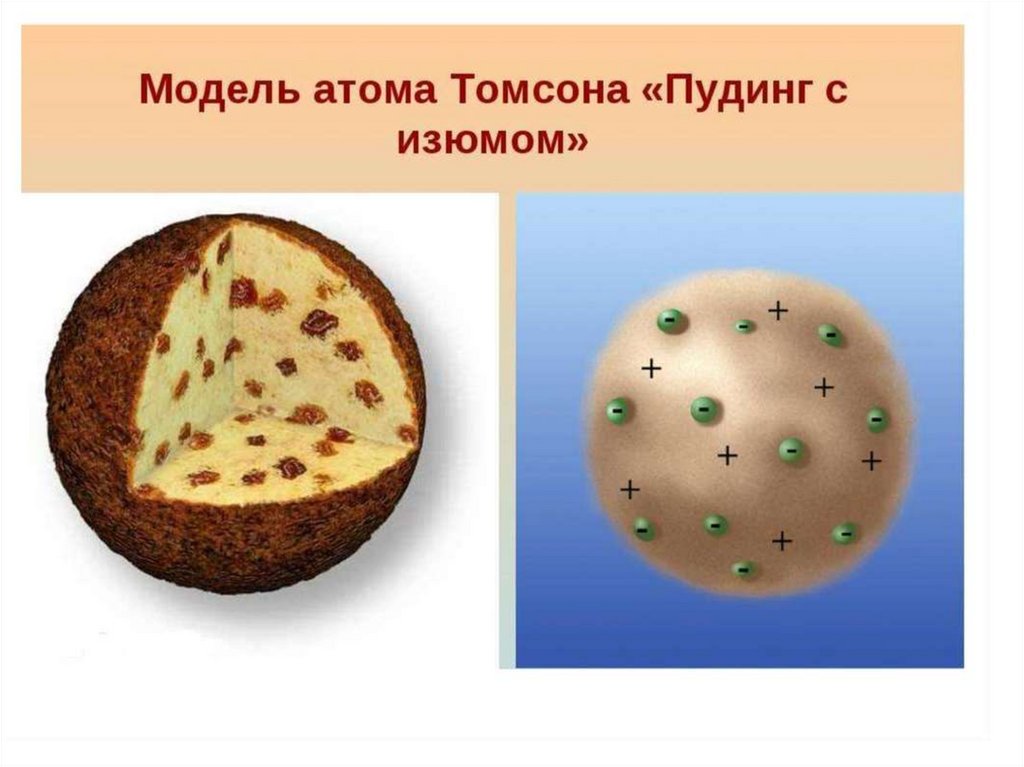
3.
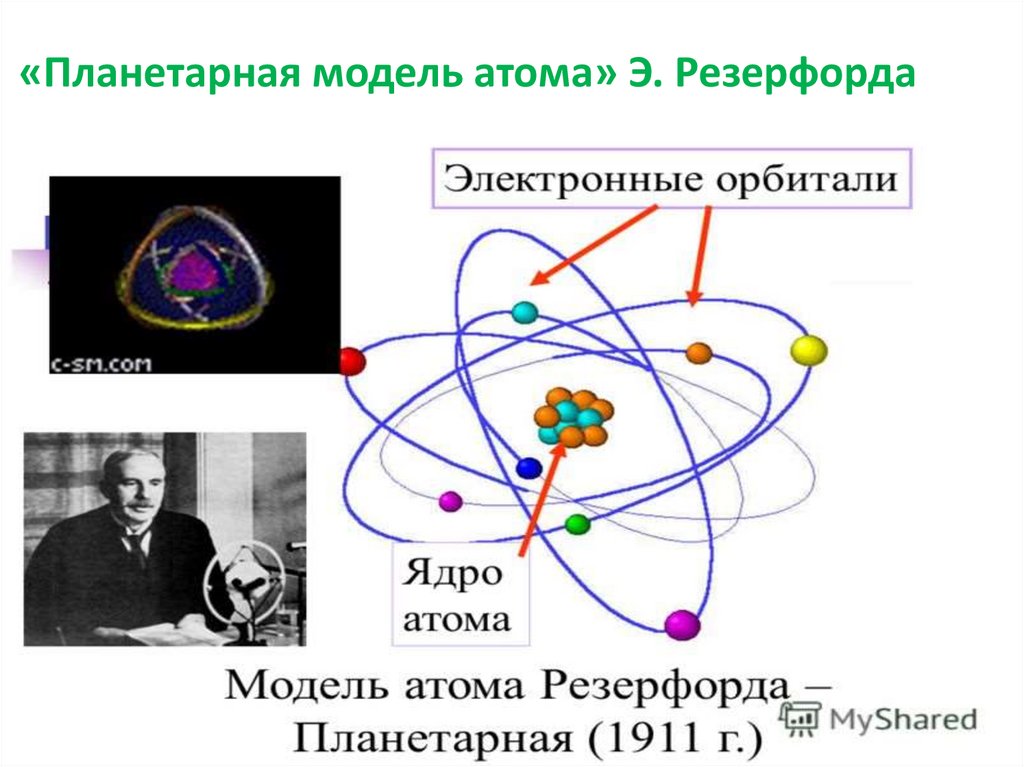
«Планетарная модель атома» Э. Резерфорда4.
5.
Строение атома запомнить легко:В центре помещается ядро,
Зарядом и массой обладает оно.
Заряд определяется числом протонов,
Масса — суммой протонов и нейтронов.
Атом нейтральным является,
Потому что электроны появляются.
По массе они маленькие очень,
Заряд у них минус один, впрочем.
Электроны, как попало, не болтаются,
На особых “орбитах” размещаются.
Число электронов и протонов легко определяется:
Оно порядковому номеру равняется.
Число нейтронов легко считается:
Из атомной массы порядковый номер вычитается.
6.
СТРОЕНИЕ АТОМА КИСЛОРОДА7.
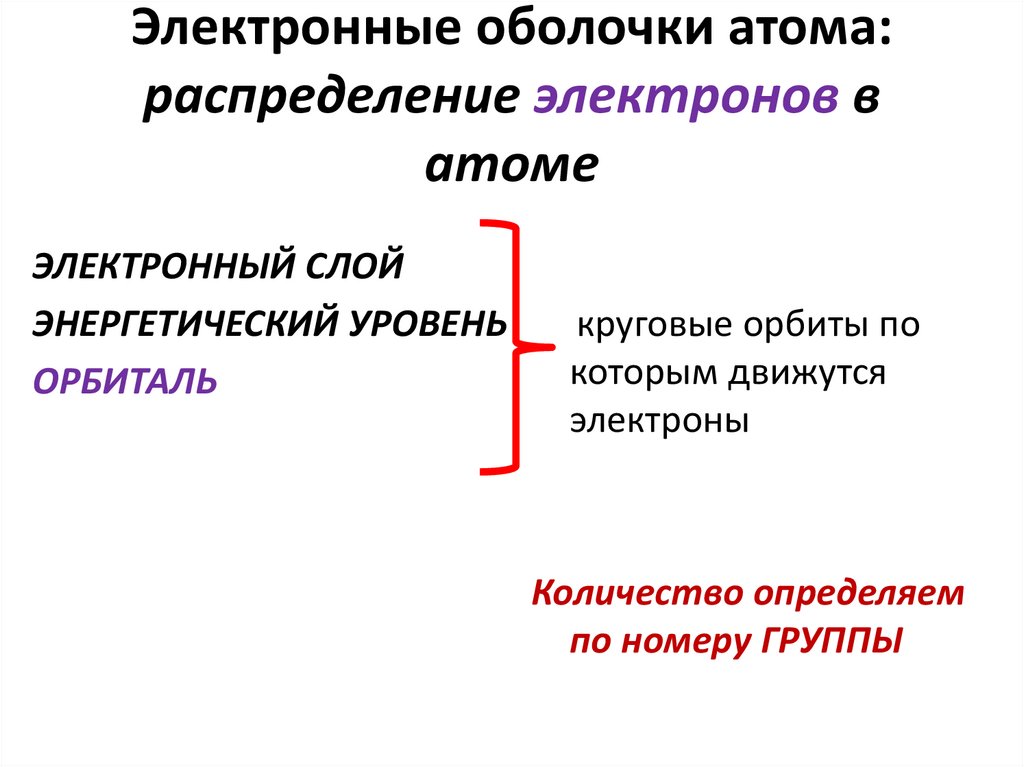
Электронные оболочки атома:распределение электронов в
атоме
ЭЛЕКТРОННЫЙ СЛОЙ
ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ
ОРБИТАЛЬ
круговые орбиты по
которым движутся
электроны
Количество определяем
по номеру ГРУППЫ
8.
Строение и модель атомауглерода
9.
схема строения// количество частицАТОМА УГЛЕРОДА
10.
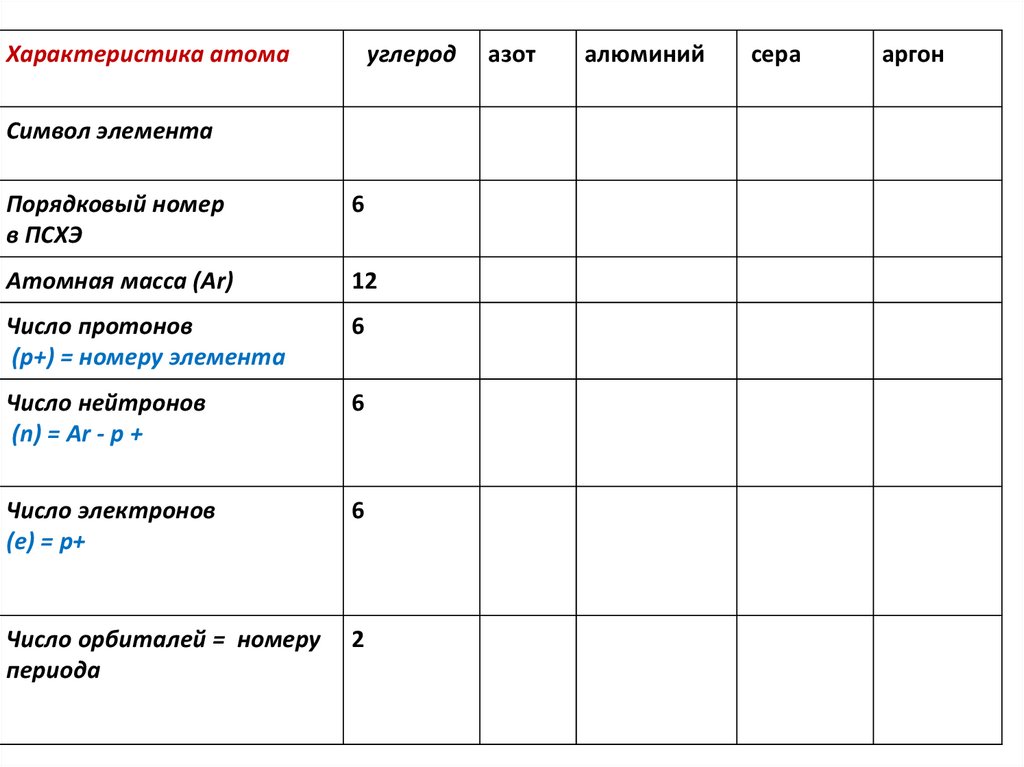
ЗАДАНИЕЗаполнить таблицу и нарисовать
схемы строения атома.
!!!На следующем уроке будет СР.
11.
Характеристика атомауглерод
Символ элемента
Порядковый номер
в ПСХЭ
6
Атомная масса (Ar)
12
Число протонов
(p+) = номеру элемента
6
Число нейтронов
(n) = Аr - p +
6
Число электронов
(e) = p+
6
Число орбиталей = номеру
периода
2
азот
алюминий
сера
аргон







 Химия
Химия