Похожие презентации:
Галогены
1.
ГАЛОГЕНЫ2.
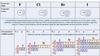
К галогенам относят пять элементов VIIА-группы периодической системы: фтор F,хлор Сl, бром Вr, йод I и астат At.
Атомы галогенов содержат по 7 электронов на внешнем электронном слое, общая
электронная конфигурация которого ns2np5, то есть галогены являются р-элементами.
Электронно-графические схемы внешнего электронного слоя атомов фтора и хлора
выглядят следующим образом:
3.
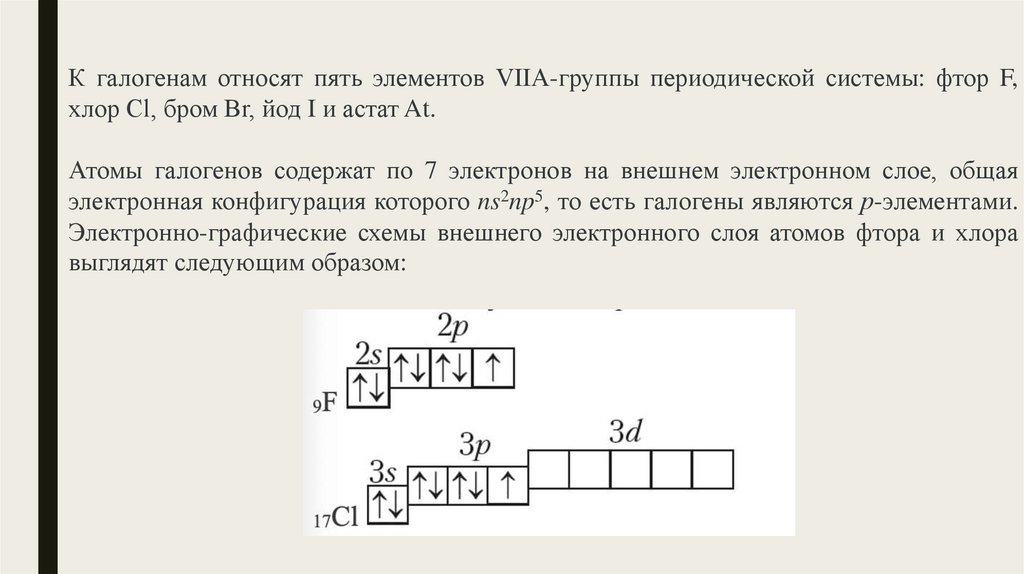
ЭлементФтор 9F
Хлор 17Cl
Бром 35Br
Йод 53I
Радиус атома, нм
0,071
0,099
0,114
0,133
χ
4,0
3,0
2,8
2,5
Степени окисления
Природные соединения
–1, 0
CaF2 (флюорит,
плавиковый шпат);
Na3[AlF6] (криолит);
Са5[РО4]3F (фторапатит)
–1, 0, +1, +3, +5, +7
NaCl (каменная соль,
галит);
KCl (сильвин);
Смесь NaCl и KCl
(сильвинит);
KMgCl3 · 6H2O (карналлит)
–1, 0, +1, +3, +5, +7
NaBr, KBr, MgBr2 — в
отложениях хлоридов; в
морской воде в виде
бромид-ионов
–1, 0, +1, +3, +5, +7
KIO3 (йодат калия) — в
залежах чилийской
селитры, в подземных
буровых водах, в морских
водорослях
4.
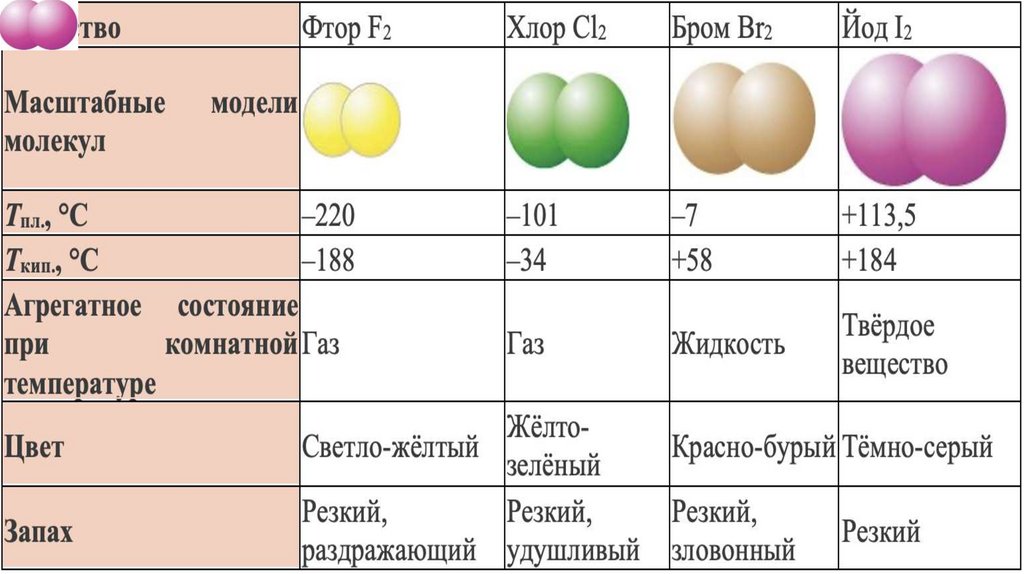
Строение простых веществ. Простые вещества галогенысостоят из двухатомных молекул, атомы в которых связаны
ковалентной неполярной σ-связью.
5.
6.
Химические свойства галогеновХимическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.
Галогены
проявляют
с металлами и неметаллами.
свойства
окислителей.
Галогены
реагируют
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида
кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора
и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
7.
Химические свойства галогенов1.4. При взаимодействии с металлами галогены проявляют свойства окислителей,
образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром
образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до
йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере
фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
8.
Химические свойства галогенов1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает
со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает
обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
9.
Химические свойства галогенов2. Со сложными веществами галогены реагируют, также проявляя преимущественно
окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в
щелочах.
2.1.
Более
активные
галогены
вытесняют
менее
активные
галогены
из солей и галогеноводородов.
Например, хлор вытесняет йод
и бром из раствора йодида калия и бромида калия
соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
2.2. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Хлор окисляет воду при нагревании или на свету:
2Cl2 + 2H2O → 4HCl + O2
10.
№225, №245, №249,№250
11.
Домашнее задание:параграф 30, №264







 Химия
Химия