Похожие презентации:
Хімічні властивості кислот
1.
Хімічні властивостікислот.
Авраменко Ю.Л
учитель хімії
ОЗ «Кролевецький ліцей №3»
2.
Повторимо хімічні властивості оксидівОксиди
кислотні
Основні
Амфотерні
SO3, P2O5, N2O5
Na2O, CaO,
ZnO, Al2O3
1.Взаємодія
водою(крім SiO2)
з
Оксид +
=кислота
=
вода
2.Взаємодія з лугами
(реакція обміну).
1.Взаємодія з водою
(тільки
активні
метали)Оксид + вода
= =основа
Оксид + луг = сіль +
+вода
2.Взаємодія
з
кислотами (реакція
обміну).
З
кислотами
реагують
не
Оксид + кислота =
сіль + +вода
3. Взаємодія між собою
З лугами не реагують
Основний оксид +
+кислотний оксид = сіль
1..Взаємодія з
кислотами
(реакція
обміну).
Оксид + кислота
= =сіль + вода
2. Взаємодія з
лугами
Оксид + основа
= =сіль + вода
3.
1. Взаємодія з основними оксидами (реакція обміну)Кислота + основний оксид = сіль + вода
2.. Реакція з основами (реакція нейтралізації)
Основа + кислота = сіль і вода
3. Реакція з солями (реакція обміну)
а) утворюється осад
сіль + кислота = нова сіль + кислота
б) сіль утворена леткою кислотою (H2CO3, H2SO3, H2S)
сіль + кислота = нова сіль + вода + газ
4. Термічний розклад оксигеновмісних кислот
Кислота = кислотний оксид + вода
H2CO3= СО2 + Н2О
H2SO3 = SO2 + Н2О
5. Взаємодія з металами (реакція заміцщення)
Усі безоксигенові кислоти та розведена H2SO4 реагують з
металами (ті що стоять до Н2 в ряді активності металів)
Кислота + Ме = сіль + водень (Н2)
6. Дія індикаторів (зміна забарвлення)
Метилоранж –рожеве Фенолфталеїн безбарвний Лакмус червоний
4.
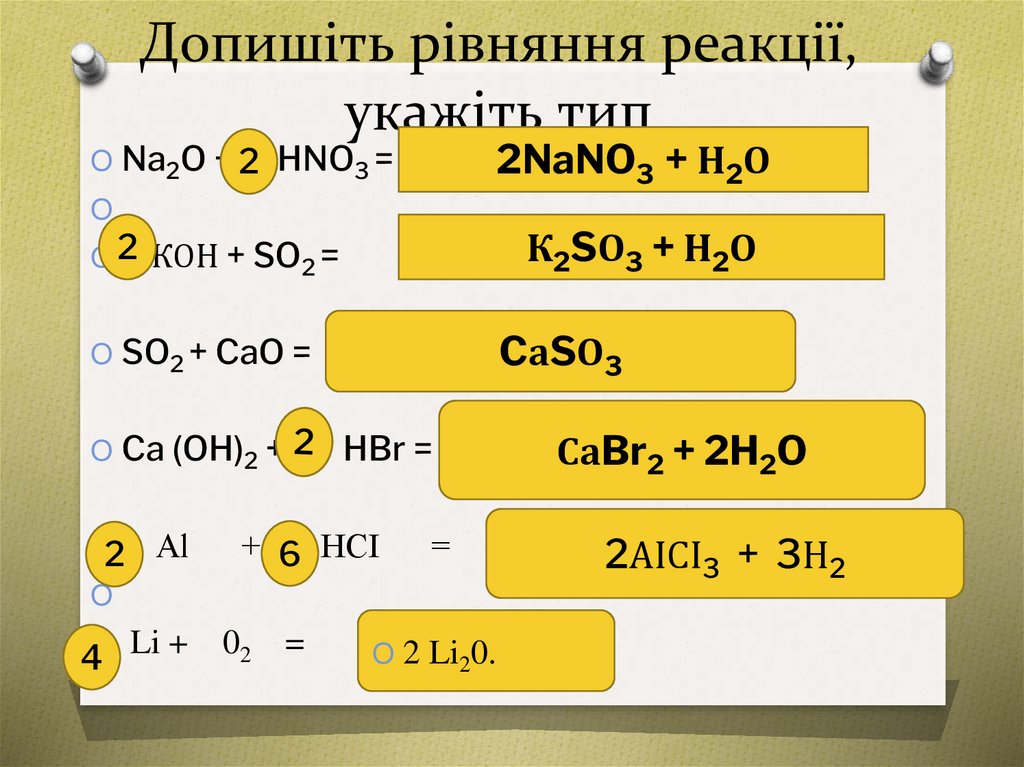
Допишіть рівняння реакції,укажіть тип
2NaNO3 + Н2О
O Na2O + 2 HNO3 =
O
К2SО3 + Н2О
O 2 КОН + SO2 =
CаSО3
O SO2 + CaO =
O Ca (OH)2 +
O2
Al
HBr =
+ 6 НСІ
=
O
4O Li +
02 =
O 2 Li20.
СаBr2 + 2H2O
2АІСІ3 + 3Н2
5.
1.Розподіліть речовини по класах, дайтеназви усім речовинам:
CaO,
Mg(OH)2,
H2CO3, SO2, CuSO4,
HBr, KNO3, H2SO4,
NaOH, Na2O.
6.
3.Виберіть метали, з якимибуде реагувати ортофосфатна
кислота та запишіть рівняння
реакції:
3Mg + 2H3PO4 = Mg3 (PO4)2 + 3H2
А) Mg
Б) Sn
3Sn + 2H3PO4 = Sn3 (PO4)2 + 3H2
В) Нg
Г) Аg SО32Al + 2H PO = 2AlPO + 3H
3
4
4
2
Д) Аl
7.
Задача Обчисліть масу солі, що утвориться привзаємодії 4 г купрум (ІІ) оксиду з надлишком розчину
хлоридної кислоти.
O 2. Записую рівняння реакції:
O 0,05 моль
х моль
O Дано:
O СuО+ 2HСІ= СuСІ2 + Н2О
O m(СuО) = 4 г
O 1 моль
1 моль
O + HСІ
O Х= 0,05 моль
O m(солі) -?
O 3. Знаходжу масу солі
O m(СuСІ2) = n*М (СuСІ2 )
O *М (СuСІ2 )= 64 + 35,5*2=135
1. 1. Знаходжу кількість
речовини купрум (ІІ) оксиду г/ моль
2. М(СuО)= 64+ 16= 80 г/моль O m(СuСІ2) = n*М (СuСІ2 )= 135
3. n(СuО) = m/ М= 4г/ 80г/моль
г/моль* 0,05 моль = 6,75 г.
=0,05 моль.
Відповідь: m(СuСІ2) = 6,75 г
8.
У реакцію з бромідною кислотою вступив кальціймасою 8г. Який об'єм водню при цьому виділився ?
2. Записую рівняння реакції:
Дано:
m(Ca) = 8 г
0,2 моль
х моль
+ HBr
Са + 2HBr = СаBr2 + Н2
1 моль
1 моль
V ( H2) -?
Х= 0,2 моль
1. 1. Знаходжу кількість
3. Знаходжу об’єм
речовини кальцію
V(Н2)= n*Vm = 0,2 моль *
2. М(Са)= 40 г/моль
22,4 л/моль = 4,48 л.
3. n(Са) = m/ М= 8г/ 40
г/моль = 0,2 моль.
Відповідь:V(Н2)= 4,48 л.
9.
O На суміш магнію та міді масою 20 г подіялирозбавленою сульфатною кислотою кислотою. При
цьому виділилось 8,96 л газу Обчисліть масові
частки металів у суміші.
Дано:
m( суміші) = 20 г
Сu і Mg
+ H2SO4
V ( газу )= 8,96л
10.
1.Аналізую умову задачі:Сu + H2SO4 =
Mg + H2SO4 = MgSO4 + H2
Роблю висновок, що водень виділився
тільки у результаті взаємодії магнію,
тому можу знайти масу магнію.
2. Знаходжу кількість речовини водню:
n(Н2)=V/Vm = 8,96 л* 22,4 л/моль =
0,4 моль
11.
3. Знаходжу кількість речовинимагнію по рівнянню реакції
Х моль
0, 4 моль
Mg + H2SO4 = MgSO4 + H2
1 моль
Х = 0,4 моль
1 моль
12.
4. Знаходжу масу магнію:m(Mg) = n*М (Mg )=
24г/моль* 0,4 моль = 9,6 г.
5. Знаходжу відсоток магнію у
суміші:
Х = 9,6 г *
20 г суміші – 100%
100/ 20 =
9,6 г магнію – х %
48%
Відповідь : магнію –
48%, міді – 52%
13.
Домашнє завдання :Повторити параграфи 34-36, № 10 на с. 192.
Підготуватися до самостійної роботи.
ДЯКУЮ ЗА УВАГУ,
УСПІХІВ!












 Химия
Химия








