Похожие презентации:
Строение электронных оболочек атомов
1.
2.
Энергетическим уровнем называют расстояние,на которое электрон смог оторваться от ядра атома
благодаря энергии, которой он обладает.
Число энергетических уровней совпадает с
номером периода.
Общее число электронов, вращающихся вокруг
ядра, совпадает с порядковым номером
химического элемента и с зарядом ядра его атома.
На каждом энергетическом уровне число
электронов совпадает с числом элементов этого
периода.
На последнем энергетическом уровне у элементов
главных подгрупп (А) число электронов совпадает с
номером группы.
3.
НF
+1
1
Al
+9
2 7
+13
2 8 3
На каждом уровне электроны вращаются в
определенном пространстве, которое называют
электронным облаком .
На каждом электронном облаке может
находиться не больше двух электронов, которые
вращаются в разном направлении.
Форма и число облаков разная (смотри на
следующих слайдах)
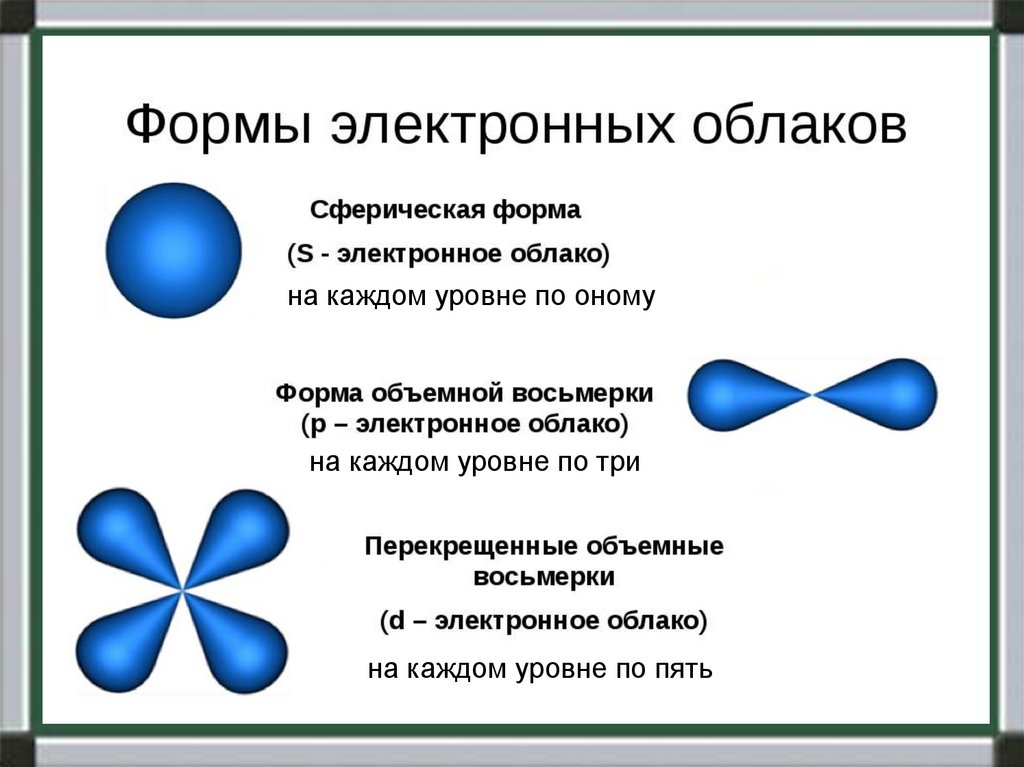
4.
на каждом уровне по ономуна каждом уровне по три
на каждом уровне по пять
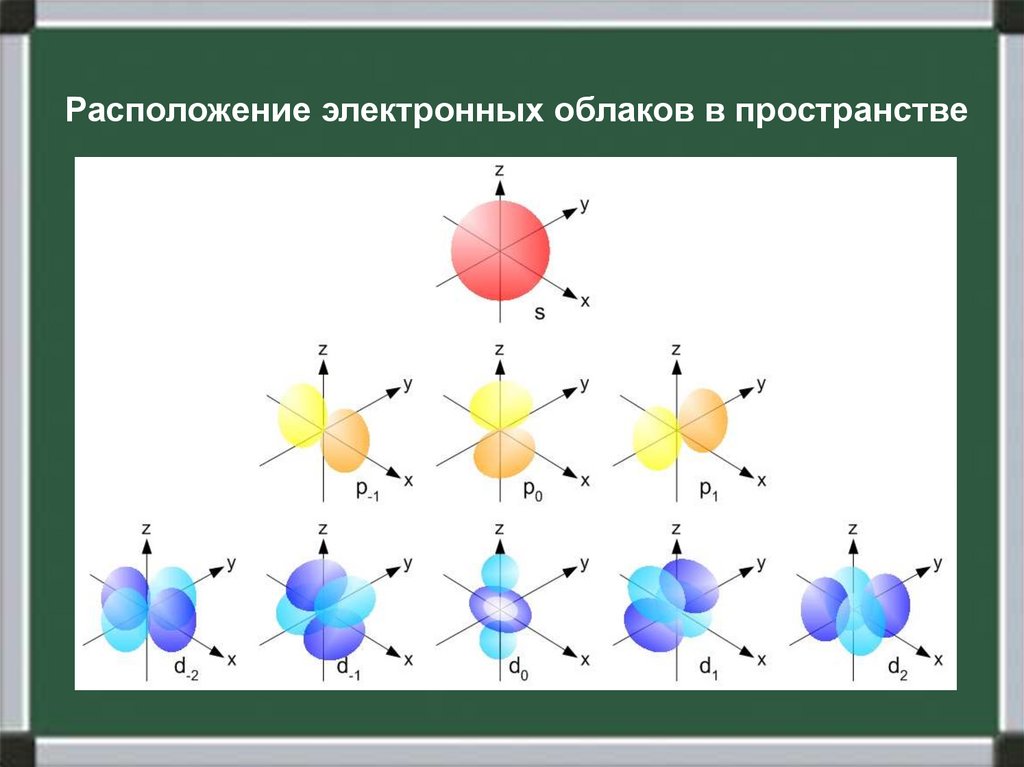
5.
Расположение электронных облаков в пространстве6.
Для удобства написания облака рисуют в виде клеток,а форму подписывают сверху:
s
p
d
Часто облака называют подуровнями.
На каждом уровне столько видов подуровней, каков
номер уровня.
Например: на первом уровне – один s – подуровень, на
втором уровне – два подуровня – s и р.
Электронами заполняется сначала один вид облаков, а
затем второй. На р - и d – облаках электроны
располагаются сначала в одном направлении по одному
на каждом облаке, а затем в другом направлении.
7.
Электроны для удобства обозначают стрелками.s
1
2
p
3
d
На следующем слайде дан шаблон характеристики элементов
главных подгрупп. Меняя подчеркнутые цифры, можно дать
характеристику любому элементу главной подгруппы.
Электронная формула повторяет расположение электронов на
электронных облаках.
8.
Под номером 6 стоит элемент углерод. Он расположен вовтором периоде, четвертой группе, главной подгруппе. Это
значит, что заряд ядра его атома +6, вокруг ядра вращаются 6
электронов на двух энергетических уровнях, на последнем
уровне 4 электрона.
С +6
2 4
1p
1n - строение ядра
6
+
6
С
=
6
1
0
12
s
1
Высший оксид ─
p
2
СО2
Летучее водородное соединение ─
2
2
2
1S 2S 2 p
- электронная формула
СН4
9.
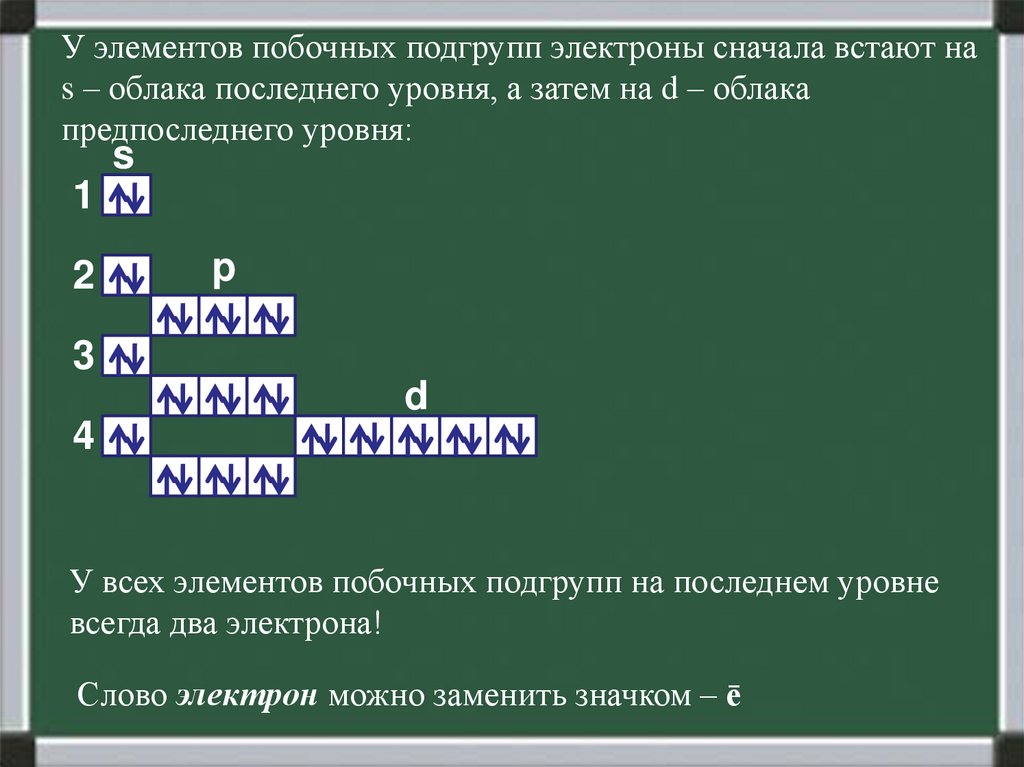
У элементов побочных подгрупп электроны сначала встают наs – облака последнего уровня, а затем на d – облака
предпоследнего уровня:
s
1
2
p
3
d
4
У всех элементов побочных подгрупп на последнем уровне
всегда два электрона!
Слово электрон можно заменить значком – ē
10.
Под номером 23 стоит элемент ванадий. Он расположен вчетвертом периоде, пятой группе, побочной подгруппе. Это
значит, что заряд ядра его атома +23, вокруг ядра вращаются
23 ē на четырёх энергетических уровнях, на последнем уровне
2 ē, электронами заполняются d-облака предпоследнего
уровня.
2
2 8 11 2
1
2
3
4
6
2
6
3
1 S 2 S 2 p 3 S 3p 3 d 4 S
V +23
s
2
p
2
51
1p
1n
V
=
23
+
28
23
1
0
Высший оксид ─
V2О5
Летучее водородное соединение ─ не существует
(как и у всех
d
элементов
поюочных
подгрупп!)







 Химия
Химия








