Похожие презентации:
Классификация и свойства кислот
1. «Классификация и свойства кислот»
БПОУ ВО«Борисоглебскмедколледж»
«Классификация и свойства кислот»
Подготовила преподаватель
общей и неорганической
химии Попова А.С.
2. Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка.
3.
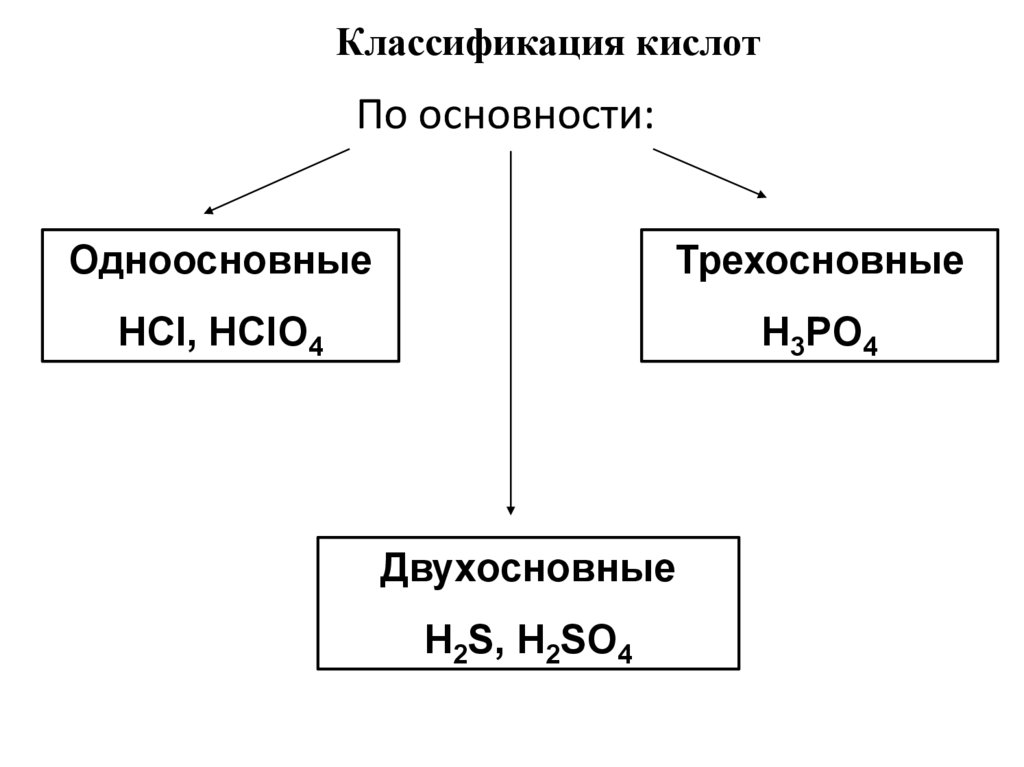
Классификация кислотПо основности:
Одноосновные
Трехосновные
HCl, HClO4
H3PO4
Двухосновные
H2S, H2SO4
4.
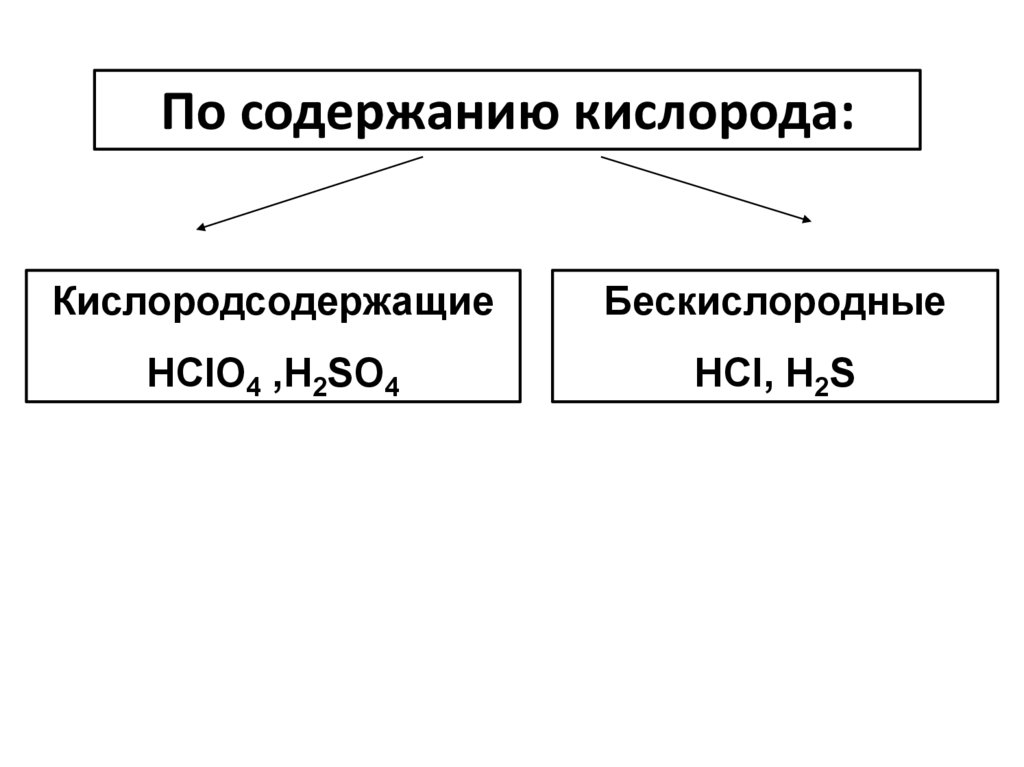
По содержанию кислорода:Кислородсодержащие
Бескислородные
HClO4 ,H2SO4
HCl, H2S
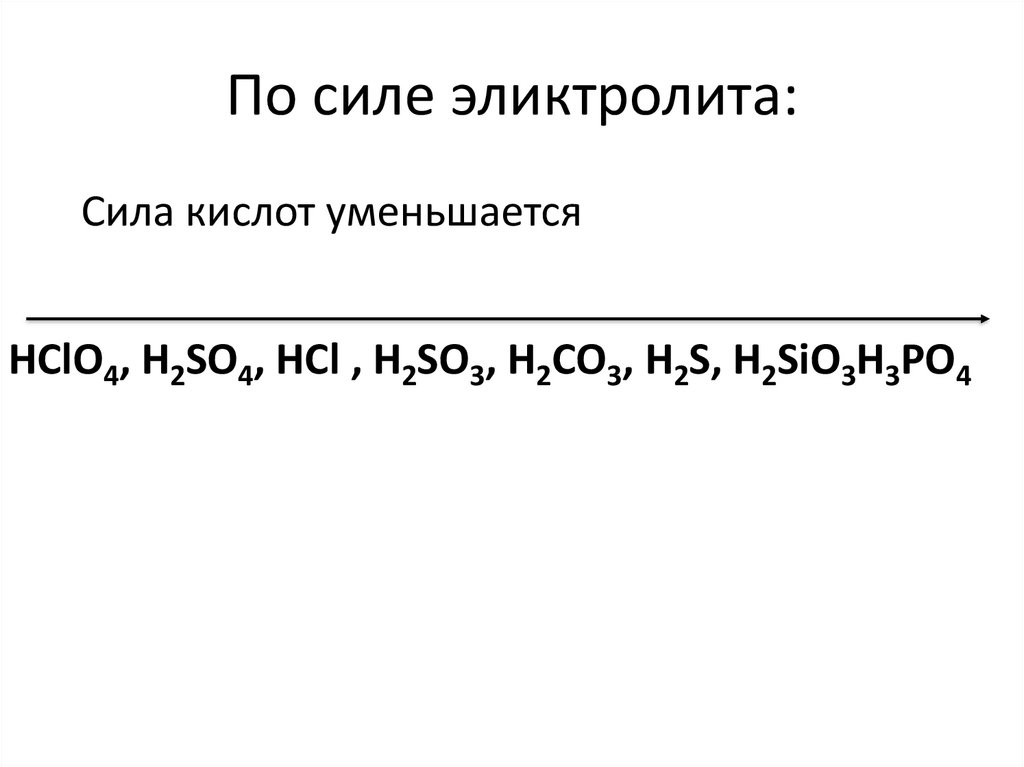
5. По силе эликтролита:
Сила кислот уменьшаетсяHClO4, H2SO4, HCl , H2SO3, H2СO3, H2S, H2SiO3H3PO4
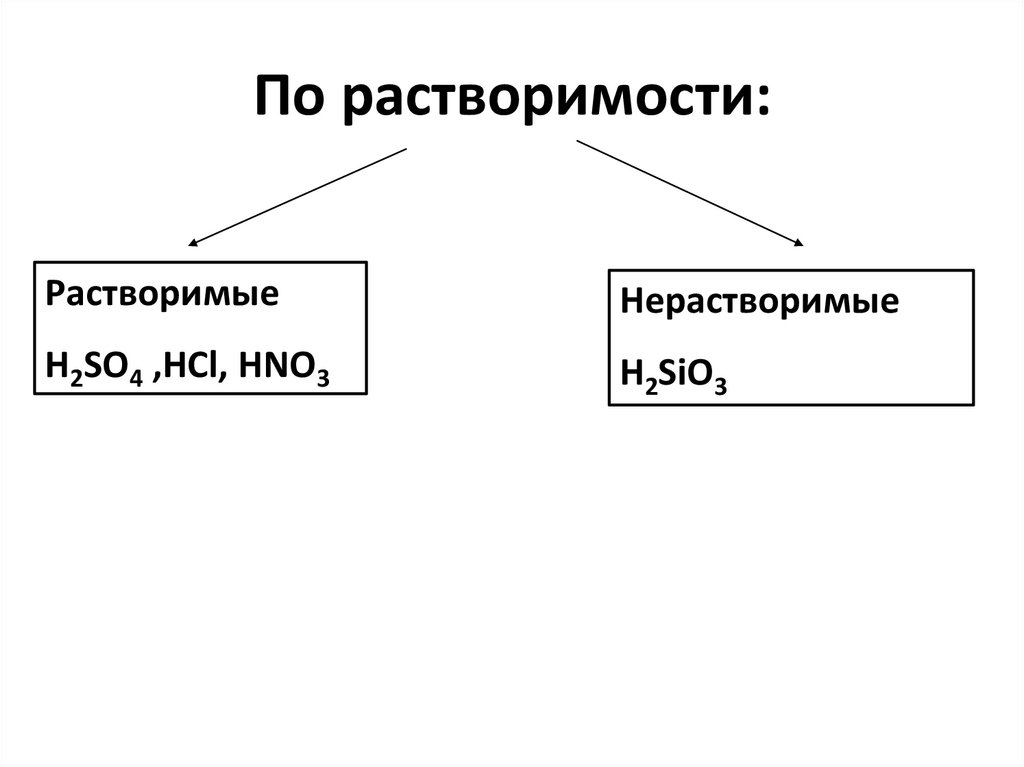
6. По растворимости:
РастворимыеНерастворимые
H2SO4 ,HCl, HNO3
H2SiO3
7. Правила техники безопасности при работе с кислотами
1. При разбавлении кислот водой следуеткислоту тонкой струйкой при
перемешивании наливать в воду, а не
наоборот.
2. Если случайно кислота попадет на руку или
на одежду, то немедленно смойте ее
большим количеством воды, а потом
обработайте место раствором
гидрокарбоната натрия (соды).
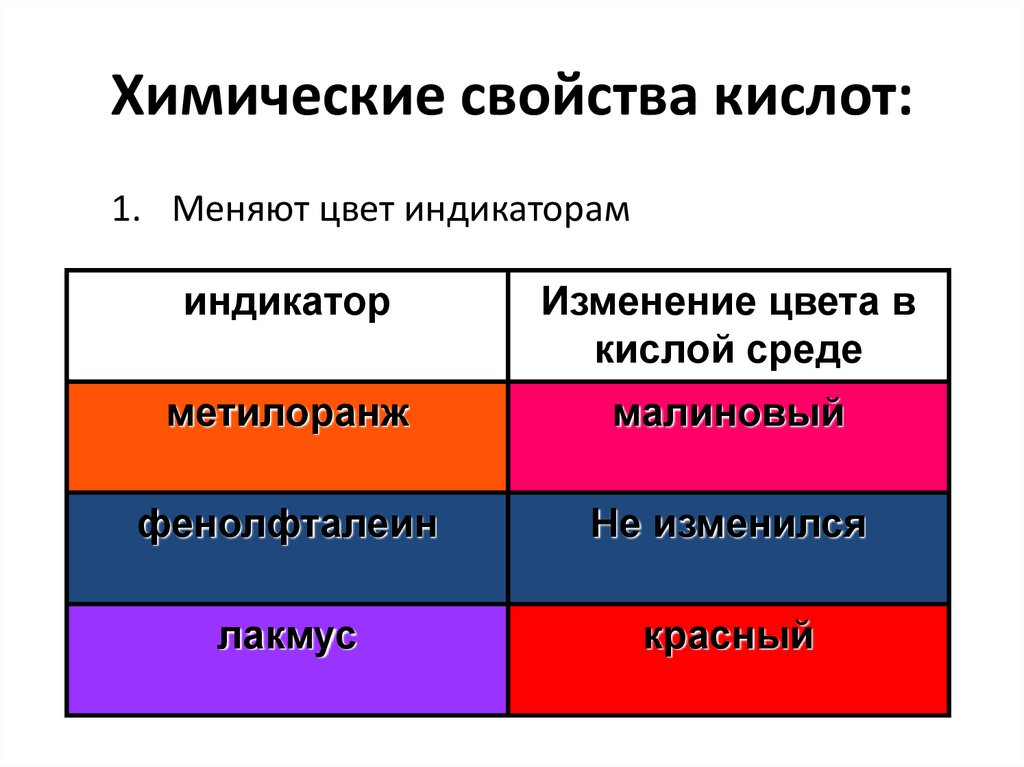
8. Химические свойства кислот:
1. Меняют цвет индикатораминдикатор
Изменение цвета в
кислой среде
метилоранж
малиновый
фенолфталеин
Не изменился
лакмус
красный
9. 2. Кислота + Металл→ соль + Н2
Три условия:• кислота растворимая (кроме HNO3)
• Ме стоит в ряду активности до водорода
• Получается растворимая соль
1) Cu + НСl —> не идет
2) Zn + 2 HCl —> ZnCI2 + H2 ↑
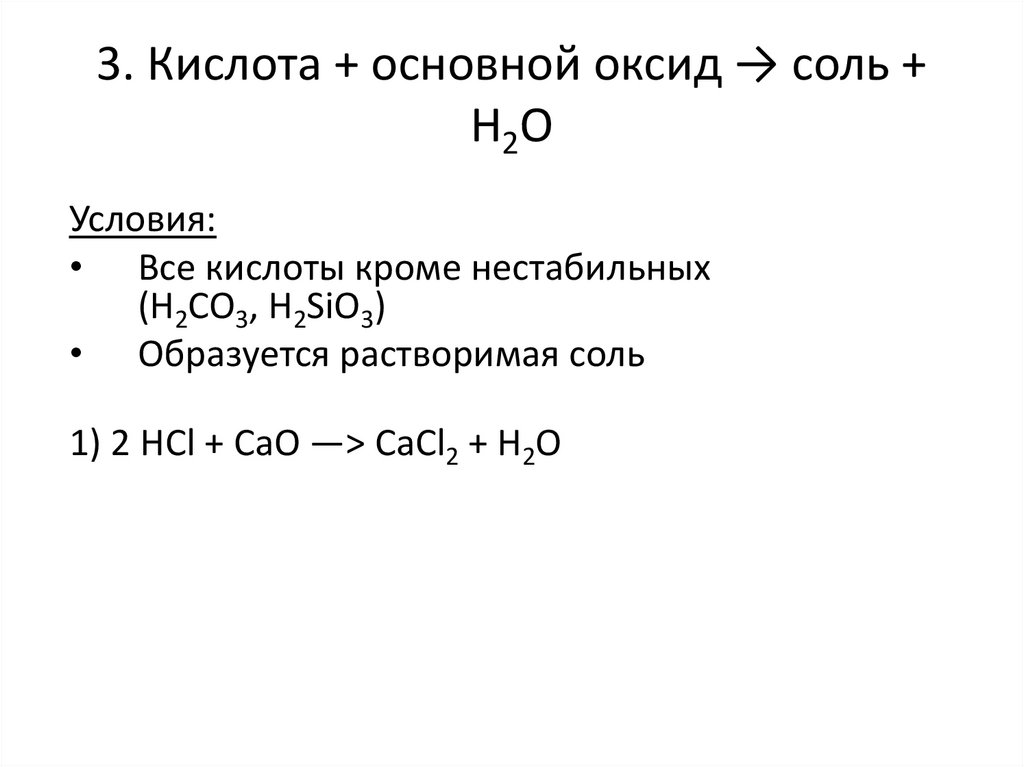
10. 3. Кислота + основной оксид → соль + Н2О
Условия:• Все кислоты кроме нестабильных
(H2CO3, H2SiO3)
• Образуется растворимая соль
1) 2 HCl + CaO —> CaCl2 + H2O
11. 4. Кислота + амфотерный оксид → соль + Н2О
Условия:• Все кислоты кроме нестабильных (H2CO3,
H2SiO3)
• Образуется растворимая соль
6 HCl + Al2O3 —> 2 AlCl3 + 3 H2O
12. 5. Кислота + основание → соль + Н2О (реакция нейтрализации)
1) H2SO4 + 2 KOH —> K2SO4 + 2 H2O2)
NaOH+HCl—>NaCl+H2O
13. 6. Кислота + соль → соль + кислота
Должно выполняться одно из двух условий:• Один из продуктов реакции – летучее
вещество (газ)
• Один из продуктов реакции выпадает в осадок
1) 2 HCl + CaCO3 —> CaCl2 + H2O + CO2↑
2) H2SO4 + BaCl2 —> BaSO4↓ + 2 HCl
14. 7. При нагревании некоторые кислоты разлагаются. Как правило, образуются кислотный оксид и вода.
Т1) H2SiO3 —> H2O + SiO2
T, свет
2) 4 HNO3
—> 2 H2O + 4 NO2↑ + O2 ↑
15. Способы получения кислот:
1. Кислотный оксид + Н2О → кислотаSO3 + H2O → H2SO4
2. Водород + НеМе → кислота
Н2 + Cl2 → 2 HCl
3. Кислота + соль → соль* + кислота*
t
2 NaCl + H2SO4 → Na2SO4 + 2 HCl↑










 Химия
Химия








