Похожие презентации:
Вакцино-профилактика у пациентов с рассеянным склерозом до начала и на фоне терапии
1.
Вакцинопрофилактика у пациентовс рассеянным склерозом до начала
и на фоне терапии ПИТРС
К.М.Н.
КОРОБКО Д.ЕНИС СЕРГЕЕВИЧ
ОБЛАСТНОЙ ЦЕНТР РС И ДРУГИХ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ НЕРВНОЙ СИСТЕМЫ ГБУЗ НСО ГНОКБ
НОВОСИБИРСК
Тула
16.10.2021
M-RU-00004809
Данная презентация подготовлена при финансовой поддержке Представительства Компании с ограниченной ответственностью ”Ф. Хоффманн Ля-Рош Лтд.”
Информация предназначена для медицинских работников, носит научный характер и не является рекламой
2.
https://coronavirus.jhu.edu/map.html (Доступ: 30.09.2021)3.
ИНФЕКЦИИ У ПАЦИЕНТОВ РСВ сравнении с общей
популяцией, пациенты с
рассеянным склерозом (РС)
имеют повышенный риск
развития инфекций,
склонность к более тяжелому
течения этих заболеваний,
большую летальность
Wijnands JM, Kingwell E, Zhu F, Zhao Y, Fisk JD, Evans C, Marrie RA, Tremlett H. Infection-related health care utilization among people with and without multiple sclerosis. Mult Scler. 2017 Oct;23(11):15061516. doi: 10.1177/1352458516681198.
4.
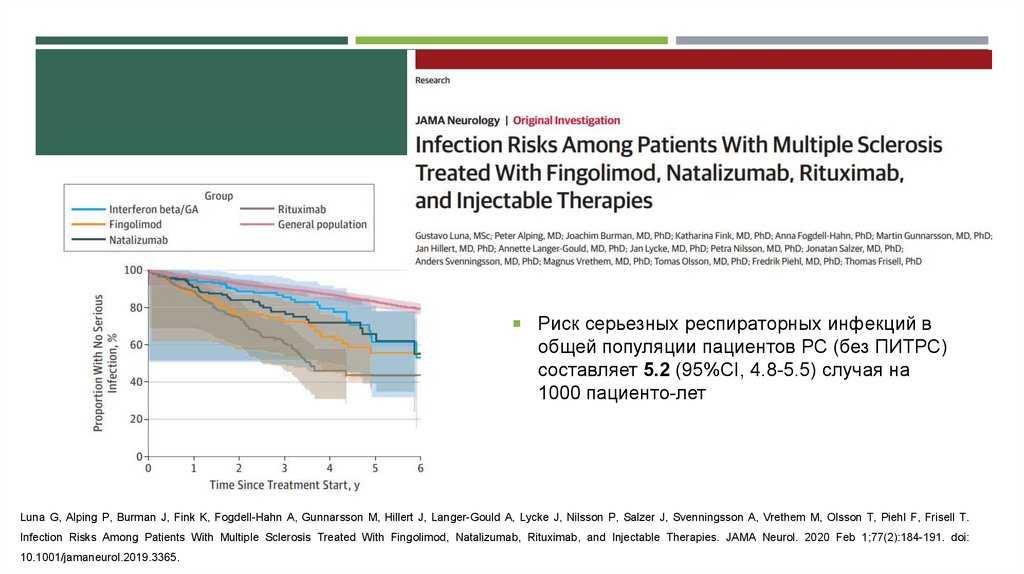
Риск серьезных респираторных инфекций вобщей популяции пациентов РС (без ПИТРС)
составляет 5.2 (95%CI, 4.8-5.5) случая на
1000 пациенто-лет
Luna G, Alping P, Burman J, Fink K, Fogdell-Hahn A, Gunnarsson M, Hillert J, Langer-Gould A, Lycke J, Nilsson P, Salzer J, Svenningsson A, Vrethem M, Olsson T, Piehl F, Frisell T.
Infection Risks Among Patients With Multiple Sclerosis Treated With Fingolimod, Natalizumab, Rituximab, and Injectable Therapies. JAMA Neurol. 2020 Feb 1;77(2):184-191. doi:
10.1001/jamaneurol.2019.3365.
5.
РИСКИ ИНФЕКЦИЙ ПРИ РСПопуляционное исследование общей когорты пациентов с РС в США и Великобритании:
риск инфекций повышен на 76% и 25% соответственно, разницу в рисках авторы объясняют более
частым использованием иммуносупрессивной терапии в США.
Респираторные инфекции также являются значительной причиной летальности на поздних
стадиях РС и составляют примерно 47,5% случаев, прочие инфекции составляют еще 9,5%, что в
сумме превышает половину случаев
Persson R, Lee S, Yood MU, Wagner M. et al. Incident cardiovascular disease in patients diagnosed with multiple sclerosis: A multi-database study. Mult
Scler Relat Disord. 2020 Jan;37:101423. doi: 10.1016/j.msard.2019.101423. Epub 2019 Oct 1. PMID: 32172996
Hirst C, Swingler R, Compston DA, Ben-Shlomo Y, Robertson NP. Survival and cause of death in multiple sclerosis: a prospective population-based study.
J Neurol Neurosurg Psychiatry. 2008 Sep;79(9):1016-21. doi: 10.1136/jnnp.2007.127332. Epub 2008 Feb 26. PMID: 18303108
6.
ФАКТОРЫ РИСКА РЕСПИРАТОРНЫХ ИНФЕКЦИЙ ПРИ РСналичие бульбарных нарушений, нарушений дыхания во сне, слабости дыхательной мускулатуры
[Tzelepis GE, McCool FD. Respiratory dysfunction in multiple sclerosis. Respir Med. 2015 Jun;109(6):671-9].
Нарушения дыхательной функции по данным инструментальных методов регистрируются уже у
пациентов с уровнем инвалидизации по EDSS 5,5 баллов
[Aiello M, Rampello A, Granella F, Maestrelli M et al. Cough efficacy is related to the disability status in patients with multiple sclerosis.
Respiration. 2008;76(3):311-6].
Существенно повышен риск бактериальных и вирусных пневмоний, в среднем риск развития
состояния повышен в 3,6 раза
[Vinogradova Y, Hippisley-Cox J, Coupland C. Identification of new risk factors for pneumonia: population-based case-control study. Br
J Gen Pract. 2009 Oct;59(567):e329-38].
7.
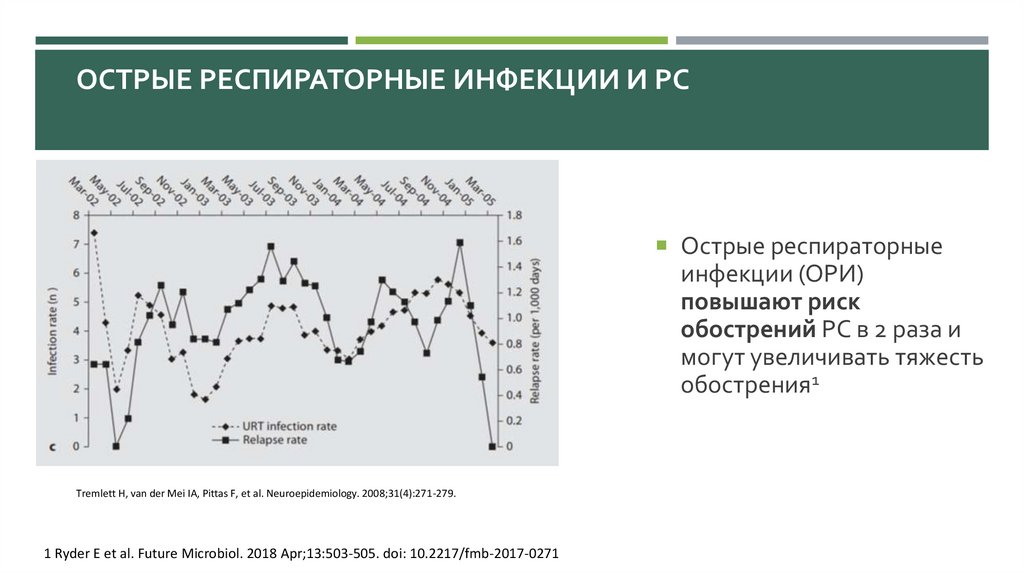
ОСТРЫЕ РЕСПИРАТОРНЫЕ ИНФЕКЦИИ И РСОстрые респираторные
инфекции (ОРИ)
повышают риск
обострений РС в 2 раза и
могут увеличивать тяжесть
обострения1
Tremlett H, van der Mei IA, Pittas F, et al. Neuroepidemiology. 2008;31(4):271-279.
1 Ryder E et al. Future Microbiol. 2018 Apr;13:503-505. doi: 10.2217/fmb-2017-0271
8.
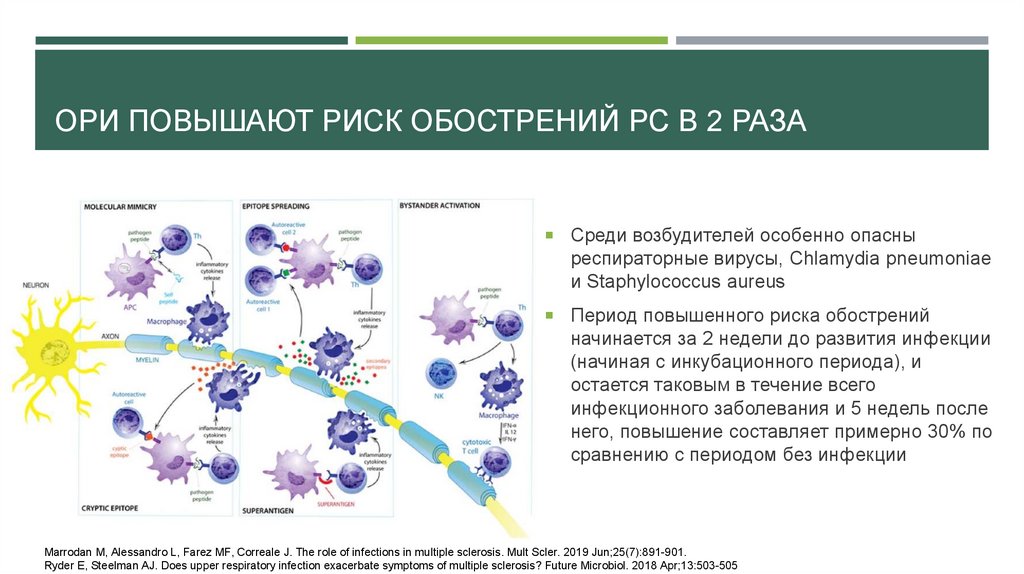
ОРИ ПОВЫШАЮТ РИСК ОБОСТРЕНИЙ РС В 2 РАЗАCреди возбудителей особенно опасны
респираторные вирусы, Chlamydia pneumoniae
и Staphylococcus aureus
Период повышенного риска обострений
начинается за 2 недели до развития инфекции
(начиная с инкубационного периода), и
остается таковым в течение всего
инфекционного заболевания и 5 недель после
него, повышение составляет примерно 30% по
сравнению с периодом без инфекции
Marrodan M, Alessandro L, Farez MF, Correale J. The role of infections in multiple sclerosis. Mult Scler. 2019 Jun;25(7):891-901.
Ryder E, Steelman AJ. Does upper respiratory infection exacerbate symptoms of multiple sclerosis? Future Microbiol. 2018 Apr;13:503-505
9.
ОБОСТРЕНИЕ, СВЯЗАННОЕ С ИНФЕКЦИОННЫМИ ТРИГГЕРАМИ, ПРИВОДИТ К БОЛЕЕДЛИТЕЛЬНОМУ И СЕРЬЕЗНОМУ КЛИНИЧЕСКОМУ УХУДШЕНИЮ, ЧЕМ СПОНТАННЫЕ
ОБОСТРЕНИЯ
Проспективное исследование ROSE
Rotterdam Study on Exacerbation
Июль 1997 – дек 1999 гг.
Среднегодовая частота обострений
2,05 vs 0,97 RR 2,1 (95% CI 1,4-3,0, p<0,0001
Buljevac D, Flach HZ, Hop WC, Hijdra D, Laman JD, Savelkoul HF, van Der Meché FG, van Doorn PA, Hintzen RQ. Prospective study on the relationship between infections and
multiple sclerosis exacerbations. Brain. 2002 May;125(Pt 5):952-60
10.
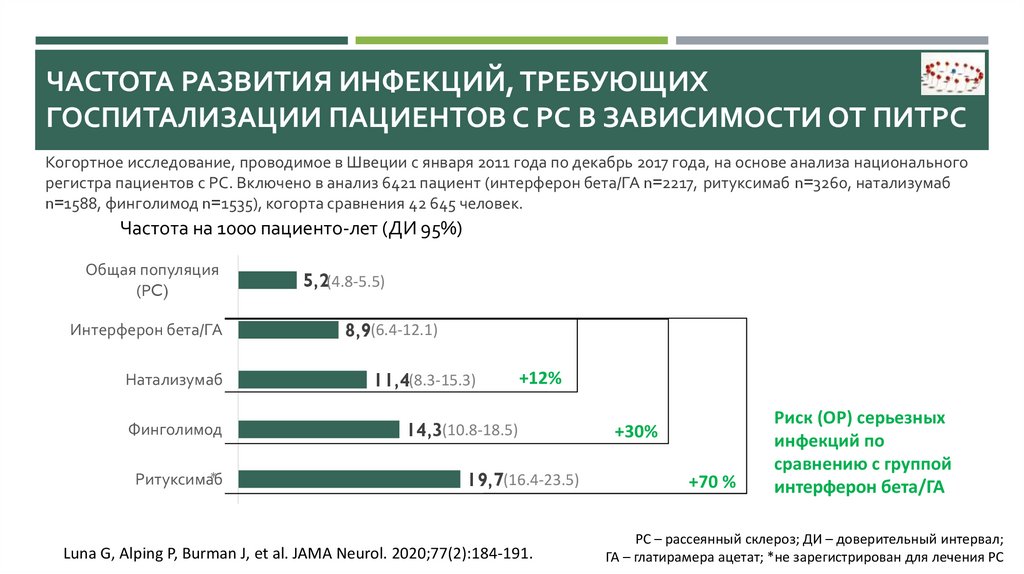
ЧАСТОТА РАЗВИТИЯ ИНФЕКЦИЙ, ТРЕБУЮЩИХГОСПИТАЛИЗАЦИИ ПАЦИЕНТОВ С РС В ЗАВИСИМОСТИ ОТ ПИТРС
Когортное исследование, проводимое в Швеции с января 2011 года по декабрь 2017 года, на основе анализа национального
регистра пациентов с РС. Включено в анализ 6421 пациент (интерферон бета/ГА n=2217, ритуксимаб n=3260, натализумаб
n=1588, финголимод n=1535), когорта сравнения 42 645 человек.
Частота на 1000 пациенто-лет (ДИ 95%)
Общая популяция
(РC)
Интерферон бета/ГА
Натализумаб
Финголимод
*
Ритуксимаб
5,2(4.8-5.5)
8,9(6.4-12.1)
11,4(8.3-15.3)
+12%
14,3(10.8-18.5)
19,7(16.4-23.5)
Luna G, Alping P, Burman J, et al. JAMA Neurol. 2020;77(2):184-191.
+30%
+70 %
Риск (ОР) серьезных
инфекций по
сравнению с группой
интерферон бета/ГА
РС – рассеянный склероз; ДИ – доверительный интервал;
ГА – глатирамера ацетат; *не зарегистрирован для лечения РС
11.
ДЕЙСТВУЮЩИЙ НАЦИОНАЛЬНЫЙ КАЛЕНДАРЬПРОФИЛАКТИЧЕСКИХ ПРИВИВОК
в Российской Федерации в редакции от 14 сентября 2020 года
предусматривает обязательную вакцинацию и вакцинацию по эпидемиологическим основаниям, при этом
спектр заболеваний и типов вакцин достаточно широк.
Важно учитывать, что во многих случаях приходится делать
выбор между рисками возникновения инфекции у пациента
и рисками дестабилизации состояния после вакцинации.
12.
ВАКЦИНАЦИЯ ПАЦИЕНТОВ С РС ВЫЗЫВАЕТ ОБЕСПОКОЕННОСТЬ ПО ПОВОДУ РАЗВИТИЯКЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ ОБОСТРЕНИЯ ЗАБОЛЕВАНИЯ И СНИЖЕННОЙ ЭФФЕКТИВНОСТИ
ВАКЦИН
• Сообщалось о том, что системные инфекции связаны с клиническими проявлениями обострения РС1–3
В отношении вакцинации пациентов с РС обеспокоенность вызывают как
минимум две основные проблемы:
Сообщалось о том, что вакцинации связаны с клиническими проявлениями
обострения РС (однако данный риск ниже по сравнению с системными
инфекциями)2–4
ПИТРС, обладающие иммуносупрессивным или иммуномодулирующим
эффектом, могут снизить эффективность ответа на вакцину ввиду
снижения способности организма пациента вырабатывать иммунный
ответ2
ПИТРС — препарат, изменяющий течение рассеянного склероза.
1. Bar-Or A, et al. Neurology 2020. doi: 10.1212/WNL.000000000001038; 2. Farez MF, et al. Neurology 2019;92:584–93; 3. Correale J, et al. Neurology 2006;67:652–659;
4. Geier DA, et al. Autoimmunity 2005;38:295–301.
13.
РИСКИ ОБОСТРЕНИЯ РСИспользование живых аттенуированных вакцин потенциально может приводить к появлению
активности по данным магнитно-резонансной томографии (МРТ) или клиническим обострениям
за счет избыточного иммунного ответа на множественные антигены возбудителя
[Сorreale J, Fiol M, Gilmore W. The risk of relapses in multiplesclerosis during systemic infections. Neurology. 2006;67(4):652–9.; Buljevac D, Flach HZ, Hop WC, Hijdra D,
Laman JD, SavelkoulHF, et al. Prospective study on the relationship between infectionsand multiple sclerosis exacerbations. Brain. 2002;125(Pt 5):952–60.].
Следует отметить, что имеющиеся данные по риску обострений после вакцинации основаны на
небольшом количестве случаев и не имеют четко доказанной причинно-следственной связи
[Loebermann M, Winkelmann A, Hartung HP, Hengel H, ReisingerEC, Zettl UK. Vaccination against infection in patients with multi-ple sclerosis. Nat Rev Neurol.
2011;8(3):143–51.].
Другим ограничением использования живых вакцин у пациентов с РС является потенциальный риск
развития самого инфекционного заболевания, а также риск появления осложнений вакцинации в связи с
особенностями иммунитета при РС
[Miauton, A., Tan, R., Pantazou, V. et al. Vaccine-associated measles in a patient treated with natalizumab: a case report. BMC Infect Dis 20, 753 (2020).
https://doi.org/10.1186/s12879-020-05475-9].
14.
ПРОТИВОПОКАЗАНИЯ К ВАКЦИНАЦИИ ЖИВЫМИ ВАКЦИНАМИЕсли пациент получает следующие ПИТРС
финголимод - в течение всего лечения и 3 месяцев после его окончания,
терифлуномид – в течение всего времени и 6 месяцев после его окончания,
Алемтузумаб – за 6 недель до начала терапии, в течение терапии и 6 месяцев после ее окончания
(критерием возможности вакцинации является уровень CD4+ клеток 200 кл/мкл,
Окрелизумаб – в течение всего времени и 6 месяцев после его окончания,
Кладрибин – за 4 недели до и до восстановления нормальных значений лейкоцитов и лимфоцитов.
Kappos L, Mehling M, Arroyo R, Izquierdo G, Selmaj K, Curovic-Perisic V, Keil A, Bijarnia M, Singh A, von Rosenstiel P. Randomized trial of vaccination in fingolimod-treated patients with multiple sclerosis. Neurology. 2015 Mar 3;84(9):872-9. doi:
10.1212/WNL.0000000000001302
Bar-Or A, Freedman MS, Kremenchutzky M, Menguy-Vacheron F, Bauer D, Jodl S, Truffinet P, Benamor M, Chambers S, O'Connor PW. Teriflunomide effect on immune response to influenza vaccine in patients with multiple sclerosis. Neurology. 2013 Aug 6;81(6):552-8.
doi: 10.1212/WNL.0b013e31829e6fbf
Meca-Lallana JE, Fernández-Prada M, García Vázquez E, Moreno Guillén S, Otero Romero S, Rus Hidalgo M, Villar Guimerans LM, Eichau Madueño S, Fernández Fernández Ó, Izquierdo Ayuso G, Álvarez Cermeño JC, Arnal García C, Arroyo González R, Brieva Ruiz L,
Calles Hernández C, García Merino A, González Platas M, Hernández Pérez MÁ, Moral Torres E, Olascoaga Urtaza J, Oliva-Nacarino P, Oreja-Guevara C, Ortiz Castillo R, Oterino A, Prieto González JM, Ramió-Torrentá L, Rodríguez-Antigüedad A, Saiz A, Tintoré M,
Montalbán Gairin X. Consensus statement on the use of alemtuzumab in daily clinical practice in Spain. Neurologia. 2020 Jan 25:S0213-4853(19)30146-X. English, Spanish. doi: 10.1016/j.nrl.2019.11.003
Bar-Or A, Calkwood JC, Chognot C, Evershed J, Fox EJ, Herman A, Manfrini M, McNamara J, Robertson DS, Stokmaier D, Wendt JK, Winthrop KL, Traboulsee A. Effect of ocrelizumab on vaccine responses in patients with multiple sclerosis: The VELOCE study.
Neurology. 2020 Oct 6;95(14):e1999-e2008. doi: 10.1212/WNL.0000000000010380.
Mateo-Casas M, Reyes S, De Trane S, Edwards F, Espasandin M, Anjorin G, Baker D, Schmierer K, Giovannoni G. Severe lymphopenia after subcutaneous cladribine in a patient with multiple sclerosis: To vaccinate or not? eNeurologicalSci. 2020 Oct 9;21:100279. doi:
10.1016/j.ensci.2020.100279.
15.
РАЗРЕШЁННЫЕ ВАКЦИНЫ ПРИ РСИнактивированные,
субъединичные,
конъюгированные вакцины,
а также вакцины на основе анатоксинов
считаются безопасными для применения у пациентов с РС, не приводят к увеличению обострений и
дестабилизации иммунологического статуса, не повышают риск поствакцинальных осложнений.
?? Эффективность иммунитета у пациентов, получивших вакцинацию.
В случае использования вакцин у наивных пациентов иммунный ответ не отличается от здоровой популяции,
в случае использования различных типов терапии ответ может отличаться.
Reyes S, Ramsay M, Ladhani S, Amirthalingam G, Singh N, Cores C, Mathews J, Lambourne J, Marta M, Turner B, Gnanapavan S, Dobson R, Schmierer K, Giovannoni G. Protecting people with multiple sclerosis
through vaccination. Pract Neurol. 2020 Dec;20(6):435-445. doi: 10.1136/practneurol-2020-002527.
Moriabadi NF, Niewiesk S, Kruse N, Jung S, Weissbrich B, ter Meulen V, Toyka KV, Rieckmann P. Influenza vaccination in MS: absence of T-cell response against white matter proteins. Neurology. 2001 Apr
10;56(7):938-43. doi: 10.1212/wnl.56.7.938
16.
ГРИППЕжегодная вакцинация против гриппа инактивированными вакцинами без дополнительных агентов
является важной для уменьшения рисков обострений.
В первую неделю после перенесенного гриппа вероятность экстренной госпитализации в связи с
обострением повышается в 3,4 раза (95% CI 2,4–4.8), при это риск выше в период гриппа А – 5.6 (95% CI
2.7–11.3) и несколько ниже в период гриппа В – 4.8 (95% CI 3.1–7.4).
Вакцинация живыми вакцинами не дает дополнительных эффектов, но существенно повышает риск
обострений.
Ghaderi S, Berg-Hansen P, Bakken IJ, Magnus P, Trogstad L, Håberg SE. Hospitalization following influenza infection and pandemic vaccination in multiple sclerosis patients: a nationwide population-based registry study from Norway. Eur J
Epidemiol. 2020 Apr;35(4):355-362. doi: 10.1007/s10654-019-00595-2. Epub 2019 Dec 23. PMID: 31873811; PMCID: PMC7222066.
Rutschmann OT, McCrory DC, Matchar DB, Immunization Panelof the Multiple Sclerosis Council for Clinical Practice Guidelines.Immunization and MS: a summary of published evidence and rec-ommendations. Neurology.
2002;59(12):1837–43
17.
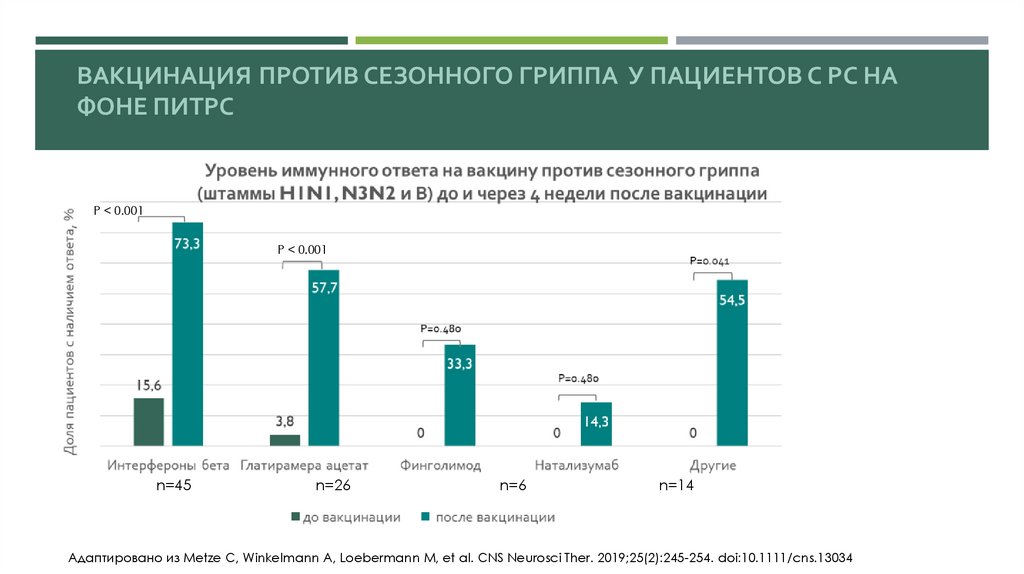
ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ГРИППАПрименение вакцины на фоне глатирамера ацетата демонстрировало сопоставимые
или несколько худшие результаты по сравнению с ИФН-бета
[Metze C., Winkelmann A., Loebermann M CNS Neurosci. Ther. 2019;25(2):245–254. doi: 10.1111/cns.13034.].
Терифлуномид незначительно снижает иммунный ответ на вакцину против гриппа –
77% в сравнении с 90% на интерферонах
[Bar-Or A., Freedman M.S., Kremenchutzky M. Neurology. 2013;81(6):552–558. doi: 10.1212/WNL.0b013e31829e6fbf.].
Диметилфумарат, вероятно, не влияет на иммунный ответ, однако, объем выборки в
исследовании был весьма ограничен
[Von Hehn C., Howard J., Liu S. Neurol. Neuroimmunol. NeuroInflammation. 2018;5(1) doi: 10.1212/NXI.0000000000000409.].
Эффективность вакцинации в группе финголимода была достоверно ниже чем в
группе контроля 71% против 94% в группе контроля
[Kappos L., Mehling M., Arroyo R. Neurology. 2015;84(9):872–879. doi: 10.1212/WNL.0000000000001302.],
сходные результаты были продемонстрированы и на сипонимоде
[Ufer M., Shakeri-Nejad K., Gardin A Neurol. Neuroimmunol. neuroinflammation. 2017;4(6):e398. doi: 10.1212/NXI.0000000000000398.].
18.
ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ГРИППАНесмотря на кажущееся противоречие с механизмом действия, низкий ответ на вакцинацию был выявлен
на терапии натализумабом – 58% против 89% в контроле
[Metze C., Winkelmann A., Loebermann M. Immunogenicity and predictors of response to a single dose trivalent seasonal influenza vaccine in multiple sclerosis patients receiving disease-modifying therapies. CNS Neurosci. Ther.
2019;25(2):245–254. doi: 10.1111/cns.13034.; Olberg H.K., Eide G.E., Cox R.J. Antibody response to seasonal influenza vaccination in patients with multiple sclerosis receiving immunomodulatory therapy. Eur J Neurol.
2018;25(3):527–534. doi: 10.1111/ene.13537.].
Использование окрелизумаба достоверно умеренно снижает иммунный ответ на вакцинацию от гриппа, в
контрольной группе - 97%, в группе окрелизумаба – 71%
[Bar-Or A, Calkwood JC, Chognot C, Evershed J, Fox EJ, Herman A, Manfrini M, McNamara J, Robertson DS, Stokmaier D, Wendt JK, Winthrop KL, Traboulsee A. Effect of ocrelizumab on
vaccine responses in patients with multiple sclerosis: The VELOCE study. Neurology. 2020 Oct 6;95(14):e1999-e2008. doi: 10.1212/WNL.0000000000010380.].
Самая низкая доля пациентов, имеющих высокие титры антител к вирусу гриппа после вакцинации,
закономерно был получен на терапии алемтузумабом – 22% против 88% в контроле, при этом эффект
сохранялся достаточно долго, вероятно до 5 лет после последнего введения
[Cooles FA, Anderson AE, Drayton T, Harry RA, Diboll J, Munro L, Thalayasingham N, Östör AJ, Isaacs JD. Immune reconstitution 20 years after treatment with alemtuzumab in a rheumatoid arthritis cohort:
implications for lymphocyte depleting therapies. Arthritis Res Ther. 2016 Dec 20;18(1):302. doi: 10.1186/s13075-016-1188-6.]
,
19.
ВАКЦИНАЦИЯ ПРОТИВ СЕЗОННОГО ГРИППА У ПАЦИЕНТОВ С РС НАФОНЕ ПИТРС
P < 0.001
P < 0.001
n=45
n=26
n=6
n=14
Адаптировано из Metze C, Winkelmann A, Loebermann M, et al. CNS Neurosci Ther. 2019;25(2):245-254. doi:10.1111/cns.13034
20.
Сохранение определенных стадий В-клеточной линии дифференцировкипредполагает поддержание гуморального иммунитета во время лечения
окрелизумабом
Восстановление B-клеток
сохранено1–3
Длительная иммунная
память сохранена1,2,4
v
Стволова Проя
Вклетка клетка
Зрелая
Пре- Незрелаяактивированна
ВВ- В-клетка
клетка
я
клетка
памяти
В-клетка
CD20
Изображения адаптированы по материалам работы: Krumbholz M, et al. Nat Rev Neurol 2012;8:613–23.
1. Hauser S.L. Mult Scler 2015; 21:8(21):2. Pescovitz MD. Am J Transplant 2006;6:859–66; 3. Leandro MJ, et al. Arthritis Rheum 2006;54:613–20;
4. DiLillo DJ, et al. J Immunol 2008;180:361–71.
Плазмо Короткоживуща Долгоживущая
я
плазматическа
бласт
плазматическая
клетка
я клетка
21.
Лечение окрелизумабом не оказывает влияния на ужесуществующий гуморальный иммунитет
ИФН β-1a 44 мкг (n=826)
Пациенты (%) с положительным
титром антител (Ат+), %
Окрелизумаб 600 мг (n = 825)
Этап
включения
В течение периода лечения (нед.
12—96)
Этап
включения
В течение периода лечения (нед.
12—96)
Вирус эпидемического паротита
94,1
Диапазон: 92,7—94,8
93,6
Диапазон: 91,8—93,5
Вирус краснухи
87,9
Диапазон: 89,8—90,8
89,0
Диапазон: 88,7—89,4
Вирус ветряной оспы
95,5
Диапазон: 96,2—97,5
95,5
Диапазон: 94,8–95,6
Средние (СО) уровни Ат, мг/л
Этап
включения
Изменение с исходного уровня до
нед. 96
Этап
включения
Изменение с исходного уровня до
нед. 96
Капсульный полисахарид S.
pneumoniae
53,67
(54,13)
–1,13
(40,25)
55,35
(67,00)
–1,99
(59,6)
Вероятно, окрелизумаб не оказывал влияния на титры антител к этим антигенам во время
контролируемых периодов лечения в исследовании OPERA, что позволяет сделать предположение
об отсутствии влияния окрелизумаба на уже существующий гуморальный иммунитет.
Ат - антитело; Ат+ - образец, содержащий антитела; ИФН β-1a - интерферон бета-1a; СО - стандартное отклонение; S. pneumoniae - Streptococcus pneumoniae; нед. - неделя.
OCREVUS® [EU SmPC]. https://www.ema.europa.eu/en/documents/product-information/ocrevus-epar-product-information_en.pdf. Дата просмотра: январь 2020 г.;
Bar-Or A et al. Представлено на CMSC 2016 (стендовый доклад DX12); Bar-Or A, et al. Neurology 2020. doi: 10.1212/WNL.000000000001038 (доп. данные).
22.
ДИФТЕРИЯ И СТОЛБНЯК. ПОЛИОМИЕЛИТВакцинация от дифтерии и столбняка согласно Национальному календарю проводится детям в 14 лет
(вместе с коклюшем), затем каждые 10 лет; имеющиеся вакцины не является живыми и не связаны с
риском обострений у пациентов.
Третья ревакцинация от полиомиелита также проводится в 14 лет, несмотря на то, что не было выявлено
связи вакцинации с активностью РС, она должна проводиться с учетом получаемой терапии, так как
вакцина является живой.
Mailand MT, Frederiksen JL. Vaccines and multiple sclerosis: a systematic review. J Neurol. 2017 Jun;264(6):1035-1050. doi: 10.1007/s00415-016-8263-4. Epub 2016 Sep 7. PMID: 27604618.
https://grls.rosminzdrav.ru (доступ 28.03.2021)
23.
КОРЬ. КРАСНУХАВакцинация от краснухи проводится девочкам и женщинам до 25 лет, не болевшим, привитым однократно
и не привитым ранее; от кори - детям и взрослым до 35 лет, не болевшим, привитым однократно и не
привитым ранее, а также взрослым до 55 лет из групп риска.
На настоящее время нет данных о повышении риска обострений после проведения вакцинации
В Российской Федерации зарегистрированы комбинированные вакцины (корь, эпидемический паротит,
краснуха), а также вакцина от краснухи и от кори, все они являются живыми.
Вакцинация против краснухи может быть рекомендована женщинам с РС, планирующим
беременность, против кори – всем пациентам, планирующим в среднесрочной перспективе получать
иммуносупрессивную терапию (анти-CD20, анти-CD52, кладрибин).
Reyes S, Ramsay M, Ladhani S, Amirthalingam G, Singh N, Cores C, Mathews J, Lambourne J, Marta M, Turner B, Gnanapavan S, Dobson R, Schmierer K, Giovannoni G. Protecting people
with multiple sclerosis through vaccination. Pract Neurol. 2020 Dec;20(6):435-445. doi: 10.1136/practneurol-2020-002527
24.
Вакцинация от туляремии, чумы, бруцеллеза, сибирской язвы, брюшного тифа, лептоспироза,холеры, менингококковой инфекции проводится лицам, проживающим на эндемичных территориях и
работающим в особых условиях потенциального контакта с возбудителями.
В Российской Федерации туляремийная, чумная, сибиреязвенная и холерная вакцины представлены только
в живой форме, поэтому решение принимается строго индивидуально, исходя из соотношения польза/риск.
Имеются отрицательные данные о связи вакцинации от холеры и тифа с дебютом РС.
Противобруцеллезная, тифозная, лептоспирозная и менингококковые вакцины имеются в инактированном
виде и могут быть рекомендованы к применению на общих основаниях, так как в имеющейся литературе
нет сведений, подтверждающих риск развития обострения на фоне их использования.
Mailand MT, Frederiksen JL. Vaccines and multiple sclerosis: a systematic review. J Neurol. 2017 Jun;264(6):1035-1050. doi: 10.1007/s00415-016-8263-4. Epub 2016 Sep 7. PMID: 27604618
https://grls.rosminzdrav.ru (доступ 28.03.2021)
25.
КЛЕЩЕВОЙ ЭНЦЕФАЛИТВакцинация от клещевого энцефалита проводится согласно Национальному
календарю по показаниям лицам, проживающим на эндемичных территориях,
выезжающим на такие территории и работающим в особых условиях
потенциального контакта с возбудителями.
Имеющиеся данные применении вакцины клещевого энцефалита в популяции пациентов с РС показывают
отсутствие влияния на течение основного заболевания .
Baumhackl U, Franta C, Retzl J, Salomonowitz E, Eder G. A controlled trial of tick-borne encephalitis vaccination in patients with multiple sclerosis. Vaccine. 2003 Apr 1;21 Suppl 1:S56-61. doi: 10.1016/s0264-410x(02)00815-0.; Winkelmann A, Metze C,
Frimmel S, Reisinger EC, Zettl UK, Loebermann M. Tick-borne encephalitis vaccination in multiple sclerosis: A prospective, multicenter study. Neurol Neuroimmunol Neuroinflamm. 2020 Jan 9;7(2):e664. doi: 10.1212/NXI.0000000000000664
26.
ПРОТИВОПОКАЗАНОВакцинопрофилактика желтой лихорадки проводится лицам,
выезжающим на эндемичные территории,
вероятно, это единственная вакцина, в отношении которой получены данные об увеличении риска обострений
на фоне ее использования – относительный риск при этом составляет 12,78 (4,28-38,13)
[Farez MF, Correale J. Yellow fever vaccination and increased relapse rate in travelers with multiple sclerosis. Arch Neurol. 2011 Oct;68(10):1267-71. doi:
10.1001/archneurol.2011.131.].
27.
БЕШЕНСТВОДля лиц, работающих в особых условиях потенциального контакта с возбудителями бешенства,
проводится вакцинация инактивированной антирабической вакциной,
данных о влиянии на течение РС по этой вакцине нет
[Mailand MT, Frederiksen JL. J Neurol. 2017 Jun;264(6):1035-1050. doi: 10.1007/s00415-016-8263-4. Epub 2016 Sep 7.],
однако, имеются сведения об отсутствии повышения риска развития РС у вакцинированных
[Bansil S et al., 1997] и достаточном иммунном ответе, даже на терапии терифлуномидом [Bar-Or A, et al., 2015].
28.
ГЕПАТИТ ВВакцинация от гепатита В связана с повышенным риском развития РС в дальнейшем, при этом одном из
исследований было показано повышение риска в когорте, не имевшей рисков заражения гепатитом В до
вакцинации
[Mikaeloff Y et al (2009) Hepatitis B vaccine and the risk of CNSinflammatory demyelination in childhood. Neurology72(10):873–880.].
Согласно данным последних исследований вакцинация от гепатита В не приводит к повышению риска
развития обострений [Langer-Gould A. et al. 2014; Martínez-Sernández V, et al. 2013.].
При активном вирусном гепатите В существенно ограничения выбора ПИТРС (интерфероны бета и
глатирамера ацетат, натализумаб).
Помимо этого, развитие гепатита В у пациента с РС сопровождается высоким риском развития осложнений
и худшим прогнозом по сравнению с общей популяцией, что, вероятно, связано с высоким уровнем
интерлейкина-17 и остеопонтина
[Mormile R. Hepatitis B, virus (HBV) infection and multiple scle-rosis: one more reason to undergo vaccination? Immunol Lett.2015;165(1):60–1.].
Вакцинация от вирусного гепатита В внесена в обязательную часть Национального календаря для
детей и взрослых до 55 лет не привитых ранее, вакцина является рекомбинантной и может быть
использована для пациентов с РС.
29.
ВЕТРЯНАЯ ОСПАНаличие низкого титра или полное отсутствие антител к вирусу ветряной оспы – ограничение
к использованию препаратов второй линии (финголимод, окрелизумаб) и индукционной терапии
(кладрибин, алемтузумаб) согласно имеющимся инструкциям.
VZV (Вирус ветряной оспы) является высококонтагиозным, при этом вероятность развития
осложнений при первичном инфицировании у взрослых в 25 раз выше, чем у детей.
Чаще всего в виде осложнений выступают пневмонит (5-14%), а также энцефалит, протекающий
в форме церебеллита и подострый васкулит сосудов мозга.
Согласно популяционным исследованиям летальность во взрослом возрасте составляет 9,22 на
100 000 случаев.
Centers for Disease Control (CDC). Varicella-zoster immune globulin for the prevention of chickenpox. MMWR Morb Mortal Wkly Rep. 1984 Feb 24;33(7):84-90, 95-100
Nathwani D, Maclean A, Conway S, Carrington D. J Infect 1998 Jan;36(Suppl. 1):59e71.;
Tarlow MJ, Walters S. J Infect 1998 Jan;36(Suppl. 1):39e47
Rawson H, Crampin A, Noah N. Deaths from chickenpox in England and Wales 1995-7: analysis of routine mortality data. BMJ. 2001 Nov 10;323(7321):1091-3. doi: 10.1136/bmj.323.7321.1091
30.
ВАКЦИНАЦИЯ ОТ ВЕТРЯНОЙ ОСПЫснижение риска первичного инфицирования,
уменьшаение частоты реактивации опоясывающего лишая более чем в 4 раза,
эффективность вакцинации живой вакциной составляет 84,8% (95%CI, 75,3-90,7%),
рекомбинантной - 85,5% (95%CI, 84,6-87,3%)
[Sun Y, Kim E, Kong CL, Arnold BF, Porco TC, Acharya NR. Effectiveness of the recombinant zoster vaccine in adults aged 50 and older in the United States: a claims-based cohort study. Clin
Infect Dis. 2021 Feb 13:ciab121. doi: 10.1093/cid/ciab121.].
31.
ВЕТРЯНАЯ ОСПАВакцинация согласно Национальному календарю проводится детям и взрослым
из групп риска, ранее не привитым и не болевшим ветряной оспой.
Существенной проблемой является отсутствие зарегистрированной в
Российской Федерации инактивированной вакцины, все вакцины от ветряной
оспы являются живыми ослабленными, поэтому должны проводиться до начала
терапии иммуносупрессантами (за 4-6 недель).
На данный момент нет данных о том, что вакцина повышает риск обострений,
не ухудшает течение прогрессирующего РС.
https://grls.rosminzdrav.ru (доступ 28.03.2021)
Ross R, Dawood M, Cheang M, Nicolle LE. Antibody response in seropositive multiple sclerosis patients vaccinated with attenuated live varicella zoster virus. Can J Infect Dis. 1996 Sep;7(5):303-6. doi: 10.1155/1996/417061
Mailand MT, Frederiksen JL. Vaccines and multiple sclerosis: a systematic review. J Neurol. 2017 Jun;264(6):1035-1050. doi: 10.1007/s00415-016-8263-4. Epub 2016 Sep 7. PMID: 27604618
32.
ВЫВОДЫПоскольку препараты первой линии менее требовательны к наличию
иммунитета возможно проведение вакцинации уже после начала терапии
эскалации.
В случае необходимости вакцинации на фоне использования второй и третьей
линий, а также препаратов индукционной терапии, необходима индивидуальная
оценка рисков и выбор времени проведения.
В любом случае необходимо избегать живых аттенуированных вакцин при
разработке плана вакцинации.
33.
Потенциальные риски COVID-19 для пациентов с РСОбострение РС (как и в случае любой
инфекции) независимо от терапии
ПИТРС
Риски, связанные с пациентами:
возраст ≥65 лет - до 14% людей с РС
коморбидность
Риски, связанные с ПИТРС
(иммуносупрессия, лейкопения,
лимфопения, повышенный риск развития
вирусных инфекций)
Berger JR, Brandstadter R, Bar-Or A. Neurol Neuroimmunol Neuroinflamm. 2020;7(4):e761.
34.
Иммунный ответ на первичную инфекцию SARS-CoV-21-я стадия: Немедленный врожденный иммунный
1
ответ
В основном
не подвержен действию средств на основе антител к
CD202
Помогает большинству людей с ранним ответом на ИФН побороть SARS-CoV-23
2-я стадия: Быстрый приобретенный Т-клеточный
ответ
Подвержен незначительному действию средств на основе антител к
Макрофаг
NK- клетка Моноцит
T-клетка Нейтрофил
T- клетка
T- клетка
CD204
T- клетка
Фенотипы Т-клеток памяти, специфические для SARS-CoV, могут быть
долгоживущими (10+ лет)5
3-я стадия: Более медленный приобретенный Bклеточный
гуморальный
Снижен под действием
средств наответ
основе антител к CD20
B-клетки памяти, специфические для SARS-CoV, обеспечивают
низкий ответ, а гуморальный ответ является непродолжительным6
ИФН - интерферон; SARS-CoV-2 - коронавирус тяжелого острого респираторного синдрома-2.
1. Scully E et al. Nat Rev Immunol 2020;20:442–7; 2. Неопубликованные данные компании Roche; 3. Channappanavar R, Perlman S. Semin Immunopathology 2017;39;529–39;
4. Vermersch P, et al. Представлено на ECTRIMS 2017 (стендовый доклад P668); 5. Le Bert N, et al. Nature 2020. doi: 10.1038/s41586-020-2550-z; 6. Tang F et al. J Immunol 2011;186:7264–8.
В-клетка
Антитело
35.
ФАКТОРЫ РИСКА ТЯЖЕЛОГО ТЕЧЕНИЯ COVID-19Итальянское ретроспективное исследование Musc-19
Мультивариантный анализ, n=279*
OR (95% C.I.)
p
Возраст
1.05 (1.02-1.08)
0.002
Пол (женщины vs мужчины)
0.76 (0.42-1.35)
0.35
Тип течения РС (ПРС vs РРС)
1.10 (0.38-3.18)
0.86
EDSS
1.16 (0.95-1.43)
0.15
Длительность болезни
1.00 (0.96-1.03)
0.65
ИМТ
0.98 (0.93-1.04)
0.51
Сопутствующая патология
0.93 (0.58-1.47)
0.74
Метилпреднизолон в течение 1 мес до симптомов
4.55 (1.11-18.53)
0.035
* Только подтвержденные случаи
Sormani MP, et al.; Musc-19 study group. Disease modifying therapies and Covid-19 severity in Multiple Sclerosis. Ann Neurol. 2021 Jan 21. doi:
10.1002/ana.26028. Epub ahead of print. PMID: 33480077
36.
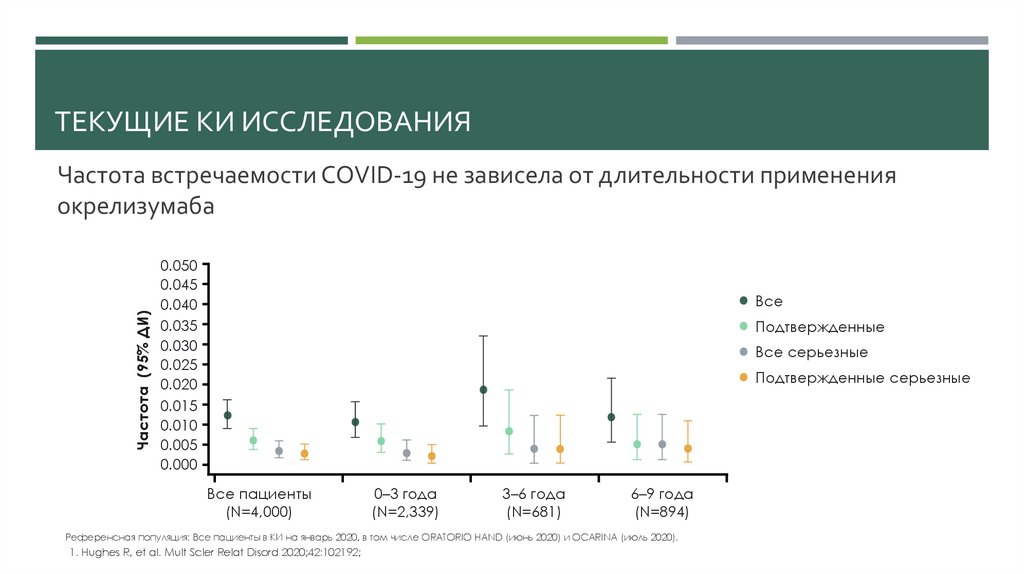
ТЕКУЩИЕ КИ ИССЛЕДОВАНИЯЧастота (95% ДИ)
Частота встречаемости COVID-19 не зависела от длительности применения
окрелизумаба
0.050
0.045
0.040
0.035
0.030
0.025
0.020
0.015
0.010
0.005
0.000
Все
Подтвержденные
Все серьезные
Подтвержденные серьезные
Все пациенты
(N=4,000)
0–3 года
(N=2,339)
3–6 года
(N=681)
6–9 года
(N=894)
Референсная популяция: Все пациенты в КИ на январь 2020, в том числе ORATORIO HAND (июнь 2020) и OCARINA (июль 2020).
1. Hughes R, et al. Mult Scler Relat Disord 2020;42:102192;
37.
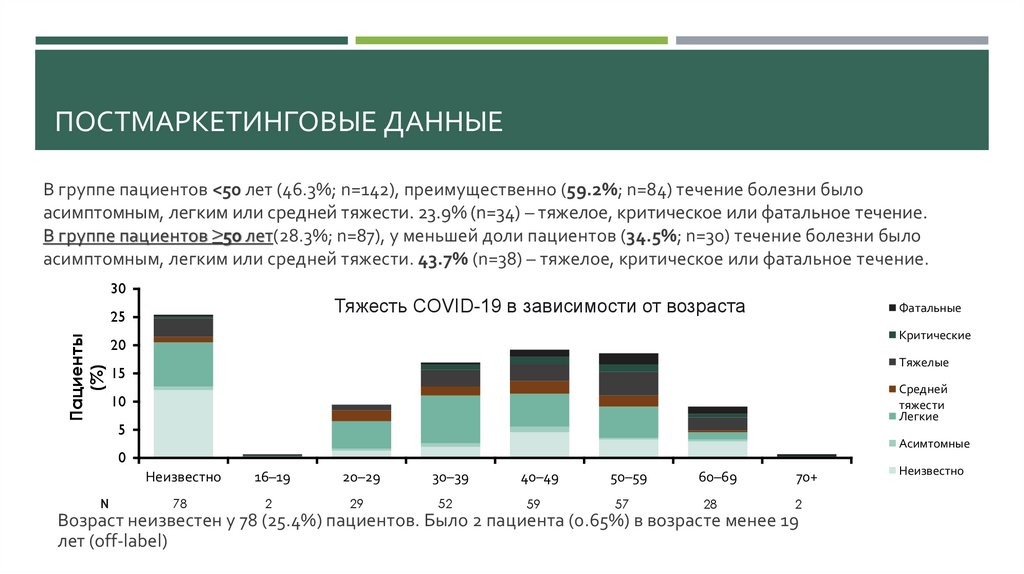
ПОСТМАРКЕТИНГОВЫЕ ДАННЫЕВ группе пациентов <50 лет (46.3%; n=142), преимущественно (59.2%; n=84) течение болезни было
асимптомным, легким или средней тяжести. 23.9% (n=34) – тяжелое, критическое или фатальное течение.
В группе пациентов ≥50 лет(28.3%; n=87), у меньшей доли пациентов (34.5%; n=30) течение болезни было
асимптомным, легким или средней тяжести. 43.7% (n=38) – тяжелое, критическое или фатальное течение.
30
COVID-19
severity
by age от возраста
Тяжесть
COVID-19
в зависимости
Пациенты
(%)
25
Фатальные
Критические
20
Тяжелые
15
Средней
тяжести
Легкие
10
5
Асимтомные
0
N
Неизвестно
16–19
20–29
30–39
40–49
50–59
60–69
70+
78
2
29
52
59
57
28
2
Возраст неизвестен у 78 (25.4%) пациентов. Было 2 пациента (0.65%) в возрасте менее 19
лет (off-label)
Неизвестно
38.
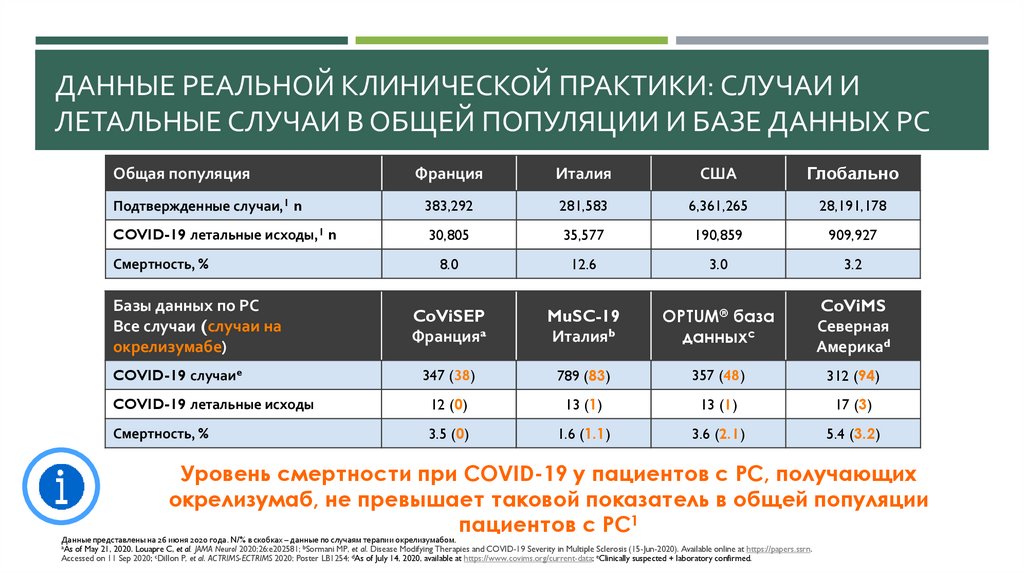
ДАННЫЕ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ: СЛУЧАИ ИЛЕТАЛЬНЫЕ СЛУЧАИ В ОБЩЕЙ ПОПУЛЯЦИИ И БАЗЕ ДАННЫХ РС
Общая популяция
Франция
Италия
США
Глобально
Подтвержденные случаи,1 n
383,292
281,583
6,361,265
28,191,178
COVID-19 летальные исходы,1 n
30,805
35,577
190,859
909,927
8.0
12.6
3.0
3.2
CoViSEP
Францияa
MuSC-19
Италияb
OPTUM® база
данныхc
CoViMS
Северная
Америкаd
COVID-19 случаиe
347 (38)
789 (83)
357 (48)
312 (94)
COVID-19 летальные исходы
12 (0)
13 (1)
13 (1)
17 (3)
Смертность, %
3.5 (0)
1.6 (1.1)
3.6 (2.1)
5.4 (3.2)
Смертность, %
Базы данных по РС
Все случаи (случаи на
окрелизумабе)
Уровень смертности при COVID-19 у пациентов с РС, получающих
окрелизумаб, не превышает таковой показатель в общей популяции
1
пациентов
с
РС
Данные представлены на 26 июня 2020 года. N/% в скобках – данные по случаям терапии окрелизумабом.
aAs of May 21, 2020. Louapre C, et al. JAMA Neurol 2020;26:e202581; bSormani MP, et al. Disease Modifying Therapies and COVID-19 Severity in Multiple Sclerosis (15-Jun-2020). Available online at https://papers.ssrn.
Accessed on 11 Sep 2020; cDillon P, et al. ACTRIMS-ECTRIMS 2020; Poster LB1254; dAs of July 14, 2020, available at https://www.covims.org/current-data; eClinically suspected + laboratory confirmed.
39.
ПАЦИЕНТЫ С ЛАБОРАТОРНО ПОДТВЕРЖДЁННЫМ COVID ДЕМОНСТРИРОВАЛИОТВЕТ АНТИТЕЛ НА SARS-COV-2, НО У ОКР+ ПАЦИЕНТОВ ЭТОТ ОТВЕТ БЫЛ
ОСЛАБЛЕН
Тест нейтрализующих антител с
Доля положительного результата в тесте на антитела
в группе лабораторно подтверждённого COVID-19
Количественное
определение
антител
ОКР+, % (n)
ОКР-, % (n)
p
Elecsys® (n=55)a
58% (11/19)
97% (35/36)
0,0004
использованием живого вируса SARS-CoV-2
Медианное значение
*
10000
1000
89% (16/18)
Нейтрализующие
Ат (n=35)
62% (10/16)
97% (33/34)
0,27
IC50
Тест NYU на
основе
мультиплексного
количественного
определения с
использованием
микросфер
(n=52)b
84% (13/19)
100
0,74
• Мультиплексный тест NYU обнаружил антитела почти у всех
пациентов, включая OCR+ пациентов, но уровень IgG антител к
спайковому белку был значительно ниже в группе ОКР+, чем в
группе ОКР- (p=0,02, t-критерий Фишера)
• Медиана IC50 нейтрализующих антител была значительно ниже в
группе ОКР, чем в группе ОКР- (p= 0,02 по критерию Манна Уитни)
10
0
Covid+ ОКР+
Covid+ ОКР−
Kister I et al., Preliminary Results of Ongoing, Prospective Study of Antibody and T-Cell Responses to SARS-CoV-2 in Patients With MS on Ocrelizumab or Other Disease-Modifying Therapies.
Представлено на 73м собрании Американской академии неврологии (ANN), виртуальный форум 2021 г.; 17-22 апреля2021 г. Презентация № P15.014
*p=0,02; аРезультат в тесте Elecsys® считался положительным, если образец был положительным либо на N-, либо на S- антитела по методу Roche DIA, или положительным на оба спайковых белка RBD; bРезультат в мультиплексном
тесте NYU считался положительным, если образец был положительным на IgG антитела к спайку; пороговое значение для этих тестов определялось по образцам, собранным до пандемии (среднее +3СО). Ат - антитело; ОКР окрелизумаб; RBD - домен связывания рецептора; SARS-CoV-2 - коронавирус 2 тяжёлого острого респираторного синдрома.
39
40.
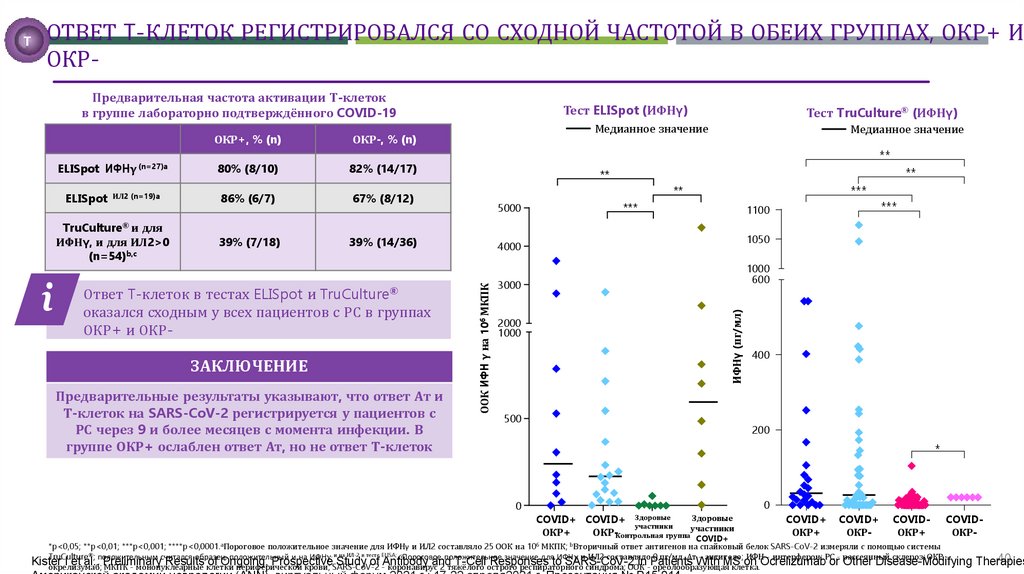
ОТВЕТ T-КЛЕТОК РЕГИСТРИРОВАЛСЯ СО СХОДНОЙ ЧАСТОТОЙ В ОБЕИХ ГРУППАХ, ОКР+ ИОКРПредварительная частота активации Т-клеток
в группе лабораторно подтверждённого COVID-19
ОКР-, % (n)
ELISpot ИФНγ (n=27)a
80% (8/10)
82% (14/17)
ELISpot ИЛ2 (n=19)a
86% (6/7)
67% (8/12)
TruCulture® и для
ИФНγ, и для ИЛ2>0
(n=54)b,c
39% (7/18)
39% (14/36)
Ответ T-клеток в тестах ELISpot и TruCulture®
оказался сходным у всех пациентов с РС в группах
ОКР+ и ОКР-
ЗАКЛЮЧЕНИЕ
Предварительные результаты указывают, что ответ Ат и
Т-клеток на SARS-CoV-2 регистрируется у пациентов с
РС через 9 и более месяцев с момента инфекции. В
группе ОКР+ ослаблен ответ Ат, но не ответ Т-клеток
Тест TruCulture® (ИФНγ)
Медианное значение
Медианное значение
**
**
**
***
**
5000
***
1100
1000
600
3000
2000
1000
***
1050
4000
ООК ИФН γ на 106 МКПК
ОКР+, % (n)
Тест ELISpot (ИФНγ)
ИФНγ (пг/мл)
T
500
400
200
*
0
0
Здоровые
COVID+ COVID+ Здоровые
участники
ОКР+
ОКР-Контрольная группаучастники
COVID+
ОКР+
COVID+
ОКР-
COVIDОКР+
COVIDОКР-
COVID+
*p<0,05; **p<0,01; ***p<0,001; ****p<0,0001.aПороговое положительное значение для ИФНγ и ИЛ2 составляло 25 ООК на 106 МКПК; bВторичный ответ антигенов на спайковый белок SARS-CoV-2 измеряли с помощью системы
TruCulture®; положительным считался образец, положительный и на ИФНγ, и на ИЛ-2 в тесте ELISA; cПороговое положительное значение для ИФНγ и ИЛ2 составляло 0 пг/мл. Ат - антитело; ИФН - интерферон; РС - рассеянный склероз; ОКР 40
Kister
I et al., Preliminary Results of Ongoing, Prospective Study of Antibody and T-Cell Responses to SARS-CoV-2 in Patients With MS on Ocrelizumab or Other Disease-Modifying Therapies
окрелизумаб; МКПК - мононуклеарные клетки периферической крови; SARS-CoV-2 - коронавирус 2 тяжёлого острого респираторного синдрома; ООК - ореолообразующая клетка.
41.
РЕКОМЕНДАЦИИ ПО ВАКЦИНАЦИИ ПАЦИЕНТОВ С РС (AAN)Вакцинация на фоне терапии ПИТРС возможна согласно календарю прививок с учетом
оценки пользы и риска для конкретного препарата
Временной интервал от вакцинации до начала терапии иммуносупрессивными ПИТРС -
не менее 4–6 недель
Не рекомендуется использовать живые вакцины пациентам с РС, получающим
иммуносупрессивные ПИТРС
Farez MF, Correale J, Armstrong MJ, et al. Neurology. 2019;93(13):584-594.
42.
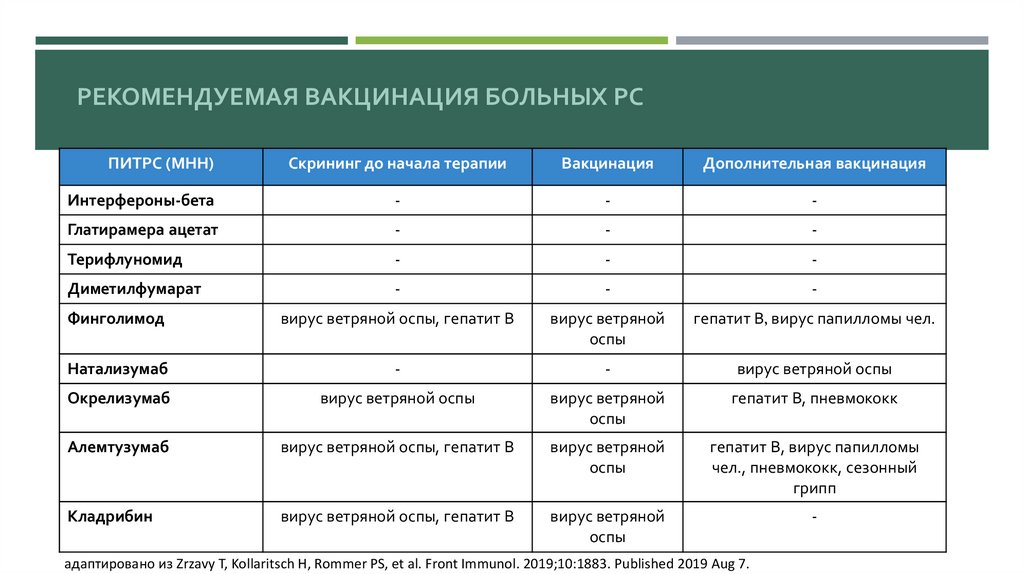
РЕКОМЕНДУЕМАЯ ВАКЦИНАЦИЯ БОЛЬНЫХ РСПИТРС (МНН)
Скрининг до начала терапии
Вакцинация
Дополнительная вакцинация
Интерфероны-бета
-
-
-
Глатирамера ацетат
-
-
-
Терифлуномид
-
-
-
Диметилфумарат
-
-
-
Финголимод
вирус ветряной оспы, гепатит В
вирус ветряной
оспы
гепатит В, вирус папилломы чел.
Натализумаб
-
-
вирус ветряной оспы
Окрелизумаб
вирус ветряной оспы
вирус ветряной
оспы
гепатит В, пневмококк
Алемтузумаб
вирус ветряной оспы, гепатит В
вирус ветряной
оспы
гепатит В, вирус папилломы
чел., пневмококк, сезонный
грипп
Кладрибин
вирус ветряной оспы, гепатит В
вирус ветряной
оспы
-
адаптировано из Zrzavy T, Kollaritsch H, Rommer PS, et al. Front Immunol. 2019;10:1883. Published 2019 Aug 7.
43.
ВАКЦИНАЦИЯ ПРОТИВ COVID-19Существует несколько типов вакцин против COVID-19
Векторная вакцина ГамКовидВак - Спутник V (Центр им. Н.Ф. Гамалеи),
Пептидная вакцина - ЭпиВакКорона (Центр Вектор, Новосибирск)
цельновирионная инактивированная вакцина - КовиВак (Центр им. М.П.
Чумакова).
Спутник-лайт
Неврология, нейропсихиатрия, психосоматика. 2021;13(2):157–161
44.
Хотя современные данные позволяют считать, что наличие РС не делает пациента более склонным кразвитию COVID-19, тяжелому течению коронавирусной инфекции или смерти от нее по сравнению с
населением в целом, тем не менее, поскольку риски заболевания COVID-19 перевешивают любые
потенциальные риски, связанные с самой вакциной, экспертные сообщества разных стран рекомендуют
пациентам с РС и членам их семей пройти вакцинацию как можно скорее, чтобы обеспечить максимально
высокий уровень защиты от COVID-19.
Опубликованные научные данные свидетельствуют о том, что вакцины от COVID-19 безопасны и
эффективны. Ни одна из этих вакцин не является живой или аттенуированной, следовательно, они не
способны вызывать инфекцию и могут применяться у пациентов с РС, в том числе получающих
иммуносупрессивные ПИТРС.
Маловероятно, что указанные типы вакцин могут вызывать обострение РС или усугублять имеющиеся
симптомы этого заболевания. К настоящему времени доказательств того, что люди с РС подвергаются
более высокому риску осложнений от подобных вакцин по сравнению с общей популяцией, не
опубликовано.
Хачанова Н.В. с соавт. Неврология, нейропсихиатрия, психосоматика. 2021;13(2):157–161
45.
Терапия некоторыми ПИТРС может повлиять на эффективность вакцины от COVID-19,поскольку под действием ряда препаратов меняется система иммунного ответа,
включая развитие селективной иммуносупрессии как ожидаемого эффекта терапии.
Для принятия решения о вакцинации от COVID-19:
оценить риск развития COVID-19 и текущее состояние пациента.
Во время обострения и в течение 30 дней после него вакцинацию
проводить не следует.
Следует по возможности выбрать оптимальное время вакцинации в зависимости от
характера терапии ПИТРС
Хачанова Н.В. с соавт. Неврология, нейропсихиатрия, психосоматика. 2021;13(2):157–161
46.
Российские рекомендации по вакцинации от COVID-19пациентов с РС в зависимости от терапии ПИТРС (1)
ПИТРС
Вакцинация до начала
терапии ПИТРС
Вакцинация во время терапии
ПИТРС
Интерферон бета-1а, Пег-интерферон
бета-1а, интерферон бета-1б,
глатирамера ацетат, терифлуномид,
диметилфумарат
Начало терапии возможно в любое время.
Терапия не влияет на эффективность
вакцинации.
Терапию продолжить, не меняя режима
дозирования.
Терапию можно начинать не ранее, чем через
4 недели после введения последней дозы
вакцины.
Временно приостанавливать терапию на
период вакцинации не рекомендуется. При
этом необходимо учитывать, что иммунный
ответ на вакцину может быть снижен.
Терапию можно начинать не ранее, чем через
4 недели после введения последней дозы
вакцины.
Временно приостанавливать терапию на
период вакцинации не рекомендуется. При
этом необходимо учитывать, что иммунный
ответ на вакцину может быть снижен.
Начало терапии возможно в любое время.
Терапия не влияет на эффективность
вакцинации.
Терапию продолжить, не меняя режима
дозирования.
Финголимод
Сипонимод
Натализумаб
https://oooibrs.ru/org/oooibrs/novosti-oooibrs/2021/03/rekomendacii-po-vakcinacii-pacientov-s-rasseyannym-sklerozom-ot-covid-19/
47.
Российские рекомендации по вакцинации от COVID-19пациентов с РС в зависимости от терапии ПИТРС (2)
ПИТРС
Вакцинация до начала терапии
ПИТРС
Окрелизумаб
Ритуксимаб
Терапию можно начинать не ранее, чем через 4 недели после Введение первой дозы вакцины рекомендовано через 12
введения последней дозы вакцины.
недель после последней инфузии окрелизумаба. При этом
необходимо учитывать, что иммунный ответ на вакцину может
быть снижен.
Проведение очередной инфузии окрелизумаба возможно не
ранее, чем через 4 недели после введения последней дозы
вакцины.
Алемтузумаб
Терапию можно начинать не ранее, чем через 4 недели после Вакцинацию следует проводить спустя 6 месяцев и более после
введения последней дозы вакцины.
лечебного курса алемтузумаба. При этом необходимо
учитывать, что иммунный ответ на вакцину может быть снижен.
Начало следующего курса алемтузумаба возможно не ранее,
чем через 4 недели после введения последней дозы вакцины.
Кладрибин в таблетках
Терапию можно начинать не ранее, чем через 4 недели после Вакцину можно вводить в любое время после курса
введения последней дозы вакцины.
кладрибина. При этом необходимо учитывать, что иммунный
ответ на вакцину может быть снижен. Следующий курс
кладрибина следует проводить не ранее, чем через 4 недели
после введения последней дозы вакцины.
Не зарегистрирован по показанию РС
Вакцинация во время терапии
ПИТРС
48
https://oooibrs.ru/org/oooibrs/novosti-oooibrs/2021/03/rekomendacii-po-vakcinacii-pacientov-s-rasseyannym-sklerozom-ot-covid-19/
48.
VELOCE: Многоцентровое открытое исследование IIIb фазы для оценкивлияния ОКР на формирование гуморального ответа на определенные
вакцины у пациентов с РРС
Вакцина
Тип вакцинации
ТТ
Инактивированный токсин
23-PPV
Полисахаридная вакцина
13-PCV
KLH
Грипп
Полисахаридный/белковый
конъюгат
Новый иммуноген
Инактивированная вакцина
из вирусных белков ГА
Путь иммунного ответа
Обоснование
В основном T-клеточнозависимый ответ на известный
антиген
Вторичный иммунный ответ
В основном B-клеточнозависимый ответ
Ответ на Т-клеточно-независимый антиген
Оценка ответа на вакцину 23-PPV
после введения бустерной
вакцины 13-PCV на неделе 4 в
сравнении с вакцинацией только
23-PPV
Определение того, сможет ли бустерная вакцина
усилить гуморальный ответ
Гуморальный иммунный ответ на
неоантиген
Ответ на неоантиген
Ответ на клинически значимую
вакцину
Гуморальный ответ
13-PCV - 13-валентная конъюгированная пневмококковая вакцина; 23-PPV - 23-валентная пневмококковая полисахаридная вакцина; ГА: гемагглютинин; KLH - гемоцианин лимфы улитки;
ОКР - окрелизумаб; РРС - рецидивирующий РС;
TT - вакцина, содержащая столбнячный анатоксин.
Millar L, et al. Представлено на CMSC 2016 (стендовый доклад P21128); Bar-Or A, et al. Neurology 2020. doi: 10.1212/WNL.000000000001038.
49.
VELOCE: У ПАЦИЕНТОВ, ПОЛУЧАВШИХ ОКРЕЛИЗУМАБ, МОЖЕТВЫРАБАТЫВАТЬСЯ ИММУННЫЙ ОТВЕТ ПОСЛЕ ВВЕДЕНИЯ
НЕОАНТИГЕНОВ И ВАКЦИН
У пациентов, получавших лечение окрелизумабом:
• Гуморальные ответы после введения клинически значимых вакцин были
сниженными во все временные точки по сравнению с пациентами в контрольной
группе
• Гуморальный ответ после введения неоантигена белка, KLH, был сниженным во
все временные точки по сравнению с пациентами в контрольной группе
• Серопротекция или значительное повышение уровней антител могли
сохраняться или наблюдаться после вакцинации
KLH - гемоцианин лимфы улитки.
Bar-Or A, et al. Neurology 2020. doi: 10.1212/WNL.000000000001038
50.
У ПАЦИЕНТОВ, ПОЛУЧАВШИХ ОКРЕЛИЗУМАБ, ПО-ПРЕЖНЕМУМОЖЕТ РАЗВИВАТЬСЯ ГУМОРАЛЬНЫЙ ОТВЕТ НА НЕОАНТИГЕНЫ
Данные, полученные в
исследовании VELOCE, указывают на
то, что у пациентов с истощенной
популяцией CD20+ B клеток, может
вырабатываться гуморальный
иммунный ответ на неоантиген.
Ответы IgM и IgG на неоантиген KLH1
Группа окрелизумаба
Введение KLH
Титры IgM
60 000
Титры IgG
Средние геометрические
значения титра (IgG)
Средние геометрические
значения титра (IgM)
2000
Контрольная группа (ИФН β или без ПИТРС)
1500
40 000
1000
20 000
500
0
До введения Неделя 4
KLH
Неделя 8
Неделя после введения
Неделя 12
0
До
Неделя 4
Неделя 8
введения
KLH
Неделя после введения
Этот аспект иммунной системы у
таких пациентов все еще работает,
хотя и в меньшей степени, в
отношении этого конкретного
Неделя 12
белка.
ПИТРС - препарат, изменяющий течение рассеянного склероза; ИФН - интерферон; Ig - иммуноглобулин; KLH - гемоцианин лимфы улитки.
1. Bar-Or A, et al. Neurology 2020. doi: 10.1212/WNL.000000000001038.
51.
ВЫВОДЫ: ВАКЦИНАЦИЯ ОТ COVID-191. Инфекция COVID-19 и ее осложнения могут оказывать длительное
отрицательное влияние на состояние здоровья в целом и неврологические функции
пациентов с РС.
2. Вакцинация против инфекции COVID-19 является чрезвычайно важной с точки
зрения как здоровья самих пациентов с РС, так и обеспечения популяционных
профилактических мер.
3. Все одобренные в настоящее время вакцины против COVID-19 не имеют
противопоказаний для их использования при РС и должны назначаться согласно
инструкции по их применению.
4. Перед вакцинацией против COVID-19 пациентам с РС целесообразно получить
рекомендации от лечащего невролога относительно возможных изменений в
терапии, включая соблюдение сроков начала, дозирования и смены ПИТРС.
52.
СПАСИБОЗА ВНИМАНИЕ!










































 Медицина
Медицина