Похожие презентации:
Металлы. Особенности строения атомов Ме. 9 класс
1. Металлы
9 класс2. Проверка знаний
• Особенности строения атомов Ме.• Где расположены Ме в ПС?
• Какие электроны называются
свободными?
• Что такое Ме химическая связь?
• Назвать самый легкий и самый тяжелый
Ме; самый легкоплавкий и тугоплавкий;
самый мягкий и самый твердый Ме
3. Положение Ме в ПС
•rатМе
rат
•ЭО
rат
•е на внешнем уровне
•ЭО
неМе
rат
Ме – пе = Ме
+п
•восстановители
- число е на внешнем уровне от 1- 3 (у d элементов s и d
электроны предвнешнего уровня)
- значение ЭО от 0,7 – 1,9
Как в группе и периоде изменяются Ме свойства, а
значит и восстановительные?
4. Физические свойства
• Общность свойств объясняется общим строениемкристаллической решетки р.38, 39
- электро- и теплопроводность
- ковкость и пластичность
- плотность
- твердость (мягкие – щелочные металлы)
- tпл металлов (Нg – 38,9 W – 3390С)
- металлический блеск
- магнитные свойства
ферромагнетики парамагнетики диамагнетики
Fe Ni Co
ЩМ ЩЗМ
Cu Au Ag Bi
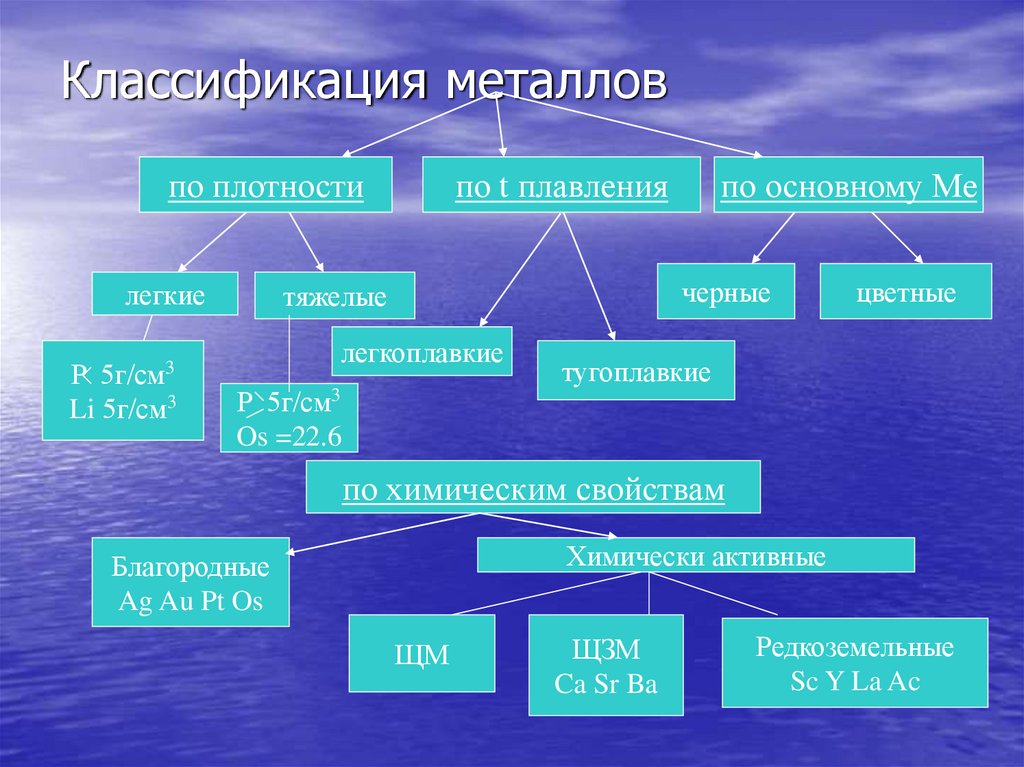
5. Классификация металлов
по плотностилегкие
P 5г/см
Li 5г/см3
по t плавления
черные
тяжелые
легкоплавкие
3
по основному Ме
P 5г/см
Os =22.6
цветные
тугоплавкие
3
по химическим свойствам
Химически активные
Благородные
Ag Au Pt Os
ЩМ
ЩЗМ
Ca Sr Ba
Редкоземельные
Sc Y La Ac
6. Химические свойства
1.С простыми веществамиМе0 + неМе0 = Ме+пнеМе-п
О2 Наl S N P
активность уменьшается
наиболее активные реагируют с Н
гидриды
2.Со сложными веществами
Взаимодействи
е с веществами
+ H2O
+ кислота
+ соли
Li K -
-
Mg -
без нагревания
Н2 + МеОН
- Pb (H)
при нагревании
Н2 + МеО
При комнатной температуре
Кислота +Ме = соль (раствор)
+Н2
Кислота +Ме = соль +Н2
Cu Hg
Pt Au
не
взаимодействуют
С
концент
рирован
ными
Не
взаим
одейс
твуют
Ме стоящие левее вытесняют из солей Ме
стоящие правее
7. Лабораторный опыт 12
• С.72• Запишите в тетради название опыта
• Цель: познакомиться с химическими
свойствами металлов
• Записать уравнение в молекулярном,
ионном виде. Указать окислитель и
восстановитель
• Написать вывод
8. Получение металлов
• Металлургия – отрасльзанимающаяся
производством Ме. Приводит природные
соединения
в
форму
доступную
для
обработки.
- обжиг руд (Ме
МеО)
- растворение нерастворимых
соединений(кислоты, сода)
. Восстановителями являются: С Н2 СО Аl Mg
ЩМ эл.ток
9.
• ПирометаллургияPbS + 3O2 =2PbO + 3SO2
PbO + H2 = Pb + H2O (или С, СО)
3TiCl4 + 4Al = 3Ti + 4AlCl3
Гидрометаллургия
CuO + H2SO4 =CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu (для получения Cu Au Zn)
Электрометаллургия
2 KCl
2 K + Cl2 (ЩМ, ЩЗМ, Al)
Микробиологический метод (бактерии переводят
нерастворимые руды в растворимые)
CuS
CuSO4
10. Лабораторный опыт 13
• С.75• Запишите в тетради название опыта
• Цель: познакомиться с рудами металлов
• Записать наблюдение в таблицу из трех
граф
• Написать вывод
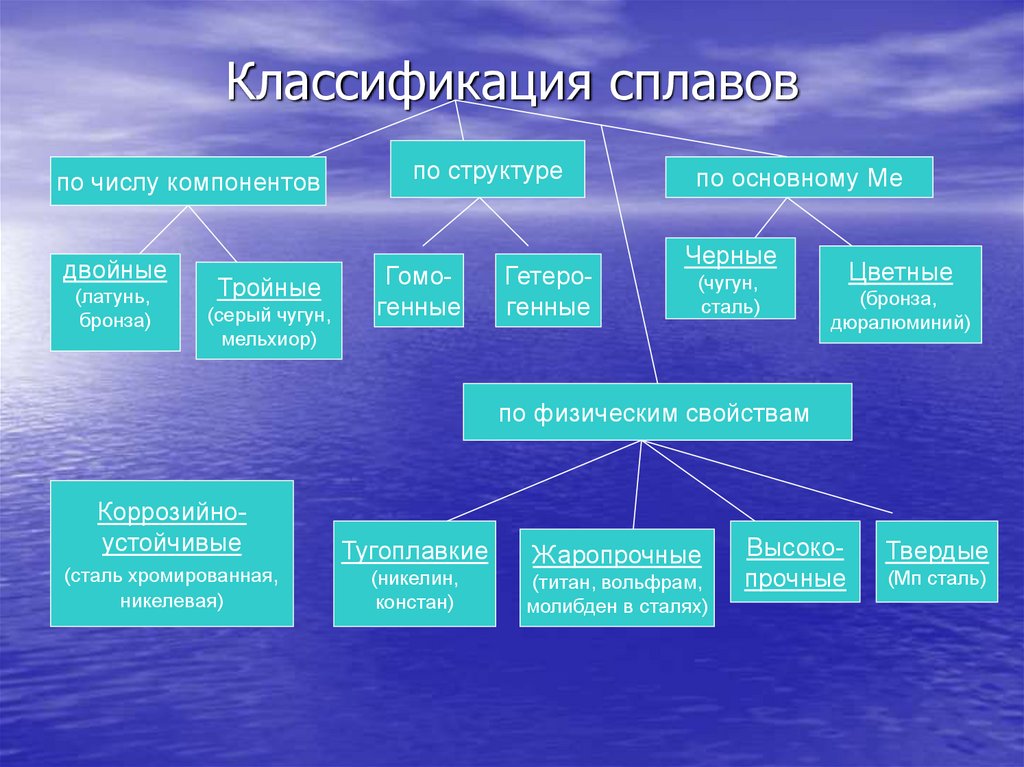
11. Классификация сплавов
по числу компонентовдвойные
(латунь,
бронза)
Тройные
(серый чугун,
мельхиор)
по структуре
Гомогенные
Гетерогенные
по основному Ме
Черные
(чугун,
сталь)
Цветные
(бронза,
дюралюминий)
по физическим свойствам
Коррозийноустойчивые
(сталь хромированная,
никелевая)
Тугоплавкие
(никелин,
констан)
Жаропрочные
(титан, вольфрам,
молибден в сталях)
Высокопрочные
Твердые
(Мп сталь)
12. Проверка знаний
Написать уравненияCa + S =
Na + H2O =
Cu + AgNO3 =
Fe + HCl =
Cu + FeSO4 =
Al + H3PO4 =
возможных реакций
Al + O2 =
Zn + O2 =
Na + Zn(NO3)2=
Ag + H2O =
Zn + Pb(NO3)2=
H2S + Mg =
13. Коррозия металлов
• ОВП при котором Ме выступают в качествевосстановителя, компоненты окружающей среды в
качестве окислителя
Виды
химическая
электрическая
2Zn +O2 =2ZnO
оцинкованное Fe луженое Fe
2 Fe +3Cl2 =2FeCl3
Fe + Zn
Fe + Sn
Fe + O2 + H2O= Fe(OH)3 более активные Ме портятся быстрее
Zn0 -2e = Zn2+
Fe0 -2e = Fe2+
2H+ + 2e = H2
2H+ + 2e = H2
Fe0 + 2H+ = Fe2+ + H2
14. Домашнее задание
• П.10 зад.2,4 п.11 зад.2,5 п.12 в.3,4новый уч. П.29 зад.4-6 п.36 зад.3-6












 Химия
Химия








